Изучение растворимости осадков некоторых лантаноидов в карбонатных средах
Автор: Кашурин Руслан Романович, Герасв Степан Алексеевич, Суслов Арсений Павлович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 4 т.12, 2020 года.
Бесплатный доступ
Исследование рассматривает процесс растворения осадков карбонатов и фосфатов редкоземельных металлов при изменении концентрационных параметров системы. Задачей исследования является определение характера процесса растворения при различных составах изучаемых сред. В результате анализа теоретической базы представлены качественное и количественное содержание редкоземельных металлов в красном шламе и фосфогипсе, обуславливающие интерес к рассматриваемой проблеме. Также были рассмотрены доступные технологии извлечения редкоземельных металлов из красного шлама и фосфогипса, приведены их преимущества и недостатки. Рассматривался перспективный карбонатно-щелочной способ извлечения редкоземельных металлов. Для выявления возможности проведения процесса были рассчитаны термодинамические параметры системы. В ходе эксперимента рассмотрены факторы, влияющие на процесс растворения: концентрация карбонат-иона, природа катиона растворителя и катиона редкоземельного металла. В качестве анализируемых компонентов рассматривались карбонаты и фосфаты европия, гольмия и неодима. Карбонаты и фосфаты неодима, европия и гольмия растворялись в модельных растворах карбоната K2CO3 с концентрацией от 0,2-4,5 моль/л до состояния равновесия. Полученные результаты показывают зависимость растворимости осадков редкоземельных металлов от природы растворителя и его концентрации. Данные представлены в виде изотерм растворимости. На основании экспериментальных данных рассчитаны значения степени извлечения редкоземельного металла в раствор. Для карбонатов неодима, европия и гольмия максимальная степень извлечения αmax составила соответственно 72,8 %, 81,2 %, 83,0 % масс. В ходе эксперимента с растворением фосфатов лантаноидов получены следующие результаты: максимальная степень извлечения неодима - 60,59 %, европия - 51,66 %, гольмия - 93,01 %.
Карбонат калия, изотерма, растворение, редкоземельные металлы, техногенное сырье, лантаноиды, шлам
Короткий адрес: https://sciup.org/147234240
IDR: 147234240 | УДК: 546.650+544.032.72+544.032.732 | DOI: 10.14529/chem200403
Текст научной статьи Изучение растворимости осадков некоторых лантаноидов в карбонатных средах
Исследование химических и физико-химических свойств соединений редкоземельных металлов является актуальным направлением, поскольку затрагивает сразу несколько проблем:
-
1. Большая часть редкоземельных элементов находится в отвалах (фосфогипсе и красном шламе) [1, 2].
-
2. Экономический ущерб, который возникает вследствие хранения фосфогипса. Так, в Польше в 2015 году затраты на хранение составили 18,5 млн. злотых ($ 4,5 млн) [3]. Более 85 % всего производимого фосфогипса подвергается утилизации без переработки [4]. Большие экономические и экологические проблемы вызывают хранение и накопление красного шлама – отхода алюминиевой промышленности. Несмотря на высокий уровень производственной технологии переработки боксита, предприятия отправляют в хвостохранилища и отвалы тысячи тонн ядовитого отхода [5, 6].
-
3. Лидирующее положение на рынке РЗМ занимает Китай, который контролирует 94 % этого рынка, поэтому необходима разработка и внедрение собственных технологий, чтобы восполнить дефицит некоторых РЗМ (например, диспрозия) [7].
Идея исследования заключается в выявлении возможности извлечения редкоземельных элементов из отвалов карбонатным методом (на примере переработки фосфогипса и красного шлама), а также в поиске оптимальных условий для осуществления процессов карбонизации.
Изотермы растворимости являются научной основой для моделирования процесса растворения и способны наглядно представить поведение различных систем в идентичных условиях. В природе редкоземельные металлы находятся в виде различных нерастворимых в воде соединений, так, в фосфогипсе они находятся преимущественно в виде фосфатов и оксидов, а в красных шламах в виде оксидов и гидроксидов [7–9]. Целью работы является изучение процесса растворения карбонатов, фосфатов и гидроксидов некоторых лантаноидов в карбонатных средах.
Ряд редкоземельных металлов включает в себя 17 элементов: 15 лантаноидов, скандий и иттрий [7]. РЗМ получили широкое распространение в различных отраслях: электроэнергетика, автомобиле- и приборостроение, военная отрасль [7].
Редкоземельные металлы входят в состав более 160 минералов, среди которых наиболее важными являются монацит и бастнезит [3, 7]. Методы производства редкоземельных металлов из традиционного сырья (такие минералы, как лопарит, монацит, гадолинит, пегматит и др.) трудоемки, а также требуют значительного финансирования. В настоящее время активно развивается направление рационального использования сырья, а именно получения редкоземельных металлов из техногенных отходов: красных шламов, фосфогипса, кеков, шлаков и угольных отходов. Исследования специалистов [10], занимавшихся извлечением скандия и РЗМ из красного шлама, показывают содержание в исходном сырье – бокситах, направляемых на переработку БАЗ – 49,7 г/т Sc, 326 г/т Y, 161 г/т La, 13,6 г/т Yb и суммы оксидов редкоземельных металлов 1080 г/т. Существуют данные по существованию в красных шламах значительного количества La, Ce, Pr, Nd и других редкоземельных металлов с суммарным содержанием 5062500 г/т [11], включая 90-110 г/т Sc2O 3 [12]. После процесса выщелачивания РЗМ преимущественно переходят в отвалы из-за их неактивности в алюминатном растворе.
Фосфогипс является безопасным вторичным источником лантаноидов, поскольку общий радиоактивный фон его не превышен. Содержание редкоземельных металлов в фосфогипсе находится в диапазоне 0,4–0,6 % [1, 8, 13].
Основной источник производства фосфатных удобрений и фосфорной кислоты – апатит, который в среднем содержит 0,1–0,8 % РЗМ, при этом установлено, что легких РЗМ в его составе находится больше [7]. Анализ элементного состава РЗМ, входящих в состав фосфогипса, подтверждает также справедливость правила Гаркинса, согласно которому лантаноиды с четным порядковым номером встречаются значительно чаще (Ce, Nd), чем лантаноиды с нечетным номером [14]. Данные исследования [15] свидетельствуют о значительном содержании в фосфогипсе следующих элементов: Ce, Pr, Nd, Sm, Eu, Gd, Dy и Y.
Большинство исследований посвящено извлечению редкоземельных металлов из красного шлама и фосфогипса в ходе выщелачивания минеральными кислотами, преимущественно серной, соляной, реже азотной [16–18], также есть данные по выщелачиванию красного шлама гидросульфатом аммония [19]. Кислотное выщелачивание дает хорошие результаты по степени извлечения, однако следует учитывать высокую стоимость сырья и организацию дополнительных стадий утилизации кислоты. Наряду с этим наблюдается извлечение в раствор попутных компонентов (железо, титан, кремнезем), загрязняющих конечный концентрат РЗМ.
Первично необходимо было установить, при каком мольном отношении n (CO 3 2–) : n (Ln3+) достигается максимальное растворение осадка. В основе расчета лежит следующее уравнение реакции:
La2 (CO3 )3 + CO 2- ^ 2[Ln(CO3 )2] - . (1)
Для изучения процессов комплексообразования редкоземельных элементов были проведены многочисленные исследования. Было установлено, что в природных водах преобладают карбонатные комплексы РЗМ, и большая часть редких земель существует в виде комплексного иона [Ln(CO3)2] - [20, 21]. Результаты другого исследования также указывают на то, что из образующихся карбонатных комплексов [LnCO3] + , [Ln(CO 3 )2] - гораздо устойчивее последний [22].
Экспериментальная часть
При подготовке к процессу растворения было проведено теоретическое исследование термодинамических параметров процесса. Данные о значениях констант устойчивости различных комплексов взяты из [23] и представлены в табл. 1.
Таблица 1
Значения констант диссоциации карбонатных комплексных ионов и стандартной энергии Гиббса диссоциации комплекса
|
Реакция |
K |
A rG 29g , кДж/моль |
|
Nd(CO s )2- # Nd3+ + 2CO 3 2- |
2,51·10–13 |
71,881 |
|
Еи(СО з ) 2 - ^ Eu3+ + 2СО з 2- |
1,26·10–13 |
73,592 |
|
Ho(cO3)2- # Ho3+ + 2CO32- |
5,01·10–14 |
75,874 |
Расчёты изменения энергии Гиббса диссоциации приведённых выше комплексов проводились по следующей формуле:
A rG°298 =-RTnK(2)
Для вычисления стандартной энергии Гиббса образования комплекса было использовано следующее выражение:
ArG98 (Ln(CO3 )2)- = A fG298 (Ln3+) + 2 AfG^ (CO32-) - AfG98 (ВД)2)-
Из (3) выражается:
AfG209g (Ln(CO3)2)— = AfG209g (Ln3+) + 2 AfG29g (CO32-) - ArG98 (ВД)2)—
Некоторые важные термодинамические данные для различных соединений РЗМ были взяты из [24] и из базы данных термических констант веществ [25]. Значения стандартных энергий Гиббса образования веществ приведены в табл. 2, 3.
Таблица 2
Значения стандартных энергий Гиббса образования фосфатов
|
РЗМ |
A f G 29g ( LnPO4 ) , кДж/моль |
A f G 09g ( CO l " ) , кДж/моль |
A fG 29g ( Ln ( CO3 ) 2 ) , кДж/моль |
A f G 29g ( PO 4 " ) , кДж/моль |
|
Nd |
–1877 |
–527,60 |
–1797,19 |
–1271,52 |
|
Eu |
–1869 |
–527,60 |
–1706,62 |
–1271,52 |
|
Ho |
–1842 |
–527,60 |
–1816,97 |
–1271,52 |
Таблица 3
Значения стандартных энергий Гиббса образования карбонатов
|
РЗМ |
A f G 09g ( Ln2 ( CO3 ) 3 ) , кДж/моль |
A fG o9g ( CO3 ) , кДж/моль |
A fG29g ( Ln ( CO3 ) 2 ) ’ кДж/моль |
|
Nd |
–2923,03 |
–527,60 |
–1797,19 |
|
Eu |
–2738,46 |
–527,60 |
–1706,62 |
|
Ho |
–2954,58 |
–527,60 |
–1816,97 |
Учитывая преобладание формы [Ln(CO 3 )] 2 – в системе, реакции растворения фосфата и карбоната РЗМ идут согласно уравнениям:
LnPO 4( тв ) + 2СО 2-ж ) = (Ln(CO 3 ) 2 ) Ж + ™4" ж )
Ln 2 ( CO 3 ) ( me ) + Ш2 ^ ) = 2(Ln(CO 3 ) 2 ) ж
Согласно реакции, рассчитывается стандартное изменение энергии Гиббса реакции. Результаты представлены в виде графика на рис. 1. Из полученных результатов можно сделать вывод, что растворение карбонатов и фосфатов РЗМ в карбонатах щелочных металлов с образованием карбонатных комплексов состава [Ln(CO 3 )] 2 – термодинамически возможно.
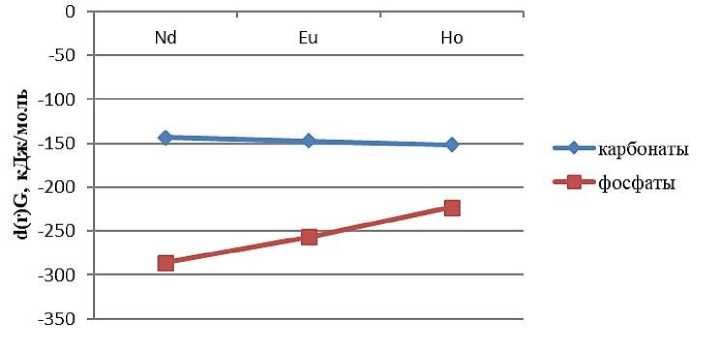
Рис. 1. Изменение энергии Гиббса реакции растворения с образованием карбонатных комплексов для различных РЗМ
Самой распространенной классификацией РЗМ является распределение их на легкие, средние и тяжелые согласно атомным массам. В качестве легкого лантаноида был взят неодим, в качестве среднего – европий, а тяжелого – гольмий. Таким образом, сравнивая изотермы растворимости трех элементов, можно спрогнозировать процесс растворения остальных.
Для осуществления растворения карбонатов, фосфатов и гидроксидов лантаноидов был выбран K2CO3, поскольку растворение осадков в его присутствии проходит хорошо и его растворимость в воде (111 г на 100 г H 2 O) выше, чем у (NH 4 ) 2 CO 3 (96 г на 100 г H 2 O) и Na 2 CO 3 (21,8 г на 100 г H 2 O). В последующих экспериментах варьировался параметр времени перемешивания, и было установлено, что при разных температурах равновесие системы достигается за разное время. Процесс растворения карбонатов и фосфатов редкоземельных металлов в карбонате калия производился следующим образом: изучались модельные растворы карбоната K 2 CO 3 с концентрацией от 0,2–4,5 моль/л. В раствор объёмом 100 мл помещалась навеска карбоната РЗМ массой 0,05 г. Раствор с навеской перемешивался при постоянной температуре 293 K. После перемешивания раствор выдерживался 24 часа до достижения равновесия. Для определения концентрации ионов РЗМ в растворе применялся ЭДТА и арсеназо (III). Отбирались аликвоты исследуемого раствора объёмом 10 мл, и определяли содержание редкоземельного металла методом трилоно-метрического титрования.
Результаты и обсуждение
Процессы растворения карбоната и фосфата редкоземельного металла различны. Карбонаты растворяются легче при более низких температурах и времени контакта фаз. В ходе перемешивания навески карбоната неодима в течение 1 часа и выдержки 24 часов до установления максимальной концентрации в растворе K2CO3 при температуре T = 293 K и концентрации карбонат-ионов с 0,941 моль/л максимальная степень извлечения остается постоянной и составляет α = 72,8 %. В ходе растворения карбоната европия при тех же условиях удается добиться значения степени извлечения α = 81,2 %. Карбонат гольмия в аналогичном эксперименте показывает лучший среди карбонатов результат со значением α = 83,0 %. Таким образом, при растворении карбонатов РЗМ можно говорить об увеличении растворимости с ростом атомной массы редкоземельного металла.
Фосфаты редкоземельных металлов растворяются при повышенных температурах и большем интервале времени. Поскольку при температурах от 50 до 90 °С степень извлечения в раствор NdPO4 одинакова, а при большей температуре время перемешивания значительно меньше, то было принято решение строить изотерму растворимости при 90 °С. Время перемешивания пульпы при различных концентрациях варьировалось от 2 до 6 часов. Максимальная растворимость NdPO 4 имеет значение α = 60,59 % и соответствует концентрации C (K 2 CO 3 ) = 4,5 М.
В ходе экспериментов было установлено, что растворимость EuPO 4 также не зависит от температуры в диапазоне 50–110 °С. Для построения изотермы была выбрана температура T=90 °C, так как при этой температуре процесс протекает быстро и с таким же выходом реакции. При концентрации карбоната калия 2 моль/л происходит скачкообразное увеличение растворимости, что может свидетельствовать об изменении механизма реакции при концентрации выше этого значения. Максимальная степень превращения EuPO 4 составила α = 51,66 % (при C (K 2 CO 3 ) = 5 М).
Для HoPO4 экспериментально было установлено, что его растворимость не сильно зависит от температуры (на интервале 50–110 °С). Высокая степень извлечения в раствор HoPO 4 происходит даже при низких концентрациях растворителя и изменяется плавно с увеличением концентрации карбоната калия. Максимальная степень извлечения в раствор соответствует концентрации C (K 2 CO 3 ) = 4,5 М и имеет значение α = 93,01 %. Минимальное значение α = 38 % достигается при C (K 2 CO 3 ) = 0,5 М. Результаты представлены на рис. 2.
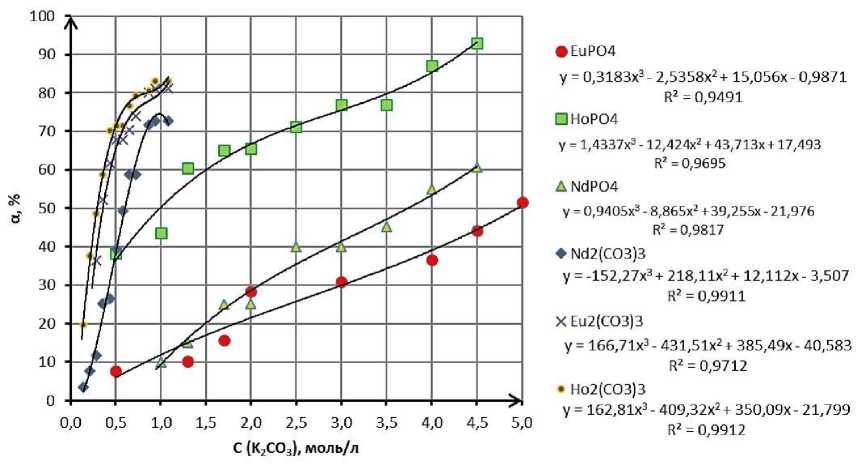
Рис. 2. Сравнение полученных изотерм растворимости
Графики растворения как группы фосфатов, так и группы карбонатов имеют общий вид, что подтвержает их схожесть в химических и физико-химических свойствах. Различие в растворимости связано с тем, что свойства РЗМ сильно зависят от их атомного или ионного радиуса (эффект лантаноидного сжатия) [26]. Таким образом, радиус сильно влияет на их основность, которая, в свою очередь, влияет на такие свойства, как растворимость и способность образовывать комплексы [9].
Выводы
Главным результатом работы является установление функциональной зависимости между степенью извлечения в раствор карбонатов и фосфатов некоторых лантаноидов (Nd, Eu, Ho) и концентрацией растворителя. На основании результатов расчетов Δ r G реакций растворения карбонатов и фосфатов РЗМ в карбонатах щелочных металлов можно сделать вывод, что процесс карбонизации для отдельных групп лантаноидов будет протекать по-разному. Различия профилей изотерм растворимости является подтверждением влияния эффекта лантаноидного сжатия на ионный радиус и кислотно-основные свойства элементов. Переход РЗМ в комплексы термодинамически возможен, следовательно, извлечение их из фосфогипса и красного шлама осуществимо.
Определены условия, при которых возможно достичь максимальную растворимость карбонатов редкоземельных металлов: для Nd 2 (CO 3 ) 3 α max = 72,8 %, для Eu 2 (CO 3 ) 3 α max = 81,2 %, а для Ho 2 (CO 3 ) 3 α max = 83,0 %.
В ходе эксперимента с растворением фосфатов лантаноидов в растворе карбоната калия степень извлечения составила: для NdPO 4 α max = 60,59 %, для EuPO 4 α max = 51,66 %, а для HoPO 4 α max = 93,01 %.
Список литературы Изучение растворимости осадков некоторых лантаноидов в карбонатных средах
- Мольков, А.А. Способ переработки фосфогипса / А.А. Мольков, Ю.И. Дергунов, B.П. Сучков // Известия Челябинского научного центра. - 2006. - Вып. 4. - С. 59-60.
- Химические аспекты карбонатного выщелачивания скандия из красных шламов / C.И. Степанов, М.М. Аунг, Х. Йе. Аунг и др. // Вестник ВГУИТ. - 2018. - № 4. - С. 349-355. DOI: 10.20914/2310-1202-2018-4-349-355.
- Podbiera-Matysik, K. Potential Management of Waste Phosphogypsum with Particular Focus on Recovery of Rare Earth Metals / K. Podbiera-Matysik, K. Gorazda, Z. Wzorek // Pol. J. Chem. Tech-nol. - 2015. - P. 55-57. 10.1515/pjct-2015-0009.
- Study of Rare Earths Leaching After Hydrothermal Conversion of Phosphogypsum / A.S. Mas-moudi, I.N. Hammas, K. Horchani Naifer, M. Ferid // Chem. Afr. - 2019. - № 2. - P. 415-422. DOI: 10.1007/s42250-019-00048-z.
- Evan, K. The History, Challenges and New Developments in the Management and Use of Bauxite Residue / K. Evan // J. Sustain. Met. - 2016. - V. 2. - P. 316-331. DOI: 10.1007/s40831-016-0060-x.
- Ritters, S.K. Making the Most of Red Mud / S.K. Ritters // Chem. Eng. News. - 2014. - V. 92, no. 8. - P. 33. DOI: 10.1021/cen-09208-scitech1.
- Soltani, F. Selection of an Appropriate Leaching Method for Light REEs from Esfordi Flotation Concentrate Based on Mineral Characterization / F. Soltani, M. Abdollahy // J. South. Afr. Inst. Min. Metall. - 2017. - P. 443-449. DOI: 10.17159/2411-9717/2017/v117n5a6.
- Найманбаев, М.А. Комплексное использование фосфогипса / М.А. Найманбаев, Н.Г. Лохова, Ж.А. Балтабекова // Горный журнал Казахстана. - 2009. - С. 28-29.
- Royen, H. Rare Earth Elements - Purification, Separation and Recycling / H. Royen, U. Fortkamp // Sweden: IVL Swedish Environmental Research Institute Ltd. Technical Report No. C211. - 2016. - P. 8-28.
- Переработка отвального шлама глиноземного производства с извлечением скандиевого концентрата / И.Н. Пягай, В.Л. Кожевников, Л.А. Пасечник и др. // Записки горного института. -2016.- Т. 218. - С. 225-232.
- Towards Zero-Waste Valorization of Rare-Earth-Containing Industrial Process Residues: A Critical Review / K. Binnemans, P.T. Jones, B. Blanpain et al. // J. Clean. Prod. - 2015. - V. 99. -P. 17-38. DOI: 10.1016/j.jclepro.2015.02.089.
- Скандий России: перспективы освоения минерально-сырьевой базы и развития производства / Л.З. Быховский, В.В. Архангельская, Л.П. Тигунов и др. // Минеральное сырье. Серия геолого-экономическая. - 2007. -№ 22. - C. 45.
- Mattila, H.-P. Mineral Carbonation of Phosphogypsum Waste for Production of Useful Carbonate and Sulfate Salts Thermal and Flow Engineering Laboratory / H.-P. Mattila, R. Zevenhoven // Front. Energy Res. - 2015. - P. 1-3. DOI: 10.3389/fenrg.2015.00048.
- Бушуев, Н.Н. Физико-химическое исследование промышленного осадка, содержащего редкоземельные элементы, полученного из упаренной экстракционной фосфорной кислоты / Н.Н. Бушуев, Д.С. Зинин // Успехи в химии и химической технологии. - 2013. - Т. 27. - C. 19-20.
- Phosphogypsum Processing for Rare Earths Recovery - A Review / Y. Xiaosheng, D. Salvador, H.T. Makkonen et al. // Natural Resources. - 2019. - P. 325-336. DOI: 10.4236/nr.2019.109021.
- Extraction of lanthanum and cerium from Indian red mud / Abhilash, S. Sinha, M.K. Sinha et al. // Int. J. Miner. Process. - 2014. - № 127. - P. 70-73. DOI: 10.1016/j.minpro.2013.12.009.
- Lambrini, V.T. Investigation of the Separation of Scandium and Rare Earth Elements from Red Mud by Use of Reversed-Phase HPLC / V.T. Lambrini, M.Th. Ochsenkuhn-Petropoulou, L.N. Mendrinos // Anal. Bioanal. Chem. - 2004. - № 379. - P. 796-802. DOI: 10.1007/s00216-004-2667-1.
- Pilot-Plant Investigation of the Leaching Process for the Recovery of Scandium from Red Mud / M. Ochsenkuhn-Petropulu, K.S. Hatzilyberis, L.N. Mendrinos et al. // Ind. Eng. Chem. Res. - 2002. -№ 41. - P. 5794-5801. DOI: 10.1021/ie011047b.
- Деревянкин, В.А. Поведение скандия и лантана при переработке красного шлама / В.А. Деревянкин, Т.П. Поротникова, Е.К. Кочерова // Известия вузов. Цветная металлургия. -1981. - № 5. - С. 86-87.
- Cantrell, K.J. Rare Earth Element Complexation by Carbonate and Oxalate Ions / K.J. Cantrell, R.H. Byrne // Geochim. Cosmochim. Acta. - 1987. - P. 597-605. DOI: 10.1016/0016-7037(87)90072-X.
- Millero, F.J. Stability Constants for the Formation of Rare Earth Inorganic Complexes as a Function of Ionic Strength / F.J. Millero // Geochim. Cosmochim. Acta. - 1992. - P. 3123-3132. DOI: 10.1016/0016-7037(92)90293-R.
- Johannesson, K. H. The Rare Earth Element Geochemistry of Mono Lake Water and the Importance of Carbonate Complexing / K.H. Johannesson, W. Berry Lyons // Limnol. Oceanogr. - 1994. -V. 39(5). - P. 1141-1154. DOI: 10.4319/lo.1994.39.5.1141.
- Spahiu, K. A Selected Thermodynamic Database for REE to be Used in HLNW Performance Assessment Exercises / K. Spahiu, J. Bruno // MBT Tecnologia Ambiental, Cerdanyola, Spain. -1995. - P. 2-22.
- Kenneth N.H. Effect of Anions on the Solubility of Rare Earth Element-Bearing Minerals in Acids / N.H. Kenneth // Mining, Metallurgy & Exploration. - 2018. - P. 4-14. DOI: 10.1007/s42461-018-0029-3.
- База данных «Термические константы веществ» - http://www.chem.msu.ru/cgi-bin/tkv.pl?show=welcome.html (дата обращения: 30.04.2020).
- Taketatsu, T. Dissolution and Anion Exchange Behavior of the Rare Earth Elements in Potassium and Ammonium Carbonate Solutions / T. Taketatsu // Bull. Chem. Soc. Japan - 1962. - P. 15731576. DOI: 10.1246/bcsj.35.1573.


