Изучение развития лучевого пневмонита в легких у крыс при ротационном и статическом облучении
Автор: О.А. Пашковская, Н.А. Филатова, А.А. Докучаева, В.В. Шигаев, С.Э. Красильников
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.38, 2023 года.
Бесплатный доступ
Использование в клинической практике результатов исследований по лучевой терапии (ЛТ) на животных в настоящее время незначительно. Исследование лучевых осложнений после облучения легких у крыс с помощью облучателя с визуальным контролем SmART+ (Precision, Северный Бранфорд, Коннектикут, США) является пилотным для разработки модели радиационно-индуцированной легочной токсичности на животных. Цель работы: определение дозы и объема облучения мишени в легких у крыс, при которых характерно развитие лучевого пневмонита. Материал и методы. В исследовании были определены 4 группы крыс линий Wag и Wistar, отличающиеся возрастом (10–16,5 мес.) и весом (350–850 г). Облучение мишени в легком проводилось с предварительным дозиметрическим планированием в статическом или ротационном режимах, различными дозами (от 10 до 30 Гр), объемами мишени в легком (0,045–1,24 см3) и локализацией (левое или правое легкое, верх или низ легкого). Дозиметрическое планирование обеспечивает оптимальное лучевое воздействие на мишень и контроль дозовых нагрузок на органы риска. Развитие лучевых повреждений наблюдалось на КТ сканированиях в течение 16 нед. Результаты. Для получения плотности легких крыс (в единицах Хаунсфилда) было проведено КТ сканирование здоровых животных, выполнена обработка снимков, определены среднее значение и стандартное отклонение плотности. Значения плотности легких крыс (в единицах Хаунсфилда) составили – 519,6 ± 46,2 (контрольные значения). Выполнено сравнение экспериментальных данных для облученных животных и контрольных значений. В результате анализа установлена зависимость объема мишени, подведенной дозы и выживаемости животных после облучения. Показано, что параметр «среднее значение плотности легкого (в единицах Хаунсфилда)» может использоваться для количественного анализа изменений в легком после облучения. Выводы. Определены доза и объем облучения мишени в легких у крыс, при которых характерно развитие лучевого пневмонита. При дозе облучения 16 Гр и объеме облученного легкого не менее 0,5 см3 (8%) характерно появление участка снижения пневматизации в зоне облучения.
Лучевой пневмонит, облучение легких крыс, КТ сканирование, плотность легкого в единицах Хаунсфильда
Короткий адрес: https://sciup.org/149141589
IDR: 149141589 | УДК: 616.24-085.849.5-06:616.24-002-073.756.8]-092.9 | DOI: 10.29001/2073-8552-2023-38-1-118-125
Текст научной статьи Изучение развития лучевого пневмонита в легких у крыс при ротационном и статическом облучении
Лечение рака легкого (РЛ) является сочетанием нескольких методов лечения (хирургия, лучевая терапия (ЛТ), системная терапия – химиотерапия, иммунотерапия и тар-гетные препараты). ЛТ является единственным методом лечения при раке легкого, для которого есть показания на всех стадиях заболевания и при любых общих состояниях пациента. Моделирование показало, что 77% пациентов с РЛ имеют научно обоснованные показания к ЛТ [1]. Оптимальное использование ЛТ может привести к 5-летнему росту локального контроля на 8,3% и выживаемости на 4% [2]. 5-летняя выживаемость составляет 23% [3].
Основными исследуемыми задачами в ЛТ является определение оптимальных разовой и суммарной доз, подводимых к опухоли, схемы фракционирования и общего времени лечения [4, 5]. Исторически дозы в ЛТ выбирались эмпирически, основываясь на клиническом опыте при лечении пациентов. Основным ограничивающим эскалацию дозы фактором является превышение толерантностей критических органов в рамках существующих рекомендаций QUANTEC (Quantitative Analysis of Normal Tissue Effects in the Clinic) [6], которое приводит к развитию токсических эффектов, таких как лучевой пневмонит и фиброз легочной ткани.
Последние три десятилетия развитие технологий ЛТ позволило улучшить сохранение критических нормальных тканей и увеличить подводимую к опухоли дозу [7–10]. Повышение дозы в областях с высокой молекулярной активностью или пролиферации приводит к увеличению выживаемости и улучшению локального контроля [11]. Однако также имеются клинические исследования, изучавшие эту гипотезу [12, 13], которые не устанавливают истинную связь увеличения дозы и повышения выживаемости. Это объясняется в первую очередь множеством ограничений, связанных с сопутствующими заболеваниями пациентов. В настоящее время нет оснований полагать, что применение инновационных технологий и эскалация дозы в исследованиях на пациентах дают доказательные клинические результаты значительного увеличения выживаемости [14]. Проведение доклинических исследований может помочь расширить данные для определения эффективности повышения дозы.
В настоящий момент использование в клинической практике результатов исследований на животных незначительно. Это в первую очередь связано с отсутствием широкого использования соответствующей приборно-экспериментальной базы, а также сложностью трансляции результатов доклинических исследований в клиническую практику. Экспериментальные данные предоставили лишь поверхностные знания или подтвердили биологические основания клинических наблюдений. Например, ранние результаты ЛТ на животных доказали, что доза за фракцию имеет принципиальное значение в снижении поздних лучевых реакций. В исследовании по облучению легких у крыс было показано, что риск развития симптоматического лучевого пневмонита возрастает при включении в облучение части сердца [15]. Облучение основания легкого у мышей с большей вероятностью вызывает лучевой пневмонит, чем облучение верхушки или срединной части легкого. Поскольку гистологическое повреждение легкого не зависит от локализации облучения, были сделаны выводы о функциональной значимости различных отделов легкого [16, 17].
В доклинических исследованиях на животных, в отличие от клинической практики, редко применяются конформные методики ЛТ, в частности IMRT и VMAT. Также использование данных ранних исследований ЛТ на животных сильно ограничено ввиду того, что распределение изодоз сильно отличается от используемых в современной практике. В последнее время получило широкое применение использование химиотерапевтических препаратов для радиомодификации во время ЛТ. Для получения достоверных данных в эксперименте должно использоваться оборудование, функционально схожее с клиническим, а также методики облучения должны полностью имитировать клинические. Исследование лучевых осложнений после облучения легких у крыс с помощью облучателя с визуальным контролем может позволить отработать методы ЛТ (различные дозы, объемы облучения, методики подведения, вовлеченность здоровых структур и дозовая нагрузка критических органов) при РЛ. Применение химио- и лечебных препаратов в лабораторных условиях на живых организмах, в частности крысах, также поможет исследовать воздействие новых препаратов совместно с ЛТ.
Цель работы: определение дозы и объема облучения мишени в легких у крыс, при которых характерно развитие лучевого пневмонита.
Предполагается использовать данное исследование в качестве базового для разработки модели радиационно-индуцированной легочной токсичности на животных.
Материал и методы
Экспериментальная работа состояла из следующих этапов:
-
1. Однократное облучение мишени в легких крыс в статическом или ротационном режимах, различными дозами (от 10 до 30 Гр), объемами (0,045–1,24 см3) и локализацией (левое или правое легкое, верх или низ легкого) под визуальным контролем с предварительным дозиметрическим планированием.
-
2. Проведение еженедельных КТ исследований для наблюдения развития лучевых повреждений (в течение 16 нед.).
-
3. Обработка снимков.
-
4. Анализ данных для определения дозы и объема облучаемой мишени, при которых развивается лучевой пневмонит.
Оборудование
Для облучения крыс и наблюдения в работе использовался облучатель с визуальным контролем SmART+ (Precision, Северный Бранфорд, Коннектикут, США), рисунок 1.

Рис. 1. Облучатель с визуальным контролем SmART +
Fig. 1. Image-guided irradiation platform SmART +
Аппарат, оснащенный рентгеновской трубкой, системой коллимации (фильтр для визуализации – 2 mm Al, фильтр для облучения – 0,3 mm Cu; фиксированный коллиматор, определяющий размер поля облучения), панелью визуализации (плоскопанельный детектор) и моторизованным трехмерно движущимся столиком, позволяет проводить облучение в статическом и ротационном режимах, а также выполнять диагностическое и топометрическое КТ сканирование. Облучение проводится при энергии 225 кВ. Мощность дозы для 10 мм коллиматора с круглым отверстием составляет 4,70 Гр/мин.
Группы животных
Для исследования были определены 4 группы крыс. Группы между собой отличались возрастом (10–16,5 мес.) и линией (Wag, Wistar). Группа G1: 6 животных ли- нии Wistar, возраст 16,5 мес., вес 650–850 г. Группа G2: 3 животных линии Wag, возраст 10 мес., вес 300–400 г. Группа G3: 3 животных линии Wag, возраст 11 мес., вес 350 г. Группа G4: 3 животных линии Wag, возраст 13 мес., 350–400 г. Все экспериментальные процедуры над животными проводились после оказания анестезиологического пособия. Применялся Золетил (Virbac, Франция) в дозировке 30 мг/кг, внутримышечное введение в заднебедренную группу мышц, атропин сульфат (Дальхимфарм, Россия) в дозировке 0,01 мг/кг массы тела животного инъецировался подкожно в холку.
Облучение
Подготовка к облучению включала КТ сканирование зоны облучения (весь объем легких, а также краниальный и каудальный отступы 5–10 мм), оконтуривание и дозиметрическое планирование. Оконтуривание выполнялось с помощью программного обеспечения SmART-ATP 2.0. В качестве оконтуренных структур определялись сердце, правое легкое, левое легкое, спинной мозг, мишень. На этапе дозиметрического планирования изоцентр, объем облучения, доза, методика облучения (статическое или ротационное) выбирались произвольно с учетом минимально возможных нагрузок на сердце и спинной мозг животного. Расчет доз производился программой SmART-ATP, использующей для расчета алгоритм МонтеКарло. Далее выполнялась выдача дозы по рассчитанному плану. Параметры рентгеновской трубки при облучении: составляли: напряжение 225 кВ, ток 30 мА. Животные во время топометрической подготовки находились на столике ускорителя в неподвижном состоянии. Контроль за животными осуществлялся с помощью камеры, расположенной внутри облучателя.
Наблюдение
Наблюдение за животными длилось 16 нед. и включало еженедельное измерение веса, частоты дыхательных движений, оценку общего состояния, проведение КТ сканирования легких. В период с 4-й по 6-ю нед. после облучения проводилось еженедельное сканирование. В остальное время сканирование осуществлялось раз в две недели. КТ-изображения в формате DICOM были получены с помощью системы SmART + при использовании 2 мм алюминиевого фильтра. Параметры рентгеновской трубки при сканировании составляли: напряжение 40 кВ, ток 5 мА. В случае смерти животного проводилось вскрытие и определение причины смерти.
Обработка снимков
-
1. Обработка снимков осуществлялась с помощью медицинского диагностического программного обеспечения AW VolumeShare 7 (GE Healthcare, Франция) и включало следующие этапы:
-
2. Подбор порога значений чисел HU с целью максимального захвата легких животного и исключения других тканей и органов (от –1023 HU до –322 ÷ –190 HU). В случаях, когда не удавалось автоматически удалить структуры (трахея, кишечник), эти структуры удалялись вручную.
-
3. Определение 3D области интереса (ROI). Было выделено 3 объема ROI: ROI1 – правое легкое, ROI2 – левое легкое, ROI3 – оба легких. Разделение на ROI1 и ROI2 проводилось условно по позвоночнику, ввиду особенностей строения легких – добавочная доля прилежит к каудальной доле правого легкого и левому легкому.
Анализ и сохранение данных.
Алгоритм анализа данных
Для определения доз и объема облучения, при которых характерно развитие лучевого пневмонита, был разработан следующий алгоритм:
-
1. Определение контрольных значений плотности легких (в единицах HU) здоровых животных.
-
2. Определение зависимостей параметров облучения (Dmean lung , D5 lung, Dmean heart, D5 heart, Dmean spinal cord, D5 spinal cord, % (), V target vs. Dose) и выживаемости животных после облучения.
-
3. Построение графиков значений средней плотности легких (в единицах HU) за весь период наблюдения.
-
4. Сравнение данных для облученных и контрольных животных.
-
5. Определение характерных значений дозы и объема облучения.
Результаты
В результате дозиметрического планирования были получены гистограммы дозаобъем (DVH) и определены следующие параметры: V – объем (cm3) оконтуренной структуры; Dmean – средняя доза (Гр), получаемая структурой за облучение (Гр); D95 – доза (Гр), которую получает 95% объема структуры; D5 – доза (Гр), которую получают 5% объема структуры.
Данные, выбранные на этапе планирования (методика облучения, размер коллиматора, доза, локализация), а также полученные с помощью гистограммы DVH, представлены в таблице 1.
Таблица 1. Параметры облучения животных и результаты расчетов доз, получаемых в результате дозиметрического планирования
Table 1. Irradiation parametersof animals and results of dose calcelation by dosimetric plianning
|
№ |
Метод подведения дозы Dosing method |
Доза, гр Dosr, gr |
R/L |
V (target) cm3 |
V (lung) cm3 |
% облуч. легкого % of lung irradiated |
D5 (lung) |
D5 (heart) |
D5 (sp. cord) |
Dmean (lung) |
Dmean (heart) |
Dmean (sp. cord) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
G1 rat3 |
VMAT |
16 |
R |
0,53 |
6,3 |
8 |
15,6 |
1,4 |
1 |
3,8 |
0,4 |
0,2 |
|
G1 rat4 |
VMAT |
20 |
L |
0,56 |
3,1 |
18 |
20,1 |
6,8 |
3,1 |
4,8 |
2 |
0,5 |
|
G1 rat5 |
VMAT |
30 |
L |
0,065 |
3,5 |
1,8 |
12,8 |
3 |
1,6 |
1,7 |
0,5 |
0,2 |
|
G1 rat6 |
VMAT |
30 |
L |
0,063 |
5,5 |
1,1 |
7,5 |
4,8 |
2,5 |
1,2 |
0,7 |
0,3 |
|
G2 rat1 |
статика static |
12 |
L |
1,24 |
4,23 |
29,3 |
12,1 |
0,2 |
0,1 |
3,5 |
0,1 |
0,1 |
Окончание табл. 1
End of table 1
|
№ |
Метод подведения дозы Dosing method |
Доза, гр Dosr, gr |
R/L |
V (target) cm3 |
V (lung) cm3 |
% облуч. легкого % of lung irradiated |
D5 (lung) |
D5 (heart) |
D5 (sp. cord) |
Dmean (lung) |
Dmean (heart) |
Dmean (sp. cord) |
|
G2 rat2 |
статика static |
15 |
L |
0,22 |
5,34 |
4,1 |
2,3 |
0,1 |
0,1 |
0,7 |
0,1 |
0 |
|
G2 rat3 |
статика static |
15 |
L |
0,2 |
2,72 |
7,4 |
13,4 |
0,1 |
0 |
1,2 |
0 |
0 |
|
G3 rat1 |
VMAT |
16 |
R |
0,045 |
3,78 |
1,2 |
5 |
11 |
1,3 |
0,7 |
0,2 |
0,2 |
|
G3 rat2 |
VMAT |
20 |
L |
0,047 |
3,9 |
1,2 |
9,1 |
5,5 |
3,9 |
1,3 |
1,2 |
0,5 |
|
G3 rat3 |
статика static |
12 |
L |
0,33 |
3,35 |
9,8 |
11,7 |
0,2 |
0,1 |
1,3 |
0,1 |
0 |
|
G4 rat1 |
VMAT |
12 |
R |
0,27 |
6,37 |
4,2 |
11 |
6,1 |
3,3 |
1,6 |
1,5 |
0,9 |
|
G4 rat2 |
VMAT |
20 |
L |
0,046 |
4,67 |
0,98 |
6,1 |
0,6 |
0,7 |
1 |
0,1 |
0,1 |
|
G4 rat3 |
статика static |
20 |
R |
0,55 |
5,1 |
10,8 |
20,1 |
0,2 |
0,2 |
2,9 |
0,1 |
0,1 |
Note: VMAT – Volumetric modulated are therapy.
Анализ зависимостей параметров облучения
Данные таблицы 1 были использованы для анализа параметров облучения и выживших животных. Выявлена статистически значимая корреляция объема мишени и подведенной дозы (Vtarget vs. Dose), коэффициент корреляции Пирсона составил –0,54 (рис. 2).
Е
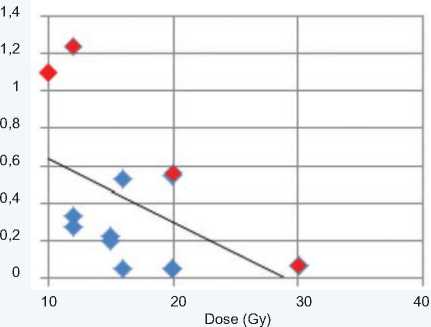
Рис. 2. Зависимость параметров облучения V target vs. Dose. Умершие животные показаны красным маркером
Fig. 2. Irradiation parameter V target vs. Dose. Dead animals are shown with a red marker выполнялось с помощью t-критерия Стьюдента для зависимых выборок.
На примере rat2.2 представлены изменения средних значений плотности в единицах Хаунсфильда (HU) легких (правое-R, левое-L, оба-both) в течение всего периода наблюдения (16 нед.), таблица 2. Построены графики (рис. 3), отражающие зависимости средних значений плотностей HU (R), HU (L), HU (both) vs. Week (неделя наблюдения).
Таблица 2. Средние значения плотности легких (R, L, both) в числах Хаунсфильда (HU) для животного rat2.2
Анализ графика показал, что точки, соответствующие умершим животным (красный маркер), лежат выше аппроксимационной линии.
Средние значения плотности легких облученных животных
Используя алгоритм анализа данных, описанный выше, была выполнена обработка 90 серий снимков КТ сканирования животных (период наблюдения – 16 нед.). Были получены средние значения плотности легких (в единицах HU). На основании данных средних значений плотности были построены графики изменений среднего значения плотности (HU) легких в зависимости от недели наблюдения. Обработка снимков проводилась двумя группами исследователей независимо. Сравнение данных двух групп не выявило статистически значимых различий ( p = 0,826). Сравнение средних значений HU
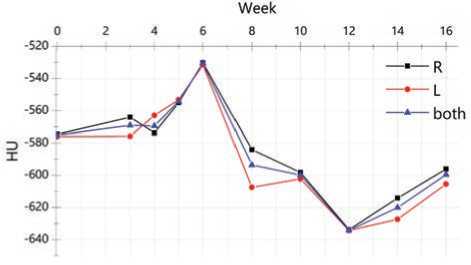
Рис. 3. Средние значения плотности легких в числах Хаунсфильда в зависимости от недели наблюдения для животного rat2.2: R – правое легкое, L – левое легкое,both – оба легких
Fig. 3. The mean lung density in Hounsfield units depending on follow-up week for animal rat2.2: R – right lung, L – left lung, both – both lungs
Table 2. The mean lung density in Hounsfield units (HU) (R, L, both) for animal rat2.2
|
Неделя Week |
HU (R) |
HU (L) |
HU (boh) |
|
0 |
–574,5 |
–575,9 |
–575 |
|
2 |
564 |
–575,7 |
–569 |
|
4 |
–573,7 |
–562,9 |
–569,4 |
|
5 |
–555 |
–553,2 |
–554,2 |
|
6 |
–530,2 |
–531,6 |
–530,5 |
|
8 |
–584 |
–607б4 |
–593,5 |
|
10 |
–598,1 |
–602,2 |
–599,8 |
|
12 |
–633,8 |
–634,2 |
–634,2 |
|
14 |
–614,1 |
–627,3 |
–620 |
|
16 |
–596 |
–605,4 |
–599,5 |
Определение контрольных значений
Определение среднего значения HU легких здоровых крыс (контрольные значения) проводилось на основании данных «0 недели» (топометрические снимки до облучения) и КТ снимков здоровых животных вивария (того же возраста и веса, что и участвующие в эксперименте животные). Всего было использовано 16 серий снимков здоровых животных. Обработка снимков осуществлялась по тому же алгоритму, что и для облученных животных.
На основании средних значений HU посчитан усредненный показатель «средних значений HU» – (HU: –519,6) и определено стандартное отклонение – (± 46,2). Таким образом, был установлен «коридор» значений «среднего значения плотности легкого (в единицах HU)» для крыс.
Анализ средних значений плотности легких (в единицах HU) у облученных животных
Для достижения поставленной в работе цели, а именно определения дозы и объема облучения, при которых характерно развитие лучевого пневмонита, то есть появление очагов пневматизации (областей в легких со значениями HU выше, чем у здоровых животных), проведено сравнение данных для облученных животных и контрольных значений. Для этого были построены графики средних значений HU всех облученных животных (черный график) за весь период наблюдения с так называемым «коридором» контрольных значений. Середина «коридора» (зеленая линия) – это усредненное значение для здоровых животных (HU:-519,6), верхняя граница (красная линия) – это усредненное значение для здоровых животных плюс стандартное отклонение (HU: –473,3), нижняя граница (синяя линия) – это усредненное значение для здоровых животных минус стандартное отклонение (HU:-565,8). Характерное увеличение плотности (выход из «коридора») в период со 2-й по 6-ю нед. считался проявлением лучевого пневмонита. Данный эффект наблюдается для двух животных rat1.3 и rat2.3 (рис. 4).
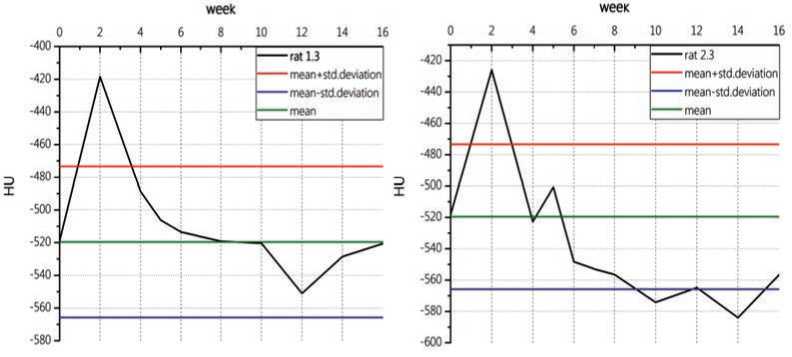
Рис. 4. Графики для животных rat1.3 (слева) и rat2.3 (справа): среднее значение плотности для облученных животных (черная линия), усредненное значение плотности легких здоровых животных (зеленая линия), усредненное значение для здоровых животных плюс стандартное отклонение (красная линия), усредненное значение для здоровых животных минус стандартное отклонение (синяя линия)
Fig. 4. Charts for animals rat1.3 (left) and rat2.3 (right): the mean lung density for irradiated animals (black), the mean lung density for healthy animals (green), the mean lung density for healthy animals plus SD (red ), the mean lung density for healthy animals minus SD (blue)
Note: SD - Среднеквадратическое отклонение
Обсуждение
В рамках исследования проводилось облучение мишени в легких у крыс различными дозами и объемами, а также наблюдение развития лучевого пневмонита.
Анализ областей интереса
При построении графиков среднего значения плотности легкого (в единицах HU) в зависимости от недели наблюдения для ROI1, ROI2 и ROI3 различия не существенны. Сравнение проводилось для значений облученного легкого и общего объема двух легких по критерию Манна – Уитни ( p = 0,05). По этой причине итоговый анализ данных выполнялся только для ROI3. Также, используя в анализе ROI3, мы исключили неопределенность, связанную с неоднозначным разделением на снимках объемов правого и левого легких.
Описание снимков
Для независимой проверки данных эксперимента для всех животных были составлены протоколы описания КТ снимков врачом-рентгенологом (с опытом клинической работы более 20 лет).
Появление участка снижения пневматизации по описанию КТ снимков наблюдается у rat1.3, rat2.2, rat3.2, rat4.1. Пример лучевого пневмонита для животного rat3.2 c 0-й по 6-ю нед. показан на рисунке 5.
Использование данных исследования
В работе было показано, что параметр «среднее значения плотности легкого (в единицах HU)» может использоваться для количественного анализа изменений в легком после облучения. Согласие экспериментальных данных с описанием снимков врачом-рентгенологом позволяет сделать вывод о возможности использования полученных результатов (характерной дозы и объема облучения, при которых развивается лучевой пневмонит) для планирования нового эксперимента, в котором можно получить средние значения плотности легких HU облученных тканей легкого на большой популяции жи- вотных, а также далее планировать эксперимент с применением химиопрепаратов и лекарственных средств, предотвращающих появление лучевого пневмонита или снижающих его проявления. Такое исследование будет важно для доклинических экспериментов новых препаратов.
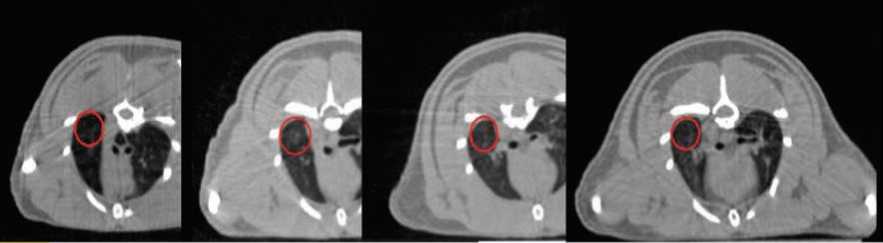
Рис. 5. Этапы развития лучевого пневмонита (0, 2, 4, 6 нед.) для животного rat3.2. Показан участок снижения пневматизации (выделен красным цветом)
Fig. 5. Radiation pneumonitis progression (weeks 0, 2, 4, 6) for animal rat 3.2. The region of decreasing aeration is shown (red circle)
Выводы
По результатам анализа параметров облучения и выживших животных установлено, что:
Увеличение средней дозы (Dmean) на легкое более 3 Гр приводит к увеличению смертности.
Доза облучения 30 Гр ведет к смертности вне зависимости от Dmean и D5 (на легкое, сердце, спинной мозг).
Объем облученного легкого более 15% приводит к увеличению смертности.
По графикам изменений средних значений плотности легкого (в единицах HU) и описания КТ снимков определены доза и объем облучения мишени в легких у крыс, при которых характерно развитие лучевого пневмонита. При дозе облучения 16 Гр и объеме облученного легкого не менее 0,5 см3 (8% общего объема легких) типично появление участка снижения пневматизации в зоне облучения.
В результате выполнения работы была разработана методика количественного анализа экспериментальных данных после облучения легких крыс.
Планируется исследование с большим количеством животных, а также разработка метода автоматической обработки КТ снимков для определения среднего значения плотности легких.
Список литературы Изучение развития лучевого пневмонита в легких у крыс при ротационном и статическом облучении
- Vinod S. International patterns of radiotherapy practice for non-small cell lung cancer. Semin. Radiat. Oncol. 2015;25(2):143–150. DOI: 10.1016/j.semradonc. 2014.11.001.
- Shafi q J., Hanna T., Vinod S., Delaney G., Barton M. A population-based model of local control and survival benefi t of radiotherapy for lung cancer. Clin. Oncol. (R. Coll. Radiol.). 2016;28(10):627–638. DOI: 10.1016/j.clon.2016.05. 006.
- National Cancer Institute. Surveillance, epidemiology, and end results (SEER) program. Statistical resources. U.S. population data 1969–2004. URL: https://seer.cancer.gov/statfacts/html/lungb.html (31.01.2023).
- Kepka L., Socha J. Dose and fractionation schedules in radiotherapy for non-small cell lung cancer. Transl. Lung Cancer Res. 2021;10(4):1969–1982. DOI: 10.21037/tlcr-20-253.
- Brada M., Forbes H., Ashley S., Fenwick J. Improving Outcomes in NSCLC: Optimum Dose Fractionation in Radical Radiotherapy Matters. J. Thorac. Oncol. 2022;17(4):532–543. DOI: 10.1016/j.jtho.2022.01.006.
- Marks L., Yorke E., Jackson A., Ten Haken R.K., Constine L.S., Eisbruch A. et al. Use of normal tissue complication probability models in the clinic. Int. J. Radiat. Oncol. Biol. Phys. 2010;76(3):S10–S19. DOI: 10.1016/j.ijrobp.2009.07.1754.
- Christian J., Bedford J., Webb S., Brada M. Comparison of inverse-planned three-dimensional conformal radiotherapy and intensity-modulated radiotherapy for non-small-cell lung cancer. Int. J. Radiat. Oncol. Biol. Phys. 2007;67(3):735–741. DOI: 10.1016/j.ijrobp.2006.09.047.
- Panakis N., McNair H., Christian J., Mendes R., Symonds-Tayler J.R., Knowles C. et al. Defi ning the margins in the radical radiotherapy of non-small cell lung cancer (NSCLC) with active breathing control (ABC) and the eff ect on physical lung parameters. Radiother. Oncol. 2008;87(1):65–73. DOI: 10.1016/j.radonc.2007.12.012.
- Bedford J., Nordmark H., McNair H.A., Aitken A.H., Brock J.E., Warrington A.P. et al. Treatment of lung cancer using volumetric modulated arc therapy and image guidance: a case study. Acta. Oncol. 2008;47(7):1438–1443. DOI: 10.1080/02841860802282778.
- Partridge M., Ramos M., Sardaro A., Brada M. Dose escalation for nonsmall cell lung cancer: analysis and modelling of published literature. Radiother. Oncol. 2011;99(1):6–11. DOI: 10.1016/j.radonc.2011.02.014.
- Bentzen S., Gregoire V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin. Radiat. Oncol. 2011;21(2):101–110. DOI: 10.1016/j.semradonc.2010.10.001.
- van Elmpt W., De Ruysscher D., van der Salm A., Lakeman A., van der Stoep J., Emans D. et al. The PET-boost randomised phase II dose-escalation trial in non-small cell lung cancer. Radiother. Oncol. 2012;104(1):67–71. DOI: 10.1016/j.radonc.2012.03.005.
- Piroth M., Pinkawa M., Holy R., Klotz J., Schaar S., Stoff els G. et al. Integrated boost IMRT with FET-PET-adapted local dose escalation in glioblastomas. Results of a prospective phase II study. Strahlenther. Onkol. 2012;188(4):334–339. DOI: 10.1007/s00066-011-0060-5.
- Bradley J., Paulus R., Komaki R., Masters G., Blumenschein G., Schild S. et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet. Oncol. 2015;16(2):187–199. DOI: 10.1016/S1470-2045(14) 7120 7-0.
- van Luijk P., Faber H., Meertens H., Schippers J.M., Langendijk J.A., Brandenburg S. et al. The impact of heart irradiation on dose-volume eff ects in the rat lung. Int. J. Radiat. Oncol. Biol. Phys. 2007;69(2):552–559. DOI: 10.1016/j.ijrobp.2007.05.065.
- Liao Z., Travis E., Tucker S. Damage and morbidity from pneumonitis after irradiation of partial volumes of mouse lung. Int. J. Radiat. Oncol. Biol. Phys. 1995;32(5):1359–1370. DOI: 10.1016/0360-3016(94)00660-D.
- Tucker S., Liao Z., Travis E. Estimation of the spatial distribution of target cells for radiation pneumonitis in mouse lung. Int. J. Radiat. Oncol. Biol. Phys. 1997;38(5):1055–1066. DOI: 10.1016/s0360-3016(97)00131-4.


