Изучение содержания белка и липид-белкового соотношения в периферическом нерве крысы в норме и после травмы
Автор: Громова Н.В., Дуленова Е.А., Мельникова Н.А., Морозова А.А., Пиняев С.И., Ревин В.В., Спирина Ю.П.
Журнал: Огарёв-online @ogarev-online
Статья в выпуске: 24 т.4, 2016 года.
Бесплатный доступ
Проводилось исследование миелин-специфических белков и их изменений при повреждении периферического нервного волокна. Также определяли количество белка в миелиновой оболочке нерва. Установлено, что после повреждения содержание белка в нерве изменяется.
Миелин-специфические белки, периферический нерв, регенерация нерва
Короткий адрес: https://sciup.org/147249253
IDR: 147249253 | УДК: 612.123:612.015.348:599.323.4
Текст научной статьи Изучение содержания белка и липид-белкового соотношения в периферическом нерве крысы в норме и после травмы
Детальное понимание структуры миелина и функций белка на молекулярном уровне необходимы для того, чтобы полностью понять их физиологические роли в миелиновой оболочке.
Материалы и методы исследования. Объектами исследования послужили белые беспородные крысы массой 150-250 г. Материалом исследования послужили седалищные нервы крыс. Животных содержали в условиях вивария в индивидуальных клетках в условиях 12 часового дня и ночи со свободным доступом к пище и воде. Эксперименты на животных выполнены под хлороформным наркозом в стерильных условиях экспериментальной операционной. Все манипуляции с животными осуществлялись в соответствии с «Правилами проведения работы с использованием экспериментальных животных» (приказ Минвуза от 13.11.1984 г. № 724).
Для исследования животные были распределены на четыре группы. К первой группе относились животные без повреждения седалищного нерва (контрольная группа без введения антибиотика); ко второй группе – животные с раздавливанием нерва, выведенные из эксперимента на 7 день; третья группа – животные с раздавливанием нерва, выведенные из эксперимента на 14 день; четвертая группа – животные с раздавливанием нерва, выведенные из эксперимента на 21 день.
Для создания модели повреждения животным сдавливали седалищный нерв в верхней трети бедра под хлороформным наркозом. Сдавливание осуществлялось кровоостанавливающим незазубренным зажимом, в положении первого зубца в течение 30 сек [1], с последующим наложением швов на мышечные/кожные ткани и подкожным введением 100 мкл раствора гентамицина концентрации 40 мг/мл.
Отпрепарированные нервы помещались в раствор Рингера (6,5 г NaCl, 0,42 г KCl и 0,25 г CaCl2, растворенные в 1 литре бидистиллированной воды) для теплокровных с температурой 37° С и выдерживались там 15 мин, после чего проводились исследования.
Для достижения поставленных целей были применены биохимические методы (определение содержания белка в миелиновой фракции методом Петерсона, определение общего содержания белка биуретовым методом, выделение белков миелиновой фракции), а также современные спектральные методы анализа (КР-спектроскопия).
Выделение белков миелиновой фракции (W.Norton and S. Poduslo, 1973). Нервные волокна были гомогенизированы в ступке тефлоновым пестиком в 0,8 М сахарозе (рН 7,0) в соотношении 1:2 соответственно. Далее гомогенат переносили в пробирку (500 мкл) и наслаивали сверху раствор 0,32 М сахарозы (250 мкл). Центрифугирование проводилось при 18 000 g, 4° С в течение 1 часа.
Полученный белый межфазный слой (≈400мкл.) осторожно удаляли из каждой центрифужной пробирки, ресуспендировали в 0,8 М сахарозы (4 мл), а затем гомогенизировали.
К гомогенату (≈750 мкл) добавляли 0,32 М сахарозу (≈250 мкл.) (наслаиванием), центрифугировали при 18 000 g, 4° С в течение 60 мин. После центрифугирования, межфазный слой суспендировали в 0,24 М сахарозе, и центрифугировали при 10000 g в течение 10 мин с целью устранения загрязнения микросом.
Затем плотно упакованный осадок гомогенизировали в дистиллированной воде и снова центрифугировали при 10000 g в течение 10 мин.
Полученная белковая фракция состояла из сырого миелина и была использована для проведения дальнейших анализов.
Определение общего содержания белка биуретовым методом (A. Gornall, 1949). Метод основан на способности белков давать с раствором сернокислой меди фиолетовое окрашивание в щелочной среде. Для биуретовой реакции необходимо наличие двух ОН-групп и трех атомов азота, находящихся в полипептидной цепи. Группа, образующая пептидную связь (– ОС – NH –) в щелочной среде, присутствует в своей таутомерной форме. В избытке щелочи происходит диссоциация водорода енольной ОН-группы, при этом возникает отрицательный заряд, с помощью которого кислород, взаимодействуя с медью, образует соль; кроме того, медь образует дополнительные (дативные) связи с атомами азота пептидных связей. Возникший комплекс характеризуется высокой стабильностью.
В пробирки, содержащие 1 мл раствора белка соответствующего разведения приливали 4 мл биуретового реактива, перемешивали и оставляли при комнатной температуре на 30 мин.
Измеряли оптическую плотность раствора на спектрофотометре UVmini-1240 при 540 нм в 1 см кювете.
Содержание белка в исследуемых растворах рассчитывали по калибровочному графику.
Определение содержания белка в миелиновой фракции по Петерсону (G.Peterson, 1983). Данный метод характеризуется высокой чувствительностью (10 – 100 мкг белка), позволяет эффективно определять белок в мембранных фракциях.
К 1 мл исследуемого раствора, содержащего белок, приливали 1 мл реагента А, перемешивали и оставляли при комнатной температуре на 10 мин. Затем в пробирку с реакционной смесью добавляли 0,5 мл реактива В, тщательно перемешивали и через 30 мин определяли оптическую плотность раствора на спектрофотометре UVmini-1240 при 670 нм в 1 см кювете.
Содержание белка в исследуемых растворах рассчитывали по калибровочному графику.
Спектроскопия комбинационного рассеяния нерва (S. Morisaki, 2013). Комбинационное рассеяние света – это рассеяние света веществом, сопровождающееся заметным изменением частоты рассеиваемого света. В основе метода лежит взаимодействие монохроматического излучения (лазерного) с веществом, частицы которого испытывают периодические изменения [2]. Спектр КР исследуемого вещества – это зависимость интенсивности КР от частотного сдвига. Изменение положения максимума пика в спектре
КР или изменение относительной интенсивности пика связаны с изменением параметров связи/связей в молекуле и, следовательно, свидетельствуют об изменении конформации молекулы [3]. Одним из преимуществ КР спектроскопии является высокая чувствительность к незначительным изменениям в структуре исследуемых веществ, а также простота пробоподготовки и большой объем получаемой информации. Поэтому все, что требуется для сбора спектра – это направить падающий луч точно на образец, а затем собрать рассеянный свет.
Исследование конформации белков было выполнено на рамановском спектрометре in Via Raman Microscope фирмы Renishaw (Англия) с короткофокусным высокосветосильным монохроматором, фокусное расстояние которого не более 250мм. Для возбуждения рамановских спектров использовали лазер (длина волны излучения 532 нм, мощность излучения 5 мВт, объектив 5х). Регистратор данных – CCD детектор (1024х256 пикселей с пельтье-охлаждением до –700С) с решеткой 1800 штр/мм.
Результаты и обсуждение. В первой серии эксперимента нами было определено общее содержание белка в нерве биуретовым методом. Повреждение нерва приводит к уменьшению содержания белка. Так, через неделю после повреждения содержание белка снижается на 59,1% (рисунок 1). В течение следующих двух недель посттравматического периода содержание белка постепенно увеличивается и через 3 недели после нанесения повреждения лишь на 11,9% отличалось от контрольных значений (см. рис. 1).
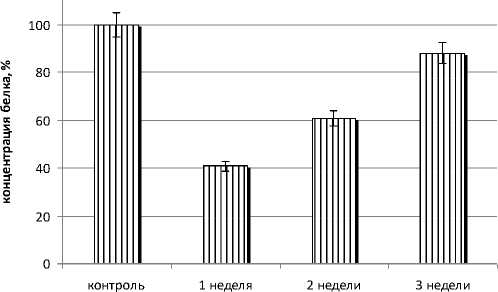
Рис. 1. Количественное изменение содержания общего белка поврежденного периферического нерва в норме и после повреждения (р ≤0,05).
Полученные результаты объясняются тем, что после травмы седалищного нерва начинается дегенерация поврежденных тканей: происходят биохимические и биофизические изменения. Вес нерва и содержание в нем воды увеличиваются, понижается концентрация липоидов мякотной оболочки. Изменяется активность различных ферментов.
Постепенно в поврежденных нервах начинаются процессы регенерации, в основе которой лежит реакция нейронов на нарушенное равновесие в системе «нервная клетка – периферическое нервное окончание». Регенерация является сложным процессом восстановления этого равновесия, осуществляемого взаимодействием нервной клетки с центральным отрезком соответствующего нервного волокна, шванновским синцитием, соединительнотканными элементами.
Аналогично общим белкам нерва изменяется количество белка миелиновой фракции (см. рис. 2). Через 1 неделю после повреждения седалищного нерва происходит достоверное снижение концентрации белка на 16,68% по сравнению с контролем; далее с течением времени концентрация белка в миелиновой фракции увеличивается, причем становится больше контрольных значений на 3,47% и 23,4% через 2 и 3 недели после повреждения нерва соответственно.
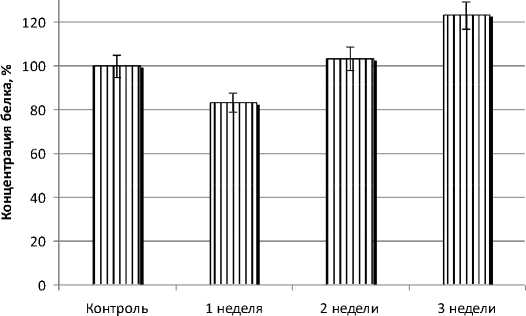
Рис. 2. Количественное изменение содержания белка в миелиновой фракции по Петерсону (р ≤ 0,05).
При изучении процессов, происходящих в поврежденном периферическом нерве, нами были получены спектры комбинационного рассеяния в области 2800-3000 см-1, в этой области для анализа нами были взяты полосы интенсивности 2940 и 2853 см-1(рисунок 3).
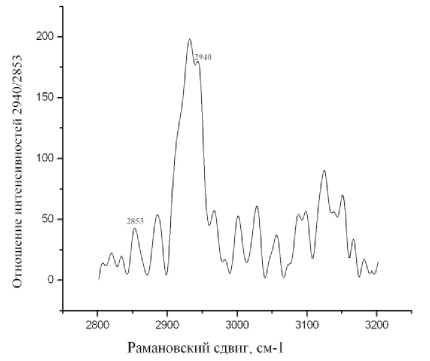
Рис. 3. Спектр комбинационного рассеяния неповрежденного седалищного нерва.
В спектре КР неповрежденной нервной ткани отображаются три важных пика в области 2800-3000 см-1. Анализ клеточных спектров предположил, что спектр седалищного нерва отражает компоненты аксона и миелина. Для миелина характерны полосы 2853 и 2885 см-1 полученные от липидов, а периферическая нервная ткань содержит большое количество липидов в составе миелиновых оболочек, которые окружают аксоны. Миелин швановских клеток включает в себя сфингомиелин и гликолипид галактоцереброзид [4]. Полоса 2940 см-1 соответствует C – H 3 симметричным валентным колебаниям, отражающим в основном содержание белка. Нервная ткань, структура, которая содержит много аксонов и белковых нейрофиламентов, последние в свою очередь, являются обильными фибриллярными компонентами цитоплазмы аксона. Нейрофиламенты состоят из полипептидных цепей с высоким содержанием остатков глутаминовой кислоты. Характерные полосы в спектре КР на 2940см-1 и 2853 см-1 определяют соотношение белкового компонента (белки аксона) к липидному компоненту (липиды миелина) путем деления 2940 см-1 на 2853 см-1.
В ходе анализа спектра КР в норме и при повреждении обнаружены следующие результаты: соотношение белок/липид через 1 неделю уменьшается на 9,1%; через 2 недели увеличивается на 18,6%; через 3 недели увеличивается на 92,1%; на 5 неделе увеличивается на 14,2% по сравнению с контролем.
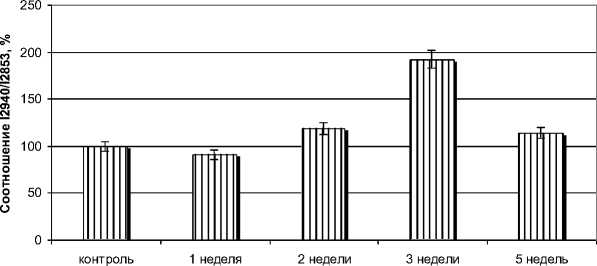
Рис. 4. Количественный анализ соотношения интенсивностей полос (I 2940 /I 2853 ) для каждого момента времени (р ≤0,05).
Полученные результаты мы можем объяснить тем, что после валлеровской дегенерации количество аксонов увеличивается и шванновские клетки начинают ремиелинизироваться вокруг аксонов, что приводит к увеличению содержания белка и липидов и накоплению их в периферической нервной ткани [5]. Следовательно, этим явлением можно объяснить изменение количественного соотношения интенсивности полос (I2940/I2853) в сторону увеличения.
Заключение.
-
1. Проанализировано содержание общего белка в норме и при повреждении и
- установлено, что с увеличением времени повреждения содержание его уменьшается. Через 1 неделю происходит уменьшение содержания общего белка на 59,1%; через 2 недели – на 39,2%; через 3 недели – 11,9% по сравнению с контролем.
-
2. Определено содержание белка в миелиновой фракции в норме и после повреждения и показано, что через 1 неделю после повреждения содержание белка уменьшается на 16,7%; через 2 недели содержание белка увеличивается на 3,5%; через 3 недели содержание белка увеличивается на 23,4% по сравнению с контролем.
-
3. Изучено соотношение белок/липид в норме и при повреждении. Получено, что соотношение максимально увеличивается через 3 недели.
Список литературы Изучение содержания белка и липид-белкового соотношения в периферическом нерве крысы в норме и после травмы
- Bridge P. M., Ball D. J., Mackinnon S. E. et al. Nerve crush injuries - a model for axonotmesis // Exp. Neurol. - 1994. - Vоl. 127. - P. 284-290.
- Morisaki S., Ota Ch., Matsuda K., Kaku N., Fujiwara H., Oda R., Ishibashi H., Kubo T., Kawatac M. Application of Raman spectroscopy for visualizing biochemical changes during peripheral nerve injury in vitro and in vivo // Journal of Biomedical Optics. - 2013. - Vol. 18. - No. 11.
- Копачевский В. Рамановская микроспектроскопия и КАРС-микроскопия для биологических применений // Наноиндустрия. - 2009. - № 4. - С. 72-75. EDN: OBQRNX
- Kim T., Pfeiffer S. E. Myelin glycosphingolipid/cholesterol-enriched microdomains selectively sequester the non-compact myelin proteins CNP and MOG // J. Neurocytol. - 1999. - No. 28. - P. 281-293. EDN: LTZMCP
- Ceballos D., Cuadras J., Verdu E., Navarro X. Morphometric and ultrastructural changes with ageing in mouse peripheral nerve // J. Anat. - 1999. - No. 195. - P. 563-576.


