Изучение сообщества микроорганизмов, выделенного из района солеразработок
Автор: Ананьина Л.Н., Алтынцева О.В., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 6, 2005 года.
Бесплатный доступ
Из района солеразработок выделено сообщество микроорганизмов, способное к эффективному росту на нафталине в качестве единственного источника углерода и энергии в присутствии до 9% хлорида натрия. Микробная ассоциация состоит из 7 штаммов бактерий, которые предварительно определены до родов: Rhodococcus, Deleya, Aquaspirillum, Arthrobacter и Microbacterium. Два штамма рода Rhodococcus способны осуществлять разложение нафталина. Исследовано влияние минерализации среды на качественный состав микробного сообщества.
Короткий адрес: https://sciup.org/147204355
IDR: 147204355 | УДК: 579.262:57.083.18
Текст научной статьи Изучение сообщества микроорганизмов, выделенного из района солеразработок
В настоящее время остро стоит проблема очистки окружающей среды от полициклических ароматических углеводородов (ПАУ). Соединения этого класса обладают канцерогенным, мутагенным, токсичным эффектами и способны к аккумуляции природными объектами (Kanaly, Harayama, 2000). Существенный вклад в загрязнение почв и водоемов ПАУ вносят предприятия химической промышленности. В литературе описаны микроорганизмы и микробные сообщества, способные к эффективной деструкции нафталина, фенантрена и ряда других ПАУ (Пунтус и др., 1997; Суровцева и др., 1997; Плотникова и др., 2001; Бабошин и др., 2003; Boldrin et al., 1993). Такие штаммы-деструкторы и их ассоциации используются в биотехнологиях восстановления загрязненных территорий (Boonchan et al, 2000; Kanaly et al, 2000).
В ряде случаев почвенные и водные экосистемы, загрязненные ПАУ, подвергаются воздействию других неблагоприятных факторов, в частности, влиянию повышенной концентрации солей. Повышенное содержание солей в почвах ограничивает применение для их очистки биопрепаратов, содержащих штаммы микроорганизмов, неадаптированных к экстремальным условиям существования (Ward, Brock, 1978; Kastner et al., 1998; Hamme et al., 2003). Следовательно, особый интерес вызывает изучение микроорганизмов и их сообществ, способных к деструкции ПАУ, выделенных из экониш с высоким уровнем загрязнения и повышенным содержанием солей (Geiselbrecht et al., 1996; Hedlund et al., 1999; Chung, King, 2001).
Цель настоящего исследования - выделение и изучение сообщества микроорганизмов, перспек тивного для использования в биоремедиации высокоминерализованных почв, загрязненных ПАУ.
Методы исследования
Выделение микробного сообщества и штаммов бактерий. Образец почвы был отобран с глубины 5-10 см на расстоянии 10 м от солеот-вала (г. Березники, Пермский край). Для получения накопительной культуры 1 г почвы вносили в колбу (объем 250 мл), содержащую 100 мл минеральной среды Раймонда (Розанова, Назина, 1982), нафталин (0.1%), NaCI (6%) и инкубировали на термостатируемой качалке. УВМТ-12-250 при 100 об ./мин. и 28°С до появления микробного роста. Сообщество микроорганизмов выделяли путем многократных пересевов накопительной культуры и культивирования при вышеперечисленных условиях. Чистые культуры микроорганизмов выделяли на полноценной агаризованной среде Раймонда в присутствии 3% NaCI (Плотникова и др., 2001).
Динамика роста сообщества микроорганизмов и штаммов бактерий. Сообщество микроорганизмов и штаммы-деструкторы выращивали в колбах (объем 250 мл) в 100 мл минеральной среды Раймонда в присутствии разных (3%, 6%, 7.5%) концентраций NaCI и без соли, с нафталином (0.1%) в качестве единственного источника углерода и энергии на качалке УВМТ-12-250 (100 об./мин.) при 28°С. Измерение оптической плотности (OD) проводили на ФЭК-5 6М с длиной волны 540 нм в кюветах с длиной оптического пути 0.5 см.
Количество колониеобразующих единиц (КОЕ) определяли методом серийных разведений с последующим высевом и подсчетом колоний микроорганизмов на чашках с полноценной средой Раймонда в присутствии 3% NaCI.
Идентификация чистых культур бактерий. Морфологию и подвижность клеток исследовали с помощью световой микроскопии (микроскоп Leica DM LS, укомплектованный фазово-контрастным устройством).
Изучение физиолого-биохимических и хемо-таксономических признаков проводили согласно ранее описанным рутинным методам (Методы общей бактериологии, 1983; Методы почвенной микробиологии и биохимии, 1991). Способность к росту микроорганизмов в присутствии разных концентраций хлорида натрия определяли при культивировании на полноценной модифицированной среде Раймонда (см. выше). Идентификацию выделенных штаммов проводили на основе морфологических, физиолого-биохимических и хемотаксономических характеристик с использованием “Определителя бактерий Берджи” (1997).
Результаты исследований и обсуждение
Выделение микробного сообщества и идентификация штаммов бактерий
Из высокоминерализованной и загрязненной отходами химических предприятий почвы методом накопительных культур изолировано микробное сообщество, обозначенное СМБ-3. Установлено, что состав сообщества сохраняется в течение 15-20 последовательных пересевов на селективные среды.
Эксперименты по выращиванию микробного сообщества на агаризованных и в жидких мине ральных средах показали, что СМБ-3 способно к росту на нафталине как единственном источнике углерода и энергии при высоких концентрациях соли (до 9 % NaCl в среде культивирования).
Путем высева на агаризованную полноценную среду, содержащую 3% NaCl, обнаружено семь различающихся по морфологии колоний штаммов бактерий, которые были отобраны для дальнейших исследований.
Грамположительные штаммы, обозначенные БЗ-7 и БЗ-8, представлены бледно-розовыми матовыми колониями, в молодых культурах преобладают неправильные удлиненные палочки или гифы, распадающиеся с возрастом на короткие палочковидные фрагменты и кокки (рис. 1, В). Штамм БЗ-7 на агаризованной среде образует субстратный мицелий. В гидролизатах целых клеток обоих штаммов присутствует мезо-диаминопиме-линовая кислота. У штаммов выявлены миколовые кислоты, идентичные таковым у представителей рода Rhodococcus. По перечисленным выше признакам штаммы отнесены к данному роду.
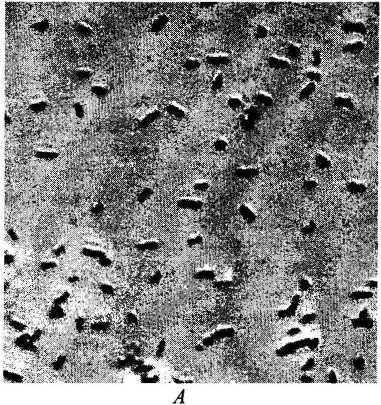
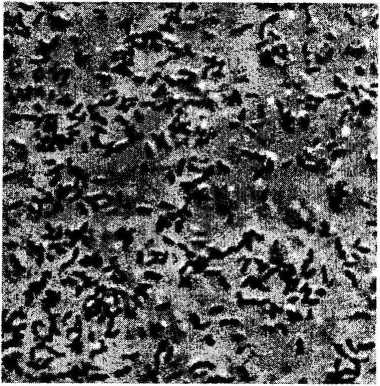
Из микробного сообщества выделены штаммы, способные к эффективному росту на полноценной среде Раймонда в присутствии до 29% хлорида натрия. Штаммы обозначены как БЗ-1 и БЗ-5 (таблица). Исследуемые индивидуальные культуры на полноценной среде образуют округлые, выпуклые, с ровным краем колонии палевого (штамм БЗ-1) и желтого (штамм БЗ-5) цвета. Клетки штаммов представляют собой грамотрицатель-ные, оксидазоотрицательные, каталазоположительные подвижные палочки (рис. 1, А, Б).
Рост бактериальных культур из микробного сообщества БЗ в присутствии ' различных концентраций хлорида натрия
|
Штамм |
Полноценная среда Раймонда, % концентрации NaCl |
Минеральная среда Раймонда с нафталином, % концентрации NaCl |
||||||||
|
0 |
3 |
8 |
10 |
17 |
29 |
0 |
7.5 |
8 |
9 |
|
|
БЗ-1 |
— |
+4-4- |
4-4-4- |
+++ |
+++ |
+ |
— |
— |
— |
|
|
БЗ-2 |
4-4- Ь |
+++ |
4*4—Н |
+ |
— |
— |
— |
— |
— |
— |
|
БЗ-З |
4-4-4- |
4-4-4- |
4-4-4- |
4-++ |
— |
— |
— |
—• |
— |
— |
|
БЗ-4 |
+++ |
+++ |
+++ |
— |
— |
— |
— |
— |
— |
— |
|
БЗ-5 |
++ |
4-+4 |
+++ |
+++ |
+++ |
+ |
— |
— |
— |
— |
|
БЗ-6 |
4-4*4- |
4-4-4- |
4-4-4* |
— |
— |
— |
— |
— |
— |
— |
|
БЗ-7 |
+++ |
+++ |
4-4-+ |
+ |
— |
— |
+++ |
+ |
— |
— |
|
БЗ-8 |
+++ |
+++ |
+++ |
+ |
— |
— |
+++ |
+++ |
4*4-4- |
+ |
“-” - нет роста, “+ - +++” - степень выраженности роста
Б
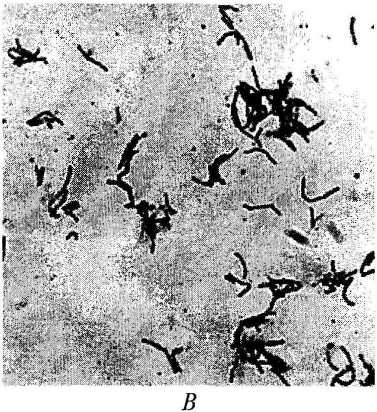
Рис. 1. Морфология клеток: А - штамм БЗ-1, Б - штамм БЗ-5, В - штамм БЗ-8. Фазово-контрастный микроскоп. А, Б- увеличение х 1500, В - увеличение х 1 000
Установлено, что бактерии не образуют сероводород, не гидролизуют желатину, не восстанавливают нитрат до нитрита, не осуществляют процесс денитрификации. Для них характерен метаболизм дыхательного типа. Штамм БЗ-1 образует кислоту из сахарозы, глюкозы, инозита, маннита, сорбита, глицерина, образует фенилаланиндезаминазу. Штамм БЗ-5 гидролизует мочевину, образует кислоту из глюкозы, маннита, сорбита, глицерина. На основе физиологических и биохимических признаков исследуемые микроорганизмы могут быть отнесены к роду Deleya (Определитель бактерий Берджи, 1997).
Грамотрицательный штамм БЗ-4 растет при концентрации 8% NaCl в культуральной среде (таблица). Штамм образует округлые, блестящие, гладкие, с ровным краем колонии бежевого цвета. Клетки представляют собой каталазо-, фосфатазо-и оксидазоположительные, изогнутые, подвижные палочки. Штамм утилизирует ограниченное количество углеводов. На основе вышеперечисленных признаков штамм предварительно отнесен к роду Aquaspirillum. Изолированный нами штамм представляет интерес, так как для рода Aquaspirillum не описаны представители, способные расти при концентрации выше 3% NaCl в среде культивирования (Определитель бактерий Берджи, 1997).
Грамположительная культура БЗ-2 образует округлые, выпуклые, с ровным краем, белые, желтеющие на свету колонии. Клетки каталазоположительные, оксидазоотрицательные, неспорули-рующие палочки неправильной формы, на стационарной фазе преобладают кокки. Метаболизм дыхательного типа. Денитрификацию, восстановление нитрата до нитрита не осуществляет. Гидролизует желатину и крахмал. В клеточной стенке ми-коловые кислоты не обнаружены. Штамм определен как Arthrobacter sp.
Грамположительная культура БЗ-З образует округлые, выпуклые, светло-зеленые колонии. Клетки каталазоположительные, оксидазоотрицательные, не образующие споры подвижные палочки. Метаболизм дыхательного типа. Денитрификацию, восстановление нитратов до нитритов, гидролиз желатины и крахмала не осуществляет. В клеточной стенке нет миколовых кислот. Штамм предварительно идентифицирован как Microbacterium sp. .
Характеристика роста микробного сообщества и индивидуальных штаммов в присутствии различных концентраций NaCl
Нами установлено, что лишь два штамма (Rhodococcus sp. БЗ-7 и БЗ-8) из микробного сообщества способны к росту на нафталине как единственном источнике углерода и энергии. Штаммы используют нафталин в качестве субстрата в отсутствии и в присутствии хлорида натрия: штамм БЗ-7 - до 7.5 %, штамм БЗ-8 - до 9 % (таблица). Сопутствующие бактериальные штаммы (БЗ-1, БЗ-2, БЗ-З, БЗ-4, БЗ-5) способны утилизировать ацетат.
Изучено влияние разных концентраций (от 3 до 7.5%) NaCl на характер роста микробного сообщества БЗ и штамма-деструктора Rhodococcus sp. БЗ-7 (рис. 2, 3).
При росте СМБ-3 в среде с нафталином в качестве ростового субстрата максимальные значения оптической плотности наблюдались при культивировании в присутствии 3% NaCl и при отсутствии в среде соли (0.489 и 0.495, соответственно). Повышение концентрации хлорида натрия в среде культивирования до 6% и 7.5% приводило к увеличению продолжительности /ag-периода и снижению оптической плотности (рис. 2).
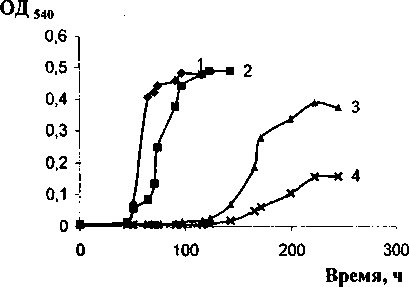
Рис. 2. Динамика роста микробного сообщества БЗ в минеральной среде Раймонда с нафталином при разных концентрациях NaCl: 7 - без соли, 2-3%, 3-6%, 4-7.5%
При культивировании бактериального штамма Rhodococcus sp. БЗ-7 в среде с нафталином в при сутствии разных концентраций соли наиболее высокое значение оптической плотности было зафиксировано при 3% NaCl, при этом отмечено отсутствие /ag-фазы. Этот факт можно объяснить тем, что инокулятом служила культура штамма БЗ-7, выращенная в минеральной среде Раймонда с содержанием NaCl 3%. В то же время описаны штаммы рода Rhodococcus, для которых концентрация 1-2% хлорида натрия оказывала стимулирующий эффект на рост (Плакунов и др., 1999). При увеличении концентрации хлористого натрия в среде до 6%, а также в отсутствии соли наблюдалось снижение оптической плотности культуры и увеличение продолжительности /ag-периода. Изменение оптической плотности штамма-деструктора при культивировании в присутствии 7.5% NaCl было незначительным (рис. 3).
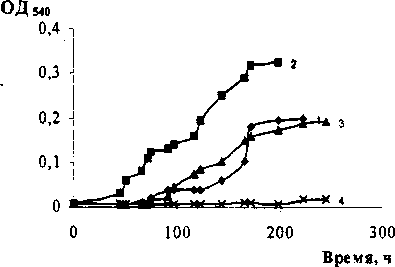
Рис. 3. Динамика роста Rhodococcus sp. БЗ-7 в минеральной среде Раймонда с нафталином при разных концентрациях NaCl: 7 - без соли, 2 - 3%, 3-6%, 4-7.5%
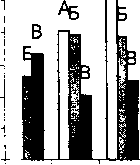
В опытах по подсчету колониеобразующих единиц исследован характер роста штамма-деструктора при культивировании в микробном сообществе и индивидуальной культуре. Наиболее высокое значение количества клеток штамма-деструктора зафиксировано в присутствии 3% NaCl (рис. 4). В отсутствии соли отмечено снижение значения КОЕ/мл. При культивировании сообщества и индивидуальной культуры штамма-деструктора БЗ-7 при 7.5% хлорида натрия наблюдалось значительное различие в значении КОЕ/мл: при культивировании штамма БЗ-7 в сообществе КОЕ/мл было на два порядка выше, чем при росте в индивидуальной культуре (рис. 4).
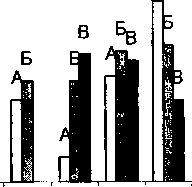
Нами было исследовано влияние минерализации среды на качественный состав сообщества микроорганизмов БЗ. Установлено, что в присутствии 3% и 6% соли в среде культивирования сохраняется состав СМБ-3 (7 штаммов). В отсутствии соли элиминируется штамм БЗ-1, а другой штамм БЗ-5 лишь незначительно увеличивает значение КОЕ/мл. В присутствии 7.5% NaCl из сообщества элиминируется штамм БЗ-4 (рис. 5).
КОЕ/мл
1,00Е+10
1,00Е+09 -
Б
1,00Е+08 п
1,00Е+07
1,00Е+06 -|
1.00Е+05
без соли

Рис. 4. Максимальное количество клеток штамма Rhodococcus sp. БЗ-7 при культивировании в минеральной среде Раймонда с нафталином при разных концентрациях NaCl: А - индивидуальная культура, Б - клетки штамма в составе микробного сообщества
КОЕ/мл
1,00Е+11 -
1.00Е+05
А
1,00Е+07
1,00Е+06
1,00Е+10 -j
1.00Е+09 J
1,00Е+08
БЗ-1 БЗ-2 БЗ-З БЗ-4 БЗ-5 БЗ-7 БЗ-8
Рис. 5. Максимальное количество клеток штаммов при росте в составе микробного сообщества в минеральной среде Раймонда на нафталине при разных концентрациях NaCl: А - без соли, Б - 3%, 5-7.5%.
Заключение
Микробная ассоциация БЗ, выделенная из района солеразработок, включает в свой состав два штамма-деструктора рода Rhodococcus-. умеренно галофильный (Кашнер, 1981) штамм БЗ-1 и экстремально галотолерантный (Кашнер, 1981) штамм БЗ-5, предварительно отнесенные к роду Deleya. Кроме того, из сообщества изолированы еще три галотолерантные бактериальные культуры, способные утилизировать ацетат. Установлено, что штамм-деструктор Rhodococcus sp. БЗ-7 растет менее эффективно на нафталине в присутствии 7.5% хлорида натрия, чем при культивировании в сообществе. Можно предположить, что бактерии-деструкторы в процессе разложения нафталина выделяют в культуральную среду метаболиты (например ацетат), которые используются в качестве субстратов сопутствующими бактериями. В свою очередь галофильные и галотолерантные микроорганизмы могут выделять в среду культивирования осмопротекторные соединения, которые обеспечивают осмотический баланс клетки. К таким соединениям относятся аминокислоты и их производные, сахара и многоатомные спирты (Ventosa, 1998). Упомянутые органические вещества могут поглощаться штаммами-деструкторами, что обусловливает их способность эффективно расти и осуществлять разложение нафталина в условиях высокой минерализации среды.
Работа поддержана грантом РФФИ-Урал № 04-04-96042.
Список литературы Изучение сообщества микроорганизмов, выделенного из района солеразработок
- Бабошин М.А., Фипкельштейн З.И., Головлева Л.А. Кометаболизм флуорена культурами Rhodococcus rhodochrous и Pseudomonas fluorescens II Микробиология. 2003. Т. 72, № 2. С. 194-198.
- Кашнер Д. Жизнь микробов в экстремальных условиях. М.: Мир, 1981. 365 с. Методы общей бактериологии/Пер. с англ. Под ред. Ф. Герхардт и др. М.: Мир, 1983. Т. 1-3.
- Методы почвенной микробиологии и биохимии: Учеб. пособие/Под ред. Звягинцева Д.Г. М.: Изд-во МГУ, 1991.304 с. Определитель бактерий Берджи/Пер. с англ. Под ред. Дж. Хоулта и др. М.: Мир, 1997. Т. 1,2.
- Плакунов В.К., Арзуманян В.Г., Воронина Н.А., Беляев С.С. Взаимосвязь кинетики роста и дыхания у родококков в присутствии высоких концентраций солей//Микробиология. 1999. Т. 68, № I.e. 40-44.
- Плотникова Е.Г., Алтынцева О.В., Кошелева И.А., Пунтус И.Ф., Филонов А.Е., Гавриш ЕЮ., Де-маков В. А., Воронин A.M. Бактерии-деструкторы полициклических ароматических углеводородов, выделенные из почв и донных отложений района солеразработок//Микробиология. 2001. Т. 70, № 1. С. 61-69.
- Пунтус И.Ф., Филонов А.Е., Кошелева И.А., Гаязов P.P., Карпов А.В., Воронин A.M. Выделение и характеристика микроорганизмов-деструкторов полициклических ароматических углеводородов//Микробиология. 1997. Т. 66, № 2. С. 269-272.
- Розанова Е.П., Назина Т.Н. Углеводородокисляющие бактерии и их активность в нефтяных пластах//Микробиология. 1982. Т. 51. С. 324-348.
- Суровцева Э.Г., Ивойлов B.C., Беляев С.С. Разрушение ароматической фракции нефти ассоциацией грамположительных и грамотрицательных микроорганизмов//Микробиология. 1997. Т 6 6,№ I.e. 78-83.
- Boldrin В., Tiehm А., Fritzsche С. Degradation of phenanthrene, fluorene, fluoranthene, and pyrene by a Mycobacterium sp. II Appl. Environ. Microbiol. 1993. V. 59, № 6. P. 1927-1930.
- Boonchan S., Britz M.L., Stanley G.A. Degradation and Mineralization of high-molecular-weight polycyclic aromatic hydrocarbons by defined fun114 gal-bacterial cocultures II Appl. Environ. Microbiol. 2000. V. 66, № 3. P. 1007-1017.
- Chung W.K., King G.M. Isolation, characterization, and polyaromatic hydrocarbon degradation potential of aerobic bacteria from marine macrofaunal burrow sediments and description of Lutibacterium anuloederam gen. nov., sp. nov., and Cycloclasticus spirillensus sp. nov. II Appl. Environ. Microbiol. 2001. V. 67, № 12. P. 5585-5592.
- Geiselbrecht A.D., Herwig R.P., Deming J. W., Staley J.T. Enumeration and phylogenetic analysis of polycyclic aromatic hydrocarbon-degrading marine bacteria from Puget Sound sediments//Appl. Environ. Microbiol. 1996. V. 62, № 9. P. 3344-3349.
- Hamme J.D., Singh A, Ward O.P. Recent advances in pefroleum microbiology II Microbiol. Mol. Biol. Rev. 2003. V. 67, № 4. P. 503-549.
- Hedlund B.P. Geiselbrecht A. D., Bair T.J., Staley J.T. Polycyclic aromatic hydrocarbon degradation by a new marine bacterium, Neptunomonas naphthovorans gen. nov., sp. nov. II Appl. Environ. Microbiol. 1999. V. 65, № 1. P. 251-259.
- Kanaly R. A., Harayama S. Biodegradation of highmolecular-weight polycyclic aromatic hydrocarbons by bacteria II J. Bacteriol. 2000. V. 182, № 8. P. 2059-2067.
- Kdstner M., Breuer-Jammali M., Mahro B. Impact of inoculation protocols, salinity, and pH on the degradation of polycyclic aromatic hydrocarbons (PAHs) and survival of PAH-degrading bacteria introduced into soil II Appl. Environ. Microbiol. 1998. V. 64, № 1. P. 359-362.
- Ventosa A., Joaquhn J.N., Oren A. Biology of halophilic aerobic bacteria II Microbiol. Mol. Biol. Rev. 1998. V. 62, № 2. P. 504.
- Ward D. M., Brock T. D. Hydrocarbon biodegradation in hypersaline environments II Appl. Environ. Microbiol. 1978. V. 35, № 2. P. 353-359.


