Изучение состава экстрактов пряных трав в процессе сушки
Автор: Кучменко Т.А., Абрамян М.К.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 1 (91), 2022 года.
Бесплатный доступ
Лекарственные и пряные травы широко применяются в фитотерапии. Для исследования растений, оценки эффективности экстракции биологически активных целевых компонентов применяют различные методы. Контроль за процессом осуществляют хроматографическими, спектральными методами. Актуален поиск новых быстрых, доступных, простых методов анализа. Предложено в качестве альтернативного метода известным - метод микровзвешивания сухой капли экстракта. Проведен анализ экстрактов пряной травы петрушки листовой четырьмя методами: спектрофотометрией, рефрактометрией, тонкослойной хроматографией и прямым взвешиванием сухой капли. Объектами исследования служили свежая петрушка защищенного грунта и сушеная петрушка марки Индана. В течение 16 суток высушивали свежую петрушку и следили за изменением химического состава водно-спиртовых экстрактов. По дифференциальным спектрам идентифицировали соединения в экстрактах. Установлено, что после 12-ти дней сушки количество веществ извлекаемых из пряного растения больше, чем в сухом образце. Подобрали состав подвижной фазы для тонкослойной быстрой хроматографии. Лучшее отделение хлорофиллов от сопутствующих веществ, происходит при объемном соотношении толуола и этилового спирта 5:5 и 6:4. Чувствительность метода рефрактометрии не позволяет установить различие в составе экстрактов свежей петрушки. Методом прямого пьезокварцевого микровзвешивания было доказано, что с увеличением времени сушки петрушки количество соединений в сухой капле экстракта увеличивается. Наиболее чувствительный метод - пьезокварцевое микровзвешивание, прибор «MCNano-WPQ-8» можно использовать во внелабораторных условиях для экспрессного мониторинга сушки растительного сырья в маленьких производствах т.к. он проще, дешевле, компактней и чувствительнее других приборов. Прибор и подход апробированы на различном виде фитосырья.
Пряные растения, контроль качества, продукция, сушка, хлорофиллы, спектрофотометрия, прямой микроанализ, экстракт, рефрактометрия, тонкослойная хроматография, сухая капля
Короткий адрес: https://sciup.org/140293798
IDR: 140293798 | УДК: 543
Текст научной статьи Изучение состава экстрактов пряных трав в процессе сушки
Пряные растения пользуются огромной популярностью во многих странах мира, в том числе и в России. Они придают утонченный вкус и аромат различным блюдам, также являются источниками биологически активных веществ (БАВ), необходимых для поддержания в норме здоровья человека [1,2]. В зимний период потребители в основном покупают сухие
травы, т. к. они более доступны. Поэтому на производстве для быстрого высушивания трав чаще всего используют сушильные шкафы, но при длительном воздействие высоких температур происходят необратимые изменения и ухудшается качества получаемого продукта [3]. Актуальным остается вопрос: как оценить качество продукции быстро и во внелабораторных условиях?
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
93 БД Agris
Для установления качества растительного сырья используются методы хроматографии [4–8], спектрофотометрии [9–12] и другие физикохимические методы [13–18]. Наиболее селективными являются хроматографические методы. Однако применение их не всегда оправдано из-за трудоемкости пробоподготовки, высокой стоимости приборов и анализа, затрат времени. В ряде случаев применяют более простой спектрофотометрический метод оценки содержания БАВ в экстрактах растений без предварительного хроматографического разделения. Для анализа пряных трав в настоящее время в качестве альтернативного метода применяют сенсорные методы анализа, в том числе метод пьезокварцевого микровзвешивания сухой капли экстракта [19].
Цель работы – изучение динамики накопления БАВ в процессе сушки растительного сырья для контроля качества продукции.
Материалы и методы
В качестве объекта исследования выбрана свежая петрушка защищенного грунта торгового наименования Global Village, и сушеная петрушка марки Индана, приобретенные в сети магазинов «Пятерочка».
В рамках эксперимента высушивали листовую петрушку свежую в естественных условиях при температуре 23 ± 2 ℃. Для сушки растений раскладывали сырье на подстилках в сухом, изолированном от солнечного света, месте слоем в 2–3 см. В течение 16 суток с периодичностью в 4 дня отбирали навеску средней пробы трав (m = 3,00 г.) и помещали в коническую колбу, добавляли 40 см3 40%-ого раствора этанола, закрывали. Экстракцию проводили в темном месте при периодическом встряхивании в течение 3-x часов.
Методы исследования экстрактов петрушки: спектрофотометрия, рефрактометрия, пьезокварцевое микровзвешивание капли, тонкослойная хроматография.
Анализ экстрактов проводили с использованием спектрофотометра КФК-3 КМ (ООО «ЮНИКО-СИС», Россия). Измеряли светопогло-щение исследуемых экстрактов в диапазоне длин волн от 325 до 800 нм с шагом 5 нм. Идентифицировали соединения, которые экстрагируются из петрушки листовой по справочным данным [20].
Рефракцию экстрактов измеряли на рефрактометре «РПЛ-4» (НПО «Аналитприбор», Украина).
Для высокоточного измерения массы экстрагируемых веществ на многоканальных нановесах «МСNаnо-WPQ-8» (Россия), наносили микрошприцем 1 мкл экстракта на одну сторону микровесов, сушили 20 мин при температуре (70 ± 5) ℃ в сушильном шкафу и 10–15 мин охлаждали в эксикаторе. Изменение частоты колебаний кварцевого резонатора после нанесения и сушки экстракта применяли для расчета массы сухих веществ по уравнению Зауэрбрея.
Для определения хлорофиллов в экстракте использовали экспрессную тонкослойную хроматографию. На линию старта по центру пластины наносили микрошприцем 7 мкл экстракта растения (предварительно 5 см3 экстракта упаривали в течение 45 минут при 95 ℃). Пластинку высушивали. В хроматографическую камеру помещали элюент (толщина слоя жидкости 0,5 см) и хроматографическую пластину марки «Silufol», пропитанную элюентом размером 10 x 0,7 см. Закрывали камеру и оставляли на некоторое время для насыщения парами растворителя. По достижении линии финиша фронтом растворителя пластину доставали из камеры и высушивали.
Результаты и обсуждение
В ходе анализа литературных источников было установлено, что для детектирования действующих веществ в пряных травах и других растениях в основном используют методы спектрофотометрии, рефрактометрии, капиллярного электрофореза, газовой и жидкостной хроматографии. Но для очень малых производств данные методы не приемлемы для контроля качества растительного сырья, т. к. они дорогостоящие, поэтому им нужны маленький, быстрый, дешевый, но сопоставимый с ними результатами и по аналитическим характеристикам прибор. При изучении накопления веществ в ходе сушки петрушки применили и сопоставили 4 метода детектирования действующих веществ в экстрактах.
В идентичных условиях на приборе спектрофотометре КФК-ЗКМ были получены и сопоставимы для разного времени сушки спектры поглощения экстрактов петрушки пучковой относительно водно-этанольного раствора (рисунок 1).
Установлено, что биологически активные вещества петрушки имеют экстремумы при длинах волн от 325 до 430 и от 625 до 720 нм, что связано с изменением состава смеси соединений в пряных растениях.
Для уменьшения ошибки спектрофотометрического определения идентификацию соединений в экстрактах проводили с помощью дифференциальных кривых спектров поглощения (рисунок 2).
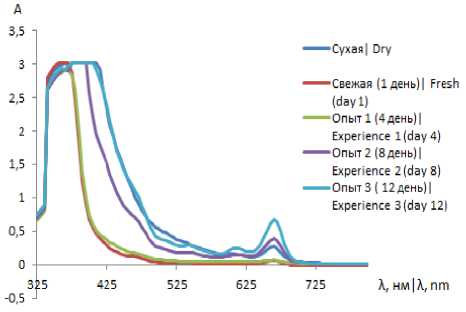
Рисунок 1. Спектры поглощения водно-спиртовых экстрактов петрушки пучковой для разных точек сушки Figure 1. Absorption spectra of water-alcohol extracts of beam parsley for different drying points
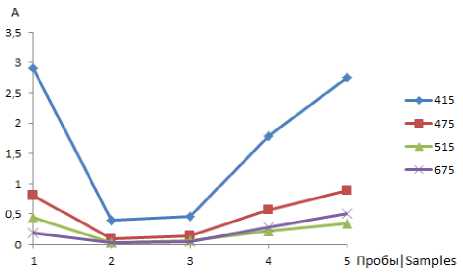
Рисунок 3. Зависимость оптической плотности экстрактов от времени сушки петрушки (1 проба – сухая петрушка, 2 проба – свежая петрушка, 3 проба – 4 дня сушки, 4 проба – 8 дней сушки, 5 проба – 12 дней сушки)
Figure 3. Dependence of the optical density of extracts on the drying time of parsley (1 sample-dry parsley, 2 sample-fresh parsley, 3 sample – 4 days of drying, 4 sample-8 days of drying, 5 sample-12 days of drying)
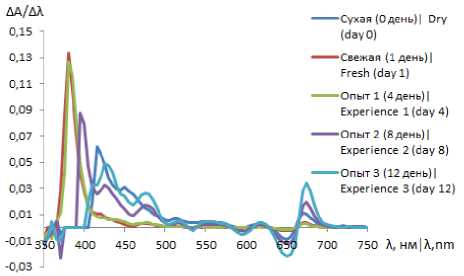
Рисунок 2. Дифференциальные спектры поглощения экстрактов петрушки после 1, 4, 8 и 12 дней сушки и сухого образца
Figure 2. Differential absorption spectra of parsley extracts after 1, 4, 8 and 12 days of drying and dry sample
Для экспрессной оценки содержания экстрагируемых веществ, в частности хлорофиллов, использовали минитонкослойную хроматографию. Предварительно оптимизировали состав подвижной фазы. В качестве подвижной фазы использовали смеси растворителей (этанол-толуол, ацетон-толуол) в разных соотношениях (таблица 1).
Таблица 1.
Идентификация хроматографических зон на хроматограммах
Table 1.
На спектрах видно, что имеются несколько максимумов у экстрактов петрушки при длинах волн: 380, 395, 415, 425, 475, 515, 675 нм, что свидетельствует о наличии в смеси таких соединений как: хлорофилл а, b, с 2, с 3 [20].
Наиболее сильно различаются составы экстрактов пряных трав в диапазоне длин волн от 350 до 500 нм. Веществ, извлекаемых при длине волны 415 нм, в экстрактах сухой петрушки больше, чем у экстрактов из свежих и высушенных листьев.
Исследованы особенности извлечения соединений петрушки при 4 характеристических длинах волн от времени сушки растения (рисунок 3).
Установлено, что после 12-ти дней сушки количество веществ извлекаемых из сырья, поглощающих при длинах волн 415, 475, 515, 675 нм, больше, чем в сухой, что свидетельствует об их деградации во времени.
Identification of chromatographic zones on chromatograms
|
Соотношение толуол/этанол| Ratio toluene/ ethanol |
Rf |
Соотношение толуол/ацетон| Toluene/аcetone ratio |
Rf |
|
5:5 |
0,95 |
5:5 |
Не |
|
6:4 |
0,95 |
6:4 |
|
|
7:3 |
0,95 |
7:3 |
движется Not |
|
8:2 |
0,95 |
8:2 |
|
|
moving |
|||
|
9:1 |
0,95 |
9:1 |
Результаты исследования позволяют утверждать, что лучшее отделение суммы хлорофиллов от сопутствующих веществ происходит при объемном соотношении толуола и этилового спирта 5:5 и 6:4, т. к. на пластинках «Silufol» наблюдались более четкие пятна. В системе растворителей ацетон / толуол компоненты хлорофилла «уходят» с фронтом растворителя (рисунок 4).

Рисунок 4. Хроматографические зоны вешеств экстрактов травы Толуол/Этанол
Figure 4. Chromatographic zones of herb extracts Toluene/Acetone
Выбрав систему растворителей для подвижной фазы, провели исследования остальных экстрактов петрушки, рассчитали подвижность R f хлорофиллов.
Установлено, что подвижность основных веществ экстрактов равна 0,88. Экстракты сухой, свежей и высушенной петрушки имеют один и тот же состав.
Для количественного определения хлорофиллов были рассмотрены хроматограграммы в цветовой модели RGB (таблица 2).
Результаты количественного определения действующих веществ различными методами предствавлены в таблице 2.
Методом экспрессной тонкослойной хроматографии было установлено, что у экстрактов петрушки R преобладает над G и B (таблица 2), следовательно, в большем количестве в смесях присутствует хлорофилл а, b, но с увеличением времени высушивания растений, количество данных пигментов снижается, что связано с их разрушением.
Установлено (таблица 2), что чувствительность метода рефрактометрии не позволяет установить различие в составе свежих растений, т. к. показатель преломления равен показателю 40-процентного этилового спирта, но с увеличением времени сушки показатель преломления увеличивается.
Методом пьезокварцевого микровзвешивания было доказано (таблица 2), что с увеличением времени сушки петрушки количество соединений увеличивается, т. к. повышается концентрация некоторых веществ.
Рассчитали чувствительность всех методов (таблица 3).
Сравнили по основным характеристикам методы оценки экстрактивных веществ (таблица 4).
Таблица 2.
Результаты исследования
Table 2.
Rеsеаrсh results
|
Проба Sample |
Хроматография Chromatography |
Рефрактометрия Refractometry |
Пьезокварцевое микровзвешивание Quаrtz crystal microbalance |
||
|
R |
G |
B |
n |
m, мкг | m, µg |
|
|
Свежая | Fresh |
207 |
198 |
169 |
1,3544 |
6,99 |
|
4 дня | 4 days |
196 |
189 |
160 |
1,3566 |
14,60 |
|
8 дней | 8 days |
162 |
154 |
106 |
1,3584 |
44,24 |
|
12 дней |12 days |
161 |
155 |
103 |
1,3594 |
70,09 |
|
Сухая | Dry |
193 |
186 |
132 |
1,3582 |
66,28 |
Таблица 3.
Чувствительность методов, применяемых для анализа веществ
Table 3.
Sensitivity of methods used for the analysis of substances
|
Метод | Methods |
Чувствительность, % | Sensitivity, % |
|
Спектрофотометрия | Spectrophotometry |
2,7 |
|
Пьезокварцевое микровзвешивание | Quаrtz crystal microbalance |
15,8 |
|
Рефрактометрия | Refractometry |
1,3 |
|
Тонкослойная хроматография | Thin-layer chromatography |
2,0 |
Таблица 4.
Сравнение основных характеристик методов оценки экстрактивных веществ
Table 4.
Comparison of the main characteristics of methods for evaluating extractive substances
|
Метод Methods |
Время анализа, мин Analysis time, min |
Необходимость пробоподготовки The need for sample preparation |
Стоимость оборудования, руб. Cost of equipment, RUB |
|
Спектрофото-метрия | Spectrophotometry |
10 |
Не требуется Not required |
275 753 |
|
Пьезокварцевое микровзвешивание Piezoquartz microweighting |
30 |
50 000 |
|
|
Рефрактометрия| Refractometry |
10 |
39 000 |
|
|
Тонкослойная хроматография Thin-layer chromatography |
10 |
Требуется Is required |
5000 |
Заключение
Установлено, что наиболее чувствительным методом определения экстрактивных веществ является пьезокварцевого микровзвешивание. Портативный прибор для измерения массы сухой капли экстракта можно использовать во внелабо-раторных условиях для экспрессного мониторинга сушки растительного сырья в маленьких производствах, т. к. он проще, дешевле и чувствительнее других приборов, изученных в работе.
Список литературы Изучение состава экстрактов пряных трав в процессе сушки
- Костко И.Г. Петрушка как сырье для производства быстрозамороженной зелени // Научное обеспечение развития АПК в условиях импортзамещения, 2017. С. 300-303.
- Muyumba N.W., Mutombo S.C., Sheridan H. et al. Quality control of herbal drugs and preparations: The methods of analysis, their relevance and applications // Talanta Open. 2021. № 4.
- Сафаров Ж., Ахмедов Ш., Жумаев Б., Дадаев Г. и др Техника и технология сушки лекарственных трав // Продовольча iндустрiя апк. 2016. № 6(45). С. 42-43.
- Khajeh M. Response surface modeling of betulinic acid pre-concentration from medicinal plant samples by miniaturized homogenous liquid-liquid extraction and its determination by high performance liquid chromatography // Arabian Journal of Chemistry. 2015. № 8. P.400^-06
- Sethiya N.K., Trivedi A., Mishra S.H. Rapid validated high performance thin layer chromatography method for simultaneous estimation of mangiferin and scopoletin in Canscora decussata (South Indian Shankhpushpi) extract // Revista Brasileira de Farmacognosia. 2015. V. 25. P. 193-198.
- Zhu J., Zhang Z., Wang R., Huang X. et al. Nanoparticles Derived from Scutellaria barbata and Hedytois diffusa Herb Pair and Their Anti-cancer Activity // Pharmacological Research-Modern Chinese Medicine. 2022. P. 100048.
- Bhargavi S., Madhan Shankar S .R. Dual herbal combination of Withania somnifera and five Rasayana herbs: A phytochemical, antioxidant, and chemometric profiling // Journal of Ayurveda and Integrative Medicine. 2021. №. 12. Р. 283-293.
- Schmidt M.E.P., Pires F.B. et al. Some triterpenic compounds in extracts of Cecropia and Bauhinia species for different sampling years // Revista Brasileira de Farmacognosia. 2018. № 28. Р. 21 -26.
- Подолина Е.А., Ханина М.А., Рудаков О.Б., Небольсин А.Е. Ультразвуковая экстракция и УФ-спектрофотометрическое определение суммы флавоноидов и дубильных веществ в надземной части василька синего // Вестник Воронежского государственного университета. Серия: Химия. Биология. 2018. № 2. С. 28-35.
- Dirar A.I. Effects of extraction solvents on total phenolic and flavonoid contents and biological activities of extracts from Sudanese medicinal plants // South African Journal of Botany. 2019. № 120. Р.261-267
- Kustiati U., Wihadmadyatami H., Kusindarta D. L. Dataset of Phytochemical and secondary metabolite profiling of holy basil leaf (Ocimum sanctum Linn) ethanolic extract using spectrophotometry, thin layer chromatography, Fourier transform infrared spectroscopy, and nuclear magnetic resonance // Data in Brief. 2022. V. 40. P. 107774.
- Kucharska-Ambrozej K., Karpinska J. The application of spectroscopic techniques in combination with chemometrics for detection adulteration of some herbs and spices // Microchemical Journal. 2020. № 153.
- Тринеева О. В., Сливкин А. И. Изучение углеводного комплекса плодов облепихи крушиновидной различными методами // Вестник воронежского государственного университета. Серия: химия. Биология. Фармация.2020. №2. С. 91-98
- Solomonenko A.N., Dorozhko E.V., Barek J., Korotkova E.I. Adsorptive stripping voltammetric determination of carbofuran in herbs on chromatographic sorbent modified electrode // Journal of Electroanalytical Chemistry. 2021. № 90.
- Kasmi S., Hamdi A., Atmani-Kilani D., Debbache-Benaida N. et al. Characterization of phenolic compounds isolated from the Fraxinus angustifolia plant and several associated bioactivities // Journal of Herbal Medicine. 2021. № 29
- Clemen-Pascual L.M., Macahig R.A.S., Rojas N.R.L. Comparative toxicity, phytochemistry, and use of 53 // Philippine medicinal plants. 2022. № 9. P. 23-35.
- Muyumba N.W., Mutombo S.C., Nachtergael H.Sh.A., Duezc P. Quality control of herbal drugs and preparations: The methods of analysis, their relevance and applications // Talanta Open. 2021. № 4.
- Nor-Ashila Aladdin, Jamia Azdina Jamal, NorainiTalip. Comparative study of three Marantodes pumilum varieties by microscopy, spectroscopy and chromatography // Revista Brasileira de Farmacognosia. 2016. №. 26. P. 1 -14.
- Абрамян М. К., Кучменко Т. А. Микровзвешивание экстрактов биологически активных веществ ромашки аптечной // Химические проблемы современности. 2020. С. 36.
- Кучменко Т.А., Шуба А.А. Современные методы анализа: методические указания по выполнению лабораторных работ. Воронеж: ВГУИТ, 2016. С. 38.


