Изучение состояния волновой активности и клеточного метаболизма тканей лица у больных периоральным дерматитом
Автор: Грашкина И.Г., Грашкин В.А., Утц С.Р.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кожные болезни
Статья в выпуске: 2 т.8, 2012 года.
Бесплатный доступ
Цель: изучение возможностей радиометрического метода для объективной оценки функционального состояния кожи лица и показателей внутриклеточного метаболизма у больных периоральным дерматитом. Материал и методы. В исследование включено 120 больных периоральным дерматитом (87,5 % женщин и 12,5 % мужчин). Степень эндогенной интоксикации организма устанавливали по уровню молекул средней молекулярной массы в сыворотке крови по методу Н. И. Габриэлян, олигопептидов в плазме крови по методу М. Я. Малаховой. Показатели клеточного метаболизма оценивали по содержанию гликогена в лейкоцитах по методу McManus, лизосомальных катионных белков в гранулоцитах по методу В. Е. Пигаревского, фагоцитарную и метаболическую активность нейтральных гранулоцитов изучали по тесту спонтанного поглощения и восстановления нитросинего тетразолия по методу Б. С. Нагоева. Результаты. Установлено статистически значимое увеличение в плазме крови больных ПД катаболического пула, концентрации молекул низкой и средней молекулярной массы, олигопептидов, диеновых конъюгатов, а в нейтрофильных гранулоцитах циркулятор-ного русла — лизосомальных катионных белков на фоне снижения гликогена, НСТ-теста. Заключение. Впервые изучены возможности радиометрического метода для объективной оценки функционального состояния кожи лица и показателей внутриклеточного метаболизма у больных периоральным дерматитом.
Внутриклеточный метаболизм, волновая активность, периоральный дерматит, радиометрический метод, эндогенная интоксикация
Короткий адрес: https://sciup.org/14917588
IDR: 14917588
Текст научной статьи Изучение состояния волновой активности и клеточного метаболизма тканей лица у больных периоральным дерматитом
1Введение. Периоральный дерматит (ПД) — заболевание кожи лица с недостаточно изученной этиологией и патогенетическими механизмами, являющееся одной из актуальных проблем дерматологии.
К предрасполагающим факторам ПД относят длительное и бесконтрольное использование топических фторированных и не фторированных кортикостероидных мазей, косметических и парфюмерных средств, прием оральных гормональных контрацептивов, изменение иммунологической реактивности, в том числе под воздействием бактериальных аллергенов и при участии условно-патогенной флоры, нарушения гормонального, метаболического статуса, нервной системы и органов пищеварения [1-4].
ПД — хроническое рецидивирующее заболевание кожи лица преимущественно у женщин молодого и среднего возраста (у мужчин и детей встречается реже). Заболевание имеет самостоятельную клиническую картину, отличную от розацеа, демодекоза, себорейного дерматита и др.
В структуре дерматологической патологии доля ПД составляет 5%, а в группе акнеформных заболеваний кожи лица цифры заболеваемости достигают 20-25%. За последние 20 лет число больных значительно увеличилось, наблюдаются случаи несвоевременной диагностики ПД, что связано с клиническими особенностями течения и сложностями дифференциальной диагностики. Пациенты часто занимаются самолечением, длительно и бесконтрольно используют топические кортикостероидные мази, декоративную косметику, что способствует изменению клинической картины дерматоза, хрониза-ции процесса, развитию осложнений. По нашим данным, правильный диагноз после появления первых клинических признаков и симптомов ПД устанавливался с большим опозданием: через 6-8 месяцев у 45%, через 1-2 года у 50% больных.
Рост числа больных ПД, фациальная локализация, сложности диагностики и лечения обуславливают актуальность и социальную значимость проблемы. Общепринятыми диагностическими критериями является визуальная оценка выраженности воспаления на основе признаков экссудативной реакции, которая в известной степени условна и носит субъективный характер. Применяемые в настоящее время инструментальные методы (дерматоскопия, УЗИ кожи, биопсия) позволяют оценить только морфологическую сторону патологического процесса, в то время как функциональное состояние органа или ткани остается неизученным. Исследования, свидетельствующие о функциональной активности и интенсивности метаболизма непосредственно в зоне поражения у больных ПД, в отечественной и зарубежной литературе фактически отсутствуют.
Цель : изучение возможностей радиометрического метода для объективной оценки функционального состояния кожи лица и показателей внутриклеточно
го метаболизма у больных периоральным дерматитом.
Методы. В исследование включено 120 больных периоральным дерматитом (87,5% женщин и 12,5% мужчин). Средний возраст пациентов составил 29,2±1,3 года. Длительность заболевания до года встречалась в 26,8% случаев, от года до 2 лет в 23,7%, от 2 до 3 лет в 20,9%, от 3 до 10 лет 28,6%.
Критериями включения больных в исследование были: установленный клинический диагноз, наличие папул и «псевдопустул», не связанных с волосяным фолликулом, локализующихся на кожных покровах лица; возраст от 16 до 60 лет; отсутствие на коже лица пациента проявлений бактериальной, вирусной или грибковой инфекции; отсутствие приема системных или топических глюкокортикостероидных препаратов.
Критериями исключения из исследования являлись: беременность и лактация; наличие воспалительных дерматозов на коже лица, в том числе герпетической и пиококковой инфекции; прием системных и топических ретиноидов в течение последних 6 месяцев; использование фотосенсибилизаторов в последние 4 недели; хронические кожные заболевания в стадии обострения; аутоиммунные заболевания; системные заболевания крови.
Степень эндогенной интоксикации организма устанавливали по уровню молекул средней молекулярной массы (ВНСММ) в сыворотке крови по методу Н. И. Габриэлян [5], олигопептидов (ОП) в плазме крови по методу М. Я. Малаховой [6].
Показатели клеточного метаболизма оценивали по содержанию гликогена в лейкоцитах по методу McManus [7], лизосомальных катионных белков (ЛКБ) в гранулоцитах по методу В. Е. Пигаревского [8], фагоцитарную и метаболическую активность нейтральных гранулоцитов изучали по тесту спонтанного поглощения и восстановления нитросинего тетразолия (НСТ) по методу Б. С. Нагоева.
Волновую активность (ВА), отражающую способность водосодержащих сред тканей к преобразованию внешнего зондирующего излучения в стимулированное излучение, исследовали с помощью радиоэлектронного диагностического комплекса «Акватон» производства ООО «Телемак», г. Саратов [9]. Диагностический комплекс состоит из модуляционного радиометра, настроенного на прием радиоволн в полосе частот 1000±25 МГц, чувствительностью ~1014 Вт, и приемно-излучающего модуля (ПИМ), включающего источник зондирующего излучения плотностью потока мощности 2,5 мкВт/см2, частотой 65 ГГц и приемной апликаторной антенны [10].
Используемый в исследовании радиоэлектронный комплекс внесен в реестр медицинской техники и изделий медицинского назначения (номер регистрационного удостоверения 07292).
Исследование ВА тканей, проводимое с помощью трансрезонансной функциональной топографии (ТРФТ), осуществлялось в соответствии со схемой, представленной на рисунке. В процессе диагности- ки осуществляется установка ПИМ диагностического комплекса на кожу обследуемой области, после чего в течение 3-5 секунд производится сканирование водосодержащих сред в проекции установки ПИМ. При необходимости в каждой области делается несколько измерений ВА.
Оценка ВА тканей лица производится в условных единицах: за 100 условных единиц принимается уровень излучения дистиллята воды при 37° С, что соответствует уровню мощности стимулированного излучения водосодержащих сред ~10~14 Вт. Схема оценки ВА тканей лица в процессе диагностики представлена на рисунке.
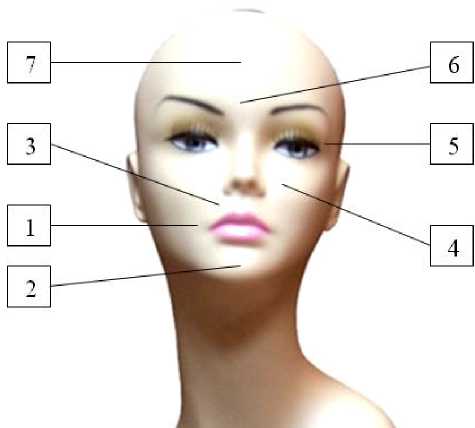
Топографическая схема оценки волновой активности тканей лица: 1 — периоральная область, 2 — область подбородка, 3 — область носогубных складок, 4 — носощечная область, 5 — периокулярная область, 6 — область глабеллы и периорбитальная, 7 — область лба
Статистическая обработка результатов исследования проводилась в программе Stati s tica 6. O. В пр о цессе обработки рассчитывалась выборочная средняя (х) и среднеквадратичное отклонение (о). Оценка статистической значимости различий проводилась с помощью критерия хи-квадрат.
Результаты. Клиническая картина у всех больных была представлена мелкими, не связанными с фолликулярным аппаратом кожи, полусферическими, конусовидными папулами диаметром не более 1-3 мм, от бледно-розового до ярко-красного цвета и единичными восковидными и блестящими полупрозрачными папуловезикулами, «псевдопустулами», которые появлялись на фоне незначительно выраженной эритемы или видимо неизмененной кожи. Элементы располагались поверхностно, чаще изолированно, беспорядочно или рассеянно, иногда группировались без тенденции к росту и слиянию, не имели воспалительного ободка, на поверхности некоторых определялись тонкие полупрозрачные чешуйки.
Высыпания в большинстве случаев (у 88% обследованных) имели симметричный характер, однако степень распространения была различной: от ограниченных на небольшом участке у 6 (1,1 %) до диффузного поражения всего лица у 52 (10,2%).
Более чем у половины обследованных (54%) отсутствовали субъективные ощущения. Зуд и жжение были слабо выраженными, отмечались у 17,7% обследованных, у 25,3% отмечалось чувство стягивания и сухости.
Результаты оценки эндогенной интоксикации у обследованных больных представлены в табл. 1.
Таблица 1
Показатели эндогенной интоксикации у больных периоральным дерматитом
|
Показатели |
Основная группа |
Группа контроля |
|
Олигопептиды, г/л |
0,79 ±0,003 |
0,44 ±0,02 |
|
ВНСММ, у.е. |
16,8 ±0,09 |
10,7 ±0,11 |
|
Катаболический пул, % |
23,1 ±0,20 |
11,3 ±0,24 |
Анализ полученных результатов свидетельствует о статистически значимом характере увеличения в плазме больных ПД уровня олигопептидов на 79,5% в сравнении со здоровыми лицами (р=0,023), а также на 57% уровня молекул средней и низкой молекулярной массы в сыворотке (р=0,036). Проведенный анализ также выявил существенное статистически значимое повышение катаболического пула в 2,04 раза (р=0,0011).
Полученные результаты свидетельствуют о том, что патологический процесс при ПД сопровождается усиленной деградацией биологических молекул, что вызывает развитие у больных умеренно выраженного эндотоксикоза.
Результаты оценки клеточного метаболизма у больных ПД представлены в табл. 2.
Таблица 2
Показатели клеточного метаболизма у больных периоральным дерматитом
|
Показатели |
Основная группа |
Группа контроля |
|
ЛКБ, сцк |
2,31 ±0,009 |
1,2 ±0,003 |
|
НСТ-тест, сцк |
1,69 ±0,006 |
1,92 ±0,003 |
|
Гликоген, сцк |
1,75 ±0,006 |
2,44 ±0,005 |
|
Г-6-ФДГ, % |
2,93±0,025 |
4,04±0,062 |
Анализ полученных результатов выявил существенные изменения метаболической активности клеток, проявляющиеся увеличением в сравнении со здоровыми лицами концентрации лизосомальных катионных белков на 48,1% (р=0,031), указывающим на активацию кислороднезависимого механизма фагоцитарной функции гранулоцитов крови, проявляющуюся на фоне существенного снижения активности ключевого фермента аэробного метаболизма Г-6-ФДГ в 1,4 раза (р=0,0031). Кроме этого, было выявлено снижение в клетках гликогена в 1,4 раза (р=0,026), а также статистически значимое снижение способности нейтрофилов к восстановлению нитро-синего тетразолия на 13,6% (р=0,044), что указывает на хронический характер течения воспалительного процесса у больных ПД.
Полученные результаты свидетельствуют о том, что патологический процесс у больных ПД существенным образом отражается не клеточном метаболизме, приводя к его угнетению, что в целом сопровождается снижением фагоцитирующей активности нейтрофилов крови и указывает на формирование дисфункции в клеточном звене иммунитета.
Особенности волновой активности водосодержащих сред тканей лица представлены в табл. 3.
Таблица 3
Результаты оценки волновой активности тканей лица у больных периоральным дерматитом
|
Область лица |
ВА, ед. |
|
|
Основная группа |
Группа контроля |
|
|
1 |
121,5±4,3 |
103,5±2,2 |
|
2 |
105,9±3,7 |
103,4±1,3 |
|
3 |
94,4±4,6 |
91,6±3,0 |
|
4 |
104,8±3,9 |
99,8±2,7 |
|
5 |
104,4±3,2 |
103,9±3,2 |
|
6 |
107,1±3,2 |
97,9±5,1 |
|
7 |
106,6±3,5 |
103,8±1,5 |
Результаты оценки состояния водосодержащих сред тканей лица у больных ПД свидетельствуют о статистически значимом повышении волновой активности тканей лица в проекции патологического очага над значениями с областей, свободных от патологических изменений. Так, у больных ПД в проекции периораль-ной области лица ВА статистически значимо на 16,5% превышает значения здоровых лиц (р=0,018). В пределах неизмененных тканей у больных ПД значения ВА находятся в интервале от 94,4 до 107,1 ед). При этом у здоровых лиц ВА водосодержащих сред тканей лица находится в пределах 91,6-103,9 ед. Указанные изменения свидетельствуют о том, что у больных с ПД в областях, в которых отсутствуют видимые проявления дерматита, имеется тенденция к повышению ВА, что указывает на формирование в непораженных участках изменений водосодержащих сред.
В исследовании проанализирован характер связи показателей эндогенной интоксикации и клеточного метаболизма в их связи с ВА водосодержащих сред у больных ПД и здоровых лиц (табл. 4).
Таблица 4
Результаты корреляционного анализа показателей эндогенной интоксикации, клеточного метаболизма и ВА у здоровых и больных лиц
|
Анализируемые показатели |
Коэффициент корреляции (г) показателей с ВА больных ПД |
Коэффициент корреляции (г) показателей с ВА здоровых лиц |
|
ЛКБ |
–0,5 |
0,46 |
|
Гликоген |
–0,34 |
–0,57 |
|
Г-6-Ф |
–0,78 |
–0,62 |
|
ВНСММ |
0,41 |
–0,94 |
|
Олигопептиды |
–0,37 |
–0,89 |
|
НСТ-тест |
0,29 |
–0,87 |
|
Катаболический пул |
0,25 |
0,32 |
Результаты корреляционного анализа позволяют говорить о существовании принципиальных различий в характере связи ВА водосодержащих сред тканей лица с рядом биохимических показателей функционального состояния организма больных ПД.
Так, было установлено, что ВА находится в сильной обратной зависимости от концентрации в крови олигопептидов (р=0,0012), молекул низкой и средней молекулярной массы (р<0,001), Г-6-Ф (р=0,019). Кроме этого, было выявлена статистически значимая сильная отрицательная связь результатов НСТ-теста, отражающего состояние фагоцитирующей функции гранулоцитов, и значений ВА водосодержащих сред тканей лица здоровых лиц (р=0,0013). Менее сильная отрицательная связь выявлена между ВА и уровнем гликогена (р=0,038). Анализ также показал, что концентрация ЛКБ нейтрофилов периферической крови здоровых лиц характеризуется слабой положительной связью с ВА (р=0,049).
Формирование патологических изменений при ПД характеризуется изменением направленности связи рассмотренных показателей и, как правило, снижением ее силы. Так, было установлено, что у больных связь концентрации ВНСММ, НСТ-теста изменяется с резко отрицательной на умеренную положительную. Тесная положительная взаимосвязь ВА и уровня олигопептидов существенно уменьшается, до уровня слабой. Анализ также показал, что корреляция уровня ЛКБ и ВА при развитии ПД изменяет свой знак на отрицательный, оставаясь неизменной по своей силе. Уровень гликогена и ВА, оставаясь отрицательной умеренной силы связью, при развитии заболевания характеризуется уменьшением своей силы. Корреляция катаболического пула и ВА, являющаяся слабой отрицательной у здоровых лиц, у больных ПД практически не изменяет своего характера.
На этом фоне взаимосвязь уровня Г-6-Ф и ВА при развитии патологических изменений характеризовалась дальнейшим усилением имеющейся сильной отрицательной корреляции.
Обсуждение. Формирование клинической картины ПД происходит на фоне измененного клеточного метаболизма, при этом формирование молекулярноклеточных изменений, определяющих развитие патологического процесса в целостном организме, приводит к изменениям со стороны водосодержащих сред тканей лица, что указывает на более глубокий уровень патологических изменений систем гомеостаза, нежели клеточный. Изменение волновой активности водосодержащих сред тканей лица свидетельствует об изменении радиофизических свойств биологической ткани, являющихся следствием нарушения нормального клеточного метаболизма.
Развитие патологических процессов при ПД затрагивает и водосодержащую среду тканей лица, приводя к изменению их радиофизических свойств и их волновой активности, что способствует прогрессированию имеющихся молекулярно-клеточных изменений, длительному и упорному течению заболевания.
Анализ результатов проведенного исследования позволил установить статистически значимое увеличение в плазме крови больных ПД катаболического пула, концентрации молекул низкой и средней молекулярной массы, олигопептидов, диеновых конъюгатов, а в нейтрофильных гранулоцитах циркуляторного русла — лизосомальных катионных белков на фоне снижения гликогена, НСТ-теста.
Таким образом, выявленные нарушения метаболического гомеостаза при ПД являются результатом эндогенной интоксикации, обусловленной накоплением в крови токсических продуктов обмена, оказы- вающих отрицательное влияние на клеточный метаболизм, способствуя развитию клеточной и тканевой гипоксии, а также нарушению микроциркуляции. Все это диктует необходимость проведения корригирующей патогенетической терапии (энтеросорбенты, антигипоксанты, стабилизаторы клеточных мембран, иммуномодуляторы).
Выводы:
-
1. Трансрезонансная функциональная топография является неинвазивным и безопасным методом диагностики, позволяющим получить объективную дополнительную информацию об особенностях течения периоральным дерматитом.
-
2. Впервые разработана методика радиометрического исследования кожи лица, объективные критерии диагностики периорального дерматита, определены значения волновой активности тканей лица, характерные для здоровых лиц и больных перио-рального дерматита.
-
3. Показана высокая информативность радиометрического исследования в диагностике воспалительных изменений кожи, клеточного метаболизма и состояния водосодержащих сред непосредственно в зонах поражения тканей кожи лица у больных перио-ральным дерматитом.
Список литературы Изучение состояния волновой активности и клеточного метаболизма тканей лица у больных периоральным дерматитом
- Олисова О. Ю., Громова С. А. Периоральный дерматит//Рус. мед. журн. 2003. № 7. С. 972 -975
- Вислобоков А. В. Опыт лечения розацеа и перио-рального дерматита//Рос. журн. кож-вен. бол. 2003. № 1. С. 75 -76
- Карелина О. Ю., Карелин Ю. М. Периоральный дерматит: лечение азелаиновой кислотой//Клин. дерматол. и вене-рол. 2006. № 1. С. 75 -77
- Takiwaki H, Tsuda Ff., Asase S., Takeichi H. Differences between intrafollicular microorganism profles in perioral and seborrh dermatitis//Clin. Exp. Dermatol. 2003. № 28. Р. 531 -534
- Габриэлян Н. И., Левицкий Э. Р., Дмитриев А. А. Скри-нинговый метод определения средних молекул в биологических жидкостях. М., 1985. 18 с.
- Малахова В. Я. Эндогенная интоксикация как отражение компенсаторной перестройки обменных процессов в организме//Эфферентная терапия. 2000. № 4. С 3 -14
- Manus J. Определение гликогена в лейкоцитах цитохимическим методом//Медицинские и лабораторные технологии: справ. СПб., 2002. 600 с.
- Пигаревский В. Е., Мазинг Ю. А. Определение лизосо-мально-катионного теста с прочным зеленым//Лаб. дело. 1981. № 10. С. 579 -582
- Петросян В. И., Громов М. С., Власкин С. В. Трансрезонансная функциональная топография: биофизическое обоснование//Миллиметровые волны в биологии и медицине. 2003. № 1. С. 23 -26
- Петросян В. И., Майбородин А. В., Дягилев Б. Л., Ры-тик А. П. Резонансы воды в радиодиапазоне//Биомедицинские технологии и радиоэлектроника. 2006. № 12. С 42 -45.


