Изучение способности алканотрофных родококков к биотрансформации стигмаст-5-ен-зр-ола
Автор: Ноговицина Е.М., Гришко В.В., Кукина Т.П., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2004 года.
Бесплатный доступ
Среди актинобактерий с высокой активностью оксигеназ, хранящихся в Региональной профилированной коллекции алканотрофных микроорганизмов ИЭГМ (www.ecology.psu.ru/ iegmcol/strains/), выявлены штаммы Rhodococcus spp., катализирующие процесс биоконверсии стигмаст-5-ен-Зр-ола (|3-ситостерола) в стигмаст-4-ен-З-он в соокислительных условиях культивирования родококков на минеральной среде с н-гексадеканом. Установлено, что клетки родококков в присутствии глюкозы и ингибитора 2,2'-ди1шридила трансформируют стиг- маст-5-ен-Зр-ол в 17(3-гидроксиандрост-4-ен-3-он (тестостерон), широко востребованный в фармацевтической практике.
Короткий адрес: https://sciup.org/147204315
IDR: 147204315 | УДК: 57.088.6+577.175.62
Текст научной статьи Изучение способности алканотрофных родококков к биотрансформации стигмаст-5-ен-зр-ола
В работе использовали 99 штаммов родококков (табл. 1), принадлежащих видам R. erythropolis, R “longus", R. opacus, R. rhodochrous, R. ruber и хранящихся в Региональной профилированной коллекции алканотрофных микроорганизмов ИЭГМ (Каталог штаммов..., 1994; www.ecology. .
Таблица 1
Коллекционные штаммы Rhodococcus spp.
|
Род, вид |
Количество штаммов |
Номер штамма в коллекции ИЭГМ |
|
R. erythropolis |
18 |
10,12,22,23,179,183,188, 192,200,203, 252,259,267, 271,487,498,505,696 |
|
R. "longus " |
4 |
28,32, 68,69 |
|
R. opacus |
3 |
246, 261,489 |
|
R. rhodochrous |
3 |
64, 647, 655 |
|
R. ruber |
71 |
71, 72,73, 74, 75, 76, 77,78, 79, 80,81, 82,83, 84, 85,86, 87,88, 89,90,91,92, 93,94, 172,219,220,221,223,224, 225,226,227,228,230,231, 232,233,234,235,236,237, 238,239,240,241,242,243, 320,321,322,323,324,325, 326,327,328,329,331,333, 346,381, 457,467,468,474, 478, 577, 583,593,597 |
Культуры выращивали в жидкой минеральной среде (г/л): KNO3- 1,0; КН2РО4 - 1,0; К2НРО4 -1,0; NaCl - 1,0; MgSO4- 0,2; СаС12-0,02; FeCl3 -0,001; дрожжевой экстракт - 0,1, содержащей 0,1 об.% н-гексадекана, 1,0 % глицерина или 1,0 % глюкозы. Стигмаст-5-ен-Зр-ол (500мг/л) предварительно растворяли в пропан-2-оле и добавляли в минеральную среду через 48 ч культивирования бактериальных клеток. В экспериментах по ингибированию 9а-гидроксилазной активности одновременно с стигмаст-5-ен-ЗР-олом в качестве ингибитора вносили 2,2'-дипиридил (70 мг/л). Культивирование родококков проводили на орбитальном шейкере (150 об/мин) при температуре 28°С. Посевным материалом служили родококки (5 х 105кл/мл), выращенные на мясопептонном агаре и отобранные в экспоненциальной фазе роста. Содержание белка определяли с использованием модифицированнового метода Лоури (Горина, Яковлева, 1980). Количество остаточного стерина в культуральной жидкости выявляли ферментативным экспресс-методом (Allain et al., 1974) с использованием спектрофотометра Lambda EZ201 (Perkin Elmer) и коммерческой тест-системы контроля уровня холестерола (ООО «Ольвекс Диагно-стикум», Санкт-Петербург).
Продукты микробного окисления экстрагировали этиловым эфиром уксусной кислоты (3 х 50
мл). Объединенные этилацетатные вытяжки сушили над обезвоженным сульфатом натрия. Растворитель удаляли с помощью роторного испарителя. Образование продуктов бактериального окисления контролировали методом тонкослойной хроматографии на Sigma-Aldrich ТСХ пластинах. Образование стигмаст-4-ен-З-она регистрировали в УФ-лучах, остальных интермедиатов — опрыскиванием H2SO4 (конц.) и последующим прогреванием при 95-100°С в течение 4-6 мин. При анализе реакционных смесей в качестве эталонного соединения использовали химически чистый стигмаст-4-ен-З-он, который получали путем окисления стигмаст-5-ен-Зр-ола хромовой смесью. Количественный состав продуктов окисления анализировали с применением высокоэффективной жидкостной хроматографии на приборе Милихром (колонка 6,3x0,2 см с фазой Lichrosorb RP-18). В качестве элюента использовали метанол, дегазированный путем продувки гелия, в качестве растворителя для нанесения пробы на колонку — смесь ацетона с метанолом (3:1); рабочая длина волны прибора - 210 нм. Содержание стигмаст-4-ен-З-она в сумме стерино-вых компонентов определяли по площадям пиков хроматограмм реакционных смесей с учетом коэффициентов, обусловленных разницей в экстинкции исходного и конечного продукта. Данные коэффициенты рассчитывали при использовании искусственных смесей стигмаст-5-ен-ЗР-ола и стиг-маст-4-ен-З-она. Качественный анализ продуктов биотрансформации проводили на газовом хроматографе Agilent 6890N с квадрупольным масс-спектрометром Agilent MSD 5973N в качестве детектора и кварцевой колонкой HP-5MS SN US 15189741-1.
Для статистической обработки результатов использовали компьютерные программы Microsoft Excel.
Результаты и их обсуждение
Экспериментами установлено, что все исследуемые штаммы родококков используют стигмаст-5-ен-ЗР-ол в качестве единственного источника углерода и энергии. При этом уровень деструкции исходного субстрата незначителен и не превышает 20%.
Нами был отобран штамм R ruber ИЭГМ 233 (табл. 2), трансформирующий стигмаст-5-ен-Зр-ол до стигмаст-4-ен-З-она (7,9%), образование которого катализируется бифункциональным ферментом - холе-стеролоксидазой, ответственным за реакции окисления ЗР-гидроксильной группы и изомеризации двойной связи. С целью повышения степени конверсии стерина данный штамм выращивали в соокислитель-ных условиях с использованием глицерина, глюкозы или н-гексадекана. По нашим данным, максимальное (68,59 мкг/мл) накопление клеточного белка наблюдается при выращивании R. ruber ИЭГМ 233 в условиях соокисления с глюкозой, в остальных слу- чаях содержание белка не превышает 20,83-27,95 мкг/мл (рис. 2).
Таблица 2
Биотрансформация стигмаст-5-ен-Зр-ола клетками Rhodococcus spp.
|
Вид, штамм |
Сумма продук-тов реакции, мг/л 460,70 |
Содержание в сумме продуктов реакции, мг/л |
|
|
Стигмаст- 5-ен-Зр-ол 460,70 |
Стигмаст- 4-ен-З-он Не обнаружено |
||
|
Абиотический контроль |
|||
|
R. erythropolis ИЭГМ 22 |
443,42 |
421,64 |
(<1) |
|
R. erythropolis ИЭГМ 23 |
468,12 |
461,45 |
(<1) |
|
R. erythropolis ИЭГМ 179 |
441,52 |
415,83 |
15,69(3,6) |
|
R erythropolis ИЭГМ 183 |
439,21 |
411,18 |
17,45 (4,0) |
|
R. ruber ИЭГМ 77 |
428,63 |
397,62 |
9,08(2,1) |
|
R. ruber ИЭГМ 80 |
451,28 |
449,43 |
(<1) |
|
R. ruber ИЭГМ 233 |
365,57 |
308,83 |
28,84 (7,9) |
|
R. ruber ИЭГМ 322 |
450,27 |
443,87 |
(<1) |
Примечание. Здесь и в табл. 3 в скобках приведено количество стигмаст-4-ен-З-она в процентах.
Как видно из табл. 3, родококки осуществляют биотрансформацию стигмаст-5-ен-ЗР-ола наиболее активно в условиях соокислительного роста в присутствии н-гексадекана. При этом в качестве основного
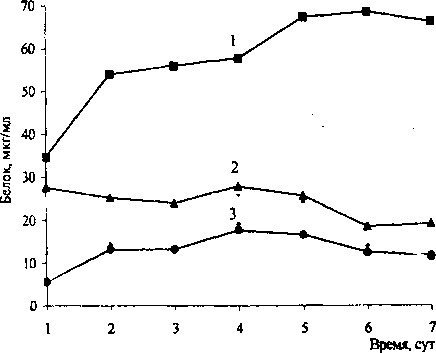
Рис. 2. Содержание клеточного белка R. ruber ИЭГМ 233 при росте в среде с стигмаст-5-ен-ЗР-олом в присутствии:
1 - глюкозы, 2 - н-гексадекана, 3 - глицерина продукта биотрансформации накапливается значительное (310,5 мг/л) количество стигмаст-4-ен-З-она -общая сумма продуктов реакции составляет 376,65 мг/л. В связи с этим все эксперименты по изучению трансформирующей активности родококков в дальнейшем проводили в соокислительных условиях с ис пользованием и-гексадекана. На рис. 3 представлены хроматограммы продуктов биотрансформации стери-на клетками Rhodococcus spp., полученные с использованием метода высокоэффективной жидкостной хроматографии. Большинство исследуемых штаммов родококков в условиях соокисления с и-гексадеканом трансформируют стигмаст-5-ен-ЗР-ол до стигмаст-4-ен-3-она, содержание которого в сумме продуктов биотрансформации у наиболее активных бактериальных культур составляет от 40,0 до 98,0%. Как видно из табл. 4, представители R ruber характеризуются наиболее выраженной холестеролоксидазной активностью в отношении стигмаст-5-ен-Зр-ола и катализируют процесс биоконверсии стерина до образования стигмаст-4-ен-З-она.
Таблица 3
Биотрансформация стигмаст-5-ен-Зр-ола клетками Rhodococcus ruber ИЭГМ 233
|
Источник углерода |
Сумма продуктов реакции, мг/л |
Содержание в сумме продуктов реакции, мг/л |
|
|
Стигмаст- 5-ен-ЗР-ол 308,83 |
Стигмаст-4-ен-З-он |
||
|
Р-Сигостерол |
365,57 |
28,84 (7,9) |
|
|
ч-Гексадекан |
376,65 |
10,75 |
310,50 (82,4) |
|
Глицерин |
248,23 |
167,47 |
60,35 (24,3) |
|
Глюкоза |
152,42 |
59,44 |
83,25 (54,6) |
Таблица 4
Биотрансформация стигмаст-5-ен-Зр-ола клетками Rhodococcus spp. в присутствии н-гексадекана
|
Вид, штамм (число штаммов) Абиотический контроль |
Количество стигмаст-4- ен-3-она, % 0 |
|
R. erythropolis (7) |
4,7-27,1 |
|
R. erythropolis (10) |
41,0-57,1 |
|
R. erythropolis ИЭГМ 10 |
70,7 |
|
R. "longus" (4) |
2,2-8,0 |
|
R. opacus (3) |
2,9-6,3 |
|
R. rhodochrous (3) |
0-14,4 |
|
R. ruber (27) |
4,6-27,4 |
|
R. ruber(13) |
33,9-47,3 |
|
R ruber (22) |
51,2-78,4 |
|
R. ruber ИЭГМ 219 |
80,0 |
|
R. ruber ИЭГМ 233 |
82,4 |
|
R. ruber ИЭГМ 235 |
90,6 |
|
R. ruber ИЭГМ 94 |
92,7 |
|
R. ruber ИЭГМ 72, ИЭГМ 85, ИЭГМ 86, ИЭГМ 172, ИЭГМ 220 |
98,0 |
Необходимо отметить, что во всех экспериментах был получен низкий уровень продуктов отщепления боковой цепи Р-ситостерола, содержание которых не превышало 2%. С учетом результатов определения способности родококков к более полной деградации стигмаст-5-ен-ЗР-ола (табл. 3) и максимального накопления клеточной биомассы в условиях соокисления с глюкозой (рис. 2)
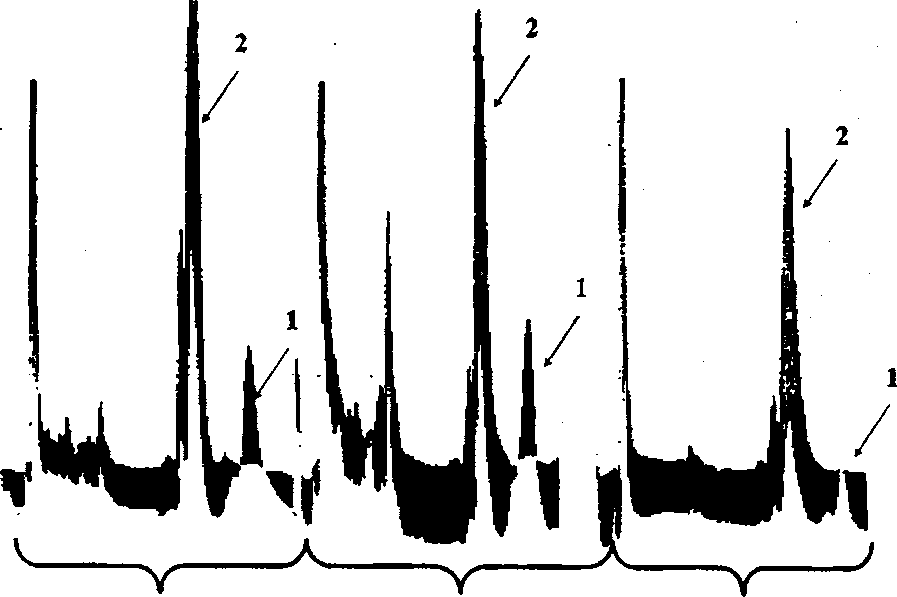
R. erythropolis ИЭГМ 203 R. ruber ИЭГМ 80 К ruber ИЭГМ 91
Рис. 3. Хроматограммы продуктов биотрансформации стигмаст-5-ен-З 0-ола клетками Rhodococcus spp. в соокислительных условиях в присутствии и-гексадекана:
1 - остаточный стигмаст-5-ен-ЗР-ол; 2 - стигмаст-4-ен-З-он последующие скрининговые исследования проводили в условиях ингибирования активности фермента 9а-гидроксилазы, катализирующего начальную стадию деструкции циклического остова молекулы стерина. По данным хромато-масс-спект-рометрии, в присутствии глюкозы и ингибитора 2,2'-дипиридила с использованием клеток родококков достигается отщепление боковой алифатической цепи стигмаст-5-ен-30-ола с образованием 10% 170-гидроксиандроста-4-ен-3-она (тестостерона). Необходимо отметить, что в литературе описана способность лишь некоторых прокариотных организмов, в частности микобактерий, к одностадийной трансформации стеринов до образования тестостерона (Hung et al, 1994; Lo et al., 2002).
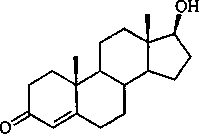
17р-Г идроксиандрост-4-ен-З-он (тестостерон)
Таким образом, нами установлено, что большинство исследованных коллекционных штаммов
Rhodococcus spp. в соокислительных условиях с н-гексадеканом трансформирует стигмаст-5-ен-30-ол в стигмаст-4-ен-З-он. При этом представители R. ruber характеризуются выраженной холестеро-локсидазной активностью по отношению к исходному стерину. Обнаружено, что родококки в соокислительных условиях с глюкозой в присутствии ингибитора 2,2’-дипиридила катализируют реакцию отщепления боковой алифатической цепи 0-ситостерола с образованием целевого продукта 170-гидроксиандроста-4-ен-3-она (тестостерона).
Работа поддержана грантами ФЦП «Интеграция науки и высшего образования России на 20022006 годы» (проект № И0573/1343), РФФИ (№ 0104-96461).
Список литературы Изучение способности алканотрофных родококков к биотрансформации стигмаст-5-ен-зр-ола
- Горина И.А., Яковлева В.И. Быстрый метод определения содержания белка в клетках микроорганизмов//Прикл. биохимия и микробиология. 1980. Т. 16, №6. С. 936-937.
- Ившина КБ. Бактерии рода Rhodococcus: биоразнообразие, детекция, иммунодиагностика: Дис... д-рабиол. наук. Пермь, 1997.
- Каталог штаммов Региональной профилированной коллекции алканотрофных микроорганизмов/Под ред. И.Б. Ившиной М.: Наука, 1994.
- AUain С.С., Рооп LS., Chan C.S.G., Richmond W., Fu P. С. Enzymatic determination of total serum cholesterol//Clin. Chem. 1974. Vol. 20, № 4. P. 470-475.
- Ambrus G., Ilkoy E., Jekkel A., Horvath 0., Bocskei Z. Microbial transformation of p-sitosterol and stigmasterol into 26-oxygenated derivatives//Steroids. 1995.'Vol. 60, № 6. P. 621-625.
- Hung B.R., Falerq A., Lanes N., Perez S., Ramirez M.A. Testosterone as biotransformation product in steroid conversion by Mycobacterium sp.//Biotechnol. Lett. 1994. Vol. 16, № 5. P. 497-500.
- Lo C.K., Pan CP., Liu W.H. Production of testosterone from phytosterol using a single-step microbial transformation by mutant of Mycobacterium sp. II J. Ind. Microbiol. Biotechnol. 2002. Vol. 28, № 5. P. 280-283.
- MacLachlan J., Wotherspoon A.T.L., Ansell R.O., Brooks, C.J.W. Cholesterol oxidase: sources, physical properties and analytical applications//J. Ster. Biochem. Mol. Biolog. 2000. Vol. 72, № 5. P. 169-195.
- Mahato S.B., Garai S. Advances in microbial steroid biotransformation II Steroids. 1997. Vol. 62, № 4. P. 332-345.
- Mahato S.B., Majumdar L Current trends in microbial steroid biotransformatioil II Phytochemistry. 1993. Vol. 34, № 4. P. 883-898.
- Murohisa Т., lida M. Studies on microbial transformation (XXVI). Some new intermediates in microbial side chain degradation II J. Ferment. Bioeng. 1993. Vol. 75, № 3. P. 174-180.
- Seidel L, Hoerhold С Selection and characterization of new microorganisms for the manufacture of 9-OH-AD from sterol II J. Basic. Microbiol. 1992. Vol. 32, № L P. 49-55.
- Warhurst A.M., Fewson A.C Biofransformations catalyzed by the genus Rhodococcus II Crit. Rev. Biotechnol. 1994. Vol. 14, № 1. P. 29-73.


