Изучение сродства n-ацильных производных 2-оксо-1-пирролидинацетамида к сайту связывания NMDA-рецептора методом молекулярного докинга
Автор: Чиряпкин А.С., Глушко А.А., Кодониди И.П.
Журнал: Juvenis scientia @jscientia
Рубрика: Медицинские науки
Статья в выпуске: 3, 2019 года.
Бесплатный доступ
Поиск новых соединений, обладающих высокой ноотропной биологической активностью, является перспективным научным направлением. Современным вычислительным методом прогнозирования фармакологической активности у изучаемых соединений является молекулярный докинг. Целью работы является исследование сродства новых N-ацильных производных 2-оксо-1-пирролидинацетамида к сайту связывания NMDA-рецептора с целью поиска новых эффективных ноотропных лекарственных препаратов. В качестве объектов исследования были использованы новые N-ацильные производные 2-оксо-1-пирролидинацетамида, рацетамы, глутамат и виртуальная модель NMDA-рецептора организма Rattus norvegicus с идентификационным кодом 2A5S из базы данных RCSB PDB. Результаты проведённого вычислительного эксперимента говорят о наличии высокой ноотропной биологической активности у исследуемых соединений. Наибольшим сродством из N-ацильных производных 2-оксо-1-пирролидинацетамида к сайту связывания NMDA-рецептора обладает соединение 3. Таким образом, считаем целесообразным проведение фармакологических in vivo исследований данных соединений на предмет наличия ноотропной биологической активности.
2-оксо-1-пирролидинацетамид, n-ацильные производные, nmda-рецептор, молекулярный докинг, сайт связывания, биологическая активность, прогноз
Короткий адрес: https://sciup.org/14114565
IDR: 14114565 | УДК: 615.21:519.876.5:577.29 | DOI: 10.32415/jscientia.2019.03.01
Текст научной статьи Изучение сродства n-ацильных производных 2-оксо-1-пирролидинацетамида к сайту связывания NMDA-рецептора методом молекулярного докинга
Введение. Ноотропные лекарственные препараты (ноотропы) – это обширная группа лекарственных препаратов, которая используется в ходе терапии различных патологических состояний и заболеваний центральной нервной системы (ЦНС). Лекарственные препараты данной фармакологической группы улучшают метаболические процессы в нейронах, нормализируют процессы кровообращения в тканях головного мозга, а также повышают устойчивость ЦНС к негативным внешним и внутренним воздействиям. В результате такого комплексного воздействия ноотропов на ткани головного мозга у человека происходит улучшение когнитивных способностей мозговой деятельности.
Одним из рецепторов, с помощью которого реализуется регуляция работы ЦНС, является NMDA-рецептор. Эти рецепторы принимают участие в процессах возбудимости нервной ткани, а также формируют синаптическую пластичность. Активирующим воздействие на NMDA-рецептор оказывают такие биогенные стимуляторы, как глутамат, ас- партат и N-метил-D-аспартат. NMDA-рецептор относится к классу глутаматных рецепторов [1, 2].
Современным методом прогнозирования наличия и выраженности определенной биологической активности у исследуемых соединений является молекулярный докинг. Данный вычислительный эксперимент основан на поиске наиболее выгодной ориентации низкомолекулярного соединения в выбранной области моделирования рецептора или фермента. При этом представляется возможным изучить с какими аминокислотами образует связи лиганд в процессе взаимодействия с сайтом связывания белковой мишени [3].
Цель работы. Исследование сродства новых N-ацильных производных 2-оксо-1-пирролидинацетамида к сайту связывания NMDA-рецептора с целью поиска новых эффективных ноотропных лекарственных препаратов.
Материалы и методы. В качестве объектов для прогнозирования биологической активности в отношении
NMDA-рецептора были выбраны синтезированные на кафедре органической химии ПМФИ – филиала ВолГМУ N-ацильные производные 2-оксо-1-пирролидинацета-мида. Это N-ацетил-2-(2-оксициклопентил)-ацетамид (1), N-пропаноил-2-(2-оксициклопентил)-ацетамид (2) и N-бутаноил-2-(2-оксициклопентил)-ацетамид (3) [4, 5]. Для сопоставления результатов сродства новых N-ацильных производных 2-оксо-1-пирролидинацетамида к сайту связывания NMDA-рецептора методом молекулярного докинга использовались глутамат и следующие рацетамы: пирацетам, анирацетам, оксирацетам, фонтурацетам и леветирацетам.
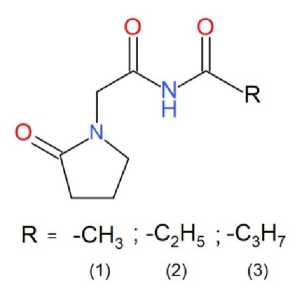
Рисунок 1. Структурные химические формулы N-ацильных производных 2-оксо-1-пирролидинацетамида
Ранее ученые Furukawa H., Singh S.K., Mancusso R. и Gouaux E., проводя рентгеноструктурный анализ комплекса субъединицы NR2A NMDA-рецептора с глутаматом, установили с какими аминокислотами сайта связывания NMDA-рецептора вступает во взаимодействие молекула глутаминовой кислоты. Это аминокислоты Ser 114, Thr 116, Arg 121, Ser 173 и Thr 174. Наличие связей низкомолекулярных соединений с данными аминокислотами необходимо для реализации активирующего действия на глутаматный рецептор [6].
С целью изучения взаимодействия низкомолекулярных соединений с сайтом связывания глутамата NMDA-рецептора была использована пространственная структура белок-лигандного комплекса организма Rattus norvegicus с идентификационным кодом 2A5S. В качестве лиганда в нем выступает молекула глутаминовой кислоты. Данный белок-лигандный комплекс был представлен в базе данных RCSB Protein Data Bank (rcsb.org) [7].
Пространственные структуры всех веществ, участвующих в исследовании, были построены в программе HyperChem 6.09. В этой же программе проведена оптимизация геометрии методом молекулярной механики MM+ [8]. В дальнейшем было проведено исследование взаимодействия лигандов с сайтом связывания NMDA-рецептора методом молекулярного докинга. Для этих целей использовалась программа Molegro Virtual Docker 6.0.1, в которой используется один из самых точных алгоритмов оценки лиганд-рецепторного сродства. Программа Molegro Virtual Docker обеспечивает более высокую точность расчёта белково-лигандных взаимодействий, чем многие другие современные программы осуществления молекулярного докинга [9, 10]. Областью проведения молекулярного докинга выступала сфера с радиусом 12 Å со следующими координатами: x = 16.42, у = 24.78, z = 37.16. В качестве функции подсчета энергии лиганд-рецепторного взаимодействия была выбрана MolDock Score [GRID] с разрешением grid 0,30 А. В результате проведенного молекулярного докинга было получено 200 вариантов образования молекулярного лиганд-рецепторного комплекса для каждого исследуемого соединения.
Результаты и обсуждение. В ходе проведенного вычислительного эксперимента были определены наиболее энергетически выгодные расположения исследуемых соединений в сайте связывания NMDA-рецептора. Результаты приведены в таблице 1.
Таблица 1 Минимальное значение энергии взаимодействия исследуемых соединений с сайтом связывания NMDA-рецептора
|
Лиганд |
Минимальная энергия лиганд-рецепторного взаимодействия, ккал/моль |
|
1 |
-109.5360 |
|
2 |
-117.4930 |
|
3 |
-120.5520 |
|
Пирацетам |
-90.5526 |
|
Анирацетам |
-114.0780 |
|
Глутамат |
-99.4834 |
|
Леветирацетам |
-103.3600 |
|
Оксирацетам |
-94.3876 |
|
Фонтурацетам |
-120.8060 |
Результаты молекулярного докинга (табл. 1) свидетельствуют о том, что все три N-ацильные производные 2-оксо-1-пирролидинацетамида обладают высоким сродством к сайту связывания NMDA-рецептора. По минимальной энергии лиганд-рецепторного взаимодействия они превосходят молекулы пирацетама, глутамата, леветирацетама и оксирацетама. Стоит отметить, что по мере удлинения N-ацильного заместителя происходит увеличение сродства N-ацильных производных 2-оксо-1-пир-ролидинацетамида к сайту связывания NMDA-рецептора. Соединением лидером из них является вещество 3-N-бу-таноил-2-(2-оксициклопентил)-ацетамид. Анирацетам за-
Соединение 1
Соединение 2
Соединение 3
Соединение 4
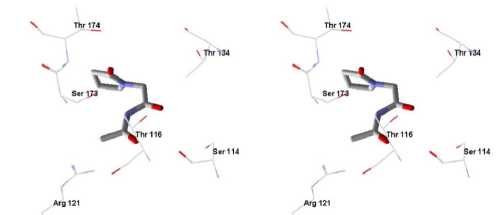
Рисунок 2. Расположение соединения 1, 2, 3 и глутамата в сайте связывания NMDA-рецептора согласно результатам молекулярного докинга нимает более энергетически выгодное расположение в сайте связывания NMDA-рецептора, чем молекула соединения. 1. Из изучаемых соединений наименьшую энергию лиганд-рецепторного взаимодействия имеет фонтураце-там, но следует отметить, что данное соединение превосходит по ней соединение 3 только на 0,254 ккал/моль. На рисунке 2 показано наиболее энергетически выгодные расположения N-ацильных производных 2-оксо-1-пирроли-динацетамида и глутаминовой кислоты по результатам молекулярного докинга в сайте связывания NMDA-рецептора. На данном рисунке обозначены аминокислоты Ser 114, Thr 116, Arg 121, Ser 173 и Thr 174, с которыми взаимодействует молекула глутамата в сайте связывания NMDA-рецептора согласно данным рентгеноструктурного анализа.
На рисунке 2 видно, что аминокислоты Ser 114, Thr 116, Arg 121, Ser 173 и Thr 174 сайта связывания NMDA-рецептора находятся близко с исследуемыми молекулами. Таким образом, можно говорить, о возможности взаимодействия изучаемых соединений с данными аминокислотами, что обусловливает наличие у них активирующего действия на глутаматный рецептор.
Заключение. По результатам проведенного вычислительного эксперимента было установлено, что все три N-ацильные производные 2-оксо-1-пирролидинацетамида обладают высоким сродством к сайту связывания NMDA-рецептора. При этом по минимальной энергии лиганд-рецепторного взаимодействия они превосходят молекулы пирацетама, глутамата, леветирацетама и оксирацетама. Наибольшим сродством из N-ацильных производных 2-оксо-1-пирролидинацетамида к сайту связывания NMDA-рецептора обладает соединение 3. Анирацетам занимает более энергетически выгодное расположение в сайте связывания NMDA-рецептора, чем молекула соединения 1. Соединение 3 уступает по минимальной энергии лиганд-рецепторного взаимодействия с сайтом связывания NMDA-рецептора от фонтурацетама на 0,254 ккал/моль. Таким образом, из полученных данных вычислительного эксперимента следует, что синтезированные N-ацильные производные 2-оксо-1-пирролидинацетамида могут обладать высокой ноотропной активностью. Считаем целесообразным проведение фармакологических in vivo исследований данных соединений на предмет наличия ноотропной биологической активности.
Список литературы Изучение сродства n-ацильных производных 2-оксо-1-пирролидинацетамида к сайту связывания NMDA-рецептора методом молекулярного докинга
- Машковский М.Д. Лекарственные средства. 15-е изд. М.: Новая Волна; 2005.
- Бурчинский С.Г. Ноотропы: классификация, механизмы действия, сравнительная характеристика фармакологических свойств. Киев: 2004.
- Глушко А.А., Воронков А.В., Кодониди И.П., и др. Молекулярный докинг N-замещенного производного изохинолонас каталитическим доменом C//Фармация и фармакология. 2014. Т. 2. № 1(2). С. 3-7 DOI: 10.19163/2307-9266-2014-2-1(2)-3-7
- Кодониди И.П., Чиряпкин А.С., Аненко Д.С. Компьютерное изучение спектра биологичечской активности N-ацильных производных 2-оксо-1-пирролидинацетамида//Разработка, исследование и маркетинг новой фармацевтической продукции: сборник научных трудов. Пятигорск: РИА-КМВ; 2018. Вып. 73.
- Чиряпкин А.С., Кодониди И.П., Аненко Д.С. Разработка методики качественного анализа N-ацильных производных 2-оксо-1-пирролидинацетамида методом тонкослойной хроматографии//Разработка, исследование и маркетинг новой фармацевтической продукции: сборник научных трудов. Пятигорск: РИА-КМВ; 2018. Вып. 73.
- Furukawa H, Singh SK, Mancusso R, et al. Subunit arrangement and function in NMDA receptors. Nature. 2005;(438):185-192 DOI: 10.1038/nature04089
- Berman HM, Westbrook J, Feng Z, et al. The Protein Data Bank. Nucleic Acids Res. 2000;28(1):235-42.
- Brian J Teppen. HyperChem, release 2: molecular modeling for the personal computer. J. Chem. Inf. Comput. Sci. 1992;32(6):757-759 DOI: 10.1021/ci00010a025
- Thomsen R, Christensen MH. MolDock: a new technique for high-accuracy molecular docking. J. Med. Chem. 2006;49(11):3315-3321 DOI: 10.1021/jm051197e
- Tri-ibiotech. Molegro Virtual Docker. URL: http://www.tri-ibiotech.com.


