Изучение свойств свободной и иммобилизованной L-фенилаланин-аммоний-лиазы из Rhodosporidium toruloides на силохроме С-80
Автор: Бабич О.О., Солдатова Л.С.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Вопросы общей биологии
Статья в выпуске: 1-1 т.14, 2012 года.
Бесплатный доступ
Резюме: L-фенилаланин-аммоний-лиаза из Rhodosporidium toruloides иммобилизована при помощи глутарового альдегида на силанизированном силохроме С-80. Изучена термо- и рН-стабильность свободного и иммобилизованного препарата L-фенилаланин-аммоний-лиазы, рассмотрено изменение его активности в процессе хранения. Исследована зависимость активности свободного и иммобилизованного ферментного препарата от концентрации белка в реакционной смеси и концентрации буфера. Проведена оценка влияния концентрации L-фенилаланина на количество образующейся транс-коричной кислоты. Проанализирована скорость дезаминирования L-фенилаланина при увеличении температуры инкубации.
L-фенилаланин-аммоний-лиаза, иммобилизация, глутаровый альдегид, фенилаланин, термостабильность
Короткий адрес: https://sciup.org/148205757
IDR: 148205757 | УДК: 577.122.332
Текст научной статьи Изучение свойств свободной и иммобилизованной L-фенилаланин-аммоний-лиазы из Rhodosporidium toruloides на силохроме С-80
В последние годы все больше исследователей посвящают свои работы изучению процессов привязывания ферментов к твердой основе [1].
Свойства иммобилизованных ферментных препаратов часто значительно отличаются от свойств исходных растворимых ферментов, и их особенности зависят от вида фермента, источника его получения и способа пришивки на твердый носитель и условий реакционной среды [2].
При иммобилизации активность фермента может значительно снижаться за счет диффузионного сопротивления, экранирования активного центра, конформационной модификации [2, 3]. C другой стороны, активность иммобилизованных ферментов, пришитых методом ковалентной фиксации, может полностью сохраняться и даже повышаться [4]. За счет повышения стабильности фермента при иммобилизации количество превращенного с его помощью субстрата возрастает во много раз [5].
L-фенилаланин-аммоний-лиаза (ФАЛ, КФ 4.3.1.5) катализирует реакцию обратимого дезаминирования аминокислоты L-фенилаланина до транскоричной кислоты и аммиака [6]. Основным источником данного фермента являются клетки дрожжей. Фермент представляет интерес в качестве терапевтического средства для лечения фенилкетонурии, может быть использован как для прямой терапии фенилкетонурии, так и для производства полноценных продуктов питания, не содержащих фенилаланин [7].
Целью настоящей работы являлось изучение оптимальных условий иммобилизации L-фенилаланин-аммоний-лиазы из Rhodosporidium toruloides методом ковалентного связывания на си-лохроме С-80. Использование силохрома для получения иммобилизованных препаратов L-фенилаланин-аммоний-лиазы имеет ряд преимуществ по сравнению с другими носителями [8]. Си-
лохром является дешевым и доступным материалом, что создает перспективы внедрения иммобилизованных на нем ферментов в крупномасштабных промышленных процессах.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследований являлся фермент L-фенилаланин-аммоний-лиаза, выделенный из клеток дрожжей Rhodotorula glutinis (Sigma-Aldrich-Louis, США). Удельная активность препарата составляла в среднем 0,87 ед./мг белка.
В качестве носителя использовался силохром марки С-80 (ТУ 6-09-17-48-82) с радиусом пор от 250 до 1000 А и удельную площадь поверхности от 20 до 98 м2/г. Силохром предварительно обрабатывался γ-аминопропилтриэтоксисиланом для введения аминогрупп и затем глутаровым альдегидом.
Для иммобилизации к влажному модифицированному носителю добавляли 30%-ный раствор исходного препарата L-фенилаланин-аммоний-лиазы в количестве 10-15 ед. удельной активности на мг носителя. Процесс привязки фермента осуществлялся при перемешивании в ледяной бане в течение заданного промежутка времени при рН 7,4-7,5, после чего носитель отделяли на пористом фильтре от жидкости. Фильтрат проверяли на присутствие белка. Промывку иммобилизованного препарата вели до исчезновения в промывных водах следов белка. Отмытый иммобилизованный ферментный препарат осушивали на стеклянном фильтре под вакуумом и в дальнейшем использовали для изучения свойств.
Содержание белка определяли методом Дюма, основанным на измерении теплопроводности молекулярного азота, образующегося после сжигания анализируемого образца при температуре около 1000ºС в атмосфере кислорода и последующего восстановления всех образующихся оксидов азота при помощи восстанавливающего агента, с использованием прибора «Rapid N Cube» (Германия).
Активность нативного и иммобилизованного фермента оценивали по образованию транскоричной кислоты при 290 нм (рН 8,7; 30ºС) [9].
Количество образующейся транс-коричной ки- Активность L-фенилаланин-аммоний-лиазы рас- слоты рассчитывали по увеличению светопоглоще- считывали по формуле ния с использованием молярного коэффициента экс тинкции, равного 104 дм3∙см-1∙моль-1 [10].
(∆ A270 nm/min Test - ∆ A270 nm/min Blank) × (3) × (df)
Ед./мл фермента = ------------------------------------------------------------------------ ,
(19,73) × (0,01)
где 3 - суммарный объем (в мл) испытания; df – фактор растворения; 19,73 – миллимолярный коэффициент экстинции транс-коричной кислоты при длине волны 270 нм.
ед./мл фермента
Ед./мг белка = --------------------- мг белка
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для определения термостабильности свободного и иммобилизованного препарата L-фенилаланин-аммоний-лиазы реакционную смесь без L-фенилаланина прогревали в течение 5 минут при температуре от 20С° до 80°С. Нагревание проводили в 0,05 М трис-HCI буфере, рН 8,5. После этого добавляли L-фенилаланин, инкубировали реакционные смеси при 30°С на качалке и определяли L-фенилаланин-аммоний-лиазную активность.
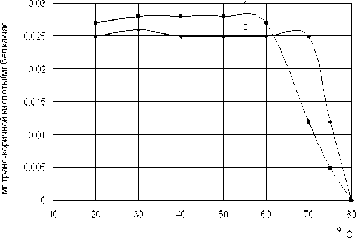
Рис. 1. Зависимость удельной активности L-фенилаланин-аммоний-лиазы Rhodosporidium toruloides от температуры: 1 - свободный препарат, 2 – иммобилизованный препарат
Данные, представленные на рис. 1, свидетельствуют о том, что свободная L-фенилаланин-аммоний-лиаза Rhodosporidium toruloides сохраняет свою активность при нагревании реакционных смесей вплоть до 60°С, а иммобилизованные препараты – до 65°С. Дальнейшее увеличение температуры приводит к падению L-фенилаланин-аммоний-лиазной активности. Полная инактивация фермента обнаружена при 75°С как у свободной, так и у иммобилизованной L-фенилаланин-аммоний-лиазы.
Дальнейшие исследования направлены на изучение изменения активности свободной и иммобилизованной L-фенилаланин-аммоний-лиазы в процессе хранения. Результаты полученных исследований представлены в таблице 1.
Анализ данных таблицы 1 свидетельствует о том, что иммобилизованная L-фенилаланин-аммоний-лиаза в течение длительного времени сохраняет более высокую активность, чем свободная. За 8 месяцев хранения при +4°С или +6°С в 0,15 М трис-HCI буфере (рН 8,8) свободная L-фенилаланин-аммоний- лиаза теряет 50% своей активности, тогда как иммобилизованная сохраняет первоначальный уровень активности фермента.
Таблица 1 . Изменение активности свободной и иммобилизованной L-фенилаланин-аммоний-лиазы в процессе хранения (в мг транс-коричной кислоты/мг белка∙час)
|
Варианты |
Время хранения, месяцы |
||||
|
0 |
3 |
4 |
6 |
8 |
|
|
Свободная |
0,02 7 |
0,02 7 |
0,02 2 |
0,01 2 |
0,01 2 |
|
Иммобилизован- |
0,04 |
0,04 |
0,04 |
0,04 |
0,03 |
|
ная |
0 |
0 |
0 |
0 |
7 |
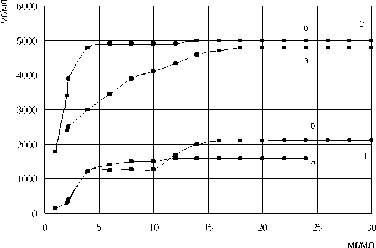
Рис. 2. Зависимость L-фенилаланин-аммоний-лиазной активности Rhodosporidium toruloides от концентрации белка: 1-4 часа инкубации; а – свободный препарат, 2 – 20 часов инкубации; б – иммобилизованный препарат
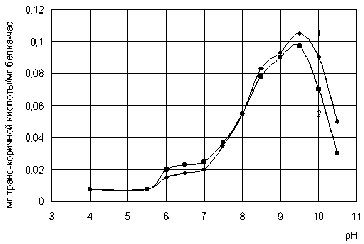
Рис. 3. Зависимость L-фенилаланин-аммоний-лиазной активности Rhodosporidium toruloides от значений рН буфера (инкубация 4 часа): 1 – свободный препарат, 2 – иммобилизованный препарат
Также выяснили, что L-фенилаланин-аммоний-лиазная активность Rhodosporidium toruloides зависит от концентрации белка в реакционной смеси. Наибольшая активность фермента обнаружена при содержании белка от 3,0 мг/мл и выше в случае им- мобилизованной и от 7,0 мг/мл и выше в случае свободной (рис. 2).
Для определения оптимального значения рН действия свободной и иммобилизованной L-фенилаланин-аммоний-лиазы величину рН варьировали от 4 до 10,5. Результаты определения активности ферментов представлены на рис. 3.
В ходе исследований выяснили, что L-фенилаланин-аммоний-лиаза активна в пределах значений рН от 5,0 до 10,0. Оптимальное значение рН для проявления активности свободной и иммобилизованной L-фенилаланин-аммоний-лиазы одинаково и лежит в пределах от 8,8 до 9,1.
Кроме того, определили, что L-фенилаланин-аммоний-лиазная активность зависит от концентрации буфера (рис. 4). Максимальное значение ферментативной активности свободной и иммобилизо- ванной L-фенилаланин-аммоний-лиазы обнаруживается при концентрациях буфера от 0,2 М и сохраняется до 1,0 М. Низкие концентрации буфера нежелательны, поскольку не обеспечивают поддержания постоянных значений рН. При концентрации буфера ниже 0,1 М значения рН уменьшались до 8,8-8,2 (исходное значение рН 9,1).
Далее в работе изучалось влияние концентрации L-фенилаланина на количество образующейся транскоричной кислоты. Результаты исследований представлены на рис. 5.
Определили, что количество транс-коричной кислоты, образуемой как свободной, так и иммобилизованной L-фенилаланин-аммоний-лиазой Rhodosporidium toruloides , увеличивается при повышении исходной концентрации L-фенилаланина в реакционной смеси.
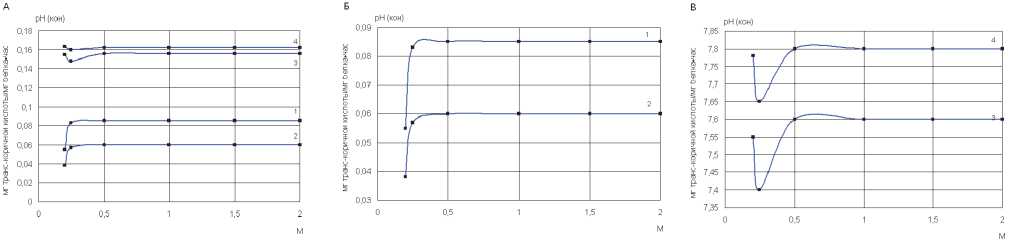
Рис. 4. Зависимость L-фенилаланин-аммоний-лиазной активности Rhodosporidium toruloides от концентрации буфера (инкубация 4 часа): А – трис-HСI буфер с рН 9,1, Б – боратный буфер с рН 9,1. Удельная ФАЛ-активность: 1 – свободный препарат, 2 – иммобилизованный препарат. рН конечный: 3 – свободный препарат, 4 – иммобилизованный препарат
С увеличением исходного содержания L-фенилаланина возрастает и количество трансформированной аминокислоты, этот процесс сопровождается образованием аммиака и транс-коричной кислоты (рис. 6).
Максимальное количество L-фенилаланина, которое может быть трансформировано за 20 часов при 30°С, составляет для свободной L-фенилаланин-аммоний-лиазы 15,0 г/л (90 мкМ/мл), а для иммобилизованной – 12,5 г/л (73 мкМ/мл) при начальном содержании аминокислоты 45 г/л. Однако при этом иммобилизованный фермент по сравнению со свободным обладает большей удельной L-фенилаланин-аммоний-лиазной активностью (0,07 и 0,05 мг транс – коричной кислоты/мг белка∙час, соответственно).
иммобилизованный препарат L-фенилаланин-аммоний-лиазы Rhodosporidium toruloides
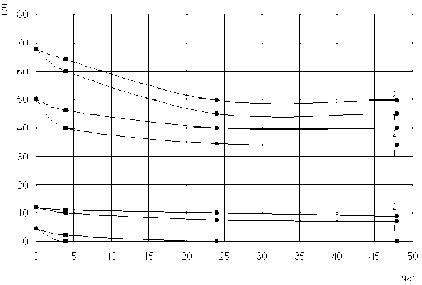
Рис. 6. Трансформация L-фенилаланина L-фенилаланин-аммоний-лиазой Rhodosporidium toruloides . 1 – свободный препарат (13 мг/мл белка), 2 – иммобилизованный препарат (12,5 мг/мл белка)
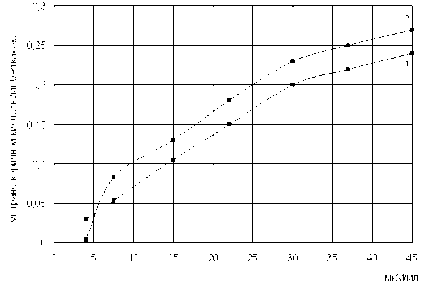
Рис. 5. Зависимость образования транс-коричной кислоты клетками от концентрации L-фенилаланина в реакционной смеси (инкубация 4 часа) 1 – свободный препарат, 2 –
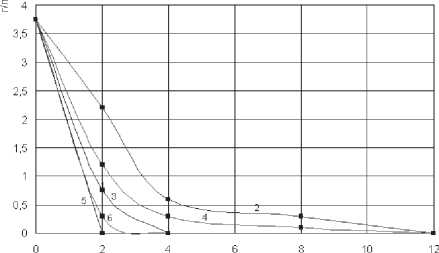
Рис. 7. Трансформация L-фенилаланина L-фенилаланин-аммоний-лиазой при разной температуре. -
свободный препарат, - иммобилизованный препарат. 1, 2 – 28°С; 3,4 – 37°С; 5,6 – 45°С
Количество трансформированного L-фенилаланина увеличивается при повышении температуры инкубации реакционных смесей (рис. 7).
Свободная и иммобилизованная L-фенилаланин-аммоний-лиаза при 30°С полностью трансформирует 2,5 г/л L-фенилаланина (15 мкМ/мл), а при 37°С и 45°С - 3,75 г/л (20 мкМ/мл). Скорость дезаминирования L-фенилаланина также возрастает при увеличении температуры инкубации. Например, при 37°С свободная L-фенилаланин-аммоний-лиаза трансформирует 3,75 г/л L-фенилаланина за 12 часов, а при 45°С - за 4 часа. Иммобилизованная L-фенилаланин-аммоний-лиаза в первые часы инкубации проводит трансформацию L-фенилаланина несколько медленнее, а затем так же интенсивно, как и свободная.
ВЫВОДЫ
В результате проделанной работы были подобраны условия, при которых свободная и иммобилизованная L-фенилаланин-аммоний-лиаза полностью трансформирует 15-20 мкМ/мл (2,5-3,75 г/л) L-фенилаланина.
Впервые получены препараты иммобилизованной на силохроме С-80 L-фенилаланин-аммоний-лиазы. Сопоставление данных по свободному и иммобилизованному ферменту свидетельствует о том, что иммобилизация L-фенилаланин-аммоний-лиазы на силохроме С-80 благоприятно сказывается на свойствах фермента. Иммобилизованная L-фенилаланин-аммоний-лиаза в течение длительного времени сохраняет более высокую активность, чем свободная. При термообработке препараты иммобилизованного фермента обнаруживают более высокую L-фенилаланин-аммоний-лиазную активность по сравнению со свободным. Однако полная инактивация как свободной, так и иммобилизованной L-фенилаланин-аммоний-лиазы наступает при одина- ковых условиях. Кроме того, показано повышение рН-стабильности фермента после иммобилизации.
Сравнение свойств свободной и иммобилизованной L-фенилаланин-аммоний-лиазы показало, что процесс иммобилизации не оказывает значительного влияния на действие фермента. Иммобилизованный фермент так же хорошо, как свободный, осуществляет неокислительное дезаминирование L-фенилаланина.
Работа выполнена в рамках Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы, госконтракт № 02.740.11.5133.
Список литературы Изучение свойств свободной и иммобилизованной L-фенилаланин-аммоний-лиазы из Rhodosporidium toruloides на силохроме С-80
- Андреева И.Н., Пантюхин А.В., Сысуев Б.Б. Иммобилизация ферментов и других биологически активных веществ. Учебное пособие.Пятигорск: Пятигорская государственная фармацевтическая академия, 2001. 340 с.
- Шкутина И.В., Стоянова О.Ф., Селеменев В.Ф. и др. Адсорбционная иммобилизация глюкоамилазы на амфотерных полиэлектролитах//Журнал физической химии. 2001. Т. 75, №11. С. 2080-2010.
- Berry C., Curtis A. Functionalisation of magnetic nanoparticles for applications in biomedicine//J. Phys. D. Appl. Phys. 2003. V. 3. P. 36.
- Bruce I.J. Sen T. Surface modification of magnetic nanoparticles with alkoxysilanes and their application in magnetic bioseparations//Langmuir. 2005. V. 21. P. 7029-7035.
- Johnson А., Zawadzka A., Deobald L., et al. Novel method for immobilization of enzymes to magnetic nanoparticles//Journal of nanoparticle research. 2008. № 10. Р. 1009-1025.
- Sarkissian C.N., Gamez A. Phenylalanine ammonia lyase, enzyme substitution therapy for phenylketonuria, where are we now?//Mol. Genet. Metab. 2005. № 86. Р.22-26.
- Sarkissian C.N., Shao Z., Blain F., et al. A different approach to treatment of phenylketonuria: Phenylalanine degradation with recombinant phenylalanine ammonia lyase//Proc. Natl. Acad. Sci. USA. 1999. № 96. Р.2339-2344.
- Вудворд Дж. Иммобилизованные клетки и ферменты. Методы. М.: Мир, 1988. 215 с.
- Havir E.A. Phenyllalanin ammonia lyase: purification and characterization from soybean suspension cultures//Arch. Biochem. Biophys. 1981. 211. P. 556-563.
- Zucker M. Induction of phenylalanine ammonia lyase in Xanthium leaf disks: photosynthetic requirement and effect of daylength//Plant. Physiol. 1969. 44. P. 912-922.


