Изучение термодинамики смешения полимеров методом обращенной газовой хроматографии
Автор: Могнонов Д.М., Буянтуев С.Л., Евстафьев С.Н., Дашицыренова М.С.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 2 (47), 2014 года.
Бесплатный доступ
Проведен литературный обзор развития представлений о термодинамических процессах образования полимер-полимерных смесей. Показана возможность количественного изучения свободной энергии Гиббса, энтальпии и энтропии при смешении полимеров методом обращенной газовой хроматографии.
Полимер-полимерные смеси, полибензимидазолы, полиаминоимидная смола, обращенная газовая хроматография, энергия гиббса, энтропия, энтальпия
Короткий адрес: https://sciup.org/142142859
IDR: 142142859 | УДК: 541.64:536.7
Текст научной статьи Изучение термодинамики смешения полимеров методом обращенной газовой хроматографии
С самого начала развития термодинамики процессов смешения полимеров исследователи пытались найти пределы взаимной растворимости компонентов и связать их с химической природой и молекулярной массой полимеров. Согласно законам термодинамики, образование термодинамически устойчивой системы должно сопровождаться уменьшением свободной энергии смешения Гиббса [1]:
AG HTAS, где H и AS изменения соответственно энтальпии и энтропии при смешении.
Необходимое, но недостаточное условие стабильности системы A G 0 выполняется в том случае, если H 0 , а T A S 0 или если H 0 , но T S | > H .
Если имеется возможность определить A G для всех возможных составов смеси, можно рассчитать значение температуры и состава, при которых смесь будет стабильной, т.е. однофазной. Однако экспериментальное определение A G для смесей полимеров связано с большими трудностями. Авторы первых работ по исследованию термодинамики полимерных смесей [2] предположили, что при смешении полимеров больших молекулярных масс ответственной за смешение является энтальпия, поскольку вклад энтропии смешения в A G чрезвычайно мал. В этом случае считали, что при H 0 полимеры совместимы, а при H 0 несовместимы. Как правило, для растворов полимеров в низкомолекулярных жидкостях условие H 0 отвечает совместимости компонентов. Однако для смесей полимеров Г.Л. Слонимский и Г.В. Струминский показали [3], что это наблюдалось не во всех случаях, следовательно, существенная роль должна принадлежать энтропийному вкладу в A G . Рас- четы, проведенные Флори и сотрудниками [4], подтвердили уменьшение энтропии смешения, т.е. AS < 0. Впервые вклад энтропии смешения во взаимную растворимость полимеров экспериментально оценили А.А. Тагер с сотрудниками [5]. Они нашли, что энтропия смешения двух полимеров не равна нулю, а может достигать больших значений и иметь разные знаки. Они также обнаружили, что для совместимых полимеров S 0 . На этом основании А.А. Тагер в качестве одного из критериев совместимости двух полимеров предложила условие AS < 0, что на самом деле не совсем корректно, так как условие AS <0 не способствует образованию термодинамически устойчивой системы.
В большинстве случаев для оценки термодинамической совместимости использовались (и используются) приближения теории регулярных растворов. В последние годы для описания термодинамических свойств полимеров начали успешно применять новые статистические теории растворов полимеров, развитые Д. Паттерсоном [6], П.Дж. Флори [7], И.К. Сан-шезом [8] и др.
В основу определения термодинамики смешения методом обращенной газовой хроматографии (ОГХ) положено уравнение Флори-Хаггинса для химического потенциала системы полимер-полимер-сорбат [4], которое в условиях бесконечного разбавления (^>[ > 0) и введения активности может быть записано в следующем виде:
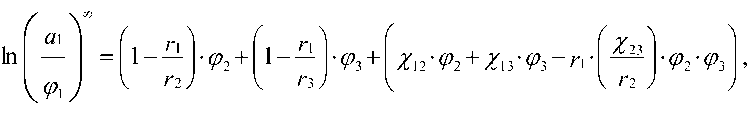
a 1
ln
(I)
где индексы 1, 2 и 3 относятся соответственно к сорбату и двум полимерам в смеси; r 1- количество сегментов в компонентах, которое в случае полимолекулярных полимеров выбирается как среднечисловая величина; ф1 - объемные доли; ^ - параметр термодинамического взаимодействия Флори-Хаггинса.
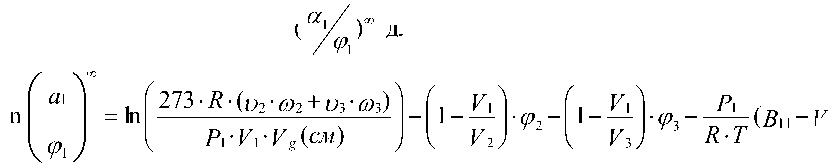
273 R ( 2 2 3 3)
P 1 V 1 V g ( см )
a 1
ln ln
(II)
и комбинируя с (I) и (II), Д. Паттерсон и сотрудники [7] получили зависимость параметра /123 от объема удерживания сорбата смесью полимеров. Значения /12 и /13 рассчитываются из данных ОГХ в раздельных экспериментах. Исходя из этого, параметр термодинамического взаимодействия Флори-Хаггинса между двумя полимерами можно вычислить как разницу между Z123 и ( ^2'Z12 + ^3'Z13 ).
Несмотря на преимущества метода ОГХ перед другими методами, использующимися для оценки термодинамической совместимости полимерных смесей, он имеет и свои недостатки. Так, во многих работах при использовании метода ОГХ для оценки параметров термодинамического взаимодействия между компонентами в смесях ( ) было обнаружено заметное влияние природы сорбата на величину Z23 [9, 10]. Авторы работы [10] обнаружили, что при использовании неполярных сорбатов значения Z23 между компонентами смеси поли- £ -капролактон - поли(4-гидрокси)стирол положительны, а при использовании полярных сорбатов - отрицательны. Отрицательные значения параметров термодинамического взаимодействия были приписаны наличию специфических взаимодействий между компонентами стационарной фазы, которые приводят к комплексообразованию, следствием которого является исключение из сферы взаимодействия с сорбатом части групп, с которыми он взаимодействует специфически. Так, при использовании в качестве сорбата метанола, образующего водородную связь с полярными группами смеси, было найдено, что на графиках зависимо- сти lgV от 1/ T для смесей разных составов наблюдается, по крайней мере, два четких температурных перехода, не связанных с фазовыми превращениями в системе. Тогда как при использовании неполярного сорбата (гептана) никаких температурных переходов не наблюдалось. Авторы объясняют это тем, что температурные переходы, обнаруживаемые с помощью метанола, обусловлены ослаблением водородных связей (причем разного типа) при нагревании смеси. Освобождающиеся при этом полярные группы взаимодействуют с метанолом, приводя к увеличению удерживаемого объема. Аналогичный эффект наблюдался и в работе [9] для смесей на основе полиамидов и полиэфиров. Эти данные свидетельствуют о том, что часть полярных групп, специфически взаимодействующих с сорбатом, действительно уходит из сферы взаимодействия, что, в принципе, может привести к отрицательным значениям параметров z . Как показано в работе [10], отрицательные значения z вообще характерны для термодинамически совместимых систем, особенно при наличии специфических взаимодействий. Необходимо отметить, что отрицательные значения параметров z получены в смесях и без растворителя.
Наличие различных функциональных групп в структуре полимеров создает различные возможности для возникновения межмолекулярных связей, таким образом, сорбаты разной природы будут селективно разрушать контакты разного типа, и это может стать причиной наблюдаемой зависимости параметра z от природы сорбата, используемого для его определения. Зависимость параметра z от природы сорбата, наблюдавшегося и авторами работы [11], объясняется предпочтительным взаимодействием сорбата с тем полимером, для которого z меньше. Этот эффект был назван « Az -эффектом».
Для того чтобы решить эту проблему и расширить область применения метода ОГХ, предлагалось множество приближений, но не одно из них до настоящего времени не признано удовлетворительным. В частности, Манк с сотрудниками предполагали, что при использовании различных сорбатов, причиной наблюдаемого непостоянства значений z23 являются некоторые экспериментальные артефакты и ошибки. Однако позже они показали, что зависимость термодинамического параметра взаимодействия Флори-Хаггинса от природы сорбата действительно существует. Другие исследователи пытались решить проблему « Az -эффекта», изменяя концентрацию в оригинальном уравнении Флори-Хаггинса и основываясь на том, что смешанная стационарная полимерная фаза не является гомогенной (т.е. поверхностная и объемная концентрации различны), что также не привело к желаемым результатам. И.К. Саншез при обработке данных ОГХ использовал уравнение состояния и обнаружил, что вклад избыточного объема в « Az -эффект» (одна из главных неточностей решеточной теории Флори-Хаггинса) не является существенным [12]. Исследователи [13] оперируют не только z , а уникальным в своем роде параметром В 23 плотностью взаимодействия, основанного на уравнении Гиллета для расчета Гильдебрандовского параметра растворимости. Авторы [14] сравнили значения z , полученные с помощью различных приближений метода ОГХ для смеси полистирол-полибутадиен, используя различные сорбаты, и обнаружили, что ни одно из приближений не дает удовлетворительных результатов. Следует отметить, что метод ОГХ дает корректные значения z как для систем с близкими значениями zиz , так и в случае если zиz существенно различны.
В случае использования для оценки термодинамической совместимости параметров z,AG или H необходимо отметить, что, как правило, их значения вычисляют при одной какой-либо температуре и определенном составе смеси. Если при данном составе z <0 или AG <0, то система термодинамически совместима, и наоборот. Но при данной температуре совместимость компонентов также является и функцией состава, поэтому система, совместимая при данном составе, может быть несовместимой при другом, и наоборот. Следовательно, для суждения о термодинамической совместимости двух полимеров желательно иметь полную концентрационную зависимость или G . Но тут возникает вопрос: а что же определяет на самом деле значение или G ? Согласно законам термодинамики условие G 0 характеризует процесс образования термодинамически устойчивой системы, критерием устойчивости которой является 22ДG/(д<р2)2 =0. Под совместимостью же, как правило, понимают молекулярное диспергирование полимера в среде другого полимера. Но поскольку условие G 0 критерий протекания любого самопроизвольного процесса, приводящего к образованию термодинамически устойчивой системы, он может характеризовать и процесс, например, самопроизвольного эмульгирования одного полимера в среде другого.
С целью проверки теоретических представлений методом ОГХ была изучена термодинамическая совместимость смесей полиаминоимидной смолы (ПАИС) и высокомолекулярного полибензимидазола (ПБИ) в диапазоне концентраций от 50 до 10 % масс. ПАИС [15]. По величине времени удерживания сорбата индивидуальными компонентами и их смесями были рассчитаны избыточные термодинамические функции смешения: энтальпия, энтропия и энергии Гиббса при 373 К. Было обнаружено, что G 0 для всех исследованных составов, что свидетельствует о термодинамической несовместимости компонентов смеси. Однако ΔН и ΔS имеют положительные значения для состава, содержащего 10% ПАИС, что свидетельствует о наименьшей термодинамической несовместимости и, как следствие, приведет к существенному повышению деформационно-прочностных показателей композита данного состава.


