Изучение токсического эффекта гомоцистеин тиолактона в условиях органотипического культивирования ткани кости
Автор: Пасатецкая Н.А., Лопатин А.И., Кипенко А.В., Лопатина Е.В.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Морфология
Статья в выпуске: 1 (53), 2017 года.
Бесплатный доступ
Повышение уровня гомоцистеина и гомоцистеин тиолактона в плазме крови связывают с увеличением риска развития заболеваний сердечно-сосудистой системы и развитием остеопороза. Рядом исследователей обнаружено уменьшение Na+, K+-АТФазной активности при гипергомоцистеинемии. В опытах in vivo показано, что гомоцистеин снижает активность Na+,K+-АТФазы, угнетая ее насосную функцию. Однако информация о физиологической роли Na+,K+-АТФазы в процессах ремоделирования ткани кости ограничена вследствие методических сложностей.
Гомоцистеин тиолактон, k+-атфаза, органотипическая культура ткани, эксплантаты костной ткани
Короткий адрес: https://sciup.org/142149262
IDR: 142149262 | УДК: 612.753
Текст статьи Изучение токсического эффекта гомоцистеин тиолактона в условиях органотипического культивирования ткани кости
Впервые связь между гипергомоцистеине-мией и заболеваниями костей была обнаружена в 1966 году, когда McKusick исследовал нарушение структуры коллагена у пациентов с гомоцистеинурией. Изучение возможной роли гомоцистеина в развитии сердечно-сосудистых заболеваний началось с работ McCully в 1969 г., которые показали предрасположенность к ате-ротромбозу пациентов с тяжелой гипергомоци-стеинемией [4].
В настоящее время повышение уровня гомоцистеина и гомоцистеин тиолактона в плазме крови связывают с увеличением риска развития атеросклероза, сердечной недостаточности [10], инфаркта миокарда, заболеваний сосудов [11] и развитием остеопороза [5].
Рядом исследователей обнаружено уменьшение Na+,K+-АТФазной активности при нейродегенерации, эпилепсии и гипергомоци-стеинемии [9, 6]. В опытах in vivo показано, что гомоцистеин уменьшает активность Na+, K+-АТФазы, угнетая ее насосную функцию [6]. Точный механизм, лежащий в основе ингибирующего действия Na+/K+-АТФазы гомоцистеином, остается неизвестным. Исследования кинетики Na+/K+-АТФазы, проведенные Streck, et al. по- казали, что гомоцистеин ингибирует натриевую помпу, не конкурируя с АТФ [9]. Предполагают, что ингибирование помпы происходит вследствие окисления тиоловых групп, опосредованного свободными радикалами, которые взаимодействуют с сайтом связывания АТФ [8].
За последние 20 лет хорошо изучена структура и локализация Na+,K+-АТФазы в клетках центральной и периферической нервной системы, сердечной и скелетной мускулатуры и некоторых клетках, формирующих эпителий. Однако информация о физиологической роли Na+,K+-АТФазы в процессах ремоделирования ткани кости ограничена вследствие методических сложностей.
ЦЕЛЬ РАБОТЫ
Проанализировать остеотоксические эффекты гомоцистеин тиолактона в условиях органотипического культивирования.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование проводили на эксплантатах ткани кости 10–12-дневных куриных эмбрионов, культивируемых в чашках Петри на подложках из коллагена в питательной среде в СО 2 -инкубаторе («Sanyo», Япония) в течение трех суток при 37 °С и 5 % СО 2 . Фрагменты бедренной кости, очищенные от надкостницы, аккуратно переносили на коллагеновую подложку чашек Петри. Каждая чашка содержала от 15 до 20 эксплантатов.
Контрольные эксплантаты культивировали в питательной среде, содержащей 45 % раствора Хенкса, 40 % среды Игла, с добавлением инсулина (0,5 ед./мл), глюкозы (0,6 %), глютамина (2 мМ), гентамицина, 5 % куриного эмбрионального экстракта и 10 % фетальной сыворотки коровы [1, 3]. Через трое суток культивирования вокруг исходной зоны наблюдали формирование зоны роста (рис. 1).
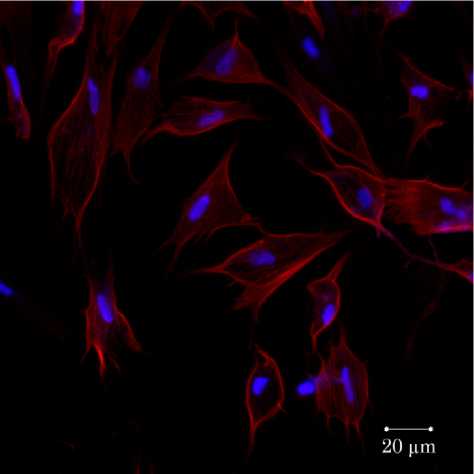
Рис. 1. Фрагмент зоны роста эксплантата ткани кости 10–12-дневного куриного эмбриона.
Третьи сутки культивирования (ув. 40). Контроль. Окраска фаллоидином, конъюгированным с Texas Red (красный цвет) и DAPI (синий цвет)
В культуральную среду экспериментальных чашек добавляли гомоцистеин тиолактон («Sigma») в диапазоне концентраций от 10-3 до 10-11 М и оуабаин октагидрат («Sigma») в широком диапазоне концентраций (от 10-4 до 10-12 М). В части исследований для оценки механизма действия гомоцистеин тиолактона в питательную среду экспериментальных чашек Петри добавляли гомоцистеин тиолактон и оуабаин октагидрат в определенных концентрациях.
Для визуализации объектов использовали микроскоп «Axiostar Plus» («Carl Zeiss», Германия) по методу, описанному ранее [2]. Полученные изображения анализировали при помощи программы ImageJ. Часть исследований прово- дили с помощью лазерного сканирующего микроскопа «LSM 710» («Carl Zeiss», Германия) с использованием прижизненного окрашивания препаратов фаллоидином, конъюгированным с флуоресцентным красителем Texas Red (Texas Red®-X phalloidin, Life Technologies, USA) (рис. 1).
Часть исследований выполнена на оборудовании ЦКП «Конфокальная микроскопия» Института физиологии им. И. П. Павлова РАН.
Для количественной оценки степени роста эксплантатов применяли морфометрический метод. Индекс площади (ИП) рассчитывали, как отношение общей площади эксплантата к площади исходной зоны. Контрольное значение ИП принимали за 100 %. Статистическую обработку результатов проводили с помощью программы STATISTICA 8.0 с использованием t-критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Гомоцистеин тиолактон исследовали в диапазоне концентраций от 10-3 до 10-11 М (рис. 2). Обнаружено, что действие препарата в указанном диапазоне концентраций является дозозависимым. В концентрации 10-3 М гомоцистеин тиолактон достоверно ингибировал рост эксплантатов ткани кости на 58 %. При введении в питательную среду препарата в концентрации 8 х 10-6 М гомоцистеин тиолактон оказывал ингибирующее действие на рост эксплантатов ткани кости. ИП экспериментальных эксплантатов был ниже контрольного значения на 39 %. В диапазоне концентраций от концентрации 7 х 10-9 до 10-11 М гомоцистеин тиолактон не оказывал выраженного ингибирующего эффекта. ИП экспериментальных эксплантатов не отличался от контрольного значения.
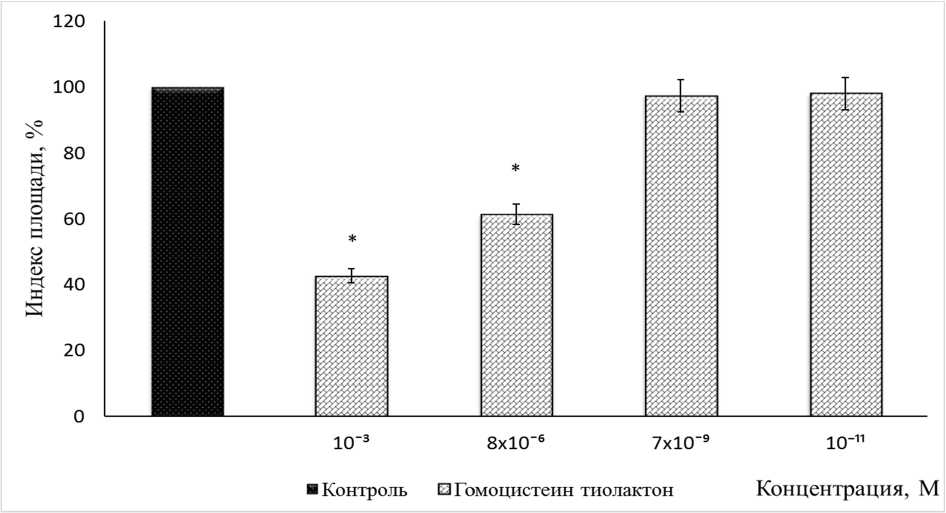
Рис. 2. Оценка действия гомоцистеин тиолактона на рост эксплантататов ткани кости 10–12-дневного куриного эмбриона. Гомоцистеин тиолактон в диапазоне концентраций 10-3 до 10-11 М
* – Достоверные различия относительно контроля, p ˂ 0,05.
Ранее в аналогичных экспериментальных условиях исследовали влияние гомоцистеин тиолактона на рост эксплантатов ткани сердца 10–12-дневных куриных эмбрионов [7]. Максимальный ингибирующий эффект гомоцистеин тиолактон проявил в концентрации 10-3 М. ИП экспериментальных эксплантатов был ниже контрольного значения на 60 %. Стимулирующее действие гомоцистеин тиолактона на рост эксплантатов ткани сердца не обнаружено [7].
Сравнительный анализ данных показал, что действие гомоцистеин тиолактона в отношении роста экспериментальных эксплантатов не является тканеспецифичным.
Для оценки участия Na+, K+-АТФазы в ремоделировании ткани кости оуабаин октагидрат исследовали в диапазоне концентраций от 10-4 до 10-12 М (рис. 3). Действие оуабаина было дозозависимым. Оуабаин практически полностью угнетал рост эксплантатов ткани кости в концентрации 10-4 М. В концентрациях 10-6 М и 10-8 М препарат ингибировал рост экспериментальных эксплантатов на 80 и 44 % соответственно. Максимальный трофотропный эффект оуабаин проявлял в концентрации 10-10 М. ИП экспериментальных эксплантатов был выше контрольного значения на 100 %. При добавлении в питательную среду оуабаина в концентрации 10-12 М ИП экспериментальных эксплантатов был выше контрольного значения на 47 %.
Исследование влияния оуабаина на рост эксплантатов ткани сердца проведено ранее. Оуабаин исследовали в концентрациях сопоставимых с эндогенными [1]. Установлено, что в дозе 10-8 М оуабаин полностью блокировал процессы клеточного роста и пролиферации. Максимальный трофотропный эффект оуабаин так же, как и оуабаин октагидрат, использованный в данном исследовании, проявлял в концентрации 10-10 М. ИП экспериментальных эксплантатов ткани сердца был выше контрольного значения на 33 % [1].
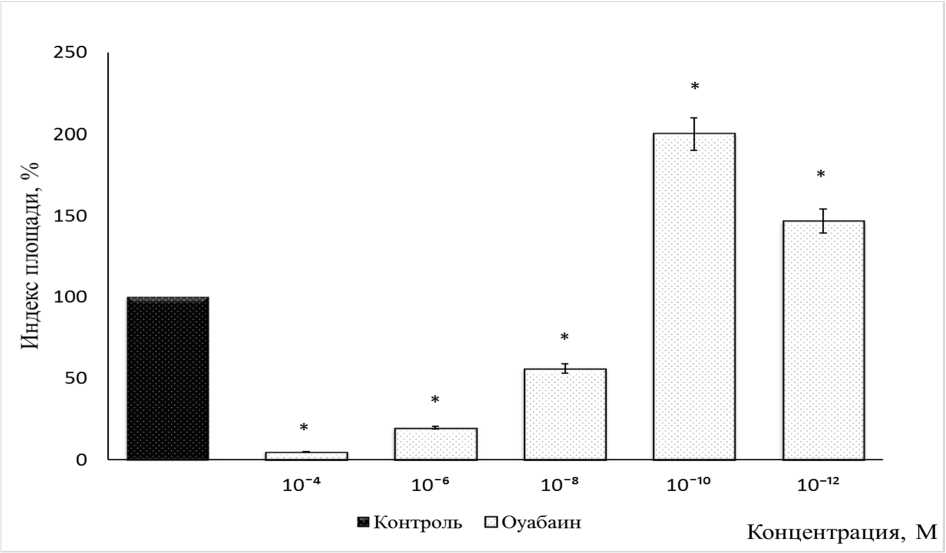
Рис. 3. Оуабаин октагидрат дозозависимо регулирует рост эксплантатов ткани кости 10–12-дневных куриных эмбрионов в диапазоне концентраций от 10-4 до 10-12 М
* – Достоверные различия относительно контроля, p ˂ 0,05.
Для оценки возможного механизма токсического действия гомоцистеин тиолактона эксплантаты ткани кости культивировали в питательной среде, содержащей гомоцистеин тиолактон (10-3 М) и оуабаин октагидрат (10-4 М) (рис. 4). ИП экспериментальных эксплантатов составил 5 % от контрольного значения. При добавлении в питательную среду, содержащую го- моцистеин тиолактон (10-3 М), оуабаина (10-10 М) ИП экспериментальных эксплантатов, зарегистрированный через 3-е суток культивирования, был ниже контрольного значения на 35 % (рис. 5). Таким образом, введение в питательную среду оуабаина несколько снижало ингибирующий рост эксплантатов ткани кости эффект гомоцистеин тиолактона (10-3 М).
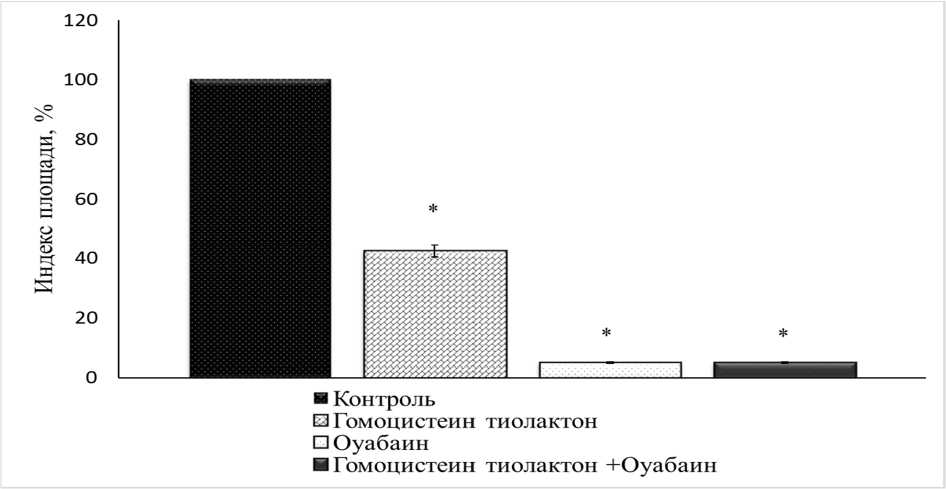
Рис. 4. Остеотоксический эффект гомоцистеин тиолактона (10-3 М) в присутствии ингибитора Na+, K+-АТФазы оуабаина (10-4 М)
* – Достоверные различия относительно контроля, p ˂ 0,05.
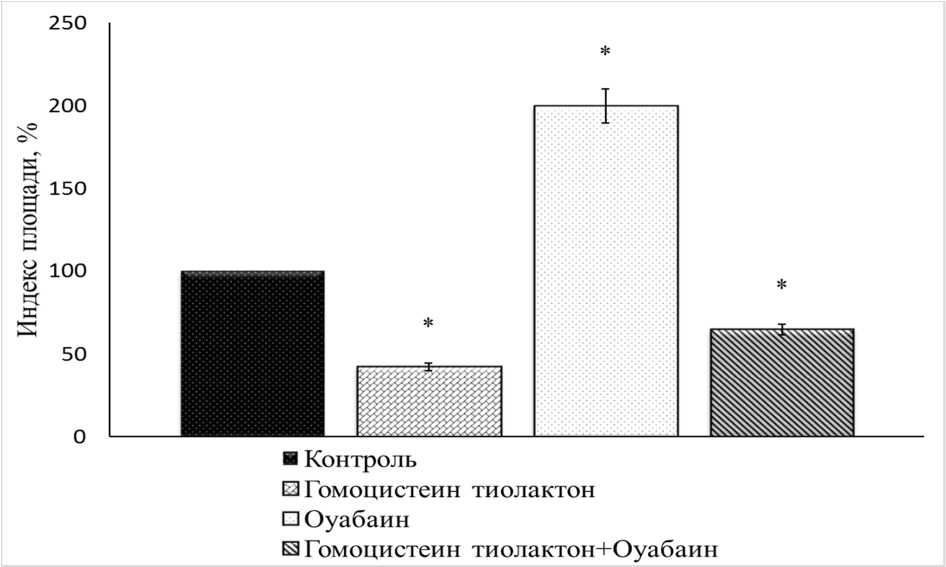
Рис. 5. Остеотоксический эффект гомоцистеин тиолактона (10-3 М) на фоне оуабаина (10-10 М), в концентрации сопоставимой с эндогенной.
* – Достоверные различия относительно контроля, p ˂ 0,05.
В аналогичных экспериментальных условиях исследовали совместное влияние гомоцистеин тиолактона (10-3 М) и оуабаина в концентрациях 10-8 и 10-10 М на рост эксплантататов ткани сердца [7]. При культивировании эксплантатов ткани сердца в питательной среде, содержащей гомоцистеин тиолактон (10-3 М) и оу-абаин (10-8 М), ИП экспериментальных эксплантатов составил 5 % от контрольного значения. Именно в этой концентрации оуабаин полностью блокирует обе функции Na+, K+-АТФазы: сигнальную и функцию ионного насоса. При добавлении в питательную среду, содержащую гомоцистеин тиолактон (10-3 М), оуабаина (10-10 М) ИП экспериментальных эксплантатов был ниже контрольного значения на 43 % [7].
ЗАКЛЮЧЕНИЕ
Таким образом, полученные данные свидетельствуют о наличии связи токсического действия гомоцистеин тиолактона на рост эксплантатов ткани кости и сердца с ингибированием насосной функции Na+, K+-АТФазы, вопрос о вовлеченности сигнальной функции фермента требует дальнейшего изучения.
Работа поддержана грантом РФФИ № 16-34-00831.
Список литературы Изучение токсического эффекта гомоцистеин тиолактона в условиях органотипического культивирования ткани кости
- Лопатина Е. В., Пеннияйнен В. А, Зайка А. А. Исследование участия Na+, K+-АТФазы в регуляции роста эксплантатов ткани сердца в органотипической культуре//Бюллетень эксперим. биологии и медицины. -2005. -Т. 140, № 8. -С. 150-153.
- Лопатина Е. В., Кипенко А. В., Пеннияйнен В. А. и др. Использование метода реконструкции оптических срезов для оценки трофотропных эффектов адреналина и атенолола//Росс. физиол. журнал им. И. М. Сеченова. -2015. -Т. 101. -С. 1022-1031.
- Пасатецкая Н. А., Кипенко А. В., Лопатин А. И. и др. Сравнительный анализ влияния фосфомицина и ванкомицина на рост ткани кости в условиях органотипического культивирования//Волгоградский научно-медицинский журнал. -2016. -№ 4. -С. 43-47.
- Родионов Р. Н., Лентц С. Р. Современные представления о гипергомоцистеинемии как факторе риска сердечно-сосудистых заболеваний//Артериальная гипертензия. -2008. -Т. 14, № 1. -С. 110-115.
- Herrmann M., Tami A., Wildemann B., et al. Hyperhomocysteinemia induces a tissue specific accumulation of homocysteine in Bone by collagen binding and adversely affects Bone//Bone. -2009. -Vol. 44. -P. 467-475.
- Hrnčič D., Rašič-Markovič A., Krstič D., et al. The role of nitric oxide in homocysteine thiolactoneinduced seizures in adult rats//Cellular and molecular neurobiology. -2010. -Vol. 30, №. 2. -P. 219-231.
- Lopatina E. V., Kipenko A. V., Penniyaynen V. A., et al. Organotypic tissue culture investigation of homocysteine thiolactone сardiotoxic effect//Acta Physiologica Hungarica. -2015. -Vol. 102, №2. -P. 137-142.
- Rašič-Markovič A., Stanojlovič O., Hrncic D. The activity of erythrocyte and brain Na+/K+ and Mg2+-ATPases in rats subjected to acute homocysteine and homocysteine thiolactone administration//Molecular and cellular biochemistry. -2009. -Vol. 327, №. 1-2. -P. 39-45.
- Streck E. L., Zugno A. I., Tagliari B., et al. Inhibition of Na+, K+-ATPase activity by the metabolites accumulating in homocystinuria//Metabolic brain disease. -2002. -Vol. 17, № 2. -P. 83-91.
- Sundström J., Vasan R. S. Homocysteine and heart failure: a review of investigations from the Framingham Heart Study//Clinical Chemical Laboratory Medicine. -2005. -Vol. 43, №. 10. -P. 987-992.
- Wang X., Cuib L., Josepha J., et al. Homocysteine induces cardiomyocyte dysfunction and apoptosis through p38 MAPK-mediated increase in oxidant stress//Journal of molecular and cellular cardiology. -2012. -Vol. 52, № 3. -P. 753-760.


