Изучение влияния нового сульфопроизводного пиримидин-4(1 Н)-она на нейродеградацию в условиях хронической травматической энцефалопатии
Автор: Мирошниченко Кирилл Александрович, Черников Максим Валентинович, Потапова Анна Александровна
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 2 (74), 2022 года.
Бесплатный доступ
Данная экспериментальная работа была произведена с целью определения влияния введения нового производного пиримидина на нейродеградацию в условиях хронической травматической энцефалопатии на 100 крысах-самцах линии Wistar. Для воспроизведения патологии была использована установка, имитирующая действие взрывной волны, воздействие на животных проводилось однократно. В качестве референтных препаратов выступали холина альфосцерат и гопантеновая кислота. Препараты сравнения и исследуемое соединение вводили однократно спустя 30 мин после моделирования патологии. Определение маркеров нейродеградации: глиально-фибриллярный кислотный белок (GFAP) и бета-амилоид (Ар) осуществляли через 1 и 14 суток после моделирования патологии с помощью твердофазного иммуноферментного анализа. Полученные результаты свидетельствуют о наличии церебропротекторной активности нового производного пиримидина.
Хроническая травматическая энцефалопатия, производные пиримидина
Короткий адрес: https://sciup.org/142235240
IDR: 142235240 | УДК: 616-001.34
Текст научной статьи Изучение влияния нового сульфопроизводного пиримидин-4(1 Н)-она на нейродеградацию в условиях хронической травматической энцефалопатии
Finding: the research was carried out with the financial support of the RFBR in the framework of scientific project No. 20-315-90062.
Хроническая травматическая энцефалопатия (ХТЭ) является прогрессирующей нейродеге-неративной патологией, основной причиной формирования которой являются сотрясения головного мозга (СГМ) [1]. Клинические проявления ХТЭ непосредственно связаны с деградацией клеток коры больших полушарий головного мозга, выражаются комплексом когнитивных, сенсомоторных, неврологических дисфункций [2].
Учитывая современный технический прогресс и политическую ситуацию в мире, наблюдается увеличение числа черепно-мозговых травм, вызванных воздействием взрывов при военных конфликтах, на производствах, в быту, дорожнотранспортных происшествиях, что создает угрозу жизни и здоровью для всего населения без привязки к какой-либо конкретной сфере деятельности [3]. В настоящее время единственным способом постановки диагноза ХТЭ является посмертный анализ мозга больного с целью выявления маркеров нейродеградации, одними из которых являются глиально-фибриллярный кислотный белок (GFAP) и бета-амилоид (Аβ) [4]. На сегодняшний день не существует ЛС для достаточно эффективной терапии ХТЭ, что делает актуальным поиск средств, обладающих цереб-ропротекторной активностью, в частности среди соединений, в структуре которых содержится ядро пиримидина, в связи с наличием у данного класса веществ широкого спектра фармакологической активности [5, 6].
ЦЕЛЬ РАБОТЫ
Определить степень влияния введения нового производного пиримидина на процессы нейродеструкции в условиях экспериментальной ХТЭ.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование произведено на 100 крысах-самцах (линия Wistar, масса животного 230–260 г). Манипуляции, проводимые с животными, строго соответствовали стандарту ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики». Воспроизводили ХТЭ с помощью методики «Blast wave» . Для достижения эффекта СГМ схожего с человеческим предварительно наркотизированных крыс (хлоралгидрат, 350 мг/кг) фиксировали в установке, имитирующей действие взрывной волны. Воздействие на животных проводилось однократно [7]. Исследуемым соединением выступало новое сульфопроизводное пиримидин-4(1Н)-она – 4-(2-метил-6-этил-
4-оксо-5-фенил-4H-пиримидин-1-ил)-бензсульфа-мид (брутто формула – С 19 H 19 N 3 O 3 S) под лабораторным шифром Com1. Препаратами сравнения выступали холина альфосцерат («Церепро», Верофарм, РФ) и гопантеновая кислота («Пантогам», «ПИК-ФАРМА ПРО», РФ). Референтные препараты и исследуемое соединение вводили перорально в дозе 100 мг/кг однократно спустя 30 мин после моделирования патологии [8, 9].
Содержание изучаемых показателей Аβ и GFAP устанавливали по прошествии 1 и 14 суток после воспроизведения патологии с помощью твердофазного иммуноферментного анализа с использованием реактивов компании Cloud Clone Corp . (США). Содержание Аβ устанавливали в надосадочной жидкости гомогената головного мозга, GFAP определяли в сыворотке крови.
Полученные данные подвергались статистической обработке при использовании STATISTICA 6.0 (StatSoft, Inc.), в ходе анализа данных был применен критерий сравнения Ньюмена-Кейсла.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯИ ИХ ОБСУЖДЕНИЕ
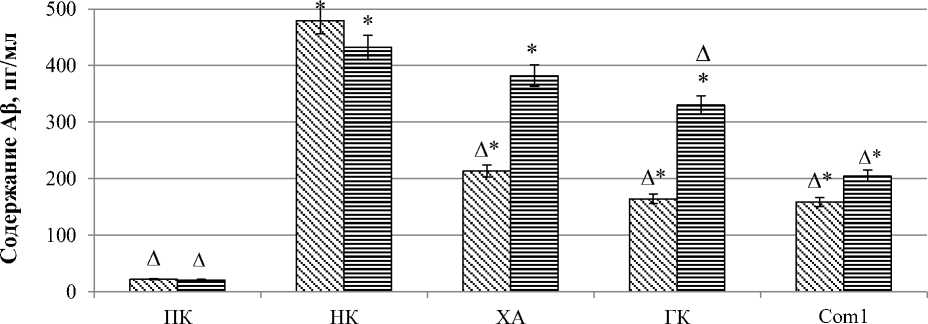
В ходе оценки концентрации Аβ спустя 24 часа после моделирования патологии установлено ее значение у крыс группы ПК на уровне (22,100 ± 0,362) пг/мл (рис. 1).
В то же время у группы животных НК содержание изучаемого показателя возросло в 22 раза (р < 0,05) по сравнению с данными группы ПК. На фоне введения в качестве фармакологической поддержки холина альфосцерата и гопантеновой кислоты отмечалось снижение уровня Аβ в 2,2 (р < 0,05) и 2,9 (р < 0,05) раза соответственно относительно крыс группы НК. Применение Com1 позволило сократить концентрацию Аβ в 3 раза (р < 0,05) по сравнению со значением группы животных НК.
При изучении содержания Аβ по прошествии 14 суток после воспроизведения патологии установлено, что у животных группы ПК его значение составило (20,600 ± 1,211) пг/мл. При этом уровень Аβ у крыс группы НК повысился по сравнению с животными группы ПК в 21 раз (р < 0,05). Применение холина альфосцерата и гопантеновой кислоты позволило сократить значение исследуемого показателя по отношению к крысам группы НК в 1,1 и 1,3 раза (р < 0,05) соответственно. Введение Com1 позволило сократить концентрацию Аβ по отношению к животным группы НК в 2,1 раза (р < 0,05).
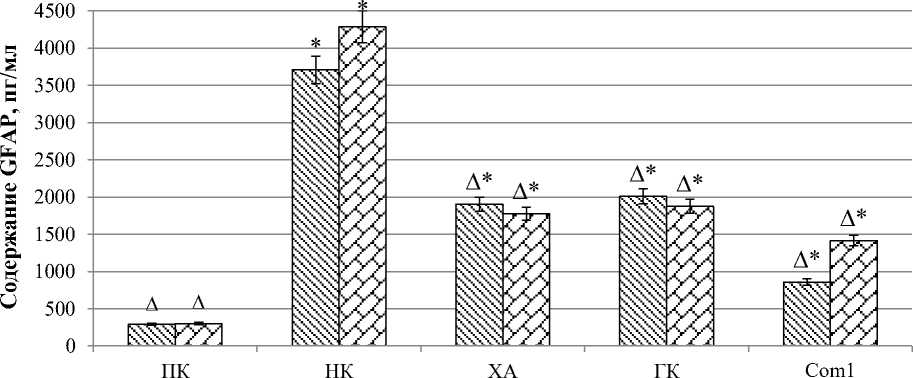
Содержание GFAP по прошествии 24 часов после моделирования патологии у животных группы ПК было на уровне (290,300 ± 8,254) пг/мл (рис. 2).
Исследуемые группы крыс
□ Спустя 1 сутки в Спустя 14 суток
Рис. 1. Динамика содержания Аβ у крыс в условиях ХТЭ и ее коррекции:
статистически значимо (критерий Ньюмена – Кейлса) относительно ПК группы животных (* – р < 0,05), относительно крыс НК группы (∆ – p < 0,05). ПК – группа крыс положительного контроля; НК – группа крыс негативного контроля; ХА – группа крыс, получавшая холина альфосцерат; ГК – группа крыс, получавшая гопантеновую кислоту; Com1 – группа крыс, получавшая исследуемое соединение Com1
Исследуемые группы крыс
-
□ Спустя 1 сутки □ Спустя 14 суток
Рис. 2. Содержание GFAP у крыс в условиях ХТЭ и ее коррекции: статистически значимо (критерий Ньюмена – Кейлса) относительно ПК группы животных (* – р < 0,05), относительно крыс НК группы (∆ – p < 0,05). ПК – группа крыс положительного контроля; НК – группа крыс негативного контроля; ХА – группа крыс, получавшая холина альфосцерат; ГК – группа крыс, получавшая гопантеновую кислоту; Com1 – группа крыс, получавшая исследуемое соединение Com1
Концентрация изучаемого показателя у крыс группы НК увеличилась в 12,8 раза (р < 0,05) относительно значения группы крыс ПК. Введение холина альфосцерата и гопантеновой кислоты позволило сократить уровень GFAP относи- тельно группы НК в 1,9 (р < 0,05) и 1,8 (р < 0,05) раза соответственно.
Применение Com1 способствовало снижению концентрации GFAP в 4,3 раза (р < 0,05) по отношению к животным группы НК.
По прошествии 14 суток после моделирования ХТЭ установлена концентрация GFAP на уровне (301,100 ± 6,362) пг/мл у группы животных ПК. У группы крыс НК содержание GFAP увеличилось по сравнению с животными группы ПК в 14,3 раза (р < 0,05). Введение крысам холина альфосцерата и гопантеновой кислоты способствовало снижению уровня GFAP относительно животных группы НК в 2,4 (р < 0,05) и 2,3 (р < 0,05) раза соответственно. При введение Com1 отмечалось снижение концентрации GFAP в 3 раза (р < 0,05) по сравнению со значением крыс группы НК.
Установленное церебропротекторное действие нового сульфопроизводного пиримидин-4(1Н)-она Com1, вероятно, связано со способностью данного класса соединений восстанавливать функции эндотелия сосудов головного мозга и митохондриальные функции клеток головного мозга, что, в свою очередь, поддерживает физиологически необходимый уровень метаболизма, тем самым снижая уровень нейродеградации [10, 11].
ЗАКЛЮЧЕНИЕ
Проанализировав результаты исследования, можно сказать, что новое сульфопроизводное пиримидин-4(1Н)-она Com1 обладает церебропротекторной активностью, которая, в свою очередь, выражается достоверно значимым снижением процессов нейродеградации относительно животных, лишенных фармакологической поддержки в условиях экспериментальной ХТЭ.
(In Russ.). https://doi : 10.30906/0869-2092-2019
82-11-11-14.
Список литературы Изучение влияния нового сульфопроизводного пиримидин-4(1 Н)-она на нейродеградацию в условиях хронической травматической энцефалопатии
- Quantitative Proteomic Analysis Reveals Impaired Axonal Guidance Signaling in Human Postmortem Brain Tissues of Chronic Traumatic Encephalopathy / B. Bi, H. P. Choi, S. J. Hyeon [et al.] // Experimental neurobiology. 2019. Vol. 28, no. 3. P. 362–375. https://doi: 10.5607/en.2019.28.3.362.
- Mild chronic traumatic encephalopathy neuropathol-ogy in people with no known participation in contact sports or history of repetitive neurotrauma / G. L. Iverson, T. M. Luoto, P. J. Karhunen [et al.] // J Neuropathol Exp Neurol. 2019. Vol. 78, no. 7. P. 615–625. https://doi. 10.1093/jnen/nlz045.
- Жарова Е. Н. Оптимизация сочетанного лечения физическими факторами пациентов с черепно-мозговой травмой в ранний период : автореф. дис. … докт. мед. наук. СПб. 2019. 28 с.
- The spectrum of disease in chronic traumatic encepha-lopathy / A. C. McKee, R. A. Stern, C. J. Nowinski [et al.] // Brain. 2013. Vol. 136(Pt 1). P. 43–64. https://doi. 10.1093/brain/aws307.
- Гимадиева А. Р., Чернышенко Ю. Н., Мустафин А. Г., Абдрахманов И. Б. Синтез и биологическая активность производных пиримидина // Башкирский химический журнал. 2007. № 14(3). С. 5–21.
- Shabanova N. B., Gerashchenko A. D., Voronkov A. V. The effect of PIR-20 compound on cognitive deficit re-duction in experimental global cerebral ischemia in rats // Archiv Euro Medica. 2021. Vol. 11, no 3. P. 26–28.
- Chronic traumatic encephalopathy in blast-exposed military veterans and a blast neurotrauma mouse model / L. E. Goldstein, A. M. Fisher, C. A. Tagge [et al.] // Sci Transl Med. 2012. No. 16. P. 134. https://doi. 10.1126/scitranslmed.3003716.
- Слободенюк Т. Ф. Нейропротекторные свойства ноотропов при черепно-мозговой травме в условиях нормобарической гипоксической тренировки // Забайкальский медицинский вестник. 2017. № 1. С. 128–136.
- Сысоев Ю. И., Оковитый С. В., Узуегбунам Б. Влияние нового производного диэтиламиноэтанола на выраженность неврологического дефицита у крыс после черепно-мозговой травмы // Биомедицина. 2018. № 2. С. 95–105.
- Воронков А. В., Поздняков Д. И., Мирошниченко К. А., Потапова А. А. Влияние новых производных пиримидина на вазодилатирующую функцию эндотелия сосудов головного мозга в условиях хронической травматической энцефалопатии // Экспериментальная и клиническая фармакология. 2019. № 82(11). С. 4–11. https://doi 10.30906/0869-2092-2019-82-11-11-14.
- Pyrimidine-4H-1OH derivatives restore mitochondri-al function in experimental chronic traumatic en-cephalopathy / D. I. Pozdnyakov, A. V. Voronkov, K. A. Miroshnichenko [et al.] // PharmacologyOnline. 2019. No. 3. P. 36–45.


