Изучение влияния соматических мутаций генов KRAS, NRAS, BRAF и статуса микросателлитной нестабильности на выживаемость больных колоректальным раком с перитонеальным карциноматозом
Автор: Шубин Виталий Павлович, Шелыгин Юрий Анатольевич, Ачкасов Сергей Иванович, Сушков Олег Иванович, Пономаренко Алексей Алексеевич, Арзамасцева Анна Игоревна, Цуканов Алексей Сергеевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.19, 2020 года.
Бесплатный доступ
Цель исследования - оценить влияние соматических мутаций генов KRAS, NRAS, BRAF и статуса микросателлитной нестабильности на общую и безрецидивную выживаемость больных, перенесших циторедуктивные операции с гипертермической внутрибрюшинной химиотерапией. Материал и методы. В исследование включены 45 пациентов, которые в 2012-18 гг были оперированы по поводу синхронного перитонеального карциноматоза на фоне колоректального рака. У всех пациентов определялись мутации генов KRAS, NRAS, BRAF и микросателлитный статус опухоли и метастазов на брюшине с помощью секвенирования по методу Сэнгера, фрагментного анализа и цифровой капельной полимеразно-цепной реакции. Оценивалось влияние мутаций на выживаемость пациентов. Результаты. Общая частота соматических мутаций в первичной опухоли и метастазах брюшины составила 69 %, дискордантность между опухолью и метастазами на брюшине по мутациям - 9 %. Все опухоли и метастазы на брюшине оказались микросателлитно-стабильными. Наличие мутации в исследованных генах не влияло на общую и безрецидивную выживаемость (p=0,87 и p=0,85 соответственно). Заключение. Соматические мутации в генах KRAS, NRAS или BRAF не являются фактором прогноза, влияющим на общую и безрецидивную выживаемость больных колоректальным раком с перитонеальным карциноматозом. Молекулярный статус первичной опухоли может отличаться от статуса метастаза на париетальной и висцеральной брюшине, что необходимо учитывать при назначении таргетных препаратов.
Колоректальный рак, перитонеальный карциноматоз, гены kras, микросателлитная нестабильность, выживаемость
Короткий адрес: https://sciup.org/140254384
IDR: 140254384 | УДК: 616.35-006.6:575.113 | DOI: 10.21294/1814-4861-2020-19-5-61-67
Текст научной статьи Изучение влияния соматических мутаций генов KRAS, NRAS, BRAF и статуса микросателлитной нестабильности на выживаемость больных колоректальным раком с перитонеальным карциноматозом
Перитонеальный карциноматоз является одной из форм метастазирования колоректального рака (КРР) и связан с имплантацией свободных опухолевых клеток по поверхности брюшины [1, 2] Cинхронный перитонеальный карциноматоз (ПК) обнаруживают интраоперационно у 8 % больных раком толстой кишки (РТК), метахронный ПК развивается у 19 % пациентов после радикальных резекций толстой кишки в течение последующего наблюдения [3]. До недавнего времени единственным методом лечения перитонеального карциноматоза на фоне КРР была паллиативная химиотерапия. Показатель выживаемости при этом не превышал 12 мес [4].
В настоящее время благодаря циторедуктивным операциям с гипертермической внутрибрюшинной химиотерапией (ГВБХТ) удалось улучшить прогноз в отношении общей выживаемости. Так, медиана общей выживаемости превышает показатели, достигаемые только при помощи системной химиотерапии, в 1,5–2 раза [5]. Однако у 66 % больных РТК с ПК, несмотря на применение ГВБХТ после циторедукции, возникают рецидивы карциноматоза [6]. Применение повторных циторедуктивных операций с ГВБХТ может быть оправдано у ряда больных [2]. Не исключено, что рецидивы карциноматоза возникают у пациентов с определенными молекулярно-генетическими особенностями опухоли.
Целью исследования явилось изучение первичной опухоли и карциноматозных узлов на наличие мутации генов семейства RAS ( KRAS и NRAS ) и BRAF . Кроме того, была оценена общая и безрецидивная выживаемость в зависимости от мутационного статуса.
Материал и методы
В исследование было включено 90 образцов, содержащих фрагменты (биоптаты) 45 первичных опухолей и 45 карциноматозных узлов брюшины, полученных от 45 больных, оперированных с 2012 по 2018 г. по поводу ПК на фоне КРР (табл. 1). Наличие факта проведения неоадъювантной химио- и/ или лучевой терапии служило критерием исключения пациентов из исследования. Все исследуемые образцы были морфологически верифицированы. Исследование было одобрено локальным независимым этическим комитетом учреждения.
Выделение ДНК из исследуемых образцов
Полученный операционный материал ткани опухолей и синхронных метастазов размером 1 мм3 немедленно помещали в 200 мкл лизирующего раствора (buffer ATL, Qiagen) и замораживали при -70 °С до следующего анализа. ДНК выделяли с помощью набора QIAamp DNA Mini Kit (Qiagen), согласно протоколу производителя.
ПЦР и секвенирование по методу Сэнгера
Для определения мутационного статуса фрагменты генов KRAS (RefSeq_NM_004985) (24 экзоны), NRAS (RefSeq_NM_002524) (24 экзоны), BRAF (RefSeq_NM_004333) (15 экзон) амплифицировали с помощью полимеразной цепной реакции (ПЦР) на программируемом термоциклере Veriti, используя оригинальные олигонуклеотидные праймеры-затравки. Состав реакционной смеси: 0,1–1,0 µ g геномной ДНК; по 0.25 µ М каждого оригинального олигопраймера; по 200 µ М каждого нуклеозидтрифосфата; 1 ед HotTaq-полимеразы; буфер для ПЦР (500 мМ трис, 500 мМ KCl, pH 8,74), 2,5 мкл MgCl2 (25 мМ)); деионизованная вода. Мутации в генах определяли на автоматическом секвенаторе ABI PRISM 3500 (8 capillaries; Applied Biosystems). Для интерпретации результатов по мутациям использовали программное обеспечение фирмы Applied Biosystems.
Анализ статуса микросателлитной нестабильности
Определение статуса микросателлитной нестабильности проводили с помощью фрагментного анализа на приборе «ABI PRISM 3500» (8 capillaries; Applied Biosystems) по пяти мононуклео-
Таблица 1/table 1
Характеристика больных КРР с ПК characteristics of patients with peritoneal carcinomatosis from colorectal cancer
|
Признак/Characteristics |
Значение/Values |
|
|
Возраст, лет/Age (years) |
66 (60; 72) (40–86) |
|
|
Пол/Sex |
Муж/Male Жен/Female |
22 (49 %) 23 (51 %) |
|
Локализация первичной опухоли/ Localization of the primary tumor |
Правые отделы ободочной кишки/ Right colon Левые отделы ободочной кишки*/ Left colon* |
17 (38 %) 28 (62 %) |
|
G1 |
– |
|
|
G2 |
14 (31 %) |
|
|
Гистологическая дифференцировка опухоли/ |
G3 |
29 (65 %) |
|
Histological tumor differentiation |
G4 |
– |
|
Перстневидноклеточный рак/ Signet ring cell carcinoma |
2 (4 %) |
|
|
Размер первичной опухоли, см/Primary tumor size, cm |
6 (4,5; 7,5) (3–12) |
|
|
Перитонеальный карциноматозный индекс/ |
>6 |
19 (42 %) |
|
Peritoneal cancer index |
<6 |
26 (58 %) |
|
ПК/Peritoneal carcinomatosis |
30 (67 %) |
|
|
Метастатическое поражение/ |
Перитонеальный карциноматоз + |
|
|
Metastatic Lesion |
внебрюшинные метастазы/ Peritoneal carcinomatosis + metastases |
15 (33 %) |
Примечание: данные представлены в виде абсолютного числа больных (%) или медианы (1-й картиль; 3-й квартиль) (минимум-максимум); * – включая опухоли прямой кишки.
Note: data are presented as the absolute number of patients (%) or median (1st quartile; 3rd quartile) (minmax); * – including rectal tumors.
тидным маркерам (NR21, NR24, NR27, BAT25 и BAT26), описанным в работах [7, 8] .
Цифровая капельная ПЦР
Поиск мутации гена BRAF (p.V600E) проводили с помощью цифровой капельной полимеразной цепной реакции на приборе QX200 (BioRad), используя UTP-мастер микс, праймеры-зонды. Меченные FAM соответствовали последовательности мутации p.V600E, а меченные HEX соответствовали последовательности дикого типа (wt). Перед амплификацией формировались капли с помощью генератора капель QX200 Droplet Generator (BioRad) (рекомендованное число сгенерированных капель не менее 10 000). Программа амплификации: 95°C – 10 мин; 40 циклов: 94°C – 30 сек, 55°C – 1 мин; 98°C – 10 мин. Анализ полученных результатов осуществляли с помощью программы QuantaSoft Version 1.6.6.0320 (BioRad).
Анализ данных выполняли с помощью программы Statistica 13.0. Сравнение частоты мутаций в зависимости от признака (пол, локализация опухоли, дифференцировка опухоли, перитонеальный карциноматозный индекс, локализация метастатического очага) осуществлялось по двустороннему критерию Фишера. Для анализа выживаемости использовался логранговый метод и метод Каплан–Майера.
Результаты
Из 45 пациентов было 22 мужчины и 23 женщины. Средний возраст – 65 лет. Демографические характеристики пациентов, клиникоморфологические показатели опухоли и частота мутаций в зависимости от этих показателей представлены в табл. 2.
Общая частота мутаций генов KRAS , NRAS и BRAF в опухолях толстой кишки составила 67 % (30/45). Среди них на долю мутаций гена KRAS пришлось 80 % (24/30), на долю NRAS и BRAF по 10 % (3/30 – NRAS и 3/30– BRAF ). Спектр мутаций этих генов представлен на рис. 1.
Общая частота мутаций генов KRAS , NRAS и BRAF в карциноматозных узлах ниже, чем в первичной опухоли, и составила 62 % (28/45). У одного пациента в карциноматозном узле обнаружена мутация p.D54N, а в первичной опухоли мутации не обнаружено. В другом случае у пациента выявлены разные мутации в опухоли и карциноматозном узле: в опухоли – мутация p.G12D, а в карциноматозном узле – p.G13D. У двух пациентов мутации встретились только в опухоли (p.G13D и p.V600E). Таким образом, дискордантность между первичным очагом и его метастазами на брюшине составила 9 % (4/45). Установлено, что частота мутаций значимо выше у женщин с G3 дифференцировкой опухоли
Таблица 2/table 2
Характеристика пациентов и клинико-морфологические показатели опухоли в зависимости от мутационного статуса patient characteristics, clinical and morphological parameters and tumor mutational burden
|
Признак/Characteristics |
«Дикий» тип/ «Wild» type (n=14) |
Мутации/Mutation (n=31) |
p |
|
|
Средний возраст, лет/Middle Age, years |
68 (64; 74) (42–84) |
66 (59; 70) (40–86) |
0,54 |
|
|
Пол/Sex |
Муж/Male Жен/Female |
4 (29 %) 10 (71 %) |
12 (39 %) 19 (61 %) |
0,74 |
|
Локализация первичной опухоли/ Localization of the primary tumor |
Правые отделы ободочной кишки/Right colon Левые отделы ободочной кишки + прямая кишка/ Left colon + rectum |
5 (36 %) 9 (64 %) |
12 (39 %) 19 (61 %) |
0,19 |
|
G1 |
— |
|||
|
Гистологическая дифференцировка опухоли/ Histological tumor differentiation |
G2 G3 G4 Перстневидноклеточный рак/ Signet ring cell carcinoma |
7 (50 %) 5 (36 %) 2 (14 %) |
7 (23 %) 24 (77 %) — – |
0,09 0,02 0,09 |
|
Размер первичной опухоли, см/Primary tumor size, cm |
6 (4,5; 7) (3–7) |
6 (4,5; 8) (3–12) |
0,25 |
|
|
Перитонеальный карциноматозный индекс/ Peritoneal cancer index |
>6 <6 |
9 (64 %) 5 (36 %) |
10 (32 %) 21 (68 %) |
0,06 |
|
Метастатическое поражение/ Metastatic lesion |
ПК/Peritoneal carcinomatosis ПК + внебрюшинные метастазы/ Peritoneal carcinomatosis + metastases |
9 (64 %) 5 (36 %) |
21 (68 %) 10 (32 %) |
1,0 |
Примечание: данные представлены в виде абсолютного числа больных (%) или медианы (1-й квартиль; 3-й квартиль) (мин-макс).
Note: data are presented as an absolute number of patients (%) or median (1st quartile; 3rd quartile) (min-max).
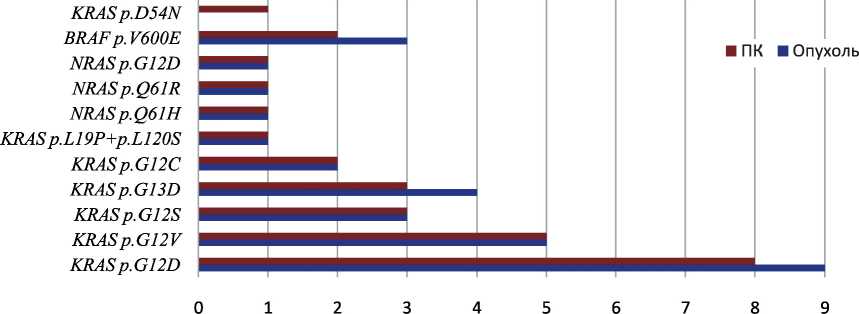
Рис. 1. Cпектр мутаций генов KRAS , NRAS и BRAF в опухоли и карциноматозных очагах Fig. 1. KRAS , NRAS , and BRAF mutation spectrum in tumor and carcinomatous lesions
(p=0,02). Также замечено, что мутации гена BRAF обнаружены у женщин, опухоли которых располагались в правых отделах толстой кишки. Анализ на микросателлитную нестабильность показал, что все опухоли и карциноматозные узлы имели микросателлитный стабильный статус.
Однофакторный COX-регресионный анализ показал, что наличие мутации в опухоли или карциноматозном узле не влияет на общую и без-рецидивную выживаемость, p=0,87 и p=0,85 соответственно (рис. 2).
Учитывая, что наличие мутации гена BRAF (p.V600E) в опухоли является фактором неблагоприятного прогноза, было принято решение провести дополнительный анализ опухолей и карциноматозных узлов на наличие данной мута-
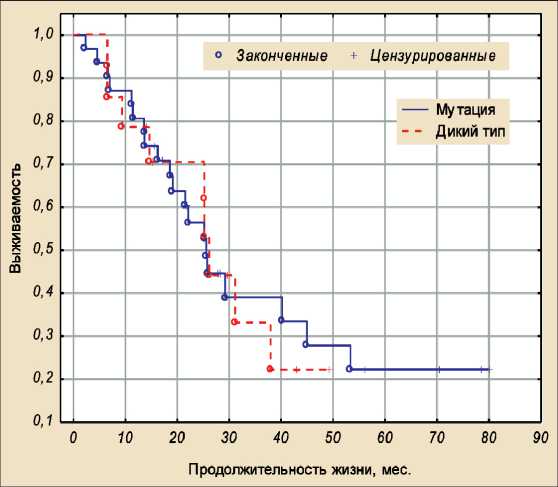
Рис. 2. Общая выживаемость у пациентов с мутацией генов KRAS , NRAS , BRAF и без мутации
Fig. 2. Overall survival in patients with/without KRAS , NRAS , BRAF mutation
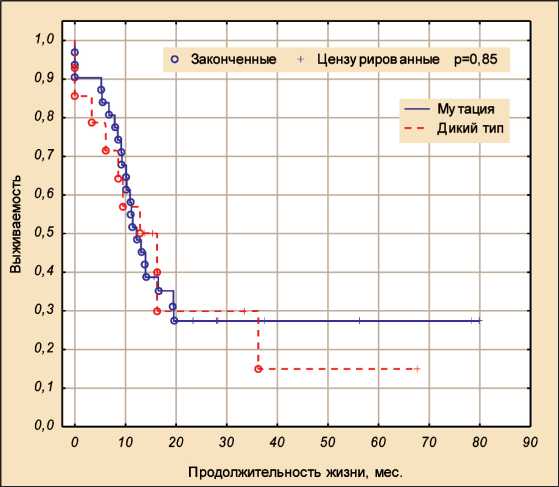
Рис. 3. Безрецидивная выживаемость у пациентов с мутацией генов KRAS , NRAS , BRAF и без мутации
Fig. 3. Relapse-free survival in patients with/without KRAS , NRAS , BRAF mutation
ции с помощью цифровой капельной ПЦР. Даже несмотря на то, что цифровая капельная ПЦР имеет высокую чувствительность, дополнительных мутаций не обнаружено.
Обсуждение
Для метастатического колоректального рака разработано достаточно много таргетных препаратов, но лишь несколько было одобрено FDA [9, 10]. В настоящее время успешно применяются препараты цетуксимаб и панитумумаб, наиболее эффективные при «диком типе» генов KRAS , NRAS, BRAF . Эти гены являются эффекторами гена EGFR . Другими словами, наличие мутированных генов KRAS , NRAS или BRAF приводит к образованию одноименного мутантного белка, который активирует EGFR-RAS-RAF сигнальный путь, что, в свою очередь, приводит к неконтролируемому делению клеток, нарушению регуляции пролиферации и устойчивости к апоптозу [11].
В нашем исследовании мутации KRAS, NRAS и BRAF обнаружены у 69 % больных колоректальным раком с синхронным карциноматозом, что не отличается от частоты мутаций этих генов (55–75 %) в карциномах толстой кишки, установленной в других исследованиях [12]. В то же время были выявлены некоторые особенности. Так, была обнаружена молекулярно-генетическая дискордантность по мутациям между первичным очагом и синхронным карциноматозом. Причём у одного пациента этот феномен выражался наличием разных мутаций в опухоли (p.G12D) и синхронном метастазе брюшины (p.G13D). У другого пациента обнаружена мутация p.D54N только в карциноматозном узле. Эти находки указывают на то, что молекулярно-генетический статус первичной опухоли может отличаться от статуса метастаза на париетальной брюшине у больных РТК с ПК. Поэтому для такого рода пациентов при назначении таргетных анти-EGFR препаратов необходимо учитывать не только статус первичного очага, но и метастазов. Интересен тот факт, что у больных РТК с синхронными метастазами в печени дискордантность по статусу гена KRAS не наблюдалась [13]. Возможно, это связано с разным типом метастазирования. То есть метастазы на брюшине образуются в результате имплантационного, а в печени гематогенного метастазирования.
До открытия антител к PD-L рецептору статус микросателлитной нестабильности как диагностический маркер определяли только при II стадии заболевания. В настоящее время наличие высокого уровня микросателлитной нестабильности, в том числе и при IV стадии заболевания, подразумевает успешное применение иммунотерапевтических препаратов [14]. В нашем исследовании все опухоли и синхронные метастазы на париетальной брюшине имели статус микросателлитно стабильных, это может свидетельствавать о том, что пациенты с карциноматозом брюшины имеют плохой прогноз.
Заключение
Пациенты с колоректальным раком и синхронным карциноматозом брюшины характеризуются высокой частотой мутаций генов RAS ( KRAS , NRAS ), BRAF и стабильным статусом опухоли по микросателлитам. Мутации этих генов не влияли на общую и безрецидивную выживаемость в нашей группе пациентов. Молекулярный статус первичной опухоли может отличаться от статуса метастаза на париетальной брюшине, что необходимо учитывать при назначении таргетных препаратов.
Список литературы Изучение влияния соматических мутаций генов KRAS, NRAS, BRAF и статуса микросателлитной нестабильности на выживаемость больных колоректальным раком с перитонеальным карциноматозом
- Losa F., Barrios P., Salazar R., Torres-Melero J., Benavides M., Massuti T., Ramos I., ArandaE. Cytoreductive surgery and intraperitoneal chemotherapy for treatment of peritoneal carcinomatosis from colorectal origin. Clin Transl Onco. 2014. 16(2): 128-140. doi: 10.1007/s12094-013-1053-x.
- Шелыгин Ю.А., Ачкасов С.И., Сушков О.И., Пономаренко А.А. Роль циторедуктивной хирургии и внутрибрюшной интраоперационной химиотерапии в лечении рака толстой кишки с перитонеальным карциноматозом. Колопроктология. 2017; 1(59): 53-58. [Shelygin Y.A., Achkasov S.I., Sushkov O.I., Ponomarenko A.A. The role of cytoreductive surgery (CRS) and intraperitoneal intraoperative chemotherapy (IIC) in the treatment of peritoneal carcinomatosis from colorectal origin. Koloproctol-ogy. 2017; 59(1): 53-58. (in Russian)].
- Koppe M.J., Boerman O.C., Oyen W.J., Bleichrodt R.P. Peritoneal carcinomatosis of colorectal origin: Incidence and current treatment strategies. Ann Surg. 2006; 243: 212-222. doi: 10.1097/01. sla.0000197702.46394.16.
- Сушков О.И., Ачкасов С.И. Перитонеальный карциноматоз при раке толстой кишки. Подходы к лечению (Обзор литературы). Колопроктология. 2016; 58(4): 69-79. [Sushkov O.I., Achkasov S.I. Peritoneal colorectal carcinomatosis. Approaches to treatment (Review). Koloproctology. 2016; 58(4): 69-79. (in Russian)].
- СтепановИ.В., ПадеровЮ.М., Афанасьев С.Г. Перитонеальный канцероматоз. Сибирский онкологический журнал. 2014; (5): 45-53. [StepanovI.V., Paderov Yu.M., Afanasyev S.G. Peritoneal carcinomatosis. Siberian Journal of Oncology. 2014; (5): 45-53. (in Russian)].
- Ceelen W.P. Peritoneal Carcinomatosis. Springer, 2007. 548 p. doi: 10.1007/978-0-387-48993-3.
- Цуканов А.С., Шелыгин Ю.А., Шубин В.П. Микросателлитная нестабильность при колоректальном раке (обзор литературы) Колопроктология. 2017; 60(2): 100-104. [Tsukanov A.S., Shelygin Yu.A, Shubin V.P. Microsatellite instability in colorectal cancer (review). Koloproctology. 2017; 60(2): 100-104. (in Russian)].
- Паклина О.В., Сетдикова Г.Р., Даабуль А.С., Шубин В.П., ПоспеховаН.И., Ротин Д.Л. Роль микросателлитной нестабильности при ампулярной карциноме. Фарматека. 2016; 321(8): 80-84. [Paklina O.V., Setdikova G.R., Daabul A.S., Shubin V.P., PospekhovaN.I., RotinD.L. The role of microsatellite instability in ampullar carcinoma. Farmateka. 2016; 321(8): 80-84. (in Russian)].
- Karapetis C.S., Khambata-FordS., JonkerD.J., O 'Callaghan C.J., Tu D., Tebbutt N.C., Simes R.J., Chalchal H., Shapiro J.D., Robitaille S., Price T.J., Shepherd L., Au H.J., Langer C., Moore M.J., Zalcberg J.R. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med. 2008; 359: 1757-1765.
- Amado R.G. WolfM., PeetersM., Van Cutsem E., Siena S., Freeman D.J., Juan T., Sikorski R., Suggs S., Radinsky R., Patterson S.D., Chang D.D. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol. 2008; 26: 1626-1634.
- Шубин В.П., Поспехова Н.И., Цуканов А.С., Рыбаков Е.Г., Панина М.В., Сушков О.И., Ачкасов С.И., Жданкина С.Н., Кашни-ков В.Н., Фролов С.А., Шелыгин Ю.А. Частота и спектр мутаций в гене KRAS при раке толстой кишки разной локализации и раке анального канала. Медицинская генетика. 2014; 13(5): 3135. [Shubin V.P., Pospekhova N.I., Tsukanov A.S., Rybakov E.G., Panina M.V. Sushkov O.I., Achkasov S.I., Zhdankina S.N., Kashnikov V.N., FrolovS.A., Shelygin Yu.A. Frequency and spectrum KRAS mutations in different localization of colon cancer and anal cancer. Medicinskaa genetika. 2014; 13(5): 3135. (in Russian)].
- Иванцов А.О., Янус Г.А., Суспицын Е.Н., Анисимова Е.И., Имянитов Е.Н. Молекулярные маркеры чувствительности и резистентности карцином толстой кишки к терапии антагонистами EGFR. Сибирский онкологический журнал. 2016; 15(1): 59-66. [Ivantsov A.O., Yanus G.A., Suspitsin E.N., Anisimova E.I., Imyanitov E.N. Molecular markers of sensitivity and resistance of colorectal cancer to anti-EGFR T. Siberian Journal of Oncology. 2016; 15(1): 59-66. (in Russian)]. doi: 10.21294/1814-4861-2016-15-1-59-66.
- Shubin V.P., PonomarenkoA.A., Tsukanov A.S., Maynovskaya O.A., Rybakov E.G., Panina M.V., Kashnikov V.N., Frolov S.A., Shelygin Y.A. Heterogeneity in colorectal primary tumor and synchronous liver metastases. Russian Journal of Genetics. 2018. 54(6): 698-702. doi: 10.1134/ S1022795418060091.
- Kalyan A., Kircher S., Shah H., Mulcahy M., Benson A. Updates on immunotherapy for colorectal cancer. J Gastrointest Oncol. 2018; 9(1): 160-169. doi: 10.21037/jgo.2018.01.17.


