Изучение влияния состава модельных питательных сред на основе капусты белокочанной на развитие Leuconostoc mesenteroides на предферментативном этапе
Автор: Кондратенко В.В., Лялина О.Ю., Посокина Н.Е., Захарова А.И., Шишлова Е.С., Колоколова А.Ю., Терешонок В.И.
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 2 (40), 2018 года.
Бесплатный доступ
Целью исследований являлось изучение закономерности влияния культуральной среды (субстрата) на развитие микрофлоры на этапе предварительного ферментирования модельной среды, изготовленной из белокочанной капусты сорта «Парус», с использованием штаммов молочнокислых микроорганизмов Leuconostoc mesenteroides ВКПМ B-8818. Основная задача в процессе исследований состояла в проведении поэтапной математической обработки экспериментальных данных и их анализе, получении функциональных зависимостей адекватно аппроксимирующих экспериментальные данные для базовой (БМС) и модифицированной (ММС) модельных сред. Анализ экспериментальных данных показал, что в зависимости от вида (состава) среды один и тот же вид микроорганизмов проявляет различную динамику нарастания титра. В связи с этим был разработан алгоритм определения оптимальной продолжительности предферментирования - «стоп-точки». Результаты исследований показали, что модификация модельной среды с внесением в неё поваренной соли и аскорбиновой кислоты способствует формированию положительной динамики показателя сравнения. Данная динамика имеет три выраженных экстремума, однако практический смысл имеют только экстремумы, которые находятся в интервале периода монотонного убывания титра. Одним из условий для успешного развития стартовой культуры на основном этапе ферментации является относительно малая величина титра первой культуры по завершению этапа предварительной ферментации с целью исключения конкуренции. Следовательно, положение «стоп-точки» соответствует периоду после последнего пика показателя сравнения. Данные исследования по закономерности влияния предварительного культивирования грамположительных микроорганизмов на активность молочнокислых микроорганизмов в процессе ферментации актуальны, так как от этого подхода в полном объеме зависит протекание всего процесса и получение высококачественной продукции.
Капуста белокочанная, предфермента-тивный этап, базовая и модифицированная модельные среды, штаммы молочнокислых микроорганизмов, математическая обработка данных, динамика титра культуры, показатель сравнения
Короткий адрес: https://sciup.org/140223778
IDR: 140223778 | УДК: 579.67
Текст научной статьи Изучение влияния состава модельных питательных сред на основе капусты белокочанной на развитие Leuconostoc mesenteroides на предферментативном этапе
Традиционно квашеная капуста изготавливается без использования молочнокислых бактерий, естественным путем, этот принцип основан на молочнокислом сбраживании сахаров [1]. Под действием молочнокислых бакте- рий, присутствующих на поверхности свежих овощей, углеводы преобразуются в молочную кислоту, также во время процесса молочнокислого брожения (ферментации) образуются и побочные продукты – уксусная кислота, маннит, этанол и др. При этом процесс изготовления квашеной капу- сты высокого качества не прост, поскольку непосредственное молочнокислое брожение является сложным микробиологическим процессом, в котором в итоге молочнокислые бактерии должны доминировать над посторонней микробной флорой [2].
Ферментация капусты белокочанной может быть разделена на две фазы – первая является газообразной, так как в ней присутствуют молочнокислые бактерии гетерофермен-тативного типа ( Leuconostoc mesenteroides и Lactobacillus brevis ), которые формируют молочную и уксусную кислоты, а также СО2, а вторая – не газообразная, где преобладают уже бактерии гомоферментативного типа (Lactobacillus plantarum). Каждой фазе соответствует определенная последовательность микроорганизмов, которые сменяют друг друга или развиваются одновременно [1].
Основным видом бактерий, которые размножаются на первой гетероферментативной (газообразной фазе) являются молочнокислые микроорганизмы L. mesenteroides (процесс занимает ~ 4-6 суток). Активное развитие L. mesenteroides обеспечивает условия для роста других молочнокислых бактерий в известной последовательности и является определяющим для получения высококачественного ферментированного продукта [3].
На смену L. mesenteroides приходит L. brevis, а затем размножаются Lactobacillus plantarum , которые опять продуцируют кислоту, снижая значение рН ниже 4,0. Достаточное количество молочной кислоты и анаэробные условия позволяют хранить квашеную капусту в анаэробных условиях в течение нескольких месяцев [3].
Изначально количество молочнокислых бактерий, которые присутствуют на поверхности сырья, невелико, но достаточно для начала процесса молочнокислого брожения. Необходимо отметить, что в таком динамичном процессе с многочисленными физическими, химическими и микробиологическими изменениями, важным моментом в начале ферментации является критическая точка, так как количество молочнокислых бактерий должно быстро увеличиваться для быстрого снижения pH и увеличения титруемой кислотности, так как это тормозит развитие посторонней микрофлоры и процесс идет правильно, в итоге готовая продукция, обладает хорошими органолептическими и микробиологическими показателями, а так же сенсорными и структурными качествами [2].
Альтернативой естественному процессу брожения является использование заквасок (штаммов молочнокислых микроорганизмов, стартерных культур, консорциумов), так как с их помощью можно управлять процессом ферментации. Закваски могут быть добавлены к сырью в виде монокультур, которые содержат только один штамм молочнокислых бактерий или в виде многокомпонентных культур (консорциумов молочнокислых микроорганизмов), содержащих несколько штаммов [4].
Добавление заквасок позволяет ускорить процесс образования молочной кислоты, приводящий к быстрому снижению pH и росту титруемой кислотности, так как изменение этих показателей в начале ферментации благоприятно влияет на весь процесс, поскольку минимизирует влияние патогенных и других нежелательных микроорганизмов, присутствующих на поверхности перерабатываемого сырья. Использование заквасок гарантирует правильное течение всего процесса ферментации и получение продукта с улучшенной пищевой ценностью и функциональными свойствами [3, 5].
Цели и задачи
Целью исследований являлось изучение закономерности влияния культуральной среды (субстрата) на развитие мик- рофлоры на этапе предварительного ферментирования модельной среды, изготовленной из капусты белокочанной сорта Парус, с использованием штаммов молочнокислых микроорганизмов Leuconostoc mesenteroides ВКПМ B-8818.
Основная задача в процессе исследований состояла в проведении поэтапной математической обработки экспериментальных данных и их анализе, получении функциональных зависимостей адекватно аппроксимирующих экспериментальные данные для базовой (БМС) и модифицированной (ММС) модельных сред. Также был разработан алгоритм определения оптимальной продолжительности предфер-ментирования – «стоп-точки».
Материалы и методы
В качестве объектов исследования использовали штамм микроорганизмов рода Leuconostoc вида L. mesenteroides ВКПМ B-8818 , предоставленные ФГУП ГосНИИгенетика.
Монокультуры культивировали на двух модельных питательных средах на основе капусты белокочанной сорта Парус, предоставленной ФГБНУ ФНЦО.
Подготовка модельных сред проходила по [6]. Базовую модельную среду (БМС) готовили последовательными операциями, включающими мойку, шинкование, гомогенизацию капусты белокочанной до получения однородной кашицеобразной массы. Аналогично базовой модельной среде отдельно готовили модифицированную модельную среду (ММС). Различие этих сред состояло в том, что в модифицированную модельную среду дополнительно вносили NaCl в количестве 1,5% от массы среды, с последующим перемешиванием до полного растворения соли. Для сохранения модельных сред их фасовали в стеклянные банки объёмом 0,1 дм3 (л) с винтовым типом укупорки, герметично укупоривали и стерилизовали при противодавлении 1 бар в течение 20 мин с последующим охлаждением до комнатной температуры. В модифицированную модельную среду в стерильных условиях добавляли аскорбиновую кислоту в количестве 35 мг на 100 г среды (таким образом доводили содержание витамина С в ММС до его среднего значения в свежей капусте белокочанной – исходном сырье), перемешивали до полного растворения и вторично укупоривали также в стерильных условиях.
Регенерацию культуры L. mesenteroides проводили в боксе по следующей схеме: посев культуры, находящейся на хранении, в жидкую питательную среду MRS; термостатирование при температуре 30°С в течение 72 ч, определение начального титра культуры. Культивирование монокультур в модельных средах проводили путём их введения в количестве 1% инокулята от объёма среды. Начальный титр соответствовал следующим значениям: в L.mesenteroides БМС – 2*105 КОЕ/г, в L.mesenteroides ММС – 2*105 КОЕ/г.
Активную фазу ферментирования осуществляли в термостате при температуре 30°С в течение 7 суток (168 ч). Далее осуществляли ежесуточный выборочный контроль титра микроорганизмов в модельной среде в процессе культивирования на протяжении всего процесса ферментации по [7].
Обработку экспериментальных данных осуществляли в несколько последовательных этапов: 1) первичная статистическая обработка экспериментальных данных по изменению количества микроорганизмов в течение 7 суток (Microsoft Excel, Statistica); 2) определение функциональных зависимостей вида y=f(x) , адекватно аппроксимирующих экспериментальные данные (SYSTAT TableCurve 2D); 3) аналитический расчёт функции скорости изменения количества микроорганизмов в базовой и модифицированной модельных средах.
Первичная обработка экспериментальных данных заключалась в следующем: имеющиеся данные по изменению количества микроорганизмов в течение 7 суток вносили в программу Microsoft Excel, на втором этапе эти данные отправляли в программу SYSTAT TableCurve 2D, с помощью которой определяли функциональные зависимости вида y=f(x), соответствующие нашим запросам. На третьем этапе полученные зависимости и коэффициенты к ним вносили в программу Microsoft Excel для определения скорости изменения количества микроорганизмов в зависимости от времени и нахождения показателя сравнения.
Результаты
Результаты отбора проб и проведения микробиологических исследований по изменению количества микроорганизмов в течение всего периода ферментации представлены в таблице 1.
Таблица 1. Изменение количества микроорганизмов в течение 7 суток
Table 1. Change in the number of microorganisms within 7 days
|
Отбор проб, час |
Наименование модельной среды |
|
|
БМС |
ММС |
|
|
Количество микроорганизмов КОЕ/г |
||
|
0 |
204500 |
216000 |
|
24 |
20566667 |
172333 |
|
48 |
474250000 |
43233333 |
|
72 |
71500000 |
66333333 |
|
96 |
41750000 |
133000000 |
|
120 |
30360000 |
62750000 |
|
144 |
2735000 |
40500000 |
|
168 |
31000 |
40000 |
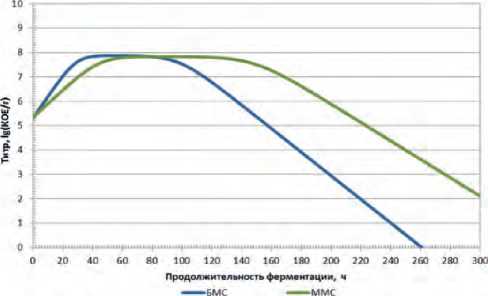
Рис.1. Динамика концентрации титра монокультуры
L. mesenteroides в БМС и ММС.
Fig.1. Dynamics of concentration of the titer of monoculture L. mesen-teroides in data for the base (BMS) and modified (MMC).
в ММС и БМС, где в качестве контрольного выбран вариант с БМС. Алгоритм включает три последовательных этапа: 1) расчёт динамики скорости изменения титра в ММС и БМС; 2) расчёт показателя сравнения k; 3) граничных условий определения параметра τ «стоп-точки».
Анализ экспериментальных данных показывает, что скорость изменения титра в случае с БМС убывает быстрее, чем с ММС за счет резкого уменьшения титра после ~ 85 ч, что говорит о более высокой активности метаболических процессов, протекающих при культивировании с L. mesenteroides на БМС. Таким образом, модификация БМС с использованием соли и аскорбиновой кислоты частично ингибирует процесс метаболизма при изначально одинаковом титре 106, титр в БМС выше, чем в ММС до ~ 55 ч.
Динамики скоростей нарастания титров в БМС и ММС в
Анализ экспериментальных данных, представленных в табл. 1, отправленных и проанализированных программой SYSTAT TableCurve 2D показал, что функциональные зависимости, наиболее адекватно аппроксимирующие экспериментальные данные, имеют вид:
– для базовой модельной среды (БМС) L. mesenteroides:
Tb= ( at/ (1+exp(-( т-Ь ь +с ь /2)М ь )))(1-1 / (1+ exp (-( т -b b -c ^/2 )/e))), (1)
– уравнение для модифицированной модельной среды (ММС) L. mesenteroides:
Tm=(am/ (1+exp(-( T-bm+cm/2)/dm )))(1-1/(1+exp(-( т -bm-cJ/2 ) /e ))) , (2)
где a - константа; b, c, d, e - коэффициенты; e(exp) - основание натурального логарифма; т - продолжительность культивирования, ч.
Характеристики аппроксимирующих функций представлены в таблице 2.
Зависимости титра от продолжительности ферментирования при культивировании монокультуры L. mesenteroides в БМС и ММС представлены на рисунке 1.
Анализ экспериментальных данных показывает, что в зависимости от состава среды один и тот же вид микроорганизмов проявляет различную динамику нарастания титра, для этого нами был разработан алгоритм определения оптимальной продолжительности ферментирования – «стоп-точки», основанный на логике сравнения скоростей изменения титра
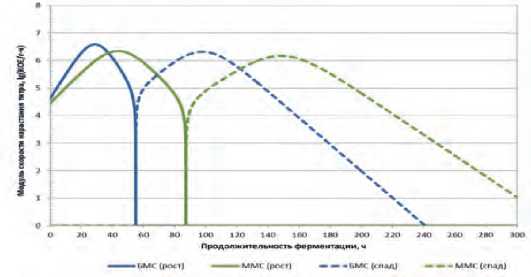
Рис. 2. Скорость изменения концентрации микроорганизмов монокультуры L. mesenteroides в БМС и ММС.
Fig. 2. Rate of change in the concentration of microorganisms in monoculture L. mesenteroides in data for the base (BMS) and modified (MMC).
формате V=fV(T) представлены на рисунке 2.
Анализ полученных данных показывает, что внесение в модельную среду поваренной соли и аскорбиновой кислоты не способствовали визуальному улучшению динамики нарастания титра в ММС по сравнению с БМС.
Из рисунка 2 видно, что кривая модуля скорости изменения титра выше в БМС, чем в ММС на начальном этапе, но при изначально быстром нарастании титра в БМС, он также быстро идет на спад. Нарастание титра в ММС и его снижение происходит
Таблица 2. Данные по аппроксимирующим функциям динамики изменения биомассы по вариантам исследований Table 2. Data on the approximating functions of the dynamics of biomass variation from study options
|
Модельная среда L. mesenteroides |
Константа и коэффициенты |
||||
|
a |
b |
c |
d |
e |
|
|
БМС |
7,55136e+07 |
63,34690795 |
69,12267193 |
4,871669741 |
8,987604856 |
|
ММС |
6,80482e+07 |
96,10094316 |
104,6614294 |
7,612859609 |
11,49981503 |
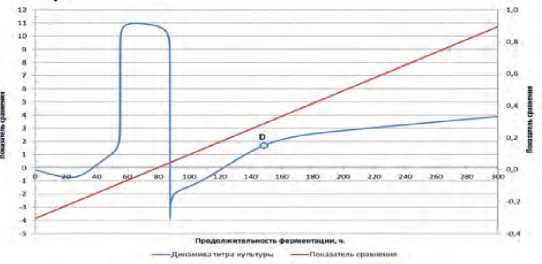
Рис.3. Динамика показателя сравнения влияния соли и витамина С в модельной среде на основе капусты белокочанной сорта Парус.
Fig.3. Dynamics of the indicator comparing the effects of salt and vitamin C in a model medium based on white cabbage varieties «Parus».
более плавно, и процесс нарастания занимает более продолжительное время в отличие от БМС.
Рассчитанная динамика показателя сравнения условий культивирования на исследованных средах, а также динамика титра культуры на ММС представлены на рисунке 3.
В зависимости от целей, стоящих при культивировании, можно анализировать либо период культивирования на всей области определения продолжительности ферментации, либо одну или несколько её отдельных интервалов с расчётом соответствующих границ, что сравнительно можно осуществить графически, аналитически или численными методами, в зависимости от требуемой точности.
«Стоп-точка» (точка D) показывает продолжительность ферментации с использованием определенного штамма молочнокислых микроорганизмов и остаточный титр, который показывает количество молочнокислых микроорганизмов. Эта точка является важным фактором для определения времени внесения и стартового титра следующей культуры. Наиболее адекватные значения «стоп-точки» (точки D) находятся от 4 до 6 суток, что соответствует диапазону от 96 ч до 144 ч. Точка D нам показывает, что L. mesenteroides перестает развиваться и на смену приходят L.brevis и L. plantarum. Для определения времени внесения этих культур необходимо найти точку D.
Из рисунка 3 видно, что кривая показателя сравнения имеет линейный характер, поэтому при любой произвольно заданной Δx, Δy будет иметь фиксированное значение и расчетным путем «стоп-точку» найти невозможно. Однако визуальный анализ кривой показателя сравнения титров (динамика титра культуры) показывает, что несмотря на монотонное возрастание данного показателя от 90 ч можно отметить наличие определенного участка, при котором скорость нарастания данного показателя снижается, а сама зависимость приобретает линейный характер.
-
• Литература
-
1. Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. – 473.
-
2. Britta Wiander. Lactic Acid Fermentation of Fruits and Vegetables // Food biology series/ Paramithiotis S. (ed.). – Boca Raton, London, New York: CRC Press, Taylor &Francis Group. 2017. – P. 65-78.
-
3. Настольная книга производителя и переработчика плодоовощной продукции. Под редакцией Н.К. Синха, И.Г. Хью. Перевод с англ. яз. – СПб.: Профессия, 2014. – С. 467-485.
-
4. Buckenhьskes, H.J. 1993. Selection criteria for lactic acid bacteria to be used as starter cultures for various food commodities. FEMS Microbiology Reviews 12: 253-272.
-
5. Josephsen J., Jespersen L. Fermented foods and starter cultures // Handbook of Food Science, Technology and Engineering / Hui Y. H. (ed.). — Boca Raton, FL: CRC Press, 2006. — P. 177- 1 — 177-20.
-
6. Кондратенко В.В., Лялина О.Ю., Посокина Н.Е., Терешонок В.И. Влияние состава культуральной среды на развитие Leuconostoc lactis на этапе предварительного ферментирования. // Овощи России. – 2017. – №5 (38). – С. 92-95.
-
7. ГОСТ 10444.11-2013 «Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов».
-
Следовательно, точка перехода области активного увеличения показателя сравнения в область умеренного линейного может быть принята в качестве условной «стоп-точки».
Сопоставление рисунков 2 и 3 показывает, что зоне перегиба соответствует зона максимума скорости снижения титра в ММС. Численное определение этой точки показало, что τ «стоп-точки» равно 148 ч (около 6 суток). В данном случае «стоп-точка» указана на кривой динамики титра культуры. Кривая показателя сравнения титров показывает граничные условия для определения «стоп-точки». Нахождение «стоп-точки» – важный этап в данной работе, так как ее значение показывает в каком временном интервале и при каком титре необходимо вносить следующую молочнокислую культуру. Потенциал развития L. mesenteroides определяется пиками (рис. 3), каждый из пиков – это эффективная область для развития микроорганизмов, «стоп-точка» находится после последнего пика в зоне некомфортного развития (угасания) отмирания данной культуры.
Выводы
Модификация модельной среды c L. mesenteroides и внесенной в нее солью и аскорбиновой кислотой (ММС) показала неоднозначные результаты. В период ферментации, соответствующий уменьшению титра, продолжительность процесса до момента достижения титром на БМС значения равного титру этой же культуры при ферментации на ММС в максимуме области определения продолжительности ферментации (300 ч) наступает на 37% раньше на БМС, чем на ММС. Природа данного явления нам неизвестна, поэтому полученные результаты требуют дальнейших более углубленных исследований.
Нахождение «стоп-точки» (точки D) является важным этапом в данной работе. Одно из условий для успешного развития стартовой культуры второго этапа является относительно малая величина титра первой культуры в конце предфермента-тивного этапа. Выполнение этого условия исключает конкуренцию между молочнокислыми микроорганизмами, которые соответствуют определенному этапу и сменяют друг друга в процессе ферментации. Из этого следует, что «стоп-точка» соответствует периоду после последнего пика показателя сравнения, однако если кривая имеет линейный характер, то точку D определяют по динамике титра культуры.
Титруемая кислотность – основной показатель для определения точки D («стоп-точки»), а по титру микроорганизмов определяются только граничные условия. Как правило, точку D находят после последнего пика, но данный алгоритм нахождения точки D не подходит для БМС и ММС с L. mesenteroides , поскольку кривая сравнения имеет линейный характер и «стоп-точку» определяют по динамике титра культуры (кривая показателя сравнения титров). Точка перехода области активного увеличения показателя сравнения в область умеренного линейного может быть принята в качестве условной «стоп-точки».
Список литературы Изучение влияния состава модельных питательных сред на основе капусты белокочанной на развитие Leuconostoc mesenteroides на предферментативном этапе
- Hutkins R.W. Microbiology and technology of fermented foods. IFT Press Blackwell Publishing, 2006. -473.
- Britta Wiander. Lactic Acid Fermentation of Fruits and Vegetables//Food biology series/Paramithiotis S. (ed.). -Boca Raton, London, New York: CRC Press, Taylor &Francis Group. 2017. -P. 65-78.
- Настольная книга производителя и переработчика плодоовощной продукции. Под редакцией Н.К. Синха, И.Г. Хью. Перевод с англ. яз. -СПб.: Профессия, 2014. -С. 467485.
- Buckenhbskes, H.J. 1993. Selection criteria for lactic acid bacteria to be used as starter cultures for various food commodities. FEMS Microbiology Reviews 12: 253-272.
- Josephsen J., Jespersen L. Fermented foods and starter cultures//Handbook of Food Science, Technology and Engineering/Hui Y. H. (ed.). -Boca Raton, FL: CRC Press, 2006. -P. 177-1 -177-20.
- Кондратенко В.В., Лялина О.Ю., Посокина Н.Е., Терешонок В.И. Влияние состава культуральной среды на развитие Leuconostoc lactis на этапе предварительного ферментирования.//Овощи России. -2017. -№5 (38). -С. 92-95.
- ГОСТ 10444.11-2013 «Микробиология пищевых продуктов и кормов для животных. Методы выявления и подсчета количества мезофильных молочнокислых микроорганизмов».


