Изучение взаимодействия 3-гидразинохиноксалин-2(1н)-она с изонитрозо--нафтоилацетоном
Автор: Бобров П.С., Андреева А.В.
Журнал: Теория и практика современной науки @modern-j
Рубрика: Химия и материаловедение
Статья в выпуске: 8 (50), 2019 года.
Бесплатный доступ
В настоящей работе приведены данные по результатам взаимодействия 3-гидразинохиноксалин-2(1Н)-она с изонитрозо-α-нафтоилацетоном в уксусной кислоте. Строение продукта конденсации подтверждено результатами хромато-масс спектрометрии, электронной и ИК - спектроскопии.
Изонитрозодикетон, 3-гидразинохиноксалин-2(1н) - он, гетерилгидразин, 3-дикетон, конденсация
Короткий адрес: https://sciup.org/140274875
IDR: 140274875 | УДК: 547.863.1
Текст научной статьи Изучение взаимодействия 3-гидразинохиноксалин-2(1н)-она с изонитрозо--нафтоилацетоном
В настоящее время актуальной задачей является поиск новых биологически активных соединений. Производные хиноксалина нашли применение в медицине в качестве антибактериальных препаратов I [1] и в сельском хозяйстве в качестве пестицидов II-III [2] (рисунок 1).
Учеными активно исследуется синтез и биологическая активность производных гидразинохиноксалина, а так же их циклических аналогов. Авторы [3] при конденсации ацетилацетона с хлорзамещенными 3-гидразинохиноксалинами получили гидразоны IV (рисунок 1), обладающие антибактериальной активностью. При циклоконденсации 1,3-дикетонов и в-кетоэфиров с 3-гидразинохиноксалин-2(1Н)-оном получены бактерицидные пиразолоны V и пиразолы VI (рисунок 1) [4].
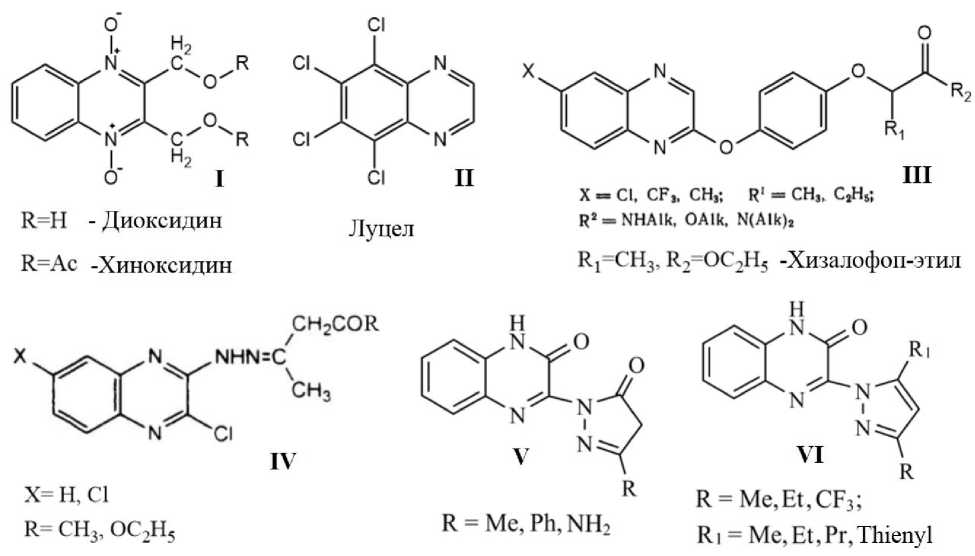
Рис. 1 Биологически активные производные хиноксалина
Ранее
нам
удалось
осуществить
циклоконденсацию
изонитрозоацетилацетона с 3-гидразинохиноксалин-2(1Н)-оном в кислой среде, в результате был получен ранее неизвестный 1-(хиноксалин-2(1Н)-он-3-ил)-3,5-диметил-4-нитрозо-1Н-пиразол [5]. Однако до сих пор не было изучено взаимодействие 3-гидразинохиноксалин-2(1Н)-она с другими известными изонитрозодикетонами. При успешном осуществлении реакции появляется возможность получить новые производные хиноксалина, которые могут обладать полезной биологической активностью. Поэтому целью нашей работы стало изучение взаимодействия 3-гидразинохиноксалин-2(1Н)-она с изонитрозо-а-нафтоилацетоном, а также доказательство строения впервые полученного соединения современными физико-химическими методами.
Для достижения поставленной цели необходимо было синтезировать исходные соединения. На первом этапе циклоконденсацией ортофенилендиамина с щавелевой кислотой по известной методике [6] получали хиноксалин-2,3(1Н,4Н)-дион, который затем вводили в реакцию с гидразингидратом и получали 3-гидразинохиноксалин-2(1Н)-он VII (рисунок 2) [7].
Для синтеза исходного изонитрозодикетона VIII конденсировали а-ацетонафтон с этилацетатом по методу Кляйзена [8], полученный в-дикетон нитрозировали нитритом натрия в уксусной кислоте по методике [9].
Изучение взаимодействия VII с VIII осуществляли в ледяной уксусной кислоте. При эквимолярном соотношении реагента и субстрата при 50-60 0С в течение 1 ч происходит образование гидразона IX с количественным выходом (рисунок 2). Ожидаемый циклический продукт X не удалось получить как при проведении реакции в кипящей уксусной кислоте в течение 2 ч, так и при попытке осуществить циклизацию гидразона IX.
Полученные результаты можно объяснить наличием стерических затруднений, создаваемых α - нафталиновым заместителем.
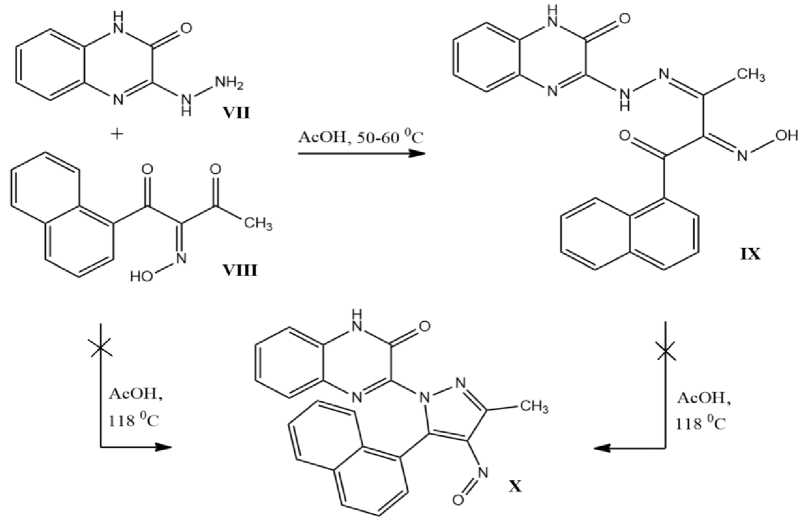
Рис.2 Изучение взаимодействия 3-гидразинохиноксалин-2(1Н)-она с изонитрозо-α-нафтоилацетоном
Строение полученного соединения IX подтверждают результаты хромато-масс спектрометрии, электронной и ИК - спектроскопии.
На хромато-масс спектре гидразона IX присутствует пик молекулярного иона m/z = 399, I отн = 25% и пик m/z = 398, I отн = 100%.
На ИК- спектре отсутствует полоса поглощения аминогруппы, и присутствуют полосы поглощения в области 3334 см-1(NH), 1683 см-1(СО), 1609 см-1, 1506 см-1, 1404 см-1, 1240 см-1, 1059 см-1, 1002 см-1, 961 см-1, 823 см-1, 756 см-1, 782 см-1 и 674 см-1.
На электронном спектре присутствуют максимумы поглощения в области 287 нм, 317 нм, 441 нм и 516 нм.
В результате конденсации 3-гидразинохиноксалин-2(1Н)-она с изонитрозо-α-нафтоилацетоном впервые получен ранее неизвестный 2-
(гидроксиимино)-3-(2-(3-гидроксихиноксалин-2-ил)гидразоно)-1 -(нафталин-1-ил)бутан-1-он. Строение продукта реакции подтверждено спектральными данными.
Экспериментальная часть
ИК спектр регистрировали на ИК микроскопе SpecTRA TECH InspectIR на базе ИК Фурьеспектрофотометра Impact 400. Хромато-масс и электронный спектр записывали на приборе Shimadzy LS/MS-2020 с колонкой RAPTOR ARC-18 100, в качестве растворителя использовали ацетонитрил. Контроль реакции и чистоты продуктов осуществляли методом тонкослойной хроматографии, пятна детектировали в ультрафиолетовом свете.
Для осуществления конденсации в 7 мл ледяной уксусной кислоты суспендировали гидразинохиноксалин VII (0,4 г, 2,27 ммоль), вводили изонитрозо-а-нафтоилацетон VIII (0,55 г, 2,27 ммоль) и перемешивали 60 мин при 50-60 0С. Образовавшийся осадок отфильтровывали, промывали 2 мл уксусной кислоты и 20 мл воды. Выход 0,84 г (93%). Желтые кристаллы, разлагающиеся при 222 0С, плохо растворимые в холодном этаноле и уксусной кислоте, хорошо растворимые в горячем этаноле, тетрагидрофуране и диметилсульфоксиде. УФ - спектр, Xmax, нм: 287, 317, 441, 516. ИК спектр, v, см-1: 3334, 1683, 1609, 1506, 1404, 1240, 1059, 1002, 961, 823, 756, 782, 674. Хромато-масс спектр, m/z (1 отн ., %): 399 (25) [М]+, 398 (100).
Список литературы Изучение взаимодействия 3-гидразинохиноксалин-2(1н)-она с изонитрозо--нафтоилацетоном
- Машковский М. Д. Лекарственные средства [Текст]: Пособие по фармакологии для врачей. Том 2 / М.Д. Машковский. М.: ООО «Издательство Новая Волна». - 2002. - 608 с.
- Мельников М. Н. Пестициды. Химия, технология и применение [Текст] / М. Н. Мельников. М.: Химия. - 1987. - 712 с.
- E. R. EI Bendary, F. E. Goda, A. R. Maarouf and F. A. Badria. Synthesis and antimicrobial evaluation of 3-hydrazinoquinoxaline derivatives and their cyclic analogues // Sci. Pharm. - 2004. - 72. - P. 175-185
- O. A. Olayinka, A. O. Craig, O. I. Chinwe, O. O. Kehinde and C. N. Obinna. Microwave-assisted synthesis and antibacterial activity of some pyrazol-1-yl-quinoxalin-2(1H)-one derivatives // Chemistry of Heterocyclic Compounds. - 2009. - Vol. 45. - No. 11. - P. 1370-1378
- Бобров, П.С. Циклоконденсация изонитрозоацетилацетона с 3-гидразинохиноксалин-2-олом [Текст] / П.С. Бобров, А.В. Андреева, А.В. Любяшкин, Г.А. Субоч // Молодые ученые в решении актуальных проблем науки. Всероссийская научно-практическая конференция. Сборник статей студентов и молодых ученых. - Красноярск: СибГУ им. М.Ф. Решетнева. - 2018. - С. 260-262
- A. P. Komin, M. Carmack. Die chemie der 1,2,5-thiadiazole. v. synthese von 3,4-diamino1,2,5-thiadiazol und №1,2,5>thiadiazolopyrazinen // J. Heterocycl. Chem. - 1976. - Nо. 1. - P. 13-22.
- G. W. H. Cheeseman, M. Rafiq. Quinoxalines and related compounds. Part VIII. The reactions of quinoxaline-2(1H)-ones and -2,3(1H,4H)-diones with hydrazine // Journal of the Chemical Society C: Organic. - 1971. - P. 452-454.
- A. Bunchetti. Su alcuni β-dichetoni // Gazz. Chim. Ital. - 1940. - Vol.70. - P. 134 - 144.
- Любяшкин, А.В. Синтез изонитрозодикетонов нафталинового ряда, нитрозопиразолов и аминопиразолов на их основе [Текст]: дисс. … канд. хим. наук: 02.00.03: защищена 29.09.2009 / А.В. Любяшкин. - Красноярск, 2009 - 113 с.


