Язвенные гастродуоденальные кровотечения с высоким риском рецидива. Тактика лечения
Автор: Бедин В.В., Коржева И.Ю., Власенко А.В., Михалянц Г.С., Цуркан В.А., Бочарников Д.С., Соколов К.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Обзор литературы
Статья в выпуске: 2 (92), 2025 года.
Бесплатный доступ
Острое язвенное кровотечение по-прежнему является основной причиной госпитализации. В этом обзоре представлен структурированный подход к современному лечению язвенных кровотечений и освещена стратегия в ситуациях, когда имеется высокий риск их рецидива. Рассматриваются первоначальные методы лечения – фармакотерапия и эндоскопия, а также стратификация риска, хирургическое вмешательство и рентгенэндоваскулярная эмболизация, и критически обсуждается их роль в лечении язвенных кровотечений с высоким риском рецидива. Освещена перспектива в отношении профилактической рентгенэндоваскулярной эмболизации. Помимо достижений фармакотерапии и эндоскопии, лечение кровотечений с высоким риском рецидива остается сложной задачей. Когда эндоскопия неэффективна, и кровотечение не прекращается или рецидивирует, для его купирования показаны хирургические и рентгенологические методы. Хирургическое лечение эффективно, но оно по-прежнему связано с более высокой инвалидизацией, длительным пребыванием в больнице и летальностью. Артериальная эмболизация рекомендуется в качестве альтернативы хирургическому вмешательству и чаще заменяет хирургическое лечение у пациентов с тяжелым коморбидным фоном. Пациенты с данной проблемой часто относятся к пожилой и старческой возрастным группам, что связано с тяжёлым коморбидным фоном, и, следовательно, требует мультидисциплинарного подхода в лечении. Алгоритм лечения нуждается в четких критериях рисков и в структурированном лечебном подходе из-за более высокой заболеваемости и смертности по сравнению с обычным язвенным кровотечением. Кроме того, многообещающий подход профилактической эмболизации при язвенной болезни с высоким риском рецидива требует дальнейшего изучения.
Пептическая язва, кровотечение, эндоскопия, рентгенэндоваскулярная эмболизация, хирургия
Короткий адрес: https://sciup.org/142244487
IDR: 142244487 | DOI: 10.17238/2072-3180-2025-2-200-212
Текст научной статьи Язвенные гастродуоденальные кровотечения с высоким риском рецидива. Тактика лечения
Распространенность язвенной болезни в Российской федерации (РФ), по оценкам, составляет около 7 % от общего числа заболеваний. Распространенность ЯБ по всем странам составляет около 4–8 % взрослого населения. При полноценном медицинском скрининге пациентов этот процент увеличивается до 20–25 %. Осложнение язвенной болезни кровотечением остается важной клинической проблемой, с показателями заболеваемости 37–172 на 100 000 человек (31–67 % от всего числа ЖКК из верхних отделов желудочно-кишечного тракта (ЖКТ)) и летальностью до 14 %, причем смертность возрастает при рецидивах и проведении открытых оперативных вмешательств, достигая 40 % [2].
Было установлено, что более высокая заболеваемость язвенной болезнью связана с мужским полом, курением, хроническими заболеваниями и с увеличением возраста. Со временем, как в РФ, так и в других странах мира наблюдалось значительное снижение частоты заболевания ЯБ, а также связанных с ней осложнений. Первое снижение связано с введением антагонистов Н2-рецепторов в 1977 году, а затем снова в 1980-х годах с введением ингибиторов протонной помпы (ИПП). Третье снижение наблюдалось в связи с пониманием роли бактерии Helicobacter pylori (H. pylori) в патогенезе ЯБ и разработкой методов его лечения, когда в 1979–1981 гг. Маршалл, Уоррен и их коллеги обнаружили, что H. pylori присутствует до 85 % пациентов страдающей язвенной болезнью [3].
Эпидемиология и этиологические факторы
В настоящее время известно, что большинство случаев язвенной болезни связано с инфекцией H. pylori или приемом нестероидных противовоспалительных препаратов (НПВП), или и с тем, и с другим [4].
Таблица 1
Факторы риска развития язвенной болезни
Table 1
Risk factors for peptic ulcer disease
Принципы лечения язвенных кровотечений
Успешная терапия язвенных гастродуоденальных кровотечений характеризуется междисциплинарным подходом, в зависимости от клинических проявлений. ЯК с высоким риском рецидива в своих основных лечебных алгоритмов следует принципам лечения кровоточащих пептических язв, которые будут кратко изложены в этом обзоре. Основной алгоритм лечения язвенных рефрактерных кровотечений по последним клиническим рекомендациям, который иллюстрирует участие эндоскописта, хирурга и интервенционного радиолога на разных этапах лечебного процесса (рис. 1) [8].
Предэндоскопический этап лечения
Все пациенты с клинической картиной ЖКК должны поступать в шоковую палату отделения анестезиологии-реанимации.
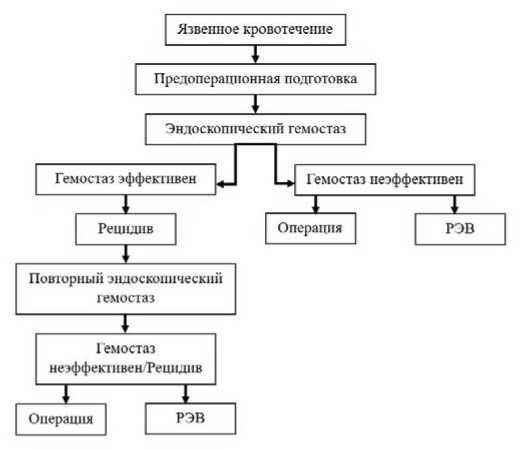
Рис. 1. Алгоритм лечения язвенных рефрактерных кровотечений
Fig. 1. Algorithm of treatment of ulcerative refractory bleeding
В случае явлений гиповолемического шока в следствие кровопотери, нестабильной гемодинамики первым этапом показано проведение интенсивной терапии, направленной на стабилизацию состояния. Кроме восполнения объема циркулирующей крови, посредством введения кристлаллоидных и коллоидных растворов, так же показано проведение трансфузионной терапии компонентами крови [2, 8].
Вопрос о уровне гемоглобина (Hb), при котором показано проведение трансфузии крови до сих пор активно обсуждается. По данным последних исследований рекомендуется отдать предпочтение тактике ограничительного (рестриктивного) метода с порогом Hb в 70 г/л, перед тактикой либерального переливания с порогом в 90 г/л [8]. Так как было установлено, что рестриктивный метод связан со значительно более низкой смертностью и частотой повторных кровотечений по сравнению с порогом либерального переливания крови в 90 г/л [9]. Однако, у пациентов с массивным ЯК в первые часы от начала заболевания ограничительная тактика имеет сомнительное применение, поскольку снижение уровня Hb до порогового значения в 70 г/л происходит в течение некоторого времени. По этим причинам при ведении пациентов с массивным кровотечением следует придерживаться местных протоколов трансфузиологии [8].
Второй вопрос касается увеличения объемов использования антитромботических препаратов при сердечно-сосудистых заболеваниях. Недавнее многоцентровое обсервационное исследование показало, что 44 % пациентов с ЖКК принимали антитромботический препарат, в то время как 25 % принимали даже больше одного. Кроме того, эти препараты являются фактором развития ЯК, но данные об оптимальном ингибировании действия этих препаратов малочисленны. Для пациентов, принимающих антагонисты витамина К, было установлено, что эндоскопический гемостаз успешно достигается при МНО 1,5–2,5. Таким образом, действующие рекомендации рекомендуют коррекцию МНО до <2,5 [10]. Кроме того, еще большее число пациентов принимает прямые ингибиторы фактора Ха, по которым не существует клинических исследований, посвященных лечению пациентов с ЯК, в действующих рекомендациях при приеме данной группы препаратов. Вследствие этого рекомендуется временно приостановить терапию прямыми ингибиторами факторами Ха [8].
Медикаментозная терапия
Применение ИПП с момента их внедрения в медицинскую практику в конце в 1980-х годах существенно изменили подход к лечению язвенной болезни. ИПП остаются основой медикаментозной терапии язвенных ЖКК. Хорошо проведенные систематические обзоры подтверждают целесообразность назначения ИПП до эндоскопического обследования при кровотечениях из верхних отделов ЖКТ, хотя явного преимущества в отношении смертности продемонстрировано не было.11,12 По последним рекомендациями всемирного общества экстренных хирургов рекомендована терапия в высоких дозах ИПП (80мг эзомепразола болюсно внутривенно и непрерывная инфузия 8 мг/ч в течение 72 ч) в течение 3-х суток, с последующим переходом на пероральные формы препарата [8].
Эндоскопический этап
Эндоскопия является основным методом лечения язвенных гастродуоденальных кровотечений. За один этап определяется точная локализация язвенного дефекта, что необходимо для стратификации риска рецидива, и проводится первичный гемостаз.
Тем не менее, сроки проведения первичной эндоскопии у данной группы пациентов по-прежнему часто обсуждаются. Последние рекомендации рекомендуют проводить эндоскопию в течение 24 ч после поступления в стационар пациента с диагнозом ЖКК [8–11]. В недавнем исследовали сравнивались сроки проведения эндоскопии, в частности, улучшает ли срочная эндоскопия исходы у пациентов с высоким риском кровотечения. Пациенты были рандомизированы на срочную (в течение 6 ч после поступления) и раннюю эндоскопию (в течение 6–24 ч после поступления). Интересно, что срочная эндоскопия не привела к снижению смертности или уменьшению дальнейшего кровотечения по сравнению со второй группой, хотя более активно кровоточащие язвы и стигматы кровотечения были обнаружены в группе неотложной помощи [12]. Таким образом, эти результаты свидетельствуют о том, что эндоскопия у пациентов с высоким риском рецидива может быть проведена в течение 24 ч после поступления. Однако, пациенты с гиповолемическим шоком, с нестабильной гемодинамикой были исключены из данного исследования, следовательно эти результаты не могут быть обобщены на эту группу. Таким образом, пациентам в тяжелом состоянии с явлениями гиповолемического шока, нестабильной гемодинамикой эндоскопия должна быть проведена сразу после стабилизации пациента, что отображено в последних мировых клинических рекомендациях.
Эндоскопический гемостаз
Всем пациентам с язвенным поражением Fia–IIa (по шкале Forrest) (рис. 2–4) (табл. 2) показано проведение эндоскопического гемостаза. Для эндоскопического гемостаза доступно три метода: инъекционный – растворами адреналина или тромбин/ фибринового клея, механический – клипсы (TTSC или OTSC) (Рис. 5), термический – аргоноплазменная коагуляция (Рис. 6).14,15 Хотя инъекции эпинефрина (адреналина) эффективны для достижения гемостаза, установлено, что его применение в качестве монотерапии уступает в предотвращении повторного кровотечения в пользу комбинации методов гемостаза.11,12,16 Тем не менее, первичное применение инъекций адреналина имеет важное клиническое значение, так как может замедлить или временно остановить кровотечение из язвы, что приводит к улучшению визуализации и дает возможность применить дополнительные методы гемостаза.16
У пациентов с язвенным поражением FIIв (рис. 7) эндоскопическое лечение все еще обсуждается из-за противоречивых данных. При отмывании тромб-сгустка выявляется язвенное кровотечение FIa–IIa до 43 % случаев [2]. Когда сгусток не удаляется при активном отмывании, удаление его посредством холодного гильотинирования, все еще остается предметом обсуждения. Два исследования показали, что удаление тромба и последующий эндоскопический гемостаз приводит к меньшему количеству рецидивов по сравнению только с медикаментозной терапией [11–16]. С другой стороны, другие два исследования не выявили различий в частоте рецидива между пациентами, получавшими эндоскопическое лечение, и пациентами, получавшими только медикаментозную тера- пию.14,17 Основываясь на этих противоречивых результатах, современные рекомендации рекомендуют индивидуальный подход опираясь на клинико-лабораторные данные пациента и на его тяжесть состояния [8].
Таблица 2
Классификация язвенных кровотечений по Forrest (1974)
Table 2
Classification of ulcerative bleeding according to Forrest (1974)
|
Тип по Forrest Type by Forrest |
Эндоскопическая картина Endoscopic picture |
Риск рецидива, % Risk of relapse, % |
|
Активное кровотечение Active bleeding |
||
|
Ia |
Пульсация струей Pulsating stream |
90 |
|
Ib |
Blood leakage Подтекание крови |
50 |
|
Признаки состоявшегося кровотечения Signs of bleeding that has occurred |
||
|
IIa |
Видимый тромбированный сосуд Visible thrombosed vessel |
25–30 |
|
IIb |
Фиксированный тромб-сгусток Fixed thrombus-clot |
10–20 |
|
IIc |
Дно язвы, покрытая гематином The bottom of the ulcer covered with hematin |
<10 |
|
III |
Язва с чистым белым дном Ulcer with a clear white bottom |
<5 |
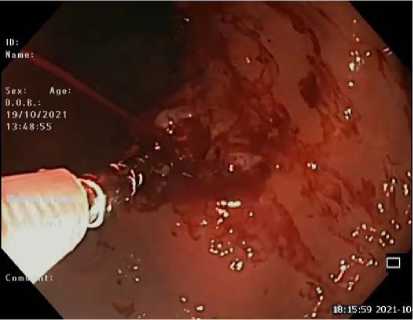
Fig. 2. Stomach ulcer FIa
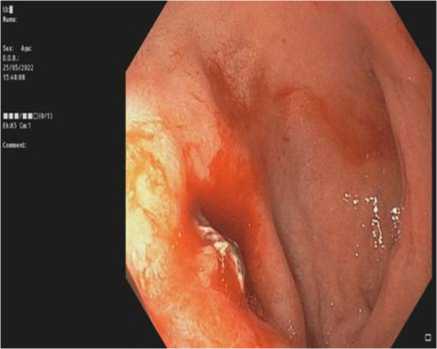
Рис. 3. Язва ДПК FIb
Fig. 3. Duodenal ulcer FIb
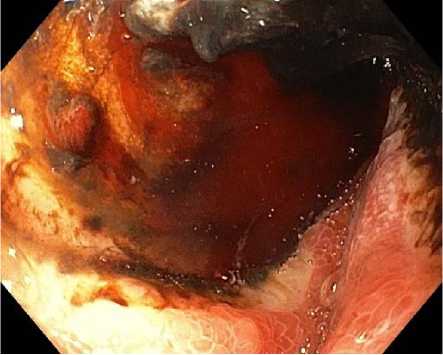
Fig. 4. Stomach ulcer FIIa
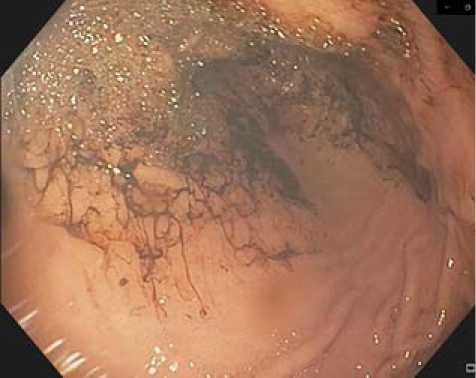
Рис. 6. Гемостаз АПК
Fig. 6. Hemostasis of the APK
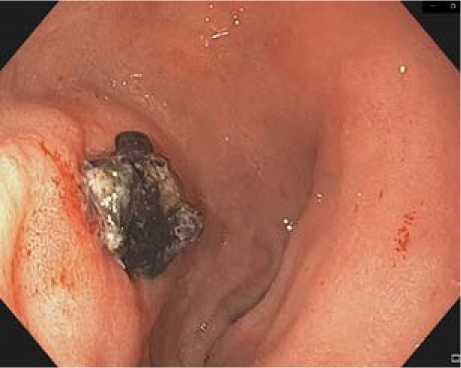
Рис. 7. Язва ДПК FIIb
Fig.7. Duodenal ulcer FIIb
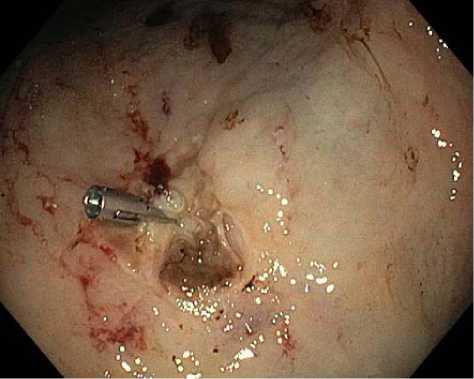
Fig. 5. Clipping of a stomach ulcer
Эндоскопическая терапия не показана пациентам с язвенным поражением FIIc и FIII (рис. 8–9) из-за низкого риска повторного кровотечения.
Если адекватный гемостаз не может быть достигнут с помощью какого-либо эндоскопического метода, то область кровотечения должна быть отмечена с помощью клипс, чтобы обеспечить маркировку локализации кровотечения при проведении рентгенологического вмешательства (РЭВ).
Постэндоскопический этап
Сразу после эндоскопии крайне важно оценить каждого пациента, чтобы выявить пациентов, имеющих высокий риск рецидива кровотечения.
На данный момент следует отметить, что точного опре- деления понятия “высокий риск рецидива” в клинических рекомендациях не существует.
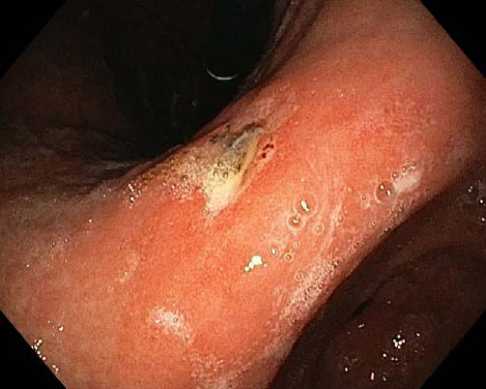
Рис. 8. Язва ДПК FIIc
Fig. 8. Duodenal ulcer FIIc
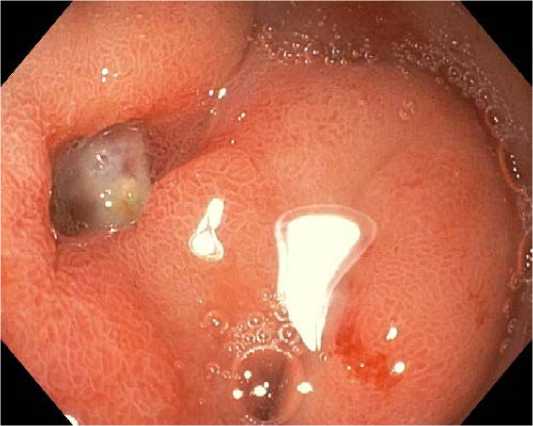
Fig 9. Stomach ulcer FIII
Повторное кровотечение возникает у 8–25 % пациентов, а летальность в случае рецидива достигает 40 %, и это по-прежнему является серьезной проблемой в лечении ЯК [2, 18].
Основываясь на системах классификации рисков, таких как оценка по шкале Rockall (табл. 3), при определении индивидуального риска кровотечения необходимо учитывать несколько других факторов.
Шкала Rockall была разработана для прогнозирования смертности и повторного кровотечения после эндоскопии [16]. Она разделяет пациентов на группы с низким (балл ≤2), средним
Вопрос о проведении плановой контрольной эндоскопии с целью оценки эффективности первичного гемостаза до сих пор дискутабелен. Очень часто проводятся рутинные повторные эндоскопии в течение 24 ч после успешного эндоскопического гемостаза независимо от риска кровотечения. Интересно, что мета-анализ, в котором изучалась роль повторной эндоскопии, выявил значительное снижение повторного кровотечения и необходимости хирургического вмешательства, но не смертности [21]. Однако, следует отметить, что этот анализ включал только 1 исследование, в котором использовались высокие дозы внутривенного ИПП. В нем рассматривалась польза контрольной эндоскопии только для пациентов с высоким риском рецидива. Таким образом, повторная эндоскопия не рекомендуется у пациентов с низким риском рецидива, но она может быть использована у пациентов с группой высокого риска.
Методы лечения при рецидивах кровотечений
На данный момент всемирные и национальные рекомендации рекомендуют применение альтернативных методов лечения при рецидивах кровотечения после 2-х неэффективных эндоскопических гемостазов, приводящих к рецидиву или в случаи невозможности проведения первичного эндоскопического гемостаза (рис. 1) [8].
В настоящее время доступны 2 варианта лечения: открытое хирургическое вмешательство и рентгенэндоваскулярная артериальная эмболизация. Оба варианта лечения имеют свои плюсы и минусы, и их применения определяются индивидуальной клинической картиной и местными факторами, такими как наличие опытного рентгенолога или хирурга. Кроме того, пациенты с язвенным ЖКК высокого риска также обычно старше и имеют больше сопутствующих заболеваний, что необходимо принимать во внимание при выборе между хирургическим вмешательством и РЭВ [7, 22].
Хирургическое вмешательство
Таблица 3
Шкала оценки риска рецидива гастродуоденального кровотечения Rockall (1995)
Table 3
Rockall Gastroduodenal Bleeding Risk Assessment Scale (1995)
|
Показатель Indicator |
0 баллов 0 point |
1 балл 1 point |
2 балла 2 points |
3 балла 3 points |
|
Возраст Age |
>60 |
60 – 79 |
<80 |
|
|
Шок Shock |
Нет шока No shock |
ЧСС>100 Heart rate>100 САД>100 systolic blood pressure>100 |
ЧСС>100 Heart rate>100 САД<100 systolic blood pressure<100 |
|
|
Сопутствующая патология Associated pathology |
Нет No |
ХСН, ИБС chronic heart failure, ischemic heart disease |
ХПН, печеночная недостаточность, метастазы chronic renal failure, liver failure, metastases |
|
|
Эндоскопическая картина Endoscopic picture |
Синдром Мэллори-Вейса Mallory-Weiss syndrome |
Язвы, эрозии и другие не раковые источники кровотечения. Злокачественные источники кровотечения Ulcers, erosions and other non-cancerous sources of bleeding. Malignant sources of bleeding |
||
|
Состояние гемостаза State of hemostasis |
Кровотечения нет No bleeding |
Кровь в просвете, сгусток крови на поверхности дефекта, пульсирующая струя крови Blood in the lumen, blood clot on the surface of the defect, pulsating stream of blood |
Очень часто эти пациенты подвергаются нескольким попыткам эндоскопического лечения, что приводит к гораздо более высокому риску и худшему прогнозу.
Таким образом, хирургическое вмешательство представляется целесообразным у пациентов с высоким риском повторного кровотечения, но оно требует тщательной оценки необходимости у пожилых пациентов из-за высокого риска послеоперационных осложнений и летальности.
Рентгенэндоваскулярная артериальная эмболизация
Данный метод является серьезным конкурентом хирургическому вмешательству и даже первым выбором лечения при неэффективном эндоскопическом гемостазе или при невозможности его проведения [23, 24].
У пациентов, относящихся к высокий группе риска рецидива, рекомендуется при проведении эндоскопического лечения расположить клипсу в месте кровотечения, а когда невозможно выполнить эндоскопический гемостаз данная процедура является обязательной. Это служит маркировкой места кровотечения для рентгенолога, которому будет легче определить локализацию кровотечения для эмболизации, поскольку активная экстравазация обнаруживается только в 61% случаев (рис. 10–11) [2, 8, 20, 21, 23, 24].
В случаях, когда при первичной ангиографии не удается обнаружить активного кровотечения, необходимо выполнить так называемую «эмпирическую» или «слепую» эмболизацию целевого сосудистого русла.
Для обеспечения успеха эмпирической эмболизации крайне важно определить и описать точную локализацию язвы эндоскопически, помимо маркировки зажимом. Это особенно важно для язв, располагающихся на задней стенке луковицы ДПК, поскольку ГДА с ее ветвями связана с местом кровотечения.
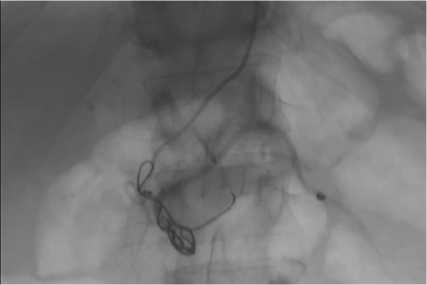
Рис. 10. Эмпирическая РЭВ с маркировочной клипсой на месте кровотечения
Fig. 10. Empiric TEA with the bleeding site marked with a clip
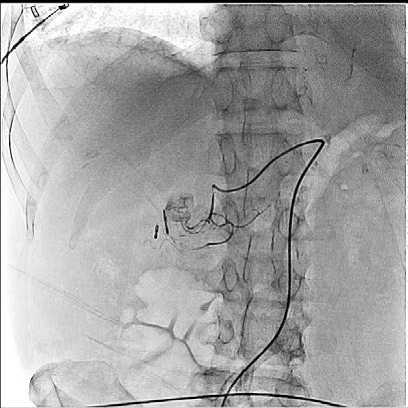
Рис. 11. Ангиография ГДА (рецидив, экстравазация)
Fig. 11. Arteriogram GDA (relapse, extravasation)
В целом, сообщалось о технических (90–100 %) и клинических (47–93 %) показателях успехах РЭВ у пациентов с рецидивирующим кровотечением, что указывает на ее эффективность [23, 26].
С другой стороны, сложная анатомия ГДА это одна из причин высокой частоты повторного кровотечения (8–55 %), о которой сообщалось в некоторых исследованиях[1,2,8,11,13,14]. По этой причине необходимо детальное анатомическое знание ГДА, чтобы эмболизировать сосуд в нужном объеме. ГДА имеет двойное кровоснабжение из общей печеночной артерии и верхней брыжеечной артерии (ВБА). Она чаще всего отходит от общей печеночной артерии и дает начало супрадуоденальной и далее задней панкреатодуоденальной артериям, она заканчивается раздвоением на правую желудочно-сальниковую и переднюю панкреатодуоденальная артерии. Вместе с нижними панкреатодуоденальными артериями, которые отходят от ВБА, формируются функциональные анастомозы. Поэтому эмболизация ГДА исключительно в ее проксимальной части неизбежно приведет к дистальной реперфузии через ВБА. По этой причине следует выполнить полную эмболизацию ГДА, начиная с дистальной части и продолжая к источнику, чтобы уменьшить частоту повторного кровотечения. Кроме того, в конце каждой эмболизации ГДА следует выполнять селективную ангиографию ВБА, чтобы исключить коллатеральное кровоснабжение места кровотечения (рис. 12) [23, 25, 26].
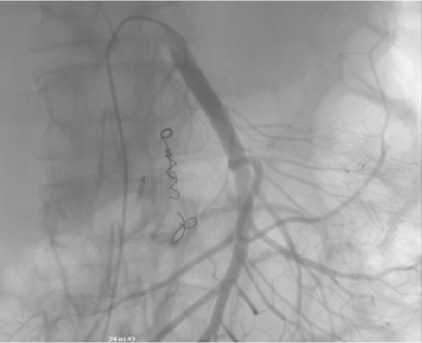
Рис. 12. Cелективная ангиография верхней брыжеечной артерии
Fig. 12. Selective angiography of the superior mesenteric artery
Первоначально РЭВ применялась только тем пациентам, у которых хирургическое вмешательство было связано с высоким риском осложнений и смертности, в то время как хирургическое вмешательство было основным методом лечения пациентов с рецидивирующим кровотечением. Однако, в настоящее время РЭВ получила широкое распространение и часто используется в клинической практике [25, 26].
В нескольких исследованиях было продемонстрировано, что это безопасная альтернатива для пациентов, неподлежащих хирургическому вмешательству. Однако, при анализе частоты рецидивов было отмечено, что РЭВ может быть связана с повышенной частотой повторных кровотечений по сравнению с хирургическим вмешательством. В одном мета-анализе подтвердили более высокий риск повторного кровотечения при РЭВ по сравнению с хирургическим вмешательством. Однако, это исследование также показало, что повторное кровотечение в группе РЭВ значительно различалось между исследованиями (15–40 %). Это может быть связано с применением различных эмболизирующих средств и методик. Например, рассасывающиеся эмболические средства, такие как желатиновая губка, как правило, связаны с более высоким риском повторного кровотечения и которую использовали в 2-х исследованиях. Кроме того, полная эмболизация кровоточащего сосуда, а именно ГДА, является существенным и превосходит только центральную эмболизацию кровоточащего участка [2, 8]. К сожалению, в большинстве исследований не упоминаются эмболизирующие агенты или методы эмболизации. Хотя в недавнем популяционном когортном исследовании, РЭВ ассоциировалась с лучшим прогнозом, меньшей продолжительностью пребывания в больнице (9 против 18 дней; р < 0,0001) и снижением риска осложнений (8 % против 32,2 %; р < 0,0001) по сравнению с хирургическим вмешательством [26]. Учитывая эти результаты и тот факт, что хирургическое вмешательство связано со значительно более частотой инвалидизации и смертности, использование РЭВ все чаще предлагается в качестве первого варианта лечения [23].
Профилактическая рентгенэндоваскулярная артериальная эмболизация
Более поздним подходом является концепция профилактической РЭВ у пациентов с ЯК высокого риска. Считается, что эта концепция снижает частоту повторных кровотечений и смертность. В 2014 году опубликовано первое исследование в соответствии с этой концепцией. Авторы проводили отбор пациентов по риску рецидива по данным эндоскопии (Forrest Ia–IIb). К сожалению, это исследование было недостаточно мощным, чтобы ее доказать.2
Впоследствии другое ретроспективное исследование, включающее отбор пациентов с учетом результатов эндоскопии (Forrest Ia–IIc, задняя луковица ДПК и размер язвы), Rockall
≥6 и индивидуальные факторы (сопутствующие заболевания, антикоагулянты и нестабильность гемодинамики) доказало, что данный метод безопасен и эффективен, что приводит к низкой частоте хирургических вмешательств (n = 1; 0,9 %) и низкой смертности, связанной с кровотечением – 4,3 % [27].
С другой стороны, в недавно опубликованном исследовании не смогли найти пользы от профилактической РЭВ в этом исследовании. Пациентов отбирали подходящими для проведения данного вмешательства, если присутствовал по крайней мере 1 из следующих критериев: размер язвы ≥20 мм, обильное кровотечение, гипотензивный шок и гемоглобин <90 г/л. Отмечено, что частота повторного кровотечения снизилась у пациентов с размером язвы ≥15 мм [28]. Такие результаты обусловлены вероятнее всего тем, что границы факторов высокого риска были очень широкими. Тем не менее, это исследование показывает, что верная стратификация риска необходима и должна включать множество факторов. На основании вышеизложенного в существующее время нет достаточных данных, чтобы рекомендовать профилактическую РЭВ в последних клинических рекомендациях. Кроме того, для отбора необходимо дополнительно изучить критерии отбора, включающие множество факторов риска. Однако, особенно при язвах ДПК с высоким риском рецидива (задняя стенка луковицы) профилактическая РЭВ может быть жизненно важным методом лечения.
Выводы
Лечение язвенных ЖКК с высоким риском рецидива является междисциплинарной задачей и включает в себя совместную работу нескольких врачебных специальностей (хирурга, эндоскописта, рентгенолога). Нет никаких сомнений в том, что эндоскопия является золотым стандартом и первым методом выбора. Тем не менее рефрактерные или рецидивирующие кровотечения являются серьезными осложнениями у данной группы пациентов, приводящими к высокой смертности. Таким образом, стратификация рисков и идентификация этих пациентов является первостепенной для дальнейшего ведения. Кроме того, пациенты с ЯК высокого риска обычно имеют несколько сопутствующих заболеваний, получают антикоагулянты и часто находятся в более худшем состоянии, и, таким образом, методы выбор лечения: повторная эндоскопия, хирургическое вмешательство или РЭВ должны проводиться в индивидуальном порядке с учетом ресурсов учреждения.
Тем не менее, стратегия лечения должна заключаться в следующем: выявлять пациентов с высоким риском, избегать повторного кровотечения и оперативно принимать решение о дальнейших вариантах лечения, основываясь на местных ресурсах.


