Эффект экстракта мицелия Duddingtonia flagrans на подкожные ксенографты клеток C33A карциномы шейки матки человека
Автор: Соловьева Ольга Игоревна, Завьялов Евгений Леонидович, Теплякова Тамара Владимировна, Лебедев Леонид Рудольфович, Разумов Иван Алексеевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.19, 2020 года.
Бесплатный доступ
Цель исследования - изучение противоопухолевого действия экстракта мицелия Duddingtonia flagrnns (штамм F-882) на ксенографты карциномы шейки матки человека C33a. Материал и методы. Для оценки противоопухолевого действия использовали абсолютные значения объёмов ксенографтов и рассчитывали показатели: торможение роста опухоли и индекс прироста опухоли. Результаты. На первом этапе эксперимента после 4 нед подкожных введений F-882 значение торможения роста опухоли составило 50,6 %, т. е. инъекции привели к почти двукратному замедлению роста опухолей в экспериментальной группе. На следующем этапе комбинированное введение, подкожное в течение 2,5 нед, а затем внутриопухолевое в течение 1,5 нед, также показало ингибирование роста ксенографтов, после окончания инъекций F-882 эффект замедления роста опухолей продолжался в течение 2,5 нед и показатель торможения роста опухоли составлял 58,7 %. Заключение. Впервые было выявлено, что экстракт мицелия F-882 способен оказывать интенсивное противоопухолевое действие на подкожные ксенографты карциномы шейки матки человека клеток C33a.
Хищные грибы, карцинома шейки матки, злокачественные новообразования
Короткий адрес: https://sciup.org/140254404
IDR: 140254404 | УДК: 618.14-006.6:582.282:615.277.3]-092.9 | DOI: 10.21294/1814-4861-2020-19-6-93-98
Текст научной статьи Эффект экстракта мицелия Duddingtonia flagrans на подкожные ксенографты клеток C33A карциномы шейки матки человека
Проблема разработки новых препаратов для борьбы с онкологическими заболеваниями является актуальной. Согласно данным ВОЗ, в 2018 г. злокачественные новообразования (ЗНО) стали причиной смерти 9,6 млн человек, а рак шейки матки (РШМ) занимает второе место по распространённости среди ЗНО репродуктивной системы [1, 2].
Многолетний опыт человечества в использовании медицинских препаратов наряду с их преимуществами показал и их недостатки. Токсическое влияние цитостатических препаратов на нормальные органы и ткани обусловливает интерес к разработке новых лекарственных средств, основанных на природных соединениях [3]. Одним из перспективных источников лекарственного сырья являются грибы. Грибы содержат биологически активные вещества (БАВ), такие как полисахариды, гликопротеины, терпены, стеролы, пигменты и др., противоопухолевые эффекты которых уже были описаны [4–8]. По данным литературы, получаемые из грибов полисахариды могут опосредованно воздействовать на всю иммунную систему организма, а также обладать непосредственно цитотоксическим эффектом в отношении опухолевых клеток [4, 5, 9]. По мнению учёных, комплексы полисахаридов с белками можно рассматривать как новый тип противоопухолевых соединений [9].
Среди большого разнообразия грибов, обладающих выраженной биологической активностью, можно выделить группу «хищных» нематофаговых грибов. Для них характерно высокое содержание ферментов, а также антибиотиков [10]. Наиболее изученным представителем этой группы является Duddingtonia flagrans. В настоящей работе использовался штамм D. flagrans F-882 (далее – F-882), который был разработан как биологическое средство борьбы с фитопатогенными нематодами растений, а также паразитическими нематодами животных [11]. Водный и этанольный экстракты F-882 являются малотоксичными в системе in vitro [12]. Помимо этого, установлено, что F-882 обладает противовирусной активностью в отношении ВИЧ-1, вирусов гриппа человека и птиц типа А и вируса осповакцины [13]. Эти свойства гриба, его относительная безопасность для животных [11] и, возможно, для человека, а также необходимость поиска новых кандидатных соединений для борьбы с онкологическими заболеваниями стали причиной изучения противоопухолевого эффекта F-882.
Целью исследования явилось изучение противоопухолевого действия экстракта мицелия Dud-dingtonia flagrans (штамм F-882) на ксенографты карциномы шейки матки человека C33a.
Материал и методы
Исследование выполнено на площадке ЦКП «SPF-виварий» Института цитологии и генетики СО РАН на животных SPF-статуса. В эксперименте были использованы бестимусные мыши линии SCID (SHO- PrkdcscidHrhr ) (самки), всего 21 животное. Все манипуляции проводили в соответствии с международными правилами работы с животными (European Communities Counsil Directive 86/609 EEC).
В работе использовали клеточную линию C33a карциномы шейки матки человека (ATCC HTB 31). Культуру клеток, хранящуюся в криобанке ЦКП «SPF-виварий» ИЦиГ СО РАН в жидком азоте, размораживали и культивировали 34 пассажа на среде DMEM/F12 1:1 с 10 % фетальной бычьей сыворотки (Invitrogen).
Для получения солидных опухолей животным подкожно вводили 100 мкл суспензии, содержащей 8×106 клеток, в область правой лопатки. В течение 2 нед наблюдали за ростом опухолевых узлов, при появлении характерных уплотнений измеряли линейные размеры штангенциркулем (Росинстру-мент, Россия) и высчитывали объём опухоли (V) по формуле [14]
V=(a×b2)×0,52, где a – наибольший диаметр опухоли, b – наименьший диаметр опухоли.
Показатель торможения роста опухоли (ТРО) рассчитывали по формуле [15]
ТРО (%)=(Vk-Vo)/Vk*100, где Vk – средний объём опухоли в контрольной группе; V – средний объём опухоли в группе «F-882». o
Также использовали показатель индекса прироста опухоли (ИПО), рассчитанный для каждого животного по формуле [16]
ИПО=V/V , i о, где Vi – объём опухоли в определённый день исследования; Vo – объём опухоли в первый день исследования (до введения препарата).
Для исследования использовали водный экстракт мицелия F-882, полученный из биомассы гриба, наработанной по методике глубинного культивирования [11]. Мицелиальную массу получали на основе штамма F-882, депонированного в Коллекции микроорганизмов ФБУН ГНЦ ВБ «Вектор». Сухой экстракт растворяли в 10 мл воды для инъекций Bufus (Renewal, Россия), получая концентрацию по полисахаридам 7,8 мг/мл и по белкам 5,7 мг/мл.
Инъекции начинали на 13-е сут от инокуляции опухолевых клеток, когда объём ксенографтов составлял около 80 мм3. Объём введения на одну мышь составлял 200 мкл раствора (1,56 мг полисахаридов и 1,14 мг белков). Использовали 2 схемы, или протокола, лечения животных: в первом случае субстанцию вводили подкожно на протяжении 4 нед с интервалом 2–3 сут (всего 11 инъекций). Во втором варианте, с использованием других животных с ксенографтами C33a, первоначально F-882 вводили подкожно в область расположения ксенографта в течение 2,5 нед, а затем вводили интратуморально на протяжении 1,5 нед с тем же интервалом (всего 10 инъекций). Возможность внутриопухолевого введения была обусловлена наличием достаточно больших объёмов опухолей. Животным контрольных групп в том же объёме и по той же схеме вводили воду для инъекций.
Статистические различия оценивали при помощи пакета программ STATISTICA 10. Полученные результаты выражали как среднее ± ошибка среднего.
Результаты
На первом этапе эксперимента по окончании введения исследуемого экстракта отмечено практически двукратное замедление роста опухолей в группе «F-882» (рис. 1). После 11 инъекций экстракта значение ТРО составило 50,6 %, а значения ИПО составляли 16,79 ± 3,24 в опытной группе и 68,84 ± 41,9 в контрольной группе. Таким образом, было отмечено ингибирующее воздействие экстракта мицелия F-882 на рост опухолей, которое, однако, не было статистически достоверным.
На втором этапе эксперимента, при изменении схемы введения с подкожного на комбинированную (4 подкожных инъекции в область опухолевого узла и 6 последующих введений в опухолевый узел) было обнаружено, что с 27-х сут от начала инъекций отличия в объёмах опухолей у животных из контрольной группы и группы «F-882» становились статистически значимыми (рис. 2).
Эффект введения F-882 на рост опухолевого узла далее сохранялся и усиливался до конца эксперимента. Показатель ТРО на 27-е сут составил 43,53 %. На 45-е сут (58-е сут от инокуляции опухолевых клеток) из эксперимента по биоэтическим нормам были выведены животные контрольной группы (n=6). На этот момент в группе «F-882» был зафиксирован максимальный терапевтический эффект со значением ТРО 58,7 %. Среднее значение ИПО контрольной группы на 45-е сут составляло 87,91 ± 25,54, при этом для группы «F-882» показатель был равен 38,47 ± 9,5. Таким образом, отличия средних объёмов опухолей в контрольной и опытной группе сохранялись достоверными на протяжении 2,5 нед после окончания инъекций исследуемой субстанции. Наблюдение за группой «F-882» было продолжено до 66-х (n=1), 72-х (n=2) и 87-х (n=3) сут от начала лечения (79-е, 85-е и 100-е сут от инокуляции опухолевых клеток). В указанные дни были зафиксированы максимально допустимые объёмы ксенографтов и осуществлена эвтаназия животных. На рис. 3 представлены фотографии животных из разных групп на 27-е сут от начала инъекций.
Впервые был обнаружен противоопухолевый эффект экстракта мицелия F-882 на подкожные ксенографты клеток C33a карциномы шейки матки человека. Полученные результаты показали, что комбинированное введение экстракта F-882 (подкожно и интратуморально) значительно замедляет рост ксенографтов даже после окончания инъекций. При этом показатель ТРО в период наблюдения последовательно увеличивался, изменившись со значения в 45,8 % до 58,7 % за 2,5 нед, что позволяет предположить накопительное действие исследуемого экстракта. Продолжительность жизни мышей, получавших F-882, была продлена на срок от 3 до 6 нед (индивидуально для каждого животного).
Обсуждение
Механизм противоопухолевого действия грибов довольно слабо изучен на данный момент. Существуют предположения о том, что БАВ грибов индуцируют экспрессию генов многих цитокининов, таким образом активизируя иммунную систему организма, оказывая протективное действие, без токсического воздействия на организм [16].
Непосредственно противоопухолевая активность экстракта мицелия F-882, возможно, связана с нарушением функций митохондрий, что приводит к снижению метаболизма и активации клеточной гибели. Данный факт, вероятно, указывает на единый механизм воздействия соединений из данного
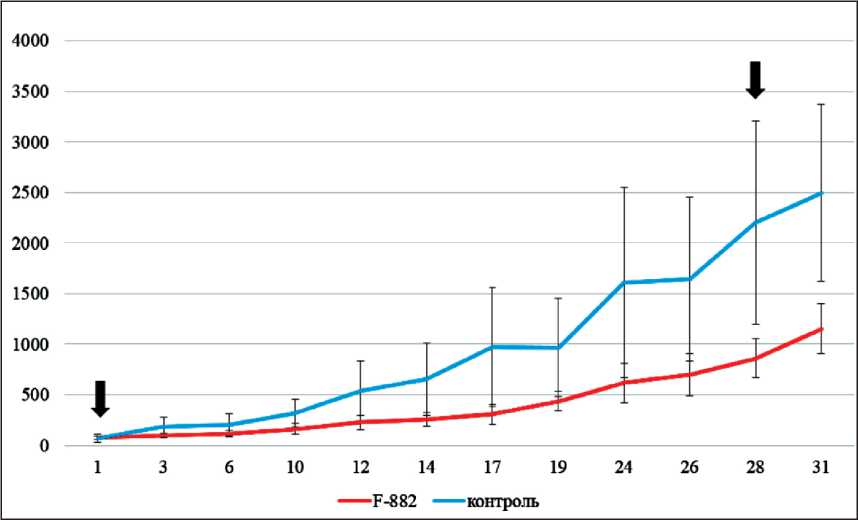
Рис. 1. Определение эффекта субстанции из мицелия F-882 на рост ксенографтов C33a у мышей SCID (подкожное введение). Примечание: по оси абсцисс представлены сут от начала инъекций, по оси ординат – средние объёмы ксенографтов в мм3; стрелками обозначены дни первой (1) и последней (28) инъекции препаратов; столбики представляют ± SE, n=3 (контроль), n=6 (F-882)
Fig. 1. Determination of the effects of the substance from mycelium F-882 on the growth of C33a xenografts in SCID mice (subcutaneous injection). Note: the abscissa axis represents the day after start of injections, and the ordinate axis represents the average xenograft volumes in mm3; the arrows indicate the days of the first (1) and last (28) days of injection of F-882 mycelium extract to animals; the bars represent ± SE, n=3 (control, blue curve), n=6 (experiment, red curve)
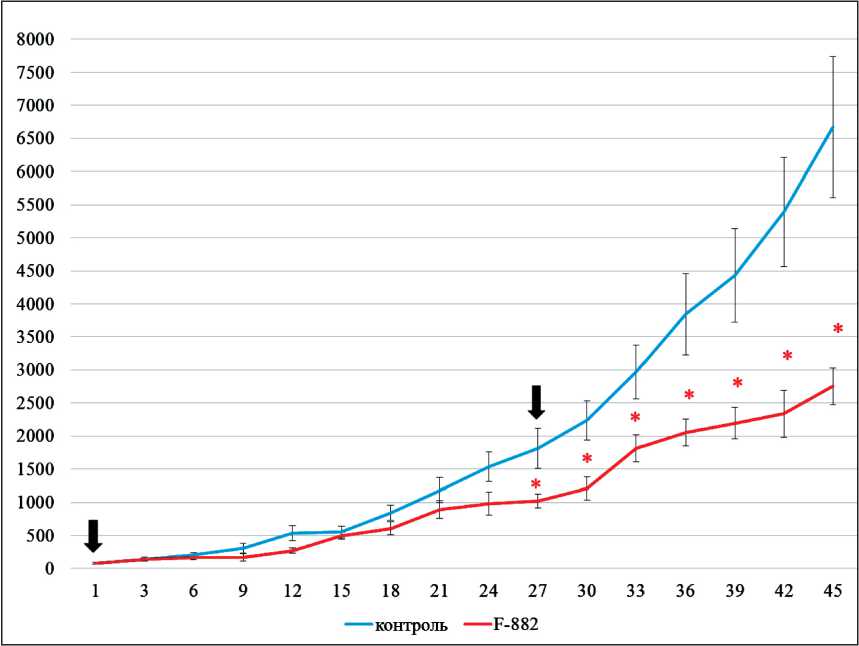
Рис. 2. Определение эффекта субстанции из мицелия F-882 на рост ксенографтов C33a у мышей SCID (комбинированное введение – подкожное и внутриопухолевое). Примечание: по оси абсцисс представлены сут от начала инъекций, по оси ординат – средние объёмы ксенографтов в мм3; стрелками обозначены дни первой (1) и последней (27) инъекции препаратов;
* – различия значимы по критерию Манна–Уитни при p<0,05, столбики представляют ± SE, n=6 (контроль), n=6 (F-882)
Fig. 2. Determination of the effects of the substance from mycelium F-882 on the growth of C33a xenografts in SCID mice (combined injection – subcutaneous and intratumoral). Note: the abscissa axis represents the day after start of injections, and the ordinate axis represents the average xenograft volumes in mm3; the arrows indicate the days of the first (1) and last (27) days of injection of F-882 mycelium extract to animals; * – the differences are significant by the Man-Whitney at p<0.05, bars represent ± SE, n=3 (control, blue curve), n=6 (experiment, red curve)
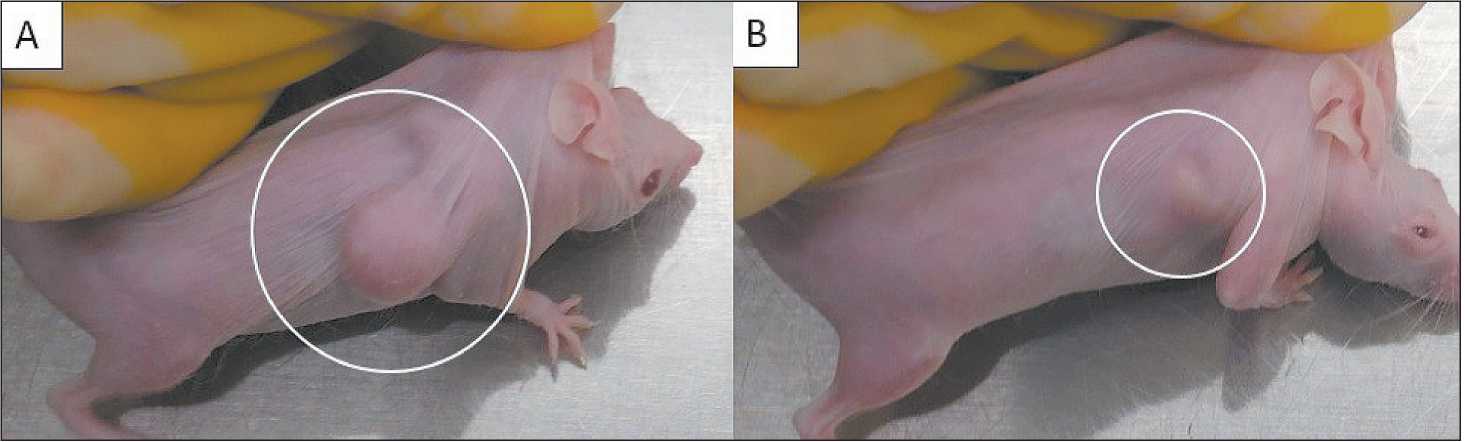
Рис. 3. Сравнение объёмов опухолей у животных из группы контроля (A) и группы «F-882» (B) на 27-е сут от начала инъекций, 40-е сут от инокуляции клеток C33a
Fig. 3. Comparison of tumor volumes in animals from the control (A) and «F-882» group (B) on the 27th day from the start of injection, 40 days from inoculation C33a
гриба на опухолевые клетки и вирусы. Наличие корреляции противоопухолевой и противовирусной активности соединений из грибов было показано в анализе исследований ГНЦ ВБ «Вектор» [9], а также публикаций российских и зарубежных авторов [17, 18]. Также предполагается влияние компонентов F-882 на уникальное метаболическое микроокружение опухолей, вносящее значительный вклад в процессы роста и метастазирования злокачественных образований [19, 20].
Список литературы Эффект экстракта мицелия Duddingtonia flagrans на подкожные ксенографты клеток C33A карциномы шейки матки человека
- БайрамоваГ.Р., ФайзуллинЛ.З., КорольковаА.И., ПолозниковАА, Киселев В.И. Скрининг рака шейки матки: что нового в мировой практике. Акушерство и гинекология. 2016; 7: 17-21 [Bayramova G.R., FayzullinL.Z., KorolkovaA.I., Poloznikov A.A., Kiselev V.I. Cervical cancer screening: what's new in world practice. Obstetrics and Gynecology. 2016; 7: 17-21. (in Russian)].
- World Health Organization. Global Health Observatory [Internet]. URL: https://www.who.int/health-topics/cancer#tab=tab_1. (cited 2020 May 03).
- Ветчинкина Е.П., Широков АА, Бучарская А.Б., Наволокин НА., Прилепский А.Ю., Буров А.М., Маслякова Г.Н., Никитина В.Е. Выявление противоопухолевой активности глубинного мицелия и плодовых тел базидиальных грибов. Успехи медицинской микологии. 2015; 14: 462-471. [Vetchinkina E.P., Shirokov A.A., Bucharskaya A.B., Navolokin N.A., Prilepsky A.Yu., Burov A.M., Maslyakova G.N., Nikitina V.E. Identification of antitumor activity of the deep mycelium and fruiting bodies of basidiomycetes. Successes of Medical Mycology. 2015; 14: 462-471. (in Russian)].
- Liskova A., Kubatka P., SamecM., Zubor P., MlyncekM., Bielik T., Samuel S.M., Zulli A., Kwon T.K., Busselberg D. Dietary Phytochemicals Targeting Cancer Stem Cells Molec. 2019; 24(5): 899. doi: 10.3390/ molecules24050899.
- MengX., LiangH., LuoL. Antitumor polysaccharides from mushrooms: a review on the structural characteristics, antitumor mechanisms and immunomodulating activities. Carbohydrate Res. 2016; 424: 30-41. doi: 10.1016/j.carres.2016.02.008.
- Chan J.S., Barseghyan G.S., Asatiani M.D., Wasser S.P. Chemical Composition and Medicinal Value of Fruiting Bodies and Submerged Cultured Mycelia of Caterpillar Medicinal Fungus Cordyceps militaris CBS-132098 (Ascomycetes). Int J Med Mushrooms. 2015; 17(7): 649-59. doi: 10.1615/intjmedmushrooms.v17.i7.50.
- Sangdee K., Buranrat B., Jaihan P., Thongchai S., Sangdee A. Evaluation of Antibacterial and Anticancer Activities of the Medicinal Fungus Ophiocordyceps sobolifera (Ascomycetes) from Thailand. Int J Med Mushrooms. 2018; 20(5): 471-484. doi: 10.1615/IntJMedMush-rooms.2018026247.
- Wijesekara I., Zhang C., Van Ta Q., Vo T.S., Li Y.X., Kim S.K. Phy-scion from marine-derived fungus Microsporum sp. induces apoptosis in human cervical carcinoma HeLa cells. Microbiol Res. 2014 Apr; 169(4): 255-61. doi: 10.1016/j.micres.2013.09.001.
- Теплякова Т.В., Косогова Т.А., Бардашева А.В. Корреляция противовирусной и противоопухолевой активностей водных экстрактов из базидиальных грибов. Успехи медицинской микологии. 2014; 12: 348-352. [Teplyakova T.V., Kosogova T.A., Bardasheva A.V. Correlation of antiviral and antitumor activities of aqueous extracts of basidiomycetes. Successes of Medical Mycology. 2014; 12: 348-52. (in Russian)].
- Buzatti A., de Paula Santos C., Fernandes M.A., Yoshitani U.Y., Sprenger L.K., dos Santos C.D., Molento M.B. Duddingtonia flagrans in the control of gastrointestinal nematodes of horses. Exp Parasitol. 2015 Dec; 159: 1-4. doi: 10.1016/j.exppara.2015.07.006.
- Теплякова Т.В., Репин В.Е., Рябчикова Е.И., Свириденко А.Н. Штамм гриба Duddingtonia flagrans, проявляющий свойства против галловых нематод растений и паразитических нематод животных и стимулирующий рост и развитие растений. Патент № 2003114166/13. Дата регистрации: 13.05.2003. Дата публикации: 10.06.2005. [Tepl-jakova T.V., Repin V.E., Rjabchikova E.I., Sviridenko A.N. Fungi strain Duddingtonia flagrans with activity against plant gall nematode and animal parasitic nematode, and stimulating of plant growth and development. Patent № 2003114166/13. Registration: 13.05.2003. Publication: 10.06.2005. (in Russian)].
- ИбрагимоваЖ.Б., АнанькоГ.Г., КостинаН.Е., Теплякова Т.В., Мазуркова Н.А. Токсичность и противовирусная активность экстрактов глубинного мицелия нематофагового гриба Duddingtonia flagrans в культуре клеток Vero. Бюллетень экспериментальной биологии и медицины. 2015; 8: 212-14. [Ibragimova Zh.B., Ananko G.G., Kostina N.E., Teplyakova T.V, Mazurkova N-А. Toxicity and antiviral activity of deep mycelium extracts of the nematophage fungus Duddingtonia flagrans in Vero cell culture. Bulletin of Experimental Biology and Medicine. 2015; 8: 212-14. (in Russian)].
- Теплякова Т.В., Косогова ТА, МазурковаН.А., ИбрагимоваЖ.Б., Гашникова Н.М., Ананько Г.Г., Булычев Л.Е., Ставский Е.А. Противовирусное средство на основе штамма нематофагового гриба Duddingtonia flagrans F-882. Патент № 216.012.271B. Дата регистрации: 20.02.2013. Дата публикации: 20.02.2013. [Teplyakova T.V., Kosogova T.A., Mazurkova N.A., Ibragimova Zh.B., Gashnikova N.M., Ananko G.G., Bulychev L.E., Stavsky E.A. Antiviral agent based on a strain of the nematophage fungus Duddingtonia flagrans F-882. Patent № 216.012.271B. Registration: 20.02.2013. Publication: 20.02.2013. (in Russian)].
- Tomayko M.M., Reynolds C.P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemother Pharmacol. 1989; 24(3): 148-54. doi: 10.1007/BF00300234.
- Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2005. 832 с. [KhabrievR.U. Guidelines for experimental (preclinical) study of new pharmacological substances. Moscow, 2005. 832 p. (in Russian)].
- Шамцян ММ., Галынкин В.А., ГарабаджиуА.В., Петрищев Н.Н. Изучение иммуномодулирующей и противоопухолевой активности высших грибов. Российский биотерапевтический журнал. 2012; 11(2): 62. [Shamtsyan M.M., Galynkin V.A., Garabadzhiu A.V., Petrishchev N.N. The study of immunomodulating and antitumor activity of higher fungi. Russian Biotherapeutic Journal. 2012; 11 (2): 62. (in Russian)].
- ПолковниковаМ.В., НосикН.Н., Гараев Т.М., КондрашинаН.Г., Финогенова М.П., Шибнев В.А. Изучение противогерпетических свойств экстрактов из березового гриба Inonotus obliquus (Противовирусная и противоопухолевая активность экстракта чаги). Вопросы вирусологии. 2014; 59(2): 45-48. [PolkovnikovaM.V., NosikN.N., Gara-ev T.M., Kondrashina N.G., Finogenova M.P., Shibnev V.A. The study of the antiherpetic properties of extracts from the birch fungus Inonotus obliquus (Antiviral and antitumor activity of chaga extract). Problems of Virology. 2014; 59(2): 45-48. (in Russian)].
- Wasser S.P. Medicinal Mushrooms in Human Clinical Studies. Part I. Anticancer, Oncoimmunological, and Immunomodulatory Activities: A Review. Int J Med Mushrooms. 2017; 19(4): 279-317. doi: 10.1615/ IntJMedMushrooms.v19.i4.10.
- Зибиров Р.Ф., Мозеров С.А. Характеристика клеточного микроокружения опухоли. Онкология. Журнал им. П.А. Герцена. 2018; 7(2): 67-72. doi: 10.17116/onkolog20187267-72. [Zibirov R.F., Moze-rovS.A. Characterization ofthe tumor cell microenvironment. P.A. Herzen. Journal of Oncology. 2018; 7 (2): 67-72. (in Russian)].
- Микроокружение опухоли и его компоненты - новые терапевтические мишени в онкологии. Молекулярная медицина. 2016; 14(5): 48. [The microenvironment of the tumor and its components are new therapeutic targets in oncology. Molecular Medicine. 2016; 14(5): 48. (in Russian)].


