Эффект резкого увеличения коэффициента центробежного разделения газовых смесей в неравновесных условиях
Автор: Григорьев Г.Ю., Максимычев А.В., Меньшиков Л.И., Меньшиков П.Л.
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Механика
Статья в выпуске: 1 (29) т.8, 2016 года.
Бесплатный доступ
Показано, что при приведении во вращательное движение струи, состоящей из смеси газов, коэффициент центробежного разделения газов сначала увеличивается, достигает максимума и далее уменьшается до стандартной величины, достигаемой в аппаратах по центробежному разделению при установившемся больцмановском равновесии. Величина коэффициента обогащения -1 в максимуме может превышать стандартное значение на порядок.
Центробежное разделение смесей газов, коэффициент разделения, диффузия и дрейф молекул
Короткий адрес: https://sciup.org/142186117
IDR: 142186117 | УДК: 533.27
Текст научной статьи Эффект резкого увеличения коэффициента центробежного разделения газовых смесей в неравновесных условиях
системе отсчёта, движущейся вместе со струёй газа, у внешней стенки преимущественно накапливаются более тяжёлые молекулы HfCU, поэтому доля X этих молекул во внутреннем потоке будет меньше их доли 1 — X во внешнем потоке, что обеспечивает эффект разделения, который будем характеризовать коэффициентом разделения а = (1 — X )/X> 1. (1)
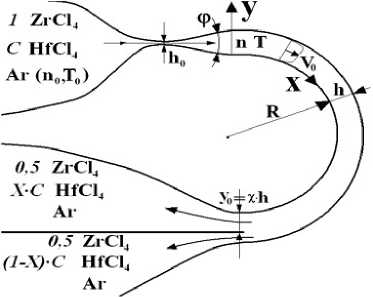
Рис. 1. Схема центробежного разделения ZrCl 4 и HfCl 4 в потоке газа-носителя (аргон), выходящем из щелевидного сопла в пространство, ограниченное концентрическими цилиндрическими поверхностями
-
2. Количественный анализ процессов
В аргоновой струе, движущейся со скоростью V y , происходит диффузия молекул-примесей с коэффициентом диффузии D. Струя движется по дуге окружности радиусом R, поэтому в системе покоя струи на молекулу массы М действует центробежная сила F = MV 02 /R. Под действием силы F молекулы дрейфуют к внешней стенке со скоростями V = цҒ и V = цҒ, где ц = D/Т и ц = D/T — подвижности молекул. Здесь и далее величины, относящиеся к более лёгким молекулам ZrCl 4 , будут снабжаться верхней чертой. Постоянная Больцмана полагается равной единице, то есть температура Т измеряется в единицах энергии. В системе покоя введём координатную систему F, у ' , где оси F и у ' направлены соответственно вдоль и поперёк движения струи. Координаты лабораторной системы связаны с ними соотношениями х = х' + V y t, у = у ’ . Изменение концентраций примесей п и п описывается уравнениями диффузии
Эп (Жуу^^) дау^^у^і) = дt + Әу' °
З у Ж'уу'^) = —D
дп^х^у^і) ду'
+ цҒп (х', у', t)
(уравнение для концентрации п (х, у, t) лёгких молекул записывается аналогично). Преобразуя уравнение к координатам лабораторной системы, получаем дп (х,у,і') дп (x,y,t) Эзу (х,у,€)
дt + V 0 дх + —ду— = °’
З у ( х, y ,t ) = —D
дп (х,у,1) ду'
+ цҒп (х,у,Ж .
с граничными условиями
n (0 , y) = 1 , n (0,y) = C,
—
—
З у (ж, 0) = З у ( ж , К ) = 0,
Некоторые обозначения приведены на рис. 1,
З у (ж, 0) = З у (ж, К) = 0.
D =
4п а г ст
/ гТ
V 2м
-
— коэффициент диффузии тяжёлых молекул ZrCl 4 и HfCl 4 в газе-носителе (см. [1], §12), вычисленный в приближении М , М ^ М а; , с = 5 • 10 15 см2 — сечение рассеяния атомов аргона на тяжёлых молекулах. Таким образом, в принятом здесь приближении D = D, д = Д. Далее,
паг ~ n A; ^К
-
— плотность атомов аргона в струе, n A ; — плотность атомов аргона в резервуаре (здесь и далее величины с верхним индексом нуль относятся к резервуару, без индекса — к расширившейся струе),
Т = Т о ( К Г
-
— температура в струе, Тд — температура в резервуаре. Установка по разделению должна иметь высокую производительность. По этой причине давление насыщенных паров в резервуаре не должно быть слишком низким, то есть величина Т д не должна быть слишком малой. С другой стороны, по техническим причинам она не должна быть слишком высокой. Из этих соображений выберем для последующих количественных оценок Т д = 500 К. Во избежание образования кластеров температура Т в струе не должна быть слишком низкой. Далее полагаем Т = 100 K, что соответствует һ д /һ = 0,089. Тогда для скорости струи и коэффициента диффузии молекул ZrCl 4 и HfCl 4 в аргоне в струе, движущейся по кругу, получаем оценки:
V) =
5Т д Ма;
1 - ( к Г
= 6 • 10 4 см/с,
3 • 10 19 см 2 n A ; [см - 3 ] с
.
Рассмотренное течение устойчиво по о тношению к развитию турбулентности при угле раствора диффузора (см. рис. 1) у < т^ЩЗ^ТЙ^К д ~ 0,3 радиана (см. [2], § 23). Здесь ж ~ 15 см 2 /с — кинематическая вязкость расширившейся струи.
Наряду с координатой ж, отсчитываемой от сопла вдоль движения струи, будем пользоваться временем t = ж/Й д движения газа от сопла до точки ж.
Диффузия и дрейф молекул характеризуются временами t oiF = K 2 /D и t dr = h/V . Их отношения для тяжёлых и лёгких молекул равны, соответственно,
3 = t 5iF = ғҒҺ = Ғһ ^ 1880 ', t DR D Т R
-
- t DIF дҒ һ Ғ Һ Һ д
-
3 = 1D7 = ТГ = - 1400R.
-
Начнём с рассмотрения поддающегося простому расчёту случая
3 » 1, 3 > 1.
В этом случае размеры диффузионного расплывания малы, поэтому профили концентраций выглядят примерно, как на рис. 2. Для определённости принято, что n (ж = 0, у) = 1/Һ, n (ж = 0,у) = C/h, поэтому r һ /*
/ Дуп(ж = 0,у) = 1, / dyn (ж = 0,у)=С.
J о Jo
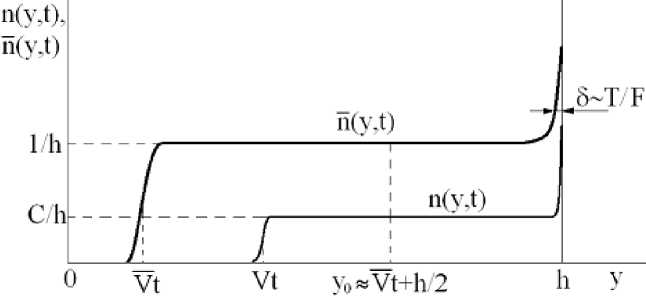
Рис. 2. Поперечные профили концентраций лёгких (п) и тяжёлых (п) молекул при t < t 1 = һ/ (2 V)
Молекулы не поглощаются стенками, поэтому, как следует из (2), эти соотношения выполняются для произвольного значения координаты ж:
N (ж, һ) = 1, N (ж, һ) = С,
где
Г У ГУ
N (ж,у) = dy' п ^-y^ , N (ж,у) = dy' п(ж,у') .
J о Jo
В случае (3) диффузией нельзя пренебречь по сравнению с дрейфом только вблизи внешней стенки в слое толщиной 5Т/D ^ һ, где между этими двумя процессами приближённо устанавливается равновесие: j y та 0, j y та 0 (далее будем его называть 5-слоем). Отсюда и из (2) заключаем, что вблизи внешней стенки
—
F п (ж,у) та dL • Т • еХР
[ ],
/ х ғ ғ (у - һ)
П (ж,у) та у н • Т • ехР ---- Т---- ,
где У L (ж) и у н (ж) — доли лёгких и тяжёлых молекул, находящихся в 5-слое.
2.1. Случай t < t 1 = h) (2 V )
Согласно (4) площади под кривыми на рис. 2 с течением времени остаются постоянными. Как пояснялось выше, граничная поверхность у о = у о (ж) определена так, что в областях 0 < у < у о и у о < у < һ находятся по 50% молекул ZrCU. Положение границы у о и величина X , необходимая для нахождения коэффициента разделения (1), вычисляются из совместного решения уравнений:
N (ж,уо) = 2 , X = N (у о ) /С.
При t < t 1 = һ/ (2V), как ясно из рис. 2, больше половины молекул ZrCU находятся в объёме, а в 5-слое их ещё меньше половины. Простой расчёт с использованием рис. 2 и уравнений (8), (9) даёт
у о та vt + һ/2,Х
1(1 -1)
һ , . т + 1
,Т =2 (V - V) >t 1 ,a ( t ) = Т — t.
Таким образом, с ростом t при t возрастает от значения a(0) = 1 до
<
t i = һ/ (2V) коэффициент разделения монотонно
a (t i )
т + ti _ 1
т - ti = 22йЛ 1 м
-
- =2,2. 1
2.2. Случай
t
1
Тяжёлые молекулы движутся к внешней стенке быстрее лёгких (V > V), поэтому они раньше лёгких оказываются в 5-слое: £2 < £3 = h/V. При £1 < £ < £2 = h/V граница у = уо расположена внутри 5-слоя, но в нём находятся ещё не все тяжёлые молекулы, а лишь часть их, равная ун ~ £/£2. (10)
Соответственно, доля лёгких молекул в 5-слое составляет
у - ~ £/£ 3 .
Из (5) и (6) получаем соотношение
Г Г n / TXT'!
1 - TV (ж, у) « у - • | 1 - exp [-------Л .
Отсюда и из (8) следует уравнение, определяющее положение граничной поверхности:
L [ғ (У о - h) ]1 1
y L • р - exp[ -^- ) = ,,
то есть
[F (уо - h) 1 1, , exP ------- = 1 - —.
L - J
Соответствующие соотношения для тяжёлых молекул получаются аналогично:
Г v I tv
1 -X = у н • ( 1 - exp [ ғ (у о - - К) ]} = у н • 1 - ( 1 - ^У - )
Отсюда и из (10), (11) следует, что во временном интервале £ 1 < £ < £ 2 коэффициент разделения (1) продолжает увеличиваться с ростом £. При £ = £ 2 все тяжёлые молекулы оказываются у внешней стенки (у н = 1), а часть лёгких молекул, равная 1 — у - = 1 — £ 2 /£ з = 1 — М/М = 0,27, ещё остаётся в объёме. В этот момент величина параметра X составляет
X = ( 1 - МfM =0,203
V 2М) ’
и коэффициент разделения достигает наибольшей величины a max = а (£ 2 ) ~ 4.
2.3. Случай t 2 < t < t 3
В этом интервале у н = 1, поэтому из (13) и (1) имеем
м
X . exp [ Ғ-И ] = ( , - 2L) м ,
_ 1 - X
= X
где у - ~ £/£ 3 . С ростом £ лёгкие молекулы поступают из объёма в 5-слой. Из-за возникающего разбавления коэффициент разделения монотонно уменьшается от величины a max до а (£ 3 ) = [1 - X (£ 3 )] /X (£ 3 ) « 1,59, где X (£ 3 ) = 2 - М/м ^ 0,386.
-
2.4. Случай t > t 3
В этом интервале оба типа молекул находятся в 5-слое, устанавливается равновесное состояние. Коэффициент разделения не меняется и равен стационарному значению а (£ 3 ) ~ 1,59.
Диффузионное расплывание границ понижает коэффициент разделения. Для учёта этого эффекта требуется выйти за рамки приближения (3) и решить уравнения (2) точно. Расчёт усложняется и поэтому вынесен в приложение. Результаты расчёта приведены на рис. 3 и 4. На рис. 4 используется безразмерная координата вдоль струи
^ _ 8 5 • 10 12 ж [ см ]
V q ^ 2 , П о [см - 3 ] ^ 2 [см]
ж ’
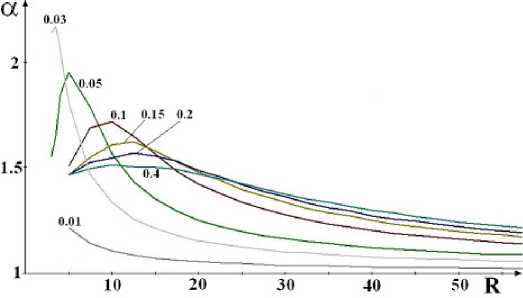
Рис. 3. Зависимость коэффициента разделения а от радиуса R концентрических цилиндрических поверхностей (см. рис. 1) при разных значениях безразмерной координаты ж ’ (указаны цифрами у кривых) для ширины щелевидного сопла һ о =0,05 см
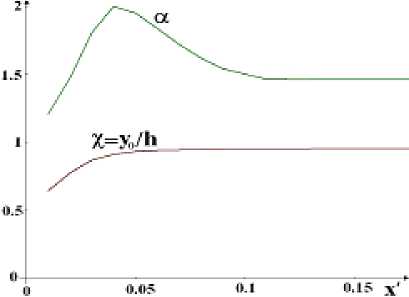
Рис. 4. Зависимость коэффициента разделения а и безразмерной координаты граничной поверхности х = У о /һ от безразмерной координаты вдоль струи ж ’ = жD /(V o h 2 ) при R = 5 см для ширины щелевидного сопла һ о = 0,05 см
-
3. Выбор оптимального режима разделения. Заключение
Как показано выше, с ростом координаты вдоль струи ж коэффициент разделения а проходит через максимум. Физическая причина состоит в том, что более тяжёлые молекулы HfCl 4 раньше подходят к внешней стенке, чем ZrCU. При дальнейшем увеличении ж к стенке приближаются уже газ более лёгких молекул. Происходит «разбавление» в нём более тяжёлых, что ведёт к уменьшению коэффициента разделения.
Пользуясь рис. 3 и 4, несложно установить приемлемые для практики параметры установки. При выборе учитываем кажущееся естественным конструктивное ограничение на длину дуги: ж < 2^R.
Струя малой плотности п ^ г ~ 2 • 10 18 см - 3 . При этом давление в камере-источнике струи составляет р ~ 0,3 атм, Һ д = 0,05 см, Һ = 0,5 см, п дг ~ 10 17 см - 3 , ж ’ = 0,03, ж = 17 см, R = 6 см, Т ~ 100 K, Т д = 500 K, х ~ 0,8. Коэффициент разделения порядка а ~ 2. Чтобы не усложнять изложение, мы не будем здесь употреблять строгое выражение Дирака для производительности Q установки по разделению. Вместо этого определим её не строго, но наглядно, а именно, как число молей ZrCU, освобождённых от примесей HfCU за одну секунду на одном сантиметре длины вдоль щелевидного сопла: Q та Һ д Ү д п ^ /А ~ 10 - 3 моль/см • с, где п ^ г ~ 2 • 10 17 см -3 — плотность молекул ZrCU в насыщенном паре в резервуаре, А = 6 • 10 23 моль - 1 — число Авогадро. Это не строгое, но наглядное определение годится при представляющих практический интерес достаточно больших значениях коэффициента разделения а > 1,5.
Струя высокой плотности п ^ г ~ 1 • 10 19 см - 3 . При этом давление в камере-источнике струи составляет р ~ 1,5 атм, Һ д = 0,05 см, Һ = 0,5 см, п дг ~ 5 • 10 17 см - 3 , ж ’ = 0,03, ж = 80 см, R = 20 см, Т ~ 100 K, Т д = 500 K, х ~ 0,65. Коэффициент разделения порядка а ~ 1,2, то есть при высокой плотности струи он мал.
Из приведённого анализа следует, что центробежное разделение смеси газов намного выгоднее производить в неустановившемся режиме течения струи. Полученные оценки указывают на перспективность и возможность практического применения изложенного метода.
Приложение
Решение уравнений (2) для молекул каждого вида находится по методу Фурье и имеет вид
D
П (ж,У) = ^2Ь 8 Ф 8 (7) exp ( — Л ^Һ 2 Ж ) ,
S = 1 ' /
Ь д =
Р
exp Р — 1,
p = ^ ф д ( y ) = exp (i7) ,ф ил = exP (It) sin (k s Һ + ^ s ) ,
, , ( 2ks X . , 2 , р2 , ks = ^s,ps = arctg I — I , Л5 = ks + —, Ь= =
2k s p [1 — ( — 1) S exp ( —р/ 2)]
Отсюда, а также из (8), (9), получаем уравнения для нахождения
л 3 / 2
величин х и X:
•
e 3x e 3
-
-
∞
1+^x/ 2 ^
S =1
k s ^ 1 — e 3/ 2 ( — 1) s ] e л = ж ’
sin (k s X) ,
X =
e ^x el3
-
-
∞
- + 2pe 3x/ 2 ^
S =1
k s [1
-
e 3/ 2 ( — 1) s l e л = ж ’
----------5--------------sin (ksx) •
(Л 5 ) 2 V
Список литературы Эффект резкого увеличения коэффициента центробежного разделения газовых смесей в неравновесных условиях
- Лифшиц Е.М., Питаевский Л.П. Физическая кинетика. М.: Наука, 1979
- Ландау Л.Д., Лифшиц Е.М. Гидродинамика. М.: Наука, 1986


