Эффективность адъювантной лучевой терапии в режиме гипофракционирования у больных операбельным раком молочной железы
Автор: Афонин Григорий Владиславович, Рагулин Юрий Александрович, Гулидов Игорь Александрович, Бекетов Евгений Евгеньевич, Каприн Андрей Дмитриевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.17, 2018 года.
Бесплатный доступ
Оценка различных режимов фракционирования послеоперационной лучевой терапии в составе комбинированного лечения рака молочной железы (РМЖ) является актуальной проблемой. Углубленное изучение вопроса позволит сформировать уточненные показания к использованию определенного режима лучевого лечения. цель исследования - оценка эффективности и безопасности методики гипофракционирования послеоперационной лучевой терапии РОД 2,7 Гр до СОД 40,5 Гр за 15 фракций в сравнении со стандартным режимом фракционирования. материал и методы. В исследование включена 321 пациентка с диагнозом рак молочной железы I-IIIA стадии, получавшая лечение в МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России с 2013 по 2017 г. В первой группе послеоперационная лучевая терапия проводилась в режиме гипофракционирования с РОД 2,7 Гр до СОД 40,5 Гр за 15 фракций (n=223), вторую группу составили больные, получившие лечение в стандартном режиме РОД 2 Гр до СОД 50 Гр за 25 фракций (n=98). Обе группы сопоставимы по стадии заболевания, молекулярно-биологическому подтипу опухоли. Проведен статистический анализ основных характеристик изучаемых режимов. Результаты. При анализе не выявлено значимых различий в показателях общей и безрецидивной выживаемости в исследуемых группах. Частота ранних лучевых осложнений I и II степени в исследуемой и контрольной группах оказалась сопоставима, 79 и 84 % соответственно. Поздние лучевые повреждения I и II степени развивались реже (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Лучевая терапия, гипофракционирование, рак молочной железы, адъювантное лечение
Короткий адрес: https://sciup.org/140254211
IDR: 140254211 | УДК: 618.19-006.6-08:615.849.1 | DOI: 10.21294/1814-4861-2018-17-5-37-44
Текст научной статьи Эффективность адъювантной лучевой терапии в режиме гипофракционирования у больных операбельным раком молочной железы
На протяжении длительного времени рак мо‑ лочной железы (РМЖ) остается одним из веду‑ щих заболеваний в структуре онкопатологии. По статистическим данным, в России на конец 2017 г. 669 636 больных находилось на учете в онкологи‑ ческих учреждениях с данным заболеванием. За последний год в нашей стране зарегистрировано 70 293 новых случая заболевания РМЖ. Индекс накопления контингента больных РМЖ растёт с каждым годом и, по последним данным, равен 10,3. У большинства (64,5 %) пациенток с диагнозом рак молочной железы используется комбинированный или комплексный метод лечения [1].
Лучевая терапия, наряду с хирургией и си‑ стемной лекарственной терапией, является неотъ‑ емлемым компонентом лечения операбельного РМЖ. По данным крупных международных ис‑ следований, послеоперационная лучевая терапия уменьшает вероятность локального рецидива как после органосохраняющих операций, так и после мастэктомий [2–5]. Учитывая высокую распро‑ страненность данного заболевания, необходима разработка новых методик лечения с целью повы‑ шения качества помощи больным.
Современные подходы к проведению после‑ операционной лучевой терапии РМЖ основаны на более широком использовании методик ги‑ пофракционирования, которые характеризуются уменьшением срока проводимого лучевого лечения за счет увеличения дневных разовых очаговых доз облучения. При подробном изучении методик гипофракционирования в сравнении с традици‑ онным режимом исследователями были показаны сопоставимые результаты общей и безрецидивной выживаемости [6–8]. Также режим гипофракцио‑ нирования не уступает конвенциональному режиму облучения по безопасности, качеству жизни и кос‑ метическим результатам при различных объёмах хирургического лечения, а, по данным некоторых исследований, является методом выбора [9–10]. В последних рекомендациях NCCN отдается предпо‑ чтение применению режимов гипофракциониро‑ вания. Дополнительное облучение ложа опухоли в дозе от 10 до 16 Гр за 4–8 фракций рекомендуется в группах высокого риска. Облучение грудной стенки реализуется в конвенциональном режиме [11]. Однако китайскими авторами в 2017 г. были представлены результаты рандомизированного исследования по изучению ускоренного режи‑ ма в СОД 43,5 Гр за 15 фракций в сравнении со стандартным фракционированием у пациенток высокой группы риска, преимущественно с III стадией заболевания, получивших хирургическое лечение в объёме РМЭ. Лучевая терапия проводи‑ лась на грудную стенку и надключичную область с использованием 2D планирования. Полученные результаты пятилетнего наблюдения не показали различий в показателях общей и безрецидивной выживаемости. Также исследуемые группы оказа‑ лись сопоставимы по количеству ранних и поздних лучевых осложнений. Лишь ранняя токсичность III степени оказалась менее выражена в исследуемой группе [12]. В свою очередь, европейские коллеги рекомендуют ускоренные режимы облучения лишь у пациенток старше 50 лет без поражения лимфо‑ узлов. Использование гипофракционирования у пациенток, перенесших мастэктомию, и проведе‑ ние облучения регионарных лимфоколлекторов остаются под вопросом [13].
Таким образом, в настоящее время нет одно‑ значной позиции в данной проблеме. Показания к проведению послеоперационной лучевой терапии в режиме гипофракционирования различаются в зависимости от стадии заболевания, возраста па‑ циенток, объёма хирургического лечения и полей облучения.
Цель исследования – оценка эффективности и безопасности методики гипофракционирования послеоперационной лучевой терапии РОД 2,7 Гр до СОД 40,5 Гр за 15 фракций в сравнении со стан‑ дартным режимом фракционирования.
Материал и методы
Материалом исследования послужила медицин‑ ская документация 321 больной раком молочной железы I–IIIA стадии, которые получали лечение в МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России с 2013 по 2017 г. Из них в составе комбинированного и комплекс‑ ного лечения послеоперационный курс лучевой терапии в режиме гипофракционирования до СОД 40,5 Гр в РОД 2,7 Гр облучения получили 223 паци‑ ентки. Лучевая терапия в контрольной группе про‑ водилась в конвенциональном режиме: РОД 2 Гр до
СОД 50 Гр в 25 фракций (n=98). Лечение в обеих группах проводилось 5 раз в неделю. Общая про‑ должительность лучевой терапии в исследуемой группе составила 15 рабочих дней, в контрольной группе на 10 рабочих дней больше.
Распространенность опухолевого процесса оценивали по данным осмотра, пальпации, мам‑ мографии, ультразвукового исследования. Во всех случаях диагноз подтвержден морфологически, проведено иммуногистохимическое исследование и определен молекулярный подтип опухоли. В обе‑ их исследуемых группах преобладал люминальный тип А опухоли (табл. 1).
Для исключения отдаленных метастазов всем больным проводилась рентгенография органов грудной клетки, остеосцинтиграфия, ультразву‑ ковое исследование органов брюшной полости, органов малого таза. По показаниям выполнялись ПЭТ/КТ, МРТ, СКТ. Опухолевый процесс стади‑ ровали по международной классификации TNM (7‑е издание, 2010). В исследование включались больные, получившие как органосохраняющее лечение (радикальные резекции, онкопластические резекции, подкожные мастэктомии с применени‑ ем эспандеров и имплантов), так и перенесшие радикальную мастэктомию с сохранением малой и большой грудной мышц. Соотношение орга‑ носохраняющих операций и РМЭ: исследуемая группа – 70/30 %, контрольная группа – 49/51 %. Системная терапия проводилась согласно отече‑ ственным и международным рекомендациям с учетом молекулярного типа опухоли, возраста пациентки и стадии заболевания.
При проведении лучевой терапии использо‑ вались линейные ускорители электронов Philips SL‑75 и SL‑20. Стандартная подготовка включала в себя КТ‑топометрию и дозиметрическое 2D‑ планирование лучевой терапии в системе «ROCS» для линейных ускорителей с энергией фотонов 6 МэВ. Лучевое воздействие на зоны регионарного метастазирования проводили в соответствии с оте‑ чественными и зарубежными рекомендациями.
Оценка острых лучевых реакций выполнялась в соответствии с критериями CTCAE v.4.03 [14]. Поздние лучевые повреждения ранжировались по шкале LENT SOMA [15].
таблица 1
Распределение РМЖ по молекулярному типу в группах
|
Режим лучевой терапии |
Молекулярный тип РМЖ Люминальный В Трижды‑ Всего Люминальный А Her2+ Her2‑ Her2+ негативный |
|
РОД 2 Гр, СОД 50 Гр РОД 2,7 Гр, СОД 40,5 Гр |
51 18 23 2 4 (52 %) (18,4 %) (23,5 %) (2 %) (4,1 %) 98 103 52 26 9 33 (46,2 %) (23,3 %) (11,7 %) (4 %) (14,8 %) 223 |
|
Итого |
154 70 49 11 37 (48 %) (21,8 %) (15,3 %) (3,4 %) (11,5 %) 321 |
Òàблицà 2
Ðàñпðåдåлåниå бîльныõ ÐMÆ пî ñтàдии зàбîлåвàния в гðóппàõ
|
Режим лучевой терапии |
Стадия заболевания |
Всего |
|||
|
IA |
IIA |
IIB |
IIIA |
||
|
РОД 2 Гр, |
19 |
22 |
37 |
20 |
98 |
|
СОД 50 Гр |
(19,4 %) |
(22,4 %) |
(37,8 %) |
(20,4 %) |
|
|
РОД 2,7 Гр, |
68 |
63 |
41 |
51 |
223 |
|
СОД 40,5 Гр |
(30,5 %) |
(28,2 %) |
(18,4 %) |
(22,9 %) |
|
|
Итого |
87 |
85 |
78 |
71 |
321 |
|
(27,1 %) |
(26,5 %) |
(24,3 %) |
(22,1 %) |
||
Статистическая обработка проводилась при помощи общепринятых статистических методик. Накопление, хранение и обработку информации проводили на персональном компьютере с помо‑ щью электронных таблиц Microsoft Excel. Выжи‑ ваемость больных оценивали методом Каплана – Майера. Сравнение кривых выживаемости прово‑ дили с помощью лог‑рангового критерия (log‑rank test). Оценка ранних и поздних лучевых реакций проводилась при помощи непараметрического критерия U Манна – Уитни. Различия считались статистически значимыми при р<0,05. Статисти‑ ческую обработку проводили в программе SPSS версии 22.
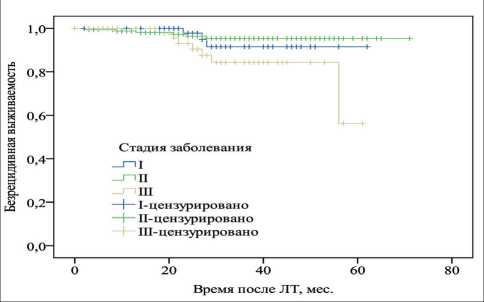
Рис. 1. Безрецидивная выживаемость в зависимости от стадии заболевания
Результаты
Проведен анализ данных по общей и без‑ рецидивной выживаемости с учетом стадии за‑ болевания, распределение больных по стадиям представлено в табл. 2. Отмечено отсутствие различий по общей выживаемости в исследуемых группах. В случае безрецидивной выживаемости пациентки с IIIА стадией заболевания показали худший прогноз заболевания по сравнению с другими стадиями. Применение логрангового критерия указывает на наличие статистически зна‑ чимого различия между II и III стадиями (p<0,05). При этом показатели больных РМЖ I и II стадий достоверно не отличались (p=0,17) (рис. 1).
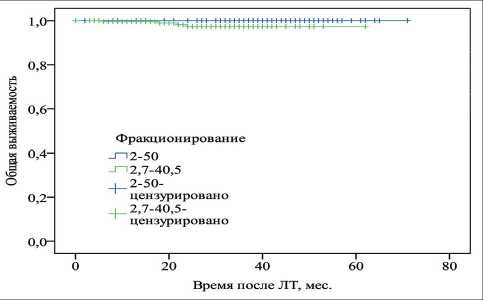
Рис. 2. Общая выживаемость в зависимости от режима фракционирования
Проведенный анализ продемонстрировал рав‑ нозначную эффективность методик по показателям выживаемости, поскольку фракционирование ЛТ не оказало достоверного влияния на исход лечения как в отношении общей (p=0,11), так и безрецидив‑ ной (p=0,17) выживаемости (рис. 2, 3).
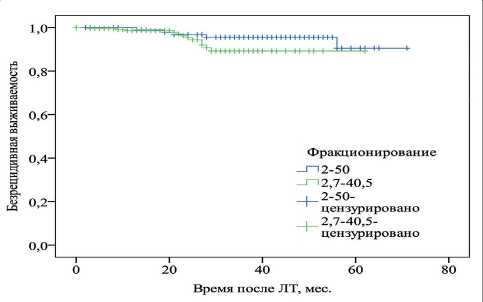
Рис. 3. Безрецидивная выживаемость в зависимости от режима фракционирования
Также проведено сравнение общей и безреци‑ дивной выживаемости пациентов с различным молекулярно‑биологическим подтипом опухоли. Согласно данным логрангового критерия, для пациентов с тройным негативным подтипом опухоли в обеих группах была характерна более низкая общая (p<0,05) и безрецидивная (p<0,01) выживаемость, чем в случае других подтипов новообразований (рис. 4, 5).
При оценке хирургического этапа в лечении данного контингента больных отмечено, что вид проведенной операции (РМЭ или органосохра‑ няющее лечение) не оказывал влияния на исход
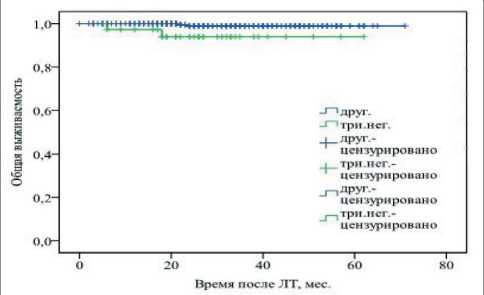
Рис. 4. Общая выживаемость в зависимости от молекулярного типа опухоли
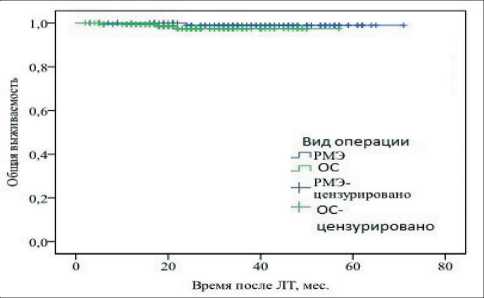
Рис. 6. Общая выживаемость в зависимости от вида проведенной операции
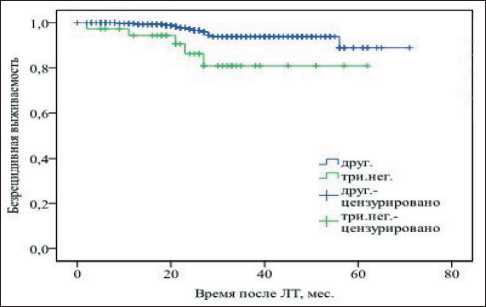
Рис. 5. Безрецидивная выживаемость в зависимости от молекулярного типа опухоли
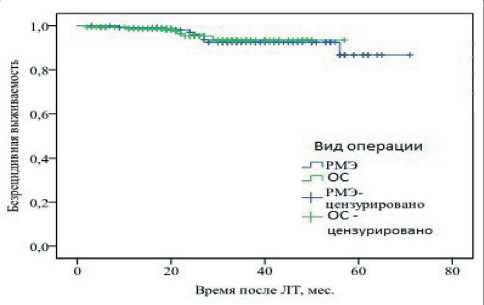
Рис. 7. Безрецидивная выживаемость в зависимости от вида проведенной операции
лечения. Этот вывод подтверждается применением логрангового критерия к кривым общей (p=0,34) и безрецидивной (p=0,89) выживаемости (рис. 6, 7).
Проведена оценка ранних и поздних лучевых осложнений. В обеих исследуемых группах наи‑ более часто проявляемой ранней лучевой ток‑ сичностью являлся радиоэпидермит I степени. Поздние лучевые повреждения преимущественно представлены фиброзом подкожной клетчатки и отдельными случаями телеангиоэктазий. Анализ ранних и поздних лучевых осложнений, прово‑ димый с помощью непараметрического критерия U Манна – Уитни, показывает статистически зна‑ чимое снижение поздних лучевых повреждений в группе гипофракционирования с РОД 2,7 Гр и СОД 40,5 Гр. по сравнению с конвенциональным режимом (табл. 3). Проведенный анализ показал, что применение режима фракционирования с бо‑ лее высокой разовой дозой облучения и меньшей суммарной очаговой дозой позволяет достоверно снизить частоту поздних лучевых реакций при одинаковом уровне общей и безрецидивной вы‑ живаемости пациенток.
Обсуждение
Таким образом, проведённое исследование по изучению послеоперационной лучевой терапии в режиме гипофракционирования в сравнении с конвенциональным режимом демонстрирует со‑ поставимые результаты по основным онкологиче‑ ским показателям. Режим гипофракционирования лучевой терапии ассоциирован с более низким уровнем поздних лучевых осложнений при равном количестве острых лучевых реакций. Полученные таблица 3
Частота ранних и поздних лучевых осложнений
Рак молочной железы имеет относительно низкое значение отношения α/β (α/β=2,88 (0,75–5,01) Гр), сопоставимое с нормальной тканью молочной же‑ лезы, и является чувствительным к величине РОД [19]. Поэтому проведение лучевой терапии укруп‑ ненными фракциями с меньшей СОД не должно сопровождаться увеличением количества поздних лучевых повреждений относительно стандартного режима фракционирования при сопоставимых по‑ казателях локального контроля.
Опыт зарубежных коллег демонстрирует раз‑ нонаправленные результаты в отношении поздней лучевой токсичности. Отдельные крупные рандо‑ мизированные исследования показывают сопо‑ ставимые результаты относительно локального контроля и поздних лучевых повреждений, при достоверном снижении острой лучевой токсич‑ ности [10]. Но существуют работы, показавшие преимущество использования методики гипоф‑
Список литературы Эффективность адъювантной лучевой терапии в режиме гипофракционирования у больных операбельным раком молочной железы
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2017 году. М., 2018. 21, 30, 31, 155, 157. [Kaprin A.D., Starinsky V.V., Petrova G.V. The state of oncological care for the population of Russia in 2017. Moscow, 2018. 21, 30, 31, 155, 157. (in Russian)].
- Early Breast Cancer Trialists’ Collaborative Group (EBCTCG), Darby S., McGale P., Correa C., Taylor C., Arriagada R., Clarke M., Cutter D., Davies C., Ewertz M., Godwin J., Gray R., Pierce L., Whelan T., Wang Y., Peto R. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet. 2011 Nov 12; 378 (9804): 1707-16. DOI: 10.1016/S0140-6736(11)61629-2
- EBCTCG (Early Breast Cancer Trialists' Collaborative Group), McGale P., Taylor C., Correa C., Cutter D., Duane F., Ewertz M., Gray R., Mannu G., Peto R., Whelan T., Wang Y., Wang Z., Darby S. Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality: meta-analysis of individual patient data for 8135 women in 22 randomised trials. Lancet. 2014 Jun 21; 383 (9935): 2127-35. DOI: 10.1016/S0140-6736(14)60488-8
- Blamey R.W., Bates T., Chetty U., Duffy S.W., Ellis I.O., George D., Mallon E., Mitchell M.J., Monypenny I., Morgan D.A., Macmillan R.D., Patnick J., Pinder S.E. Radiotherapy or tamoxifen after conserving surgery for breast cancers of excellent prognosis: British Association of Surgical Oncology (BASO) II trial. Eur J Cancer. 2013 Jul; 49 (10): 2294-302. DOI: 10.1016/j.ejca.2013.02.031
- Kunkler I.H., Williams L.J., Jack W.J., Cameron D.A., Dixon J.M.; PRIME II investigators. PRIME II investigators. Breast-conserving surgery with or without irradiation in women aged 65 years or older with early breast cancer (PRIME II): a randomised controlled trial. Lancet Oncol. 2015 Mar; 16 (3): 266-73. DOI: 10.1016/S1470-2045(14)71221-5


