Эффективность двухкомпонентного режима индукционной химиотерапии при лечении ВПЧ-позитивного плоскоклеточного рака ротоглотки
Автор: Голубев П.В., Болотина Л.В., Геворков А.Р., Дешкина Т.И., Бойко А.В., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.22, 2023 года.
Бесплатный доступ
Учитывая благоприятный прогноз течения заболевания у пациентов с ВПЧ-ассоциированным раком ротоглотки, активно обсуждается вопрос о возможности редукции объема лечения для данной когорты больных. В данной статье представлены промежуточные результаты собственного исследования, направленного на изучение возможности успешного применения двукомпонентного режима ИХТ по схеме ТР. Цель исследования - оценить результаты лечения местнораспространенного ВПЧ-позитивного плоскоклеточного рака ротоглотки путем оптимизации режима индукционной химиотерапии, в частности использования двухкомпонентной схемы. материал и методы. С 2021 г. в исследование включено 27 пациентов с местнораспространенным ВПЧ-позитивным плоскоклеточным раком ротоглотки (T3-4N0-1 либо T1-4N2-3), которым на первом этапе комбинированного лечения проводилось 3 курса ИХТ по схеме ТР. Для оценки эффективности и токсичности двухкомпонентной схемы ИХТ сформирована контрольная группа, получающая стандартный режим ИХТ по схеме TPF. Результаты. В настоящий момент проведена оценка объективного ответа для всех больных исследуемой и контрольной групп. Контроль над заболеванием достигнут у 100 % пациентов обеих групп. В исследуемой группе: полный ответ по первичной опухоли и лимфатическим узлам получен у 3 (11 %), частичный ответ - у 17 (63 %), стабилизация - у 7 (26 %) больных. В группе контроля: полный ответ по первичной опухоли и лимфатическим узлам отмечен у 4 (20 %), частичный ответ - у 13 (60 %), стабилизация - у 4 (20 %) пациентов. Медиана времени наблюдения в исследуемой группе составляет 9 мес (от 2 до 22 мес). Показатель 1-годичной ВБП оценен для 15 больных и составил 88,2 %, ОВ - 100 %. Медиана времени наблюдения для группы контроля составляет 12 мес (от 5 до 22 мес), при этом ОВ - 100 %, 1-годичная ВБП (17 пациентов) - 84,4 %. заключение. Исследовательский двухкомпонентный режим ИХТ продемонстрировал высокие показатели объективного ответа, 1-годичной общей и безрецидивной выживаемости, сопоставимые со стандартной схемой TPF.
Плоскоклеточный рак ротоглотки, вирус папилломы человека, индукционная химиотерапия, токсичность, выживаемость
Короткий адрес: https://sciup.org/140300162
IDR: 140300162 | УДК: 616.31+616.321]-006.61-08:615.28 | DOI: 10.21294/1814-4861-2023-22-2-26-33
Текст научной статьи Эффективность двухкомпонентного режима индукционной химиотерапии при лечении ВПЧ-позитивного плоскоклеточного рака ротоглотки
Лечение больных плоскоклеточным раком органов головы и шеи является актуальной проблемой современной онкологии. Согласно данным GLOBOCAN, в 2020 г. в мире выявлено 98 412 новых случаев злокачественных новообразований (ЗНО) орофарингеальной области (ОФО). Заболеваемость раком ротоглотки в мире составляет 1,1 на 100 000 населения, смертность – 0,51. Для нашей страны эти показатели несколько выше и определяются на уровне 1,8 на 100 000 населения и 0,82 соответственно. В то же время, несмотря на визуальную локализацию, порядка 80 % пациентов на момент первичного обращения к врачу имеют уже местнораспространенный процесс [1, 2].
Согласно современным данным, в 25–30 % случаев опухоли головы и шеи (ОГШ) ассоциированы с вирусом папилломы человека (ВПЧ). Частота ассоциации различается в зависимости от локализации опухолевого процесса. Наиболее высокий показатель наблюдается при раке ротоглотки –
40–60 % [3–6]. Наименьший – при опухолях полости рта (от 5,8 до 23,5 %), гортани (от 3,3 до 24 %) и мягкого неба (до 3,1 %) [3, 4, 7]. Существует и географическая неоднородность распространенности ВПЧ при ОГШ. Так, в США 59,3 % опухолей ротоглотки ассоциированы с ВПЧ, в то время как в Европе данный показатель составляет 31,1 %, а в странах Южной Америки – 4,1 %. [3, 8]. Известно около 120 генотипов ВПЧ [9]. Но подавляющее большинство ВПЧ-положительных раков ротоглотки (83 %) приходится на 16-й тип [10].
Не остается сомнений в том, что опухоли с ВПЧ-положительным и отрицательным статусом стоит рассматривать как 2 различные подгруппы рака ротоглотки. ВПЧ-ассоциированные опухоли ротоглотки имеют ряд особенностей как в показателях выживаемости, так и в течении самого онкологического процесса. Показано, что у пациентов с ВПЧ-позитивным плоскоклеточным раком ротоглотки 5-летняя общая выживаемость (ОВ) составляет 81 %, выживаемость без прогресси- рования (ВБП) – 76 %. Для ВПЧ-негативных – 48 и 46 % соответственно. Кроме того, для ВПЧ-ассоциированных опухолей характерны массивное поражение регионарного лимфоколлектора при относительно небольшом размере первичного очага, а также высокая чувствительность к консервативным методам лечения. Данная гетерогенность нашла свое отражение и в 8-й классификации TNM, где данные биологические типы рака ротоглотки имеют индивидуальное стадирование. Без сомнений можно утверждать, что ВПЧ является благоприятным прогностическим фактором течения заболевания [11–15].
Согласно современным клиническим рекомендациям, больные с положительным и отрицательным ВПЧ-статусом не имеют различий в тактике лечения. Им могут быть предложены лучевая терапия (ЛТ), хирургическое вмешательство, а у пациентов с массивным местнораспространенным процессом оправдан комбинированный подход [16–18]. Одним из эффективных вариантов является применение на первом этапе индукционной химиотерапии (ИХТ), позволяющей добиться контроля опухолевого роста не только в области первичного очага и регионарных лимфатических узлов, но и в зонах субклинического отдаленного метастазирования, а также реализовать у погранично курабельных пациентов на втором этапе химиолучевую терапию (ХЛТ) [19, 20].
Учитывая благоприятный прогноз течения заболевания у пациентов с ВПЧ-ассоциированным раком ротоглотки, активно обсуждается вопрос о возможности редукции объема лечения для данной когорты больных [21–23]. В настоящее время все чаще публикуются результаты исследований, которые демонстрируют возможность деэскалации объема лечения без снижения показателей выживаемости. Так, в исследовании II фазы «OPTIMA» (NCT02258659), включавшем 62 пациента с ВПЧ-позитивным местнораспространенным плоскоклеточным раком ОФО, было показано, что редукция объема ХЛТ со снижением дозы или отказом от радиомодификации после проведенной ИХТ не привела к снижению показателей общей и безрецидивной выживаемости [24]. В текущем году коллективом авторов из США опубликованы результаты собственного исследования, которые также продемонстрировали возможность деэскалации дозы и уменьшения полей облучения при ХЛТ местнораспространенного плоскоклеточного рака ротоглотки без снижения показателей выживаемости [22].
К сожалению, данных о возможности редукции объема индукционной химиотерапии при комбинированном лечении ВПЧ-ассоциированного плоскоклеточного рака ротоглотки не опубликовано. Согласно отечественным и зарубежным клиническим рекомендациям для пациентов с ОГШ может быть предложена единственная схема химиотерапии на этапе индукции – TPF (доцетаксел – 75 мг/м2, цисплатин – 75–100мг/м2 и 96-часовая внутривенная инфузия 5-фторурацила в дозе 1000мг/м2/сут) [25, 26]. Данный режим является крайне токсичным. По данным ряда авторов, частота нейтропении и лейкопении III–IV степени достигает 79 %, а фебрильная нейтропения регистрируется у 15 % больных, что требует обязательного профилактического введения гранулоцитарного колониестимулирующого фактора (Г-КСФ). Кроме этого, отмечается частая гастроинтестинальная и нефрологическая токсичность значимых степеней, в связи с чем данная схема может быть предложена далеко не всем больным [27].
Учитывая отсутствие в мировой практике убедительных данных о возможности безопасной деэскалации объема ИХТ, высокую токсичность существующего режима, а также наличие благоприятного прогностического фактора (ВПЧ-инфекции), в отделении химиотерапии МНИОИ им. П.А. Герцена с 2021 г. стартовало проспективное исследование, направленное на изучение возможности применения двукомпонентного режима ИХТ. Нами предложена деэскалированная схема ТР (доцетаксел – 75 мг/м2 + цисплатин – 75 мг/м2, цикл 21 день), т.е. режим с исключением длительных 96-часовых инфузий 5-фторурацила.
Целью исследования является улучшение результатов лечения пациентов с местнораспространенным ВПЧ-позитивным плоскоклеточным раком ротоглотки путем оптимизации режима индукционной химиотерапии, в частности, использования двухкомпонентной схемы, что дает возможность снизить токсичность лечения без потери его эффективности.
В данной статье мы представляем промежуточные результаты исследования, а именно: частоту объективного ответа (ЧОО) ИХТ по схеме ТР, токсичность на фоне ИХТ, а также 1-годичные показатели общей и безрецидивной выживаемости.
Материал и методы
С 2021 г. в исследование включено 27 пациентов с местнораспространенным ВПЧ-позитивным плоскоклеточным раком ротоглотки (T3–4N0–1M0 либо T1–4N2–3M0). Все пациенты подписали добровольное информированное согласие на участие в настоящем исследовании. Исследование одобрено локальным этическим комитетом МНИОИ им П.А. Герцена.
Медиана возраста пациентов составила 54 года. Доля мужчин – 75 %, женщин – 25 %. Все пациенты на момент проведения лечения имели удовлетворительный соматический статус (ECOG 0–1). Практически половина больных (43 %) имели в анамнезе длительный стаж курения. Обращает на себя внимание, что у большей части пациентов (87 %) отмечалось метастатическое поражение регионарного лимфоколлектора, при этом наиболь-
Òàблицà /Table
Õàðàêтåðиñтиêà пàциåнтîв, вêлючåнныõ в иññлåдîвàниå
Patient characteristics enrolled in the trial
Пациентам исследуемой группы на первом этапе комбинированного лечения проводилось 3 курса ИХТ по схеме ТР: доцетаксел – 75 мг/м2 + цисплатин – 75 мг/м2, цикл 21 день, с последующей первичной профилактикой нейтропении путем введения Г-КСФ. Больным контрольной группы проводилось 3 курса ИХТ по схеме ТРF: доцетаксел – 75 мг/м2 + цисплатин – 75 мг/м2 + 5-фторурацил – 1000 мг/м2/сут 1–4-й дни, цикл 21 день, с последующим профилактическим введением Г-КСФ. На втором этапе комбинированного лечения пациентам обеих групп проведена стандартная ХЛТ СОД 66–70 Гр, на фоне радиомодификации карбоплатином AUC 1,5–2,0, еженедельно.
Результаты
В настоящий момент проведена оценка объективного ответа для всех больных исследовательской и контрольной групп. Контроль над заболеванием (полный ответ + частичный ответ + стабилизация) достигнут у 100 % пациентов обеих групп.
Объективный ответ оценивался по критериям RECIST 1.1 с использованием инструментальных методов диагностики.
В исследуемой группе: полный ответ со стороны первичной опухоли и лимфатических узлов отмечен у 3 (11 %), частичный ответ – у 17 (63 %), стабилизация – у 7 (26 %) больных. Следует отметить, что при частичном ответе у 3 пациентов отмечен полный ответ по первичному очагу и частичный ответ по лимфатическим узлам, у 2 больных – полная резорбция лимфоузлов и частичный ответ по первичному очагу. У одного пациента после завершения первого этапа комбинированного лечения зафиксировано увеличение размеров опухоли на 10 %, что соответствует стабилизации по критериям RECIST 1.1. Однако, учитывая большую начальную распространенность опухолевого процесса, а также рост образования на фоне лечения, в проведении химиолучевой терапии ему отказано. Пациент завершил участие в исследовании, ему назначена 2-я линия лекарственного лечения ингибиторами контрольных точек иммунного ответа (рис. 1).
В группе контроля: полный ответ по первичной опухоли и лимфатическим узлам отмечен у 4 (20 %), частичный ответ – у 13 (60 %), стабилизация – у 4 (20 %) пациентов. При частичном ответе у 3 пациентов отмечен полный ответ по первичной опухоли и частичный ответ по лимфатическим узлам, у 1 пациента – полная резорбция лимфоузлов и частичный ответ по первичному очагу (рис. 2).
Оценка токсичности проводилась по шкалам CTC – NCIC V5.0. Всем пациентам через 24–72 ч
Объективный ответ после проведенной ИХТ по критериям RECIST 1.1 Objective response rate after IC by RECIST 1.1
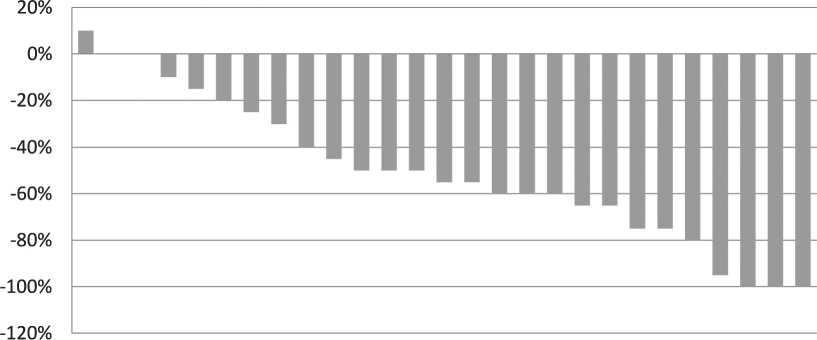
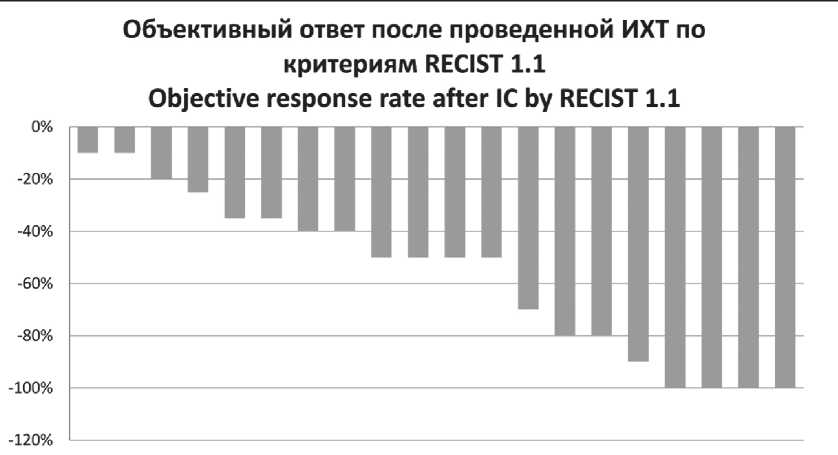
Рис. 1. Объективный ответ после ИХТ в исследуемой группе
Fig. 1. Objective response rate after IC in the research arm
Рис. 2. Объективный ответ после ИХТ в контрольной группе
Fig. 2. Objective response rate after ICH in the control arm после завершения каждого курса ИХТ проводилась первичная профилактика Г-КСФ (филграстим) 5 мг/кг 1 раз в сут до достижения уровня нейтрофилов 10×109/л. На этом фоне не отмечено ни одного случая фебрильной нейтропении в обеих группах, однако в группе контроля, несмотря на первичную профилактику Г-КСФ, у 1 (5 %) пациента к началу очередного курса отмечалась нейтропения III степени, что потребовало увеличения длительности межкурсового интервала. Анемия I–II степени наблюдалась у 8 (29 %) пациентов исследуемой и у 10 (50 %) больных контрольной группы, тромбоцитопения I степени – у 3 (11 %) и 5 (25 %) пациентов, мукозит I–II степени – у 4 (22 %) и 6 пациентов (30 %) соответственно. У 2 (10 %) больных группы контроля отмечалось развитие мукозита III степени. Кроме этого, у пациентов контрольной группы (n=10, 50 %) чаще фиксировалась астения I–II степени по сравнению с исследуемой (n=6, 22 %). Явления астении III степени наблюдались у 4 (20 %) пациентов контрольной группы и ни у одного из больных, получавших экспериментальный режим. Также у одной пациентки из группы стандартной индукции было реализовано всего два курса (из трех запланированных) ИХТ по схеме TPF из-за развившейся токсичности.
К настоящему времени медиана времени наблюдения в исследовательской группе составляет 9 мес (от 2 до 22 мес). Показатель 1-годичной ВБП оценен для 15 больных и составил 88,2 %, ОВ – 100 %. Медиана времени наблюдения в группы контроля составляет 12 мес (от 5 до 22 мес), ОВ
Выживаемость без прогрессирования / Progression-free survival
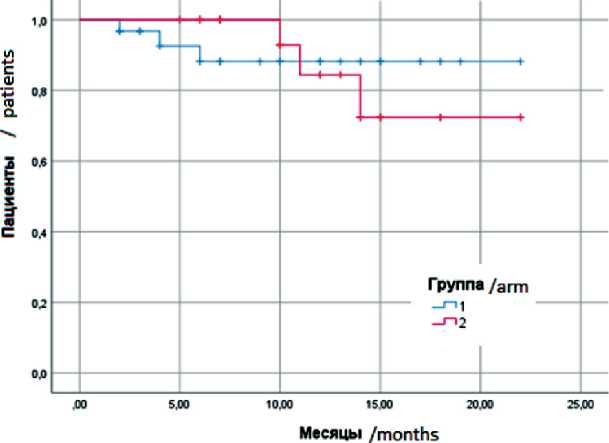
Рис. 3. Выживаемость без прогрессирования: группа 1 – исследуемая, группа 2 – контрольная Fig. 3. Progression-free survival: arm 1 – research arm, arm 2 – control arm зарегистрирована на уровне 100 %, 1-годичная ВБП (17 пациентов) составила 84,4 % (рис. 3).
Обсуждение
В настоящее время активно обсуждается вопрос о возможности редукции объема лечения для пациентов с ВПЧ-ассоциированным плоскоклеточным раком ротоглотки. Однако до сих пор не существует рандомизированных исследований, доказавших возможность деэскалации объема ИХТ при комбинированном консервативном лечении данной когорты больных как с точки зрения показателей общей и безрецидивной выживаемости, так и с точки зрения безопасности терапии.
В 2019 г. исследователи Американского общества клинической онкологии опубликовали метаанализ по деэскалации объема лечения для пациентов с р16-позитивным статусом рака ОФО благоприятного прогноза. Авторами допускается возможность редукции объема лечения для пациентов с ВПЧ-позитивным плоскоклеточным раком ОФО в связи с тем, что такой подход не приводит к снижению показателей выживаемости и в то же время характеризуется уменьшением проявления токсических реакций. Однако, по мнению авторов, данный подход не является стандартным и должен применяться только в рамках клинических исследований [28].
В нашей работе мы попытались ответить на вопрос о возможности деэскалации объема ИХТ. Конечно, однозначные выводы делать преждевре- менно, необходим больший набор больных и более длительное время наблюдения, но предварительные выводы сделать уже возможно. Анализируя показатели ЧОО в исследуемой и контрольной группах, можно утверждать, что значимых отличий не было. Обе схемы одинаково эффективны на первом этапе комбинированного лечения, что позволило реализовать ХЛТ на втором этапе лечения практически у всех пациентов. Что касается показателей общей и безрецидивной выживаемости, то можно заметить, что значимых отличий в результатах на данном этапе исследования также не наблюдается. В то же время следует отметить лучшую переносимость ИХТ по схеме ТР. Частота токсических реакций в исследуемой группе была значительно ниже, чем в группе контроля.
Список литературы Эффективность двухкомпонентного режима индукционной химиотерапии при лечении ВПЧ-позитивного плоскоклеточного рака ротоглотки
- Состояние онкологической помощи населению России в 2018 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2019. 236 с. [The status of cancer care for the population of Russia in 2018. Ed. by A.D. Kaprin, V.V. Starinsky, A.O. Shakhzadova. Moscow, 2019. 236 p. (in Russian)].
- Седаков И.Е., Семикоз Н.Г., Комендант В.В., Гончар А.Г., Чистяков А.А., Ползиков Г.Н. Современные аспекты лечения плоскоклеточного рака головы и шеи. Новообразование. 2018; 10(2): 44-50. [Sedakov I.E., Semikoz N.H., Komendant V.V., Gonchar A.H., Chis-tiakovA.A., Polzikov G.N. Modern aspects of treatment for squamous cell carcinoma of the head and neck. Novoobrazovanie. 2018; 10(2): 44-50. (in Russian)]. doi: 10.26435/neoplasm.v10i2.250.
- Kreimer A.R., Clifford G.M., Boyle P., Franceschi S. Human papil-lomavirus types in head and neck squamous cell carcinomas worldwide: a systematic review. Cancer Epidemiol Biomarkers Prev. 2005; 14(2): 467-75. doi: 10.1158/1055-9965.EPI-04-0551.
- Anantharaman D., Abedi-Ardekani B., Beachler D.C., Gheit T., OlshanA.F., WisniewskiK., Wunsch-Filho V., Toporcov T.N., TajaraE.H., Levi J.E., Moyses R.A., Boccia S., Cadoni G., Rindi G., Ahrens W., Mer-letti F., Conway D.I., Wright S., Carreira C., Renard H., Chopard P., McKay-Chopin S., Scelo G., Tommasino M., Brennan P., D'Souza G. Geographic heterogeneity in the prevalence of human papillomavirus in head and neck cancer. Int J Cancer. 2017; 140(9): 1968-75. doi: 10.1002/ ijc.30608.
- Haeggblom L., Ramqvist T., TommasinoM., Dalianis T., NasmanA. Time to change perspectives on HPV in oropharyngeal cancer. A systematic review of HPV prevalence per oropharyngeal sub-site the last 3 years. Papillomavirus Res. 2017; 4: 1-11. doi: 10.1016/j.pvr.2017.05.002.
- Charfi L., Jouffroy T., de Cremoux P., Le Peltier N., Thioux M., Freneaux P., Point D., Girod A., Rodriguez J., Sastre-Garau X. Two types of squamous cell carcinoma of the palatine tonsil characterized by distinct etiology, molecular features and outcome. Cancer Lett. 2008; 260(1-2): 72-8. doi: 10.1016/j.canlet.2007.10.028.
- Gelwan E., Malm I.J., KhararjianA., Fakhry C., Bishop J.A., Wes-tra W.H. Nonuniform Distribution of High-risk Human Papillomavirus in Squamous Cell Carcinomas of the Oropharynx: Rethinking the Anatomic Boundaries of Oral and Oropharyngeal Carcinoma From an Oncologic HPV Perspective. Am J Surg Pathol. 2017; 41(12): 1722-8. doi: 10.1097/ PAS.0000000000000929.
- Abogunrin S., Di Tanna G.L., Keeping S., Carroll S., Iheanacho I. Prevalence of human papillomavirus in head and neck cancers in European populations: a meta-analysis. BMC Cancer. 2014; 14: 968. doi: 10.1186/1471-2407-14-968.
- Винокурова С.В., Катаргин А.Н. Вирус папилломы человека и заболевания верхних дыхательных путей: рак головы и шеи и респираторный папилломатоз. Голова и шея. 2023; 11(1): 62-73. [Vinokurova S.V., Katargin A.N. Human papillomavirus and upper respiratory diseases: head and neck cancer and respiratory papillomatosis. Head and Neck. 2023; 11(1): 62-73. (in Russian)]. doi: 10.25792/ HN.2023.11.1.62-73.
- Sastre-Garau X., Harle A. Pathology of HPV-Associated Head and Neck Carcinomas: Recent Data and Perspectives for the Development of Specific Tumor Markers. Front Oncol. 2020; 10. doi: 10.3389/ fonc.2020.528957.
- Геворков А.Р., Бойко А.В., Поляков А.П., Болотина Л.В., Волченко Н.Н., Ребрикова И.В., Лемешко А.М., Шашков С.В. ВПЧ-отрицательный рак ротоглотки как отдельная прогностически неблагоприятная нозологическая форма, требующая новых подходов к лечению (клиническое наблюдение). Опухоли головы и шеи. 2019; 9(2): 71-80. [Gevorkov A.R., Boyko A.K, Polyakov A.P., Bolotina L.V., Volchenko N.N., Rebrikova I.V., Lemeshko A.M., Shashkov S.V HPV-negative oropharyngeal carcinoma as a separate prognostkally unfavorable form of cancer, requiring new approaches to treatment (case report). Head and Neck Tumors. 2019; 9(2): 71-80. (in Russian)]. doi: 10.17650/22221468-2019-9-2-71-80.
- БолотинаЛ.В., Дешкина Т.И., Корниецкая А.Л., Кравцов С.А., Устинова Т.В., Пайчадзе А.А., Каприн А.Д., Феденко А.А. Влияние результатов международных исследований на выбор лечебной тактики при нерезектабельных формах плоскоклеточного рака головы и шеи. Опухоли головы и шеи. 2020; 10(2): 10-21. [Bolotina L.V., Deshkina T.I., Kornietskaya A.L., Kravtsov S.A., Ustinova T.V., Paychadze A.A., KaprinA.D., FedenkoА.А. Influence of the results of international studies on the choice of treatment tactics for unresectable forms of squamous cell carcinoma of the head and neck. Head and Neck Tumors. 2020; 10(2): 10-21. (in Russian)]. doi: 10.17650/2222-1468-2020-10-2-10-21.
- Голубев П.В., Болотина Л.В., Геворков А.Р., Дешкина Т.И. Современный взгляд на возможность деэскалации объема лечения ВПЧ-ассоциированного плоскоклеточного рака ротоглотки. Онкология. Журнал им. П.А. Герцена. 2021; 10(3): 47-53. [Golubev P.V., Bolotina L.V., Gevorkov A.R., Deshkina T.I. A current view on the possibility of treatment volume de-escalation in HPV-associated oropharyngeal squamous cell carcinoma. P.A. Herzen Journal of Oncology. 2021; 10(3): 47-53. (in Russian)]. doi: 10.17116/onkolog20211003147.
- Thompson L.D.R., Burchette R., Iganej S., Bhattasali O. Oropharyngeal Squamous Cell Carcinoma in 390 Patients: Analysis of Clinical and Histological Criteria Which Significantly Impact Outcome. Head Neck Pathol. 2020; 14(3): 666-88. doi: 10.1007/s12105-019-01096-0.
- Ang K.K., Harris J., Wheeler R., Weber R., Rosenthal D.I., Nguyen-Tän P.F., Westra W.H., Chung C.H., Jordan R.C., Lu C, Kim H, Axelrod R., Silverman C.C., Redmond K.P., Gillison M.L. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med. 2010; 363(1): 24-35. doi: 10.1056/NEJMoa0912217.
- Nakano K., Seto A., Sasaki T., Shimbashi W., Fukushima H., Yonekawa H., Mitani H., Takahashi S. Predictive Factors for Completion of TPF Induction Chemotherapy in Patients With Locally Advanced Head and Neck Cancer. Anticancer Res. 2019; 39(8): 4337-42. doi: 10.21873/ anticanres.13601.
- Gau M., Karabajakian A., Reverdy T., Neidhardt E.M., Fayette J. Induction chemotherapy in head and neck cancers: Results and controversies. Oral Oncol. 2019; 95: 164-9. doi: 10.1016/j.oraloncology.2019.06.015.
- Saito Y., AndoM., Omura G., YasuharaK., YoshidaM., Takahashi W., Yamasoba T. Induction Chemotherapy for p16 Positive Oropharyngeal Squamous Cell Carcinoma. Head and Neck, and Tumor Biology 2016; 1(2): 28-32. doi: 10.1002/lio2.18.
- Bhattasali O., Han J., Thompson L.D.R., Buchschacher G.L. Jr, Abdalla I.A., Iganej S. Induction chemotherapy followed by concurrent chemoradiation versus concurrent chemoradiation alone in the definitive management of p16-positive oropharyngeal squamous cell carcinoma with low-neck or N3 disease. Oral Oncol. 2018; 78: 151-5. doi: 10.1016/j. oraloncology.2018.01.031.
- Tam M., Hu K. Regional Radiation Therapy for Oropharyngeal Cancer in the HPV Era. Semin Radiat Oncol. 2019; 29(2): 126-36. doi: 10.1016/j.semradonc.2018.11.011.
- Misiukiewicz K., Gupta V., Miles B.A., Bakst R., Genden E., Selkridge I., Surgeon J.T., Rainey H., Camille N., Roy E., Zhang D., Ye F., Jia R., Moshier E., Bonomi M., HwangM., Som P., PosnerM.R. Standard of care vs reduced-dose chemoradiation after induction chemotherapy in HPV+ oropharyngeal carcinoma patients: The Quarterback trial. Oral Oncol. 2019; 95: 170-7. doi: 10.1016/j.oraloncology.2019.06.021.
- Tsai C.J., McBride S.M., Riaz N., Kang J.J., Spielsinger D.J., Waldenberg T., Gelblum D., Yu Y., Chen L.C., Zakeri K., Wong R.J., Dunn L., Pfister D.G., Sherman E.J., Lee N.Y. Evaluation of Substantial Reduction in Elective Radiotherapy Dose and Field in Patients With Human Papillomavirus-Associated Oropharyngeal Carcinoma Treated With Definitive Chemoradiotherapy. JAMA Oncol. 2022; 8(3): 364-72. doi: 10.1001/jamaoncol.2021.6416.
- SchanerP.E., ChandraR.A. Decreasing the Dose and Volume of Elective Nodal Radiotherapy in HPV-Associated Oropharyngeal Cancer: How Low Can We Go? JAMA Oncol. 2022; 8(3): 372-3. doi: 10.1001/ jamaoncol.2021.6411.
- Seiwert T.Y., Foster C.C., BlairE.A., Karrison T.G., AgrawalN., Melotek J.M., Portugal L., BrissonR.J., Dekker A., Kochanny S., Gooi Z., LingenM.W., Villaflor VIM., GinatD.T., HarafD.J., VokesE.E. OPTIMA: a phase II dose and volume de-escalation trial for human papillomavirus-positive oropharyngeal cancer. Ann Oncol. 2019; 30(2): 297-302. doi: 10.1093/annonc/mdy522. Erratum in: Ann Oncol. 2019; 30(10): 1673.
- Blanchard P., Bourhis J., Lacas B., Posner M.R., Vermorken J.B., Cruz Hernandez J.J., Bourredjem A., Calais G., Paccagnella A., Hitt R., Pignon J.P.; Meta-Analysis of Chemotherapy in Head and Neck Cancer, Induction Project, Collaborative Group. Taxane-cisplatin-fluorouracil as induction chemotherapy in locally advanced head and neck cancers: an individual patient data meta-analysis of the meta-analysis of chemotherapy in head and neck cancer group. J Clin Oncol. 2013; 31(23): 2854-60. doi: 10.1200/Jm.2012.47.7802.
- Janoray G., Pointreau Y., Garaud P., ChapetS., AlfonsiM., Sire C., Jadaud E., Calais G. Long-term Results of a Multicenter Randomized Phase III Trial of Induction Chemotherapy With Cisplatin, 5-fluorouracil, ± Docetaxel for Larynx Preservation. J Natl Cancer Inst. 2015; 108(4). doi: 10.1093/jnci/djv368.
- PatelR.R., LudmirE.B., AugustynA., ZaorskyN.G., LehrerE.J., RyaliR., TrifilettiD.M., Adeberg S., AminiA., Verma V De-intensification of therapy in human papillomavirus associated oropharyngeal cancer: A systematic review of prospective trials. Oral Oncol. 2020; 103. doi: 10.1016/j.oraloncology.2020.104608.
- Adelstein D.J., Ismaila N., Ku J.A., Burtness B., Swiecicki P.L., Mell L., Beitler J.J., Gross N., Jones C.U., Kaufman M., Le Q.T., Semrad T.J., Siu L.L., Ridge J.A. Role of Treatment Deintensification in the Management of p16+ Oropharyngeal Cancer: ASCO Provisional Clinical Opinion. J Clin Oncol. 2019; 37(18): 1578-89. doi: 10.1200/ JCO.19.00441.


