Эффективность химиоиммунотерапии в первой линии лечения пациентов с диссеминированным раком желудка в зависимости от экспрессии PD‑L1 и клинической пользы в соответствии с критериями (ESMO‑MCBS) и RUSSCO: результаты мета‑анализа
Автор: Федянин М.Ю., Райс А.Б., Бесова Н.С., Обаревич Е.С., Гаврилова Д.А., Аду-Хайдар О.Б., Карасев И.А., Козлов Н.А., Трякин А.А., Стилиди И.С.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 4 т.15, 2025 года.
Бесплатный доступ
Введение: Комбинация анти PD1 антител с химиотерапии в первой линии у пациентов с диссеминированным раком желудка входит в большинство рекомендаций за рубежом и в РФ. Однако не достигнут консенсус порогового значения экспрессии PD L1 в опухоли, как маркера отбора пациентов для данного подхода (мнения расходятся от отсутствия необходимости селекции пациентов до уровня PD L1 CPS ≥ 10). В связи с этим нами проведен систематический обзор с мета анализом исследований по оценке эффективности химиоиммунотерапии в первой линии пациентов с диссеминированным раком желудка в зависимости от экспрессии PD L1 в опухоли в контексте оценки клинической пользы нового метода лечения в соответствии с критериями ESMO MCBS и RUSSCO. Материалы и методы: Нами проведен систематический обзор с метаанализом рандомизированных исследований III фазы комбинаций различных анти PD1 антител и химиотерапевтических режимов FOLFOX или XELOX в первой линии у больных распространённым Her 2 / neu негативным раком желудка в зависимости от экспрессии PD L1 с дальнейшим определением класса клинической пользы в соответствии со шкалами ESMO MCBS и RUSSCO с учетом порогового значения PD L1. Результаты: В мета анализ были включены данные 6 рандомизированных исследований (ATTRACTION 4, CHECKMATE 649, KEYNOTE 859, ORIENT 16, RATIONALE 305 и GEMSTONE 303), в которых принял участие 5531 пациент. Выявлено статистически значимое улучшение показателей общей выживаемости в пользу анти PD1 антител (ОР 0,8; 95 % ДИ 0,75–0,86; p < 0,001; I2 = 0 %). Статистически значимое улучшение общей выживаемости было отмечено только при экспрессии PD L1 CPS ≥ 5 (ОР 0,71; 95 % ДИ 0,65–0,78; p < 0,001; I2 = 0 %) с уровнем градации по ESMO MCBS в 3 балла и RUSSCO — IC и среди пациентов при экспрессии PD L1 CPS ≥ 10 (ОР 0,65; 95 % ДИ 0,59–0,71; p < 0,001; I2 = 0 %) и уровнем градации по ESMO MCBS в 4 балла и RUSSCO — IB. Выводы: Добавление ингибиторов иммунных контрольных точек к химиотерапии первой линии по схеме FOLFOX или XELOX пациентов с диссеминированным раком желудка с точки зрения клинической пользы ESMO MCBS и RUSSCO демонстрирует клиническую пользу только при отборе пациентов с экспрессией PD L1 в опухоли CPS ≥ 10.
Рак желудка, иммунотерапия, химиотерапия, анти‑PD1 антитела, ESMO‑MCBS
Короткий адрес: https://sciup.org/140313474
IDR: 140313474 | DOI: 10.18027/2224-5057-2025-061
Текст научной статьи Эффективность химиоиммунотерапии в первой линии лечения пациентов с диссеминированным раком желудка в зависимости от экспрессии PD‑L1 и клинической пользы в соответствии с критериями (ESMO‑MCBS) и RUSSCO: результаты мета‑анализа
МАТЕРИАЛЫ И МЕТОДЫ
OR “Programmed Death 1 Inhibitor” OR “Programmed Cell Death Protein 1 Inhibitor” OR “Anti-PD-1” OR “PD-L1 Inhibitor” OR “Anti-PD-L1” OR “Аnti-PD-1/PD-L1” OR “Programmed Death Ligand 1 Inhibitor” OR “pembrolizumab” OR “nivolumab” OR “avelumab” OR “sintilimab” OR “tislelizumab” OR “camrelizumab” OR “durvalumab” OR “atezolizumab” OR “toripalimab” OR “sugemalimab” AND (“gastroesophagealjunction” OR “gastroesophageal junction” OR “gastrooesophageal junction” or “gastro-oesophageal junction” OR “esophagogastric” OR “oesophagogastric” OR “gastric” OR “stomach”) AND (“cancer” OR “carcinoma” OR “adenocarcinoma”). Компьютерный поиск был дополнен изучением списка литературы обзорных статей и оригинальных работ, а также тезисов, представленных на конференциях ASCO и ESMO с 2014 до января 2025 года.
Критерии включения результатов исследований:
Основной критерий эффективности — ОВ. Дополнительный оценочный фактор — качество жизни.
После скрининга названий статей и тезисов был проведен отбор литературных источников двумя независимыми экспертами. Затем был создан перечень литературных источников для оценки соответствия критериям включения в анализ. Оба эксперта должны были согласиться с включением исследования в мета-анализ; в случае несогласия третий эксперт должен был оценить возможность включения исследования в работу. После отбора исследований была сформирована таблица с результатами исследований с указанием основного критерия эффективности — ОВ — и данных по относительному риску смерти (ОР) с 95% доверительным интервалом (95% ДИ) для ITT популяций и для подгрупп в зависимости от степени экспрессии PD-L1 в опухоли по градации CPS. Дополнительно указывался первый автор работы, страна или страны, в которых проводилось исследование, оценка качества жизни, доля пациентов с экспрессией PD-L1 СPS ≥1, ≥5 и ≥10. Диаграмма отбора исследований для анализа представлена на рис. 1.
В соответствии с рекомендациями Cochrane была проведена оценка риска систематических ошибок, отобранных в исследовании: наличие рандомизации, сокрытие распределения, выборочная отчетность, наличие заслепления исследуемого препарата, полноценность опубликованных или сообщенных данных и другие потенциальные ошибки []. Были сформированы 3 уровня градации исследований — с низким уровнем ошибок, с высоким уровнем и неясным уровнем
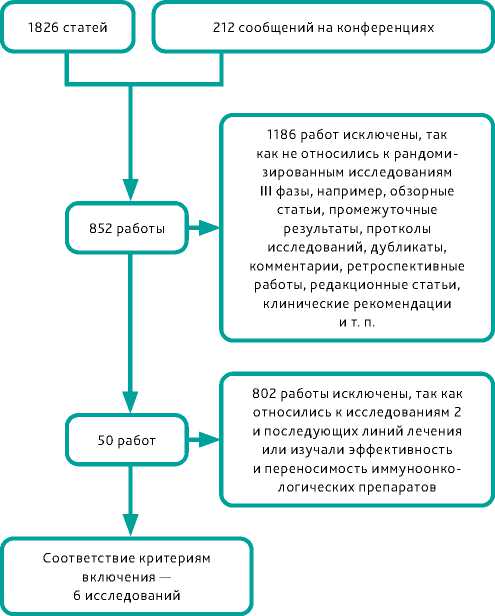
Рисунок 1. Диаграмма отбора исследований в метаанализ
Figure 1. Diagram of study selection for meta-analysis ошибок. С помощью программы Review Manager 5.3 была сформированы карта качества включенных в мета-анализ исследований.
Анализ клинической пользы
Анализ клинической пользы проводился по шкалам ESMO-Magnitude of Clinical Benefit Scale и RUSSCO во всей группе пациентов и в зависимости от различных значений экспрессии PD-L1. С учетом медианы ОВ в контрольных группах включенных исследований, составляющей более 12 месяцев в клинической ситуации, когда не идет речь об излечении, для оценки клинической пользы применялись формы 2a ESMO-MCBS (рис. 2) и класса I для RUSSCO (рис. 3).
Статистический анализ
Различия в ОВ представляли в виде отношения рисков смерти сравниваемых групп и 95% доверительного интервала (ДИ) к данному показателю. Анализ проводился во всей популяции больных, а также в подгруппах, для которых были представлены данные в статьях (экспрессия PD-L1 CPS <1 или ≥1, <5 или ≥5, <10 или ≥10.
Стандартную ошибку вычисляли из 95% ДИ. Статистический анализ включал в себя тест χ 2 для подтверждения однородности результатов включенных в ана-
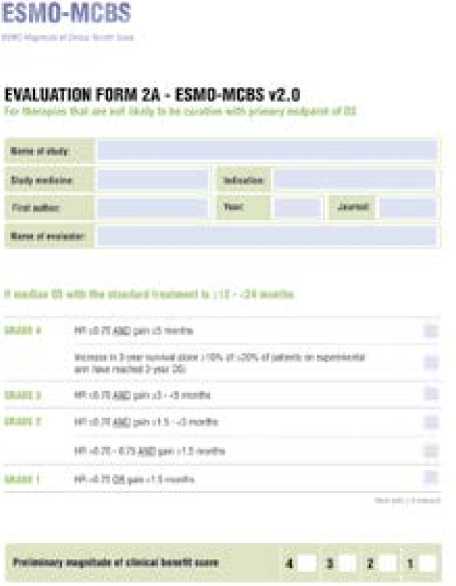
Рисунок 2. Форма 2а по оценке клинической пользы в соответствии со шкалой ESMO-MCBS
Figure 2. Form 2a for the assessment of clinical benefit according to the ESMO-MCBS scale
лиз исследований. В отсутствие статистически значимой гетерогенности результатов исследований (р > 0,1) метод “generic inverse variance” с фиксированным эффектом применяли для оценки отношения рисков прогрессирования и смерти и построения 95% ДИ. В другом случае применялась модель случайных эффектов. С целью исключения систематической ошибки, связанной с публикацией, проводилось построение воронкообразных графиков (со значениями стандартной ошибки (log OР) по оси ординат и отношением рисков (ОР).
Мета-анализ проводился с использованием программы Review Manager (RevMan) [Computer program]. Version 5.3. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014.
РЕЗУЛЬТАТЫ
Исследования, включенные в мета-анализ
После скрининга 1826 публикаций и 212 сообщений на конгрессах 1988 работ было признано неподходящими для оценки. Из оставшихся после изучения тезисов 50 были отобраны для более тщательной оценки соответствия критериям включения. Из них 44 не соответствовали критериям включения. В итоге в мета-анализ были включены данные 6 рандомизированных исследований комбинаций

Рисунок 3. Форма по оценке клинической пользы в соответствии со шкалой RUSSCO
Все включенные исследования были рандомизированными; все, за исключением исследования ATTRACTION-4, представили полные данные; все, за исключением исследования CHECKMATE-649, применяли двойной слепой метод; по другим критериям риска систематических ошибок отклонений не отмечено (рис. 4, 5).
Таблица 1. Характеристика пациентов рандомизированных исследований, включенных в мета-анализ
Table 1. Characteristics of patients in randomized trials included in the meta-analysis
|
Исследование |
CHECKMATE 649 [6, 29] |
KEYNOTE-859 [7, 30] |
ORIENT-16 [8] |
ATTRACTION-4 [9] |
GEMSTONE-303 [10] |
RATIONALE-305 [11, 15] |
|
Число пациентов |
1581 |
1579 |
650 |
724 |
479 |
997 |
|
Исследуемый препарат |
Ниволумаб |
Пембролизумаб |
Синтилимаб |
Ниволумаб |
Сугемалимаб |
Тислелизумаб |
|
Антитело |
Анти-PD1 |
Анти-PD1 |
Анти-PD1 |
Анти-PD1 |
Анти-PD-L1 |
Анти-PD1 |
|
Химиотерапия |
FOLFOX/XELOX |
XELOX/CP |
XELOX |
XELOX/SOX |
XELOX |
XELOX/CP |
|
Страны |
Глобальное |
Глобальное |
Китай |
Япония, Южная Корея, Тайвань |
Китай |
Глобальное |
|
Количество центров |
175 |
207 |
62 |
146 |
54 |
146 |
|
Женщины |
30,5% |
32% |
26% |
28% |
27% |
31% |
|
PS ECOG 1 |
58% |
63% |
73% |
46% |
75% |
68% |
|
Средний возраст |
62 |
62 |
61 |
65 |
63 |
61 |
|
Локализация опухоли в желудочно-пищеводном переходе |
19% |
21% |
18% |
11% |
10% |
19% |
|
PD-L1 CPS ≥ 1 |
82% |
78% |
84% |
16%** |
–* |
85,7% |
|
PD-L1 CPS ≥ 5 |
61% |
61% |
– |
100% |
52,4% |
|
|
PD-L1 СPS ≥ 10 |
49% |
35% |
44% |
– |
54% |
28,9% |
|
Антитело для оценки PD-L1 |
28–8 |
22C3 |
22C3 |
28–8 |
SP263 |
SP263 |
|
Медиана наблюдения (мес.) |
48,1 |
31 |
18,8 |
26,6 |
25,1 |
24,6 |
*В исследовании GEMSTONE-303 экспрессии PD-L1 оценивалась методом TAP.
** — TPS.
Таблица 2. Результаты рандомизированных исследований в отношении ОВ, включенных в мета-анализ
Table 2. Results of randomized trials regarding OS included in the meta-analysis
|
Исследование |
Checkmate 649 [6, 29] |
KEYNOTE-859 [7, 30] |
ORIENT-16 [8] |
ATTRACTION-4 [9] |
GEMSTONE-303 [10] |
RATIONALE-305 [11, 15] |
|
ОР ОВ (95% ДИ), ∆ медиан ОВ (мес.) |
0,79 (0,71–1,88), 2,1 мес. |
0,78 (0,7–0,87), 1,4 мес. |
0,77 (0,63–0,94), 2,9 мес. |
0,9 (0,75–1,08), 0,3 мес. |
– |
0,8 (0,7–0,92) 2,1 мес. |
|
ОР ОВ (95% ДИ) PD-L1 CPS < 1, ∆ медиан ОВ (мес.) |
0,95 (0,73–1,23), 0,6 мес. |
0,92 (0,73–1,16), НД |
0,84 (0,51–1,38), НД |
– |
– |
1,01 (0,67–1,53), НД |
|
ОР ОВ (95% ДИ) PD-L1 CPS < 5, ∆ медиан ОВ (мес.) |
0,95 (0,8–1,12), 0,1 мес. |
– |
0,9 (0,66–1,22), НД |
– |
– |
0,89 (0,72–1,1), НД |
|
ОР ОВ (95% ДИ) PD-L1 СPS < 10, ∆ медиан ОВ (мес.) |
0,91 (0,79–1,05), –0,1 мес. |
0,86 (0,75–0,98), НД |
0,94 (0,72–1,22), НД |
– |
– |
0,87 (0,73–1,03), НД |
|
ОР ОВ (95% ДИ) PD-L1 CPS ≥ 1, ∆ медиан ОВ (мес.) |
0,75 (0,66–0,85), 2,5 мес. |
0,73 (0,65–0,82), 1,6 мес. |
0,73 (0,59–0,91), НД |
– |
– |
0,78 (0,67–0,91), НД |
|
ОР ОВ (95% ДИ) PD-L1 CPS ≥ 5, ∆ медиан ОВ (мес.) |
0,7 (0,61–0,81), 3,3 мес. |
– |
0,66 (0,5–0,86), 5,5 мес. |
– |
0,75 (0,61–0,92), 3 мес. |
0,74 (0,6–0,89), 4,6 мес. |
|
ОР ОВ (95% ДИ) PD-L1 СPS ≥ 10, ∆ медиан ОВ (мес.) |
0,66 (0,57–0,77), 4,1 мес. |
0,64 (0,53–0,78), 3,9 мес. |
0,56 (0,41–0,77), НД |
– |
0,65 (0,49–0,86), 5,3 мес. |
0,68 (0,52–0,89), НД |
* НД — нет данных.
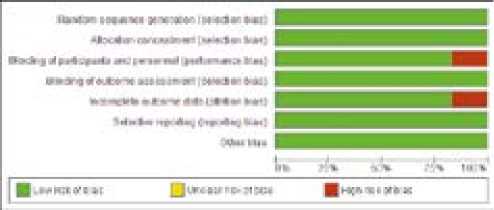
Рисунок 4. График риска смещения
Figure 4. Risk of bias graph
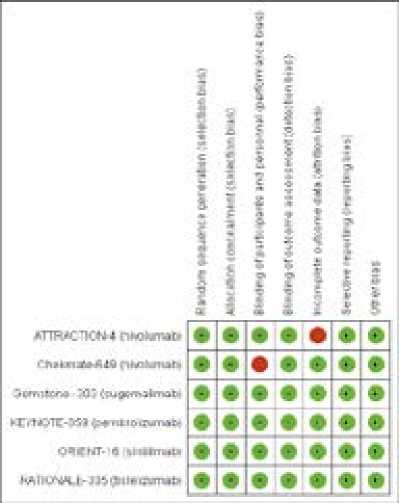
Рисунок 5. Риск смещения для каждого включенного исследования
Figure 5. Risk of bias for each included study.
Общая выживаемость
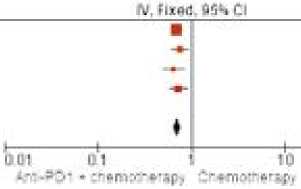
При анализе результатов добавления ингибиторов иммунных контрольных точек к первой линии химиотерапии были включены данные 6 рандомизированных исследований (для одной работы данные представлены только в группе экспрессии PD-L1 ≥ 5, что было обусловлено критериями отбора в исследование GEMSTONE 303): 2769 пациентов получали терапию комбинацией и 2762 — только химиотерапией. Тест на однородность результатов исследований, включенных в мета-анализ, в отношении ОВ показал отсутствие значимых различий — р = 0,74 (I2 = 0%). При этом выявлены статистически значимые различия в ОВ в пользу анти-PD1 антител (ОР 0,8; 95% ДИ 0,75–0,86; p < 0,001; рис. 6).
Данные по эффективности комбинации иммунотерапии и химиотерапии в подгруппе пациентов с экспрессией PD-L1 CPS < 1 доступны были в 4 исследованиях. Тест на однородность результатов исследований, включенных в мета-анализ, показал отсутствие значимых различий в данной подгруппе пациентов — р = 0,95 (I2 = 0 %). При этом отсутствовали и различия в ОВ между группами (ОР 0,93; 95 % ДИ 0,8–1,09); p = 0,38, рис. 7).
Данные по эффективности комбинации иммунотерапии и химиотерапии в подгруппе пациентов с экспрессией PD-L1 CPS ≥ 1 также были доступны в 4 исследованиях. Тест на однородность результатов исследований, включенных в мета-анализ, показал отсутствие значимых различий в данной подгруппе пациентов — р = 0,92 (I2 = 0%). При этом выявлены значимые различия в ОВ в пользу анти-PD1 антител (ОР 0,75; 95% ДИ 0,7–0,8; p < 0,001, рис. 8).
Данные по эффективности комбинации иммунотерапии и химиотерапии в подгруппе пациентов с экспрессией PD-L1 в рамках CPS < 5 доступны были в 3 исследованиях. Тест на однородность результатов исследований, включенных в метаанализ, показал отсутствие значимых различий в данной подгруппе пациентов — р = 0,88 (I2 = 0%). При этом не выявлены различия в ОВ между группами (ОР 0,92; 95% ДИ 0,82–1,04; p = 0,18, рис. 9).
U bill
|
■ЛТШТНЧ-1 плЬп-яЫ |
-г iMJt |
Q№Vi |
Ж |
■ А Эи |
pit )t !&. 1М |
|||
|
;MiF-id± |Яф т-^ит>:£"> |
5 Ивт? |
С Э41*М |
?ч |
м? |
7ft |
и ^ р 46 1 >л |
||
|
ДОЖ t «1 ЦМЛШМИМЩ |
L Л14* |
цЖш |
rw |
газ |
й/ЧЧ |
ц ■> р /и uarj |
■ |
|
|
ЧП>Г1П1Й!\"Ыгп1С1 |
■г M-M |
г irtzw |
1^ |
151 |
Ч?Г» |
'1 гг р ГА гы1| |
||
|
Чилоиис И ^q»4U |
с Н194 |
таити |
HI |
НЕ |
5Т 1« |
икни 0'3 Л |
■ |
|
|
1«Ц11№ 41 |
iris* |
J4i |
U№ |
3*0 |t.rj,0*51 |
t |
|||
|
■ -Ши w«to Ch** 1 4 ■₽ - Г |
7 |
1-------------------------------------- |
—1---------- |
----------------------------------------------1-----------------------------------------------1 |
||||
HTIH MIK ЯКТ 2* ЫМ r <0 UWJ1I
Рисунок 6. Форест-график мета-анализа исследований, в которых проводилось сравнение ОВ на всей популяции пациентов: химиотерапии или комбинации химиотерапии и анти-PD1 антител
Figure 6. Forest plot meta-analysis of a study comparing OS in all patients: chemotherapy or chemotherapy and anti-PD1 antibodies
|
siiic^m 11Ьдоц |
о; [нард c Rai:i:J |
IE |
№>gnr |
№лвгй HiIki IV FiCMl, 954 Cl |
|
. hokniMo bli^Mwjivmabl |
It U* 1-P9 |
O ' 31 №6 |
30 01 |
Q 6$ |U 73, I 231 |
|
КЕ¥№1В-ВЯ фвтЫч1ЕИПИЦ |
-5.063» |
Of 10335 |
«.ПЪ |
0.92 № 73 I 16) |
|
OKlfcNI is (IrtJlPIIdU; |
Щ1Т4Э5 |
0 ;Ы5Ы |
0.Й1 |
0 04 |UM. I 3fl| |
|
RATIONAl F-?35 ,i t МСипиМ |
В OilvJ'i |
й 71313 |
1 3 44 |
1 01 |Г1«7,1 53| |
|
"C-Tnl ."I!!1-! CO |
ни: [ ч |
O.93]O.0O, ЦЯ| |
Hrie-UBerctr ChP= О И, Л- 3 (P = G M). P = 0% ' ■■ ■■: Mi ™rn Mlrrr 7 - ‘ *■ ■.= ■ 0 ^
■4MlU K*!w
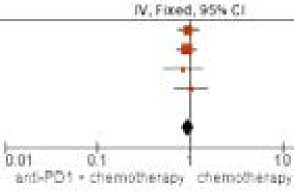
Рисунок 7. Форест-график мета-анализа исследований, в которых проводилось сравнение ОВ: химиотерапии или комбинации химиотерапии и анти-PD1 антител при экспрессии PD-L1 CPS < 1
Figure 7. Forest plot of a meta-analysis of studies comparing OS: chemotherapy or a combination of chemotherapy and anti-PD1 antibodies with PD-L1 CPS < 1
Hazard Habu
Stiiq or Зищго.п Cht№fi№tH3 (mtHirrAHil KEYNOTE $MфПП*Гй1сиТ1йМ QREMT-16 (ainObfflBbJ NtMVJHALb lOSfl-JtteulnuM
-03Ш1 0112001 10.1* 0 7 210 50,0 011
и ять u.j/yim ft.#* u.iO |иь/сон
-IdZBld Hd'O

Тмй1(95Ч сп
Wte'ugunwfr С’ll* = 0 #9. er = Зр = и 021. F=O*
Т«| Гм owral MUtet 7 о o$ (P < o OW01)
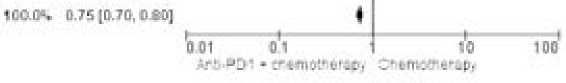
Рисунок 8. Форест-график мета-анализа исследований, в которых проводилось сравнение ОВ: химиотерапии или комбинации химиотерапии и анти-PD1 антител при экспрессии PD-L1 CPS ≥ 1
Figure 8. Forest plot of a meta-analysis of studies comparing OS with chemotherapy or a combination of chemotherapy and anti-PD1 antibodies in patients with PD-L1 CPS ≥ 1
"ам'С 'd’.u
Haza id Ha Vo
S№y« Sibaioap
GhAkmdk ii*q rrvrcihmnb)
ORENT-IB^inliniabJ
WAIIOHM F lizr.^h.’iimshl
kWIUWd Rate) St A^ht IVJUtggJISSCI II № M :l 0016 -III Oil Hl 0 'I':. Ill HQ. 1 1 ,'| -0 1 «SB D1J44M 15 74 CIO [fl 64,111] i. Ik'i.l II 1ll'ii"--n 33 09 0H1IO/7.11П|

Ul3: |«SCIJ
HBltic-jruatfr Г '3 - 3Z6 c"- :P = uOO'.
i^O^
1 rr.10ч mrmll nflrrt 7-1 33 Рисунок 9. Форест-график мета-анализа исследований, в которых проводилось сравнение общей выживаемости (ОВ): химиотерапии или комбинации химиотерапии и анти-PD1 антител при экспрессии PD-L1 CPS < 5 Figure 9. Forest plot of a meta-analysis of studies comparing overall survival (OS): chemotherapy or a combination of chemotherapy and anti-PD1 antibodies with PD-L1 CPS < 5 Данные по эффективности комбинации иммунотерапии и химиотерапии в подгруппе пациентов с экспрессией PD-L1 в рамках CPS ≥ 5 доступны были в 4 исследованиях. Тест на однородность результатов исследований, включенных в метаанализ, не выявил значимых различий в данной подгруппе пациентов — р = 0,81 (I2 = 0 %). При этом выявлены статистически значимое улучшение ОВ в пользу анти-PD-(L)1 антител (ОР 0,71; 95% ДИ 0,65–0,78, p < 0,001, рис. 10). Данные по эффективности комбинации иммунотерапии и химиотерапии в подгруппе пациентов с экспрессией PD-L1 CPS < 10 доступны были в 4 исследованиях. Тест на однородность результатов исследований, включенных в мета-анализ, показал отсутствие значимых различий в данной подгруппе пациентов — р = 0,91 (I2 = 0%). При этом выявлены значимые различия в ОВ в пользу ан-ти-PD1 антител (ОР 0,88; 95 % ДИ 0,82–0,96; p = 0,003, рис. 11). Данные по эффективности комбинации иммунотерапии и химиотерапии в подгруппе пациентов с экспрессией PD-L1 CPS ≥ 10 доступны были в 5 исследованиях. Тест на однородность результатов исследований, включенных в мета- ihiqj nr S .^(flip k>s|H*jarc l*i cl iF WA (h' Нагл 'U Palio . чгйп an^ г C^IUkril Jll- tJ? (lIMfijrilipJ 0 ЗИТ/ UU/3J4I R4 (ft »Г4Ю bi,o&i; бапкЬиФ^Зй! (tugprra Imatii ■Й 1S7F1R n тел JI 1Ц Dт^ [0 ni,Ci4 ORIENT-18 (irOIrnab) -0ШМ D 1374331 12 2% C 64 |0 *9,384; WAIUtHF <:i!i 1 ■ О.7НГ ml 0 jl+,1 и mum ?fl№ йззюао.йе^ г^аН^чсн KOUS D ■' К nt. 0 Fg) нмиадргл*)г сьг oao.df з ^FlQJl^F ПЪ fail far toriR чП«1 £ = F 18 f - U UUUIJIJ Нагл J HaUo 1IIII Рисунок 10. Форест-график мета-анализа исследований, в которых проводилось сравнение ОВ: химиотерапии (CT) или комбинации химиотерапии и анти-PD-(L)1 антител при экспрессии PD-L1 CPS ≥ 5 Figure 10. Forest plot of a meta-analysis of studies comparing OS: chemotherapy (CT) or a combination of chemotherapy and anti-PD-(L)1 antibodies with PD-L1 CPS ≥ 5 3iHl|fC' Vtniirmip >ц;[Нк*л n Ralbi| ^ ТЛ^П: НалгЛНаЬо ib.fixnii, чпча HuanJtallo ti.Funrt.^ShCI r.■’ll'^r»liЛl• MU (nvjlurrijli) JU Л31 0 074993 ЭКИ- и 91 (0 FJ, । oil kF TNrTFc ■ з /fipmb’incjTiabi -n 15ПЙ7 0 nfifiJ.I^ ятгч П йй |П 7$, 4 Ай] ORIENT-18 (Sinblmabi -ооьюо 913*529 ив*. С М |D ч I 211 HA 11 ■: IA11- ■ ■■ C- dPIc jT.it) Il liAJh II И7А?4 33 Г,Ъ II Н ? IU 711 0з| Паш иу^сн 1D0J» 4H[U14U^ I Hrnggprertf C.tir 05^ ar арадд^г os ------+---------------- Г<ыlui tori! BM j3 3.34 ll'rortj ^.^ ,fпятэЛк:1р^ сиап^изъ Рисунок 11. Форест-график мета-анализа исследований, в которых проводилось сравнение ОВ: химиотерапии или комбинации химиотерапии и анти-PD1 антител при экспрессии PD-L1 СPS < 10 Figure 11. Forest plot of a meta-analysis of studies that compared OS: chemotherapy or a combination of chemotherapy and anti-PD1 antibodies with PD-L1 expression CPS < 10 Рисунок 12. Форест-график мета-анализа исследований, в которых проводилось сравнение ОВ: химиотерапии или комбинации химиотерапии и анти-PD (L) 1 антител при экспрессии PD-L1 CPS ≥ 10 Figure 12. Forest plot of a meta-analysis of studies comparing OS with chemotherapy or a combination of chemotherapy and anti-PD (L) 1 antibodies with PD-L1 CPS ≥ 10 анализ, показал отсутствие значимых различий в данной подгруппе пациентов — р = 0,91 (I2 = 0%). При этом выявлены значимые различия в ОВ в пользу анти-PD-(L)1 антител (ОР 0,65; 95% ДИ 0,59–0,71; p < 0,001, рис. 12). Оценка качества жизни Одним из параметров, который учитывается в шкалах оценки клинической пользы, в частности ESMO, является информация по влиянию на качество жизни. Последний параметр был оценен в 4 из 6 исследований (табл. 3). Так как в исследованиях применялись различные опросники и критерии оценки, принимая во внимание наличие в большинстве работ данных по времени до ухудшения симптомов болезни по 2 опросникам QLQ-C30 и EQ-5D-5L, было решено эти данные проанализировать. Тест на однородность результатов исследований, включенных в мета-анализ, показал отсутствие значимых различий во всей группе пациентов — р = 0,84 (I2 = 0%). При этом выявлены значимое улучшение качества жизни при применении анти-PD1 антител (ОР 0,84; 95% ДИ 0,76–0,92; p < 0,001, рис. 13). Таблица 3. Оценка качества жизни в отношении времени до ухудшения симптомов болезни Table 3. Quality of life assessment in relation to time to worsening of disease symptoms Исследование Checkmate 649 [12] KEYNOTE-859 [13] ORIENT-16 ATTRACTION-4 [14] GEMSTONE-303 RATIONALE-305 [15] QLQ-C30 TTSD* – 0,87 (0,72–1,04) –– – 0,77 (0,60–0,98) EQ-5D-5L TTSD 0,86 (0,73–1,01) – – 0,81 (0,67–0,99) –– *TTSD — time to symptoms deterioration. nr 1 Hub rd Kb I'd nF ^r.flhn W.FiKPd :".',; *ПЙА£Т1Мр| InmiluiritO 0 0УУ331 iie* 0 01 IU6J.U40I ."nrFrrinlr Al£ tetmlirmiq 4 I'jIIHJ й Mio^ j'4 44fc и hl |O ,r.:. f ni| kTYNCTESbS ftBirtfotemhf -D 1Л2Б sasaliw ».Q* D от |D Fi, 1 05| НЛТЮНЛЕЬ ззд дашоитйь) 07613b 0 1 JOI 0'3 111Ъ mx f IflJSD 0 0^ ТМйЦЙ5*.Щ Wlrugunuitf cursQ®J. df= JfV = и gif, Twifor ртйГ11 rfbft 2 ■ i Й^Р a t №ij Г= 04. 100Л DlM I&T6. П.Щ oV Art PL-i • thrmoCierapr Clium^t?rjp. Рисунок 13. Форест-график мета-анализа исследований, в которых проводилась оценка качества жизни: химиотерапии или комбинации химиотерапии и анти-PD1 антител Figure 13. Forest plot of a meta-analysis of studies that assessed quality of life: chemotherapy or a combination of chemotherapy and anti-PD1 antibodies Оценка клинической пользы в соответствии со шкалами ESMO-MCBS и RUSSCO В шкалах по оценке клинической значимости ESMO и RUSSCO для градации клинической пользы, кроме значений ОР смерти, учитывается еще и увеличение медианы ОВ в месяцах. В связи с этим был проведен дополнительный анализ по определению совокупного увеличения медианы ОВ в каждой из подгрупп экспрессии PD-L1. Для подгрупп с экспрессией PD-L1 CPS <1, <5 и <10 результаты увеличения медианы ОВ доступны только в одном исследовании — CHECKMATE-649. Эти значения, а также результаты для других подгрупп, представлены в таблице 4. Принимая во внимание улучшение качества жизни во всей подгруппе пациентов по результатам мета-анализа, при расчете клинической пользы по шкале ESMO-MCBS добавлялся один балл для каждой из анализируемых подгрупп. Также, в соответствии с рекомендациями ESMO, необходимо было добавлять балл при снижении общего числа нежелательных явлений. Однако это сделано не было, так как по результатам мета-анализа Pu с соавторами отмечено увеличение относительного риска развития нежелательных явлений, ассоциированных с лечением до 1,42 (1,18–1,7) [16]. Принимая во внимание данные по снижению ОР смерти, данные по качеству жизни и изменению медианы ОВ, проведен подсчет баллов клинической пользы (табл. 4). Как видно из таблицы 4, достаточная для рекомендаций клиническая польза в соответствии со шкалой ESMO-MCBS наблюдается только при использовании порогового значения экспрессии PD-L1 CPS ≥ 10–4 балла. При ранжировании клинической пользы в соответствии со шкалой RUSSCO наибольший уровень — IB — достигнут при экспрессии PD-L1 ≥ 10, тогда как при пороговом значении экспрессии PD-L1 ≥ 5 уровень клинической пользы был ниже — IC. Таблица 4. Оценка клинической пользы в соответствии с шкалами ESMO-MCBS и RUSSCO в зависимости от порогового значения экспрессии PD-L1 Table 4. Assessment of clinical benefit according to the ESMO-MCBS and RUSSCO scales depending on the PD-L1-expression threshold Признак Число иссле-дова-ний ∆ ме- ОР (95% ДИ) р дианы ОВ, мес. ESMO- MCBS RUSSCO Вся группа 5 0,8 (0,75–0,86) < 0,001 1,76 2 ID PD1 CPS < 1 4 0,93 (0,8–1,09) 0,38 0,6 – – PD1 CPS ≥ 1 4 0,75 (0,7–0,8) < 0,001 2,05 3 IC PD1 CPS < 5 3 0,92 (0,82–1,04) 0,18 0,1 – – PD1 CPS ≥ 5 4 0,71 (0,65–0,78) < 0,001 4,1 3 IС PD1 CPS < 10 4 0,88 (0,82–0,96) 0,003 –0,1 2 ID PD1 CPS ≥ 10 5 0,65 (0,59–0,71) < 0,001 4,4 4 IB ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ По результатам нашего анализа в 6 рандомизированных исследованиях сравнивалась эффективность и безопасность добавления анти-PD-(L)1 антител к химиотерапии первой линии с включением оксалиплатина и фторпири-мидинов. В них были достигнуты достаточно однородные результаты — улучшение ОВ (все исследования). Статистически значимый выигрыш в отношении ОВ наблюдался во всех подгруппах, за исключением экспрессии PD-L1 CPS < 1 и CPS < 5. Также мы ограничились включением в мета-анализ исследований по комбинации ингибиторов иммунных контрольных точек и химиотерапии, исключив такое исследование, как JAVELIN Gastric 100, в котором изучалась лишь поддерживающая терапия анти-PD-L1 антитела авелумаба [20]. Были исключены и исследования, в которых изучались комбинации анти-CTLA4 антитела с анти-PD1 антителами как в самостоятельном варианте, так и при применении биспецифических антител с химиотерапией. Также учитывались результаты ранее не включенных в анализ исследований, например, GEMSTONE-3.