Эффективность химиотерапии по схеме EDP±митотан в лечении метастатического адренокортикального рака. Предиктивные и прогностические факторы эффективности
Автор: Жуликов Я.А., Коваленко Е.И., Бохян В.Ю., Хорошилов М.В., Габрава М.М., Артамонова Е.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 т.11, 2021 года.
Бесплатный доступ
Актуальность. Адренокортикальный рак (АКР) является орфанным заболеванием с неблагоприятным прогнозом. Наиболее эффективная терапевтическая опция в лечении метастатического АКР - это назначение комбинации химиотерапии по схеме EDP и митотана. Однако публикаций по сравнению эффективности терапии по схеме EDP в комбинации с митотаном и без него нет. Цель. Сравнение эффективности химиотерапии по схеме EDP с митотаном и без него в терапии метастатического АКР, а также изучение предиктивных и прогностических факторов эффективности терапии. Материалы и методы. Ретроспективный анализ историй болезни пациентов с гистологически подтвержденным метастатическим АКР, получивших хотя бы один курс химиотерапии по схеме EDP±митотан. В исследование включено 73 пациента, из которых 49 получили комбинацию EDP и митотана и 24 - химиотерапию по схеме EDP. Результаты. Частота объективных ответов составила 18,4 % в группе EDP+митотан против 4,1 % в группе EDP. Контроль заболевания наблюдался в 25 (51%) и 13 (54,2%) случаев, соответственно. Достоверных различий в выживаемости без прогрессирования (ВБП) между группами EDP и EDP+митотан не получено, медиана ВБП составила 6,5 и 6,0 месяца, соответственно. Медиана общей выживаемости (ОВ) в общей популяции составила 20,9 месяцев, достоверных различий между группами не получено. Однако у больных, достигших терапевтической концентрации митотана, отмечалось увеличение медианы ВБП. При этом достижение терапевтической концентрации митотана было единственным фактором, достоверно ассоциированным с улучшением ВБП (отношение рисков [HR] 0,44, р = 0,006). Достоверными фактором неблагоприятного прогноза, ассоциированными с ухудшением ОВ, стали уровень Ki-67 в первичной опухоли > 20% (HR 10,5, р = 0,006) и наличие более 1 зоны метастазирования (HR 3,82, р = 0,02). Заключение. В данном исследовании показано, что добавление митотана к химиотерапии по схеме EDP не улучшает медиану ВБП и ОВ во всей популяции больных, но достижение терапевтической концентрации митотана достоверно связано с улучшением ВБП.
Адренокортикальный рак, химиотерапия, митотан
Короткий адрес: https://sciup.org/140257651
IDR: 140257651 | DOI: 10.18027/2224-5057-2021-11-1-37-46
Текст научной статьи Эффективность химиотерапии по схеме EDP±митотан в лечении метастатического адренокортикального рака. Предиктивные и прогностические факторы эффективности
Адренокортикальный рак (АКР) является орфанным заболеванием с неблагоприятным прогнозом и низкой чувствительностью к химиотерапии [1]. Низкая распространенность заболевания затрудняет проведение крупных проспективных клинических исследований. На основе данных ретроспективных и небольших проспективных однорукавных исследований митотан в монорежиме был одобрен FDA в качестве первой и последующих линий терапии метастатического АКР [2,3]. Частота объективного
ответа при назначении митотана в монорежиме составляет 11–30% [2,4–6]. По данным ретроспективных исследований достижение терапевтической концентрации митотана (выше 14 мкг/мл) увеличивает медиану выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) [2,5,7]. Однако терапевтическая концентрация митотана достигается только у половины пациентов, а время до выхода на концентрацию составляет 1,5–3 месяца, что определяет необходимость назначения комбинации химиотерапии и митотана при агрессивном течении заболевания [4].
ЭФФЕКТИВНОСТЬ ХИМИОТЕРАПИИ ПО СХЕМЕ EDP± МИТОТАН В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО АДРЕНОКОРТИКАЛЬНОГО РАКА. ПРЕДИКТИВНЫЕ И ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ЭФФЕКТИВНОСТИ
Собственные исследования
В исследовании III фазы FIRM AKT сравнивалась эффективность митотана в комбинации с химиотерапией по схеме EDP или стрептозоцином у пациентов с метастатическим и местно-распространенным АКР [8]. Частота объективного ответа в группах EDP и стрептозотоцина составила 23,2% и 9,2% (р <0,001) соответственно. Медиана ВБП была достоверно выше в группе EDP и составила 5,0 месяцев против 2,1 месяцев в группе стрептозотоцина. У 26,1% и 7,2% пациентов в группах EDP и стрептозотоцина не наблюдалось признаков прогрессирования заболевания через 1 год после начала лечения. Приведенные выше данные значительно различаются с результатами исследований II фазы, в которых объективный ответ на фоне терапии по схеме EDP+митотан (EDP+m) наблюдался у 50% пациентов, а медиана ВБП составила 9–10 месяцев [9,10]. Низкая эффективность терапии EDP+m в исследовании FIRM-AKT может быть обусловлена как различиями в характеристиках пациентов, включенных в исследования, так и низкой частотой достижения терапевтической концентрации митотана — 20% [8]. Исследований, сравнивавших эффективность терапии по схеме EDP в комбинации с митотаном и без него, в настоящее время нет.
Целью данного ретроспективного клинического исследования стало определение различных прогностических подгрупп, а также индивидуализация лечения пациентов с метастатическим и местно-распространенным АКР.
Задачи исследования:
-
1. Сравнение эффективности химиотерапии по схеме EDP и EDP+митотан в терапии метастатического и местнораспространенного АКР (частота объективных ответов, медианы ВБП и ОВ);
-
2. Определение предиктивных и прогностических маркеров эффективности химиотерапии по схеме EDP±мито-тан для ВБП и ОВ.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты
В данное клиническое исследование включены пациенты старше 18 лет с гистологически подтвержденным метастатическим АКР, в статусе по ECOG 0–2 балла, получивших
хотя бы один курс химиотерапии по схеме EDP±m в НМИЦ онкологии им. Н.Н. Блохина с 1995 по май 2020 года.
Схема лечения
Пациенты получали химиотерапию по схеме EDP±m (Доксорубицин 40 мг/м2 в 1 день цикла, Этопозид 100мг/м2 во 2–4 дни цикла, Цисплатин 40 мг/м2 в 3–4 дни цикла) каждые 28 дней. Лечебный план составлял 6–8 циклов химиотерапии, затем пациенты продолжали прием митотана. Митотан назначался в начальной дозе 2 г/сут внутрь, разделенных на три приема, с постепенной эскалацией дозы каждые 3–5 дней до 4 г/сут, в дальнейшем доза митотана корректировалась в зависимости от уровня концентрации митотана. Максимальная суточная доза митотана составила 7 г/сут. Все пациенты получали гормонозаместительную терапию гидрокортизоном в дозе 30–90 мг/сут внутрь в три приема для коррекции надпочечниковой недостаточности.
Оценка безопасности
Концентрация митотана, свободного Т4, ТТГ, кортизола, АКТГ, биохимический анализ крови (натрий, калий, хлор, аланинаминотрансфераза, аспартатаминотрансфераза, креатинин) оценивались каждые 4 недели терапии. При достижении стабильной концентрации митотана (14–20 мкг/мл в течение 3 месяцев) дальнейшее определение концентрации митотана проводилось каждые 8 недель. Уровень холестерина, триглицеридов, ЛПВП, ЛПНП контролировались каждые 3–4 месяца. По клиническим показаниям оценивались: уровень ренина, альдостерона, тестостерона, дегидроэпиандростеронсульфата.
Алгоритм коррекции дозы митотана в зависимости от его концентрации и наличия нежелательных явлений приведен в табл. 1 (адаптировано из руководства ESMO по лечению адренокортикального рака) [11]. Оценка нежелательных явлений проводилась по Common Terminology Criteria for Adverse Events (CTCAE) v. 4.03. При негематологической токсичности 3–4 степени химиотерапия и митотан временно отменялись.
Таблица 1. Алгоритм коррекции дозы митотана в зависимости от его концентрации и наличия нежелательных явлений
|
Концентрация митотана в плазме крови |
Нежелательные явления |
||
|
Центральная нейротоксичность 2 степени/ Гастроинтестинальные нежелательные явления 3–4 степени |
Центральная нейротоксичность 3–4 степени |
||
|
Отсутствует |
Присутствует |
Присутствует |
|
|
<14 мкг/мл |
Повысить суточную дозу митотана на 1 г |
Снизить суточ1ную дозу митотана на 1 г |
Временная отмена митотана до разрешения токсичности. При возобновлении снизить дозу митотана на 50–75% |
|
14–20 мкг/мл |
Не менять дозу митотана |
Снизить суточную дозу митотана на 1,5 г |
|
|
>20 мкг/мл |
Возможна временная отмена мито-тана при центральной токсичности 1 степени до ее разрешения. Снизить суточную дозу на 50% |
Временная отмена митотана до разрешения токсичности. При возобновлении снизить дозу митотана на 50% |
|
ЭФФЕКТИВНОСТЬ ХИМИОТЕРАПИИ ПО СХЕМЕ EDP ± МИТОТАН В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО АДРЕНОКОРТИКАЛЬНОГО РАКА. ПРЕДИКТИВНЫЕ И ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ЭФФЕКТИВНОСТИ
Собственные исследования
Оценка эффективности терапии
Радиологическая оценка эффективности терапии по критериям RECIST 1.1 проводилась каждые 8–12 недель лечения.
Статистический анализ
ВБП оценивалась как интервал от начала терапии до прогрессирования заболевания по результатам радиологического обследования или даты смерти, если ни одного контрольного исследования не было выполнено до этого. ОВ определялась как интервал от начала терапии до даты смерти или последнего контакта с пациентом.
Нами была запланирована оценка частоты объективных ответов, контроля заболевания (объективный ответ и стабилизация более 6 месяцев), ВБП и ОВ в группах EDP и EDP+m. Для оценки ВБП и ОВ использовался метод Каплана–Майера. Для оценки влияния различных прогностических и предиктивных факторов на ВБП и ОВ использовался одно-и многофакторный регрессионный анализ Кокса. Статистические расчеты выполнены в программе IBM SPSS Statistics Professional 20.0.
РЕЗУЛЬТАТЫ
Характеристики пациентов
В данное сплошное ретроспективное исследование включены 73 пациента, получивших химиотерапию по схеме EDP±m. В качестве 1 линии лечение получили 58 пациентов (79,5%), в качестве 2 линии — 12 (16,4%), 3 и последующих линий — 3 (4,1%). Медиана наблюдения составила 20,9 месяцев. Химиотерапию в комбинации с митотаном получили 49 (67,1 %) пациентов, из них 25 (51 %) начали прием митотана перед началом химиотерапии в качестве адъювантой терапии или первой линии лечения. Химиотерапию по схеме EDP без митотана получили 24 (32,9%) пациента. Характеристики пациентов приведены в табл. 2. Эффективность лечения была оценена во всей популяции и в группах EDP и EDP+m.
Эффективность терапии
Лечебный план выполнен у 41 пациента (56,2%), 6 и 8 циклов EDP проведено 36 (49,3%) и 5 (6,8%) пациентам соответственно. В 32 случаях (43,8%) было проведено менее 6 циклов химиотерапии в связи с прогрессированием заболевания.
Объективный ответ был достигнут у 11 (15,1%) пациентов. В группах EDP+m и EDP объективный ответ наблюдался у 9 (18,4%) и 2 (4,1%) больных, соответственно. В том числе зарегистрирован полный ответ у 1 (1,4%) пациента в группе EDP+m. У 8 из 9 пациентов (88,9%) с объективным ответом на EDP+m была достигнута терапевтическая концентрация митотана. Стабилизация заболевания наблюдалась у 31 пациента (42,4%) в общей группе пациентов, у 18 пациентов (36,7%) в группе EDP+m и у 13 (54,2 %) в группе EDP.
Таблица 2. Характеристика пациентов
|
Характеристика |
EDP±m (n= 73) |
EDP+m (n= 49) |
EDP (n= 24) |
|
Пол |
|||
|
Мужской |
28 (38,4%) |
17 (34,7%) |
11 (45,8%) |
|
Женский |
45 (61,6%) |
32 (65,3%) |
13 (54,2%) |
|
Возраст |
|||
|
< 50 |
45 (61,6%) |
32 (65,3%) |
13 (54,2%) |
|
≥ 50 |
28 (38,4%) |
17 (34,7%) |
11 (45,8%) |
|
Медина |
47 |
46 |
50 |
|
ECOG |
|||
|
0 |
26 (35,6%) |
19 (38,8%) |
7 (29,2%) |
|
1 |
42 (57,5%) |
27 (55,1%) |
16 (66,7%) |
|
2 |
4 (5,5%) |
3 (6,1%) |
1 (4,2%) |
|
Линия терапии |
|||
|
1 |
58 (79,5%) |
38 (77,6%) |
20 (83,3%) |
|
2 |
12 (16,4%) |
10 (20,4%) |
2 (8,3%) |
|
3 и последующие |
3 (4,1%) |
1 (2%) |
2 (8,3%) |
|
Интервал от адреналэктомии |
|||
|
< 6 |
9 (18,4%) |
9 (18,4%) |
2 (8,3%) |
|
6–12 мес. |
10 (20,4%) |
10 (20,4%) |
6 (25%) |
|
> 12 |
26 (53,1%) |
26 (53,1%) |
10 (41,7%) |
|
Первично метастатический АКР |
4 (8,2%) |
4 (8,2%) |
6 (25%) |
|
Ki67 |
|||
|
0–10% |
13 (17,8%) |
9 (18,4%) |
4 (16,7%) |
|
11–20% |
15 (20,5%) |
12 (24,5%) |
3 (12,5%) |
|
>20% |
21 (28,8%) |
15 (30,6%) |
6 (25%) |
|
Нет данных |
25 (34,2%) |
13 (26,5%) |
11 (45,8%) |
|
Зоны метастазирования |
|||
|
Легкие |
44 (60,3%) |
29 (59,2%) |
15 (62,5%) |
|
Печень |
40 (54,8%) |
25 (51%) |
15 (62,5%) |
|
Местный рецидив |
41 (56,2%) |
33 (45,2%) |
9 (12,3%) |
|
Удалена ли первичная опухоль |
|||
|
Нет |
10 (13,7%) |
4 (8,2%) |
6 (25%) |
|
Да |
63 (86,3%) |
45 (91,8%) |
18 (75%) |
|
Количество зон метастазирования |
|||
|
1 |
10 (20,4%) |
10 (20,4%) |
6 (25%) |
|
2 |
18 (36,7%) |
18 (36,7%) |
11 (45,8%) |
|
3 и более |
21 (42,9%) |
21 (42,9%) |
7 (29,2%) |
|
Достигнута ли терапевтическая концентрация митотана на фоне химиотерапии |
|||
|
Да |
28 (57,1%) |
||
|
Нет |
15 (30,6%) |
||
|
Нет данных |
6 (12,2%) |
||
ЭФФЕКТИВНОСТЬ ХИМИОТЕРАПИИ ПО СХЕМЕ EDP±МИТОТАН В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО АДРЕНОКОРТИКАЛЬНОГО РАКА. ПРЕДИКТИВНЫЕ И ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ЭФФЕКТИВНОСТИ
Собственные исследования
Контроль заболевания в общей группе наблюдался у 38 (52%) пациентов, в том числе у 25 (51%) в группе EDP-m и 13 (54,2%) пациентов в группе EDP (табл. 3). Прогрессирование заболевания зарегистрировано у 31 больного (42,4 %) в общей группе, у 22 (44,9%) в группе EDP+m и у 9 (37,5%) — в группе EDP.
Таблица 3. Объективный ответ
|
Общая группа (N= 73) |
EDP+митотан (N= 49) |
ЕDР (N= 24) |
|
|
Полный ответ |
1 (1,4%) |
1 (2%) |
0 |
|
Частичный ответ |
10 (13,7%) |
8 (16,3%) |
2 (4,1%) |
|
Объективный ответ |
11 (15%) |
9 (18,4%) |
2 (4,1%) |
|
Контроль заболевания |
38 (52%) |
25 (51%) |
13 (54,2%) |
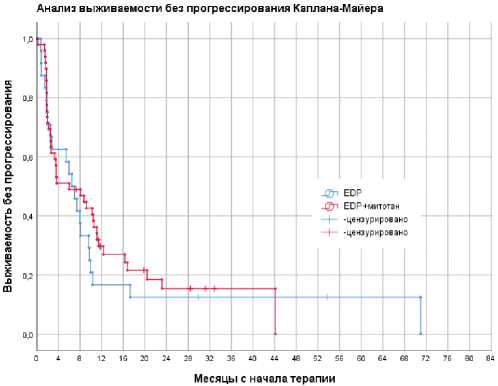
Рисунок 1. Выживаемость без прогрессирования
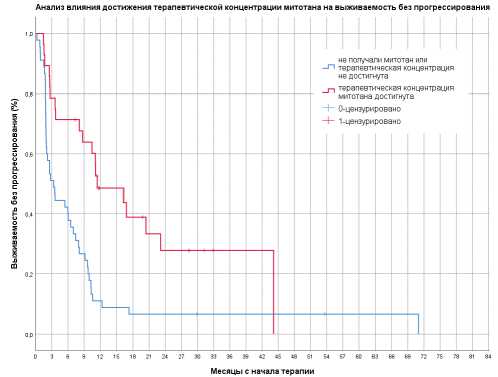
Рисунок 2. Выживаемость без прогрессирования в зависимости от достижения терапевтической концентрации митотана
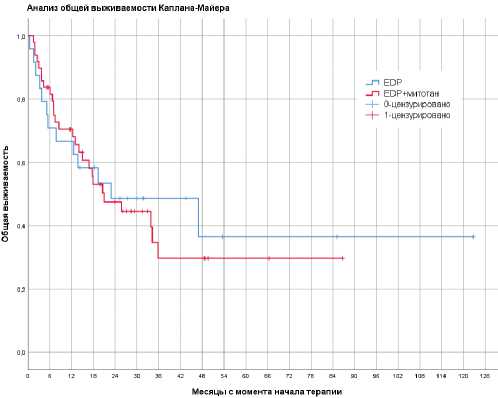
Рисунок 3. Общая выживаемость
На момент анализа данных при последующем наблюдении (медиана 20,9 месяцев) прогрессирование заболевания зарегистрировано у 62 пациентов (84,9%), смерть — у 34 (46,6%).
Анализ выживаемости без прогрессирования
Медиана ВБП в общей группе составила 6,5 месяцев (95% доверительный интервал [ДИ], 2,8–10,2). Достоверных различий между группами EDP и EDP+m не получено, медиана ВБП составила 6,5 (95 % ДИ, 4,1–8,9) и 6,03 (95% ДИ, 0,17–11,9, р =0,54) месяцев, соответственно (рис. 1). Одно-и двухлетняя ВБП в общей группе пациентов составили 19,2% и 10,9%, соответственно.
Терапевтическая концентрация митотана достигнута у 28 из 49 (57%) пациентов. В группе пациентов, достигших терапевтической концентрации митотана, медиана ВБП составила 11,4 месяцев (95% ДИ 3,66–19,2) против 3,3 месяцев (95% ДИ 1,8–4,87) у не достигших терапевтической концентрации или не получавших митотан (р =0,001, рис. 2).
Анализ общей выживаемости
Медиана ОВ во всей группе составила 20,9 месяцев (95% ДИ, 5,06–36,7). Достоверных различий между группами не наблюдалось: медиана ОВ составила 22,8 (95% ДИ, 9,8–32) и 20,9 (95% ДИ, 0–54, р =0,825) месяцев в группах EDP+m и EDP соответственно (рис. 3). Отсутствие различий в медиане ОВ, вероятно, обусловлено тем, что 29% пациентов в группе EDP получили митотан в последующих линиях терапии.
Предиктивные и прогностические факторы
С целью определения предиктивных и прогностических маркеров, достоверно влияющих на ВБП и ОВ, проведен одно-и многофакторный регресионный ана-
ЭФФЕКТИВНОСТЬ ХИМИОТЕРАПИИ ПО СХЕМЕ EDP ±МИТОТАН В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО АДРЕНОКОРТИКАЛЬНОГО РАКА. ПРЕДИКТИВНЫЕ И ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ЭФФЕКТИВНОСТИ
Собственные исследования
Таблица 4. Предиктивные факторы для ВБП
|
Характеристика |
N |
Однофакторный анализ |
Многофакторный анализ |
||||
|
HR |
95% ДИ |
p |
HR |
95% ДИ |
p |
||
|
Пол |
|||||||
|
мужской |
28 |
1 |
|||||
|
женский |
45 |
1,35 |
0,8–2,28 |
0,265 |
|||
|
Возраст |
|||||||
|
< 50 |
45 |
1 |
|||||
|
≥ 50 |
28 |
0,99 |
0,59–1,67 |
0,964 |
|||
|
ECOG |
|||||||
|
0 |
26 |
1 |
1 |
||||
|
1 |
42 |
1,67 |
0,94–2,96 |
0,016 |
1,74 |
0,94–2,96 |
0,08 |
|
2 |
4 |
4,68 |
2,02–18,94 |
0,001 |
4,61 |
1,39–15,74 |
0,013 |
|
Линия терапии |
|||||||
|
1 |
58 |
1 |
|||||
|
2 |
12 |
0,63 |
0,28–1,39 |
0,25 |
|||
|
3 и последующие |
3 |
2,5 |
0,76–8,14 |
0,13 |
|||
|
Интервал от адреналэктомии |
|||||||
|
< 6 и первично-метастатический АКР |
13 |
2,43 |
1,26–4,69 |
0,002 |
1,6 |
0,74–3,44 |
0,23 |
|
6–12 мес. |
10 |
2,59 |
1,42–4,71 |
0,008 |
1,48 |
0,74–2,98 |
0,27 |
|
> 12 мес. |
26 |
1 |
1 |
||||
|
Ki-67 |
|||||||
|
0–10% |
13 |
1 |
|||||
|
11–20% |
15 |
1,19 |
0,5–2,82 |
0,7 |
|||
|
>20% |
21 |
2,19 |
0,98–4,9 |
0,057 |
|||
|
Схема терапии |
|||||||
|
EDP+m |
49 |
0,85 |
0,5–1,44 |
0,542 |
|||
|
EDP |
24 |
1 |
|||||
|
Достигнута ли терапевтическая концентрация митотана |
|||||||
|
Нет |
15 |
1 |
1 |
||||
|
Да |
28 |
0,38 |
0,22–0,67 |
0,001 |
0,44 |
0,24–0,79 |
0,006 |
|
Метастазы в печени |
|||||||
|
Нет |
33 |
1 |
1 |
||||
|
Да |
40 |
2,57 |
1,49–4,41 |
0,001 |
1,57 |
0,83–3,00 |
0,17 |
|
Метастазы в легкие |
|||||||
|
Нет |
29 |
1 |
|||||
|
Да |
44 |
1,39 |
0,82–2,37 |
0,225 |
|||
|
Местный рецидив |
|||||||
|
Нет |
41 |
1 |
|||||
|
Да |
32 |
0,75 |
0,45–1,26 |
0,28 |
|||
|
Количество зон метастазирования |
|||||||
|
1 |
10 |
1 |
1 |
||||
|
2 |
18 |
1,93 |
0,92–4,02 |
0,08 |
1,94 |
0,88–4,28 |
0,1 |
|
3 и более |
21 |
2,28 |
1,08–4,83 |
0,03 |
2,63 |
1,17–5,89 |
0,02 |
|
Хирургическое лечение после окончания химиотерапии |
|||||||
|
Нет |
62 |
1 |
1 |
||||
|
Да |
11 |
0,40 |
0,20–0,80 |
0,01 |
0,60 |
0,24–1,47 |
0,267 |
ЭФФЕКТИВНОСТЬ ХИМИОТЕРАПИИ ПО СХЕМЕ EDP± МИТОТАН В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО АДРЕНОКОРТИКАЛЬНОГО РАКА. ПРЕДИКТИВНЫЕ И ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ЭФФЕКТИВНОСТИ
Собственные исследования лиз, включивший следующие факторы: прием митотана, достижение терапевтической концентрации митотана в крови, линия терапии, возраст (≤50 и >50 лет), пол, статус по ECOG перед началом терапии, адреналэктомия в анамнезе, интервал от адреналэктомии до начала химиотерапии (<6, 6–12, >12 месяцев), Ki-67 (≤10%, 11–20%, >20%), локализация метастазов, количество сайтов метастазирования, хирургическое лечение после завершения химиотерапии.
По данным многофакторного анализа достижение терапевтической концентрации митотана ассоциировалось со снижением риска прогрессирования заболевания (HR 0,44; 95% ДИ 024–0,79, р =0,006, табл. 4). Неблагоприятными факторами, связанными с повышением риска прогрессирования, были ECOG 2 (HR 4,61; 95% ДИ 1,39– 15,74, р =0,013), наличие 3 и более зон метастазирования (HR 2,63; 95% ДИ 1,17–5,89, р =0,02). Другие изучаемые факторы не оказали влияния на риск прогрессирования заболевания.
Факторами, ассоциированными с повышения риска смерти, стали Ki-67>20% (HR 10,5; 95% ДИ 1,96–56,6, р =0,006) и наличие более 1 зоны метастазирования (HR 3,82; 95% ДИ 1,22–11,97, р =0,02, табл. 5). Медиана ОВ не была достигнута у пациентов с Ki-67≤10%, а в группах с Ki-67 11–20% и >20% составила 46,9 месяцев и 19,3 месяца, соответственно (р <0,0001, рис. 4).
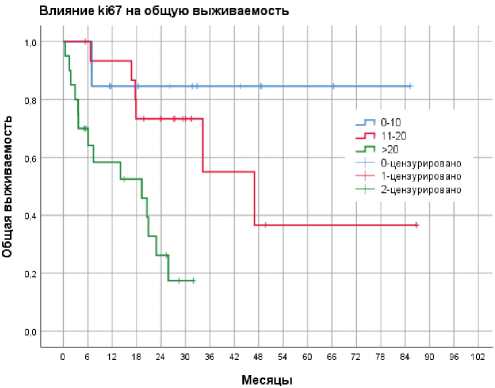
Рисунок 4. Общая выживаемость в зависимости от Ki-67
Безопасность терапии
Наиболее частыми нежелательными явлениями были гематологические: частота нейтропении 3–4 степени составила 27,4% (n =20), фебрильной нейтропении — 9,6% (n =7). Анемия 3 степени наблюдалась в 5,5% случаев (n =4). Частыми нежелательными явлениями 1–2 степени были тошнота (n =72; 98,6%), диарея (n =14; 19,2%), повы-
шение АЛТ и АСТ (n =11; 15,1%), гипотиреоз (n =6; 8,2%), гиперкалиемия (n =2; 2,7%), центральная нейротоксичность (n =6, 8,2%). Из негематологических нежелательных явлений 3–4 степени отмечались острая надпочечниковая недостаточность — у 2 (2,7%) пациентов, центральная нейротоксичность — у 2 (2,7%), повышение АЛТ и АСТ — у 2 (2,7%), тошнота и рвота — у 2 (2,7%).
ОБСУЖДЕНИЕ
В данном ретроспективном исследовании была изучена эффективность химиотерапии по схеме EDP±m в терапии метастатического АКР. В общей популяции частота объективных ответов составила 15,1 %, медиана ВБП — 6,5 месяцев. Терапевтическая концентрация митотана была достигнута у 57,1 % пациентов. Полученные результаты схожи с результатами исследования III фазы FIRM-AKT [10]. Интересно, что медианы ВБП не различались в группах EDP+m и EDP. Но достижение терапевтической концентрации митотана было единственным фактором, достоверно ассоциированным с улучшением ВБП (11,4 месяцев против 3,3 месяцев), что подчеркивает значимость достижения терапевтической концентрации митотана даже при его назначении в комбинации с наиболее эффективным режимом химиотерапии. Следует отметить, что среднее время достижения терапевтической концентрации митотана в различных исследованиях составляет 1,5–3 месяца [5–8]. Очевидно, различия в показателях ВБП между группами пациентов достигших и не достигших терапевтической концентрации митотана обусловлены тем, что часть пациентов не достигли её в связи с быстрым прогрессированием заболевания. Неблагоприятными факторами, ассоциированными с повышением риска прогрессирования, были ECOG 2 и наличие 3 и более зон метастазирования.
На данный момент остается открытым вопрос об оптимальном дозовом режиме митотана для ускорения выхода на терапевтическую концентрацию. Опубликованы результаты ретроспективного исследования, сравнивавшего скорость и частоту достижения терапевтической концентрации митотана при высоко-и низкодозовом режиме митотана [12]. Исследование включало 40 пациентов, медианы достижения терапевтической концентрации митотана не различались. Однако небольшая выборка и отсутствие других данных не позволяет сделать вывод о неэффективности стратегии увеличения суточной дозы митотана для повышения частоты и скорости достижения концентрации митотана. Наиболее актуально изучение эффективности высокодозового режима митотана в группе пациентов с Ki-67>20%, наличием 3 и более зон метастазирования, учитывая агрессивное течение заболевания у этих пациентов.
Уровень Ki-67>20% был прогностическим фактором, достоверно ассоциированным с повышением риска смерти. Небольшая выборка не позволила получить достовер-
ЭФФЕКТИВНОСТЬ ХИМИОТЕРАПИИ ПО СХЕМЕ EDP± МИТОТАН В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО АДРЕНОКОРТИКАЛЬНОГО РАКА. ПРЕДИКТИВНЫЕ И ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ЭФФЕКТИВНОСТИ
Собственные исследования
Таблица 5. Прогностические факторы для ОВ
|
Характеристики |
N= 73 |
Однофакторный анализ |
Многофакторный анализ |
||||
|
HR |
95% ДИ |
p |
HR |
95% ДИ |
p |
||
|
Пол |
|||||||
|
мужской |
28 |
1 |
1 |
||||
|
женский |
45 |
2,04 |
1,02–4,1 |
0,044 |
1,35 |
0,61–2,97 |
0,46 |
|
Возраст |
|||||||
|
< 50 |
45 |
1 |
|||||
|
≥ 50 |
28 |
0,86 |
0,45–1,66 |
0,662 |
|||
|
ECOG |
|||||||
|
0 |
26 |
1 |
1 |
||||
|
1 |
42 |
2,55 |
1,23–5,3 |
0,012 |
0,99 |
0,43–2,25 |
0,98 |
|
2 |
4 |
3,2 |
0,87–11,75 |
0,079 |
1,35 |
0,3–6,03 |
0,69 |
|
Линия терапии |
|||||||
|
1 |
58 |
1 |
|||||
|
2 |
12 |
0,79 |
0,3–203 |
0,25 |
|||
|
3 и последующие |
3 |
1,74 |
0,41–7,3 |
0,13 |
|||
|
Интервал от адреналэктомии |
|||||||
|
< 6 и первично-метастатический АКР |
13 |
2,58 |
1,15–5,8 |
0,02 |
1,47 |
0,56–3,84 |
0,43 |
|
6–12 мес. |
10 |
2,4 |
1,16–4,96 |
0,02 |
0,8 |
0,32–1,98 |
0,625 |
|
> 12 мес. |
26 |
1 |
1 |
||||
|
Ki-67 |
|||||||
|
0–10% |
13 |
1 |
1 |
||||
|
11–20% |
15 |
2,72 |
0,54–13,81 |
0,22 |
3,5 |
0,66–18,72 |
0,14 |
|
>20% |
21 |
11 |
2,27–53,12 |
0,003 |
10,5 |
1,96–56,6 |
0,006 |
|
Схема терапии |
|||||||
|
EDP+m |
49 |
1,08 |
0,55–2,09 |
0,825 |
|||
|
EDP |
24 |
1 |
|||||
|
Достигнута ли терапевтическая концентрация митотана |
|||||||
|
Нет |
15 |
1 |
1 |
||||
|
Да |
28 |
0,56 |
0,29–1,08 |
0,09 |
0,76 |
0,36–1,63 |
0,17 |
|
Метастазы в печени |
|||||||
|
Нет |
33 |
1 |
1 |
||||
|
Да |
40 |
2,78 |
1,42–5,45 |
0,003 |
1,79 |
0,78–4,1 |
0,48 |
|
Метастазы в легкие |
|||||||
|
Нет |
29 |
1 |
|||||
|
Да |
44 |
1,08 |
0,57–2,08 |
0,812 |
|||
|
Местный рецидив |
|||||||
|
Нет |
41 |
1 |
|||||
|
Да |
32 |
0,83 |
0,44–1,54 |
0,549 |
|||
|
Количество зон метастазирования |
|||||||
|
1 |
10 |
1 |
1 |
||||
|
2 |
18 |
2,6 |
0,94–7,15 |
0,065 |
3,82 |
1,22–11,97 |
0,02 |
|
3 и более |
21 |
3,84 |
1,4–10,56 |
0,009 |
8,01 |
2,3–27,8 |
0,001 |
|
Хирургическое лечение после окончания химиотерапии |
|||||||
|
Нет |
62 |
1 |
1 |
||||
|
Да |
11 |
0,23 |
0,08–0,65 |
0,006 |
0,21 |
0,36–1,27 |
0,09 |
ЭФФЕКТИВНОСТЬ ХИМИОТЕРАПИИ ПО СХЕМЕ EDP± МИТОТАН В ЛЕЧЕНИИ МЕТАСТАТИЧЕСКОГО АДРЕНОКОРТИКАЛЬНОГО РАКА. ПРЕДИКТИВНЫЕ И ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ ЭФФЕКТИВНОСТИ
Собственные исследования ных различий в общей выживаемости между группами с уровнем Ki-67≤10% и 11–20%. Однако наблюдалась тенденция к улучшению ОВ в группе с Ki-67≤10%, что, вероятно, связано с индолентным течением заболевания у этих пациентов и проводимыми интервальными циторедукциями при прогрессировании заболевания. Уровень Ki-67≤10% в первичной опухоли по результатам нескольких исследований является предиктивным фактором эффективности митотана и благоприятным прогностическим фактором при АКР [4,12]. Учитывая индолентное течение заболевания у этих пациентов и чувствительность к митотану, можно рассматривать де-эскалацию химиотерапии у этих пациентов при отсутствии клинических показаний.
ЗАКЛЮЧЕНИЕ
В данном исследовании показано, что добавление мито-тана к химиотерапии по схеме EDP не улучшает медиану ВБП и ОВ во всей популяции больных, однако достижение терапевтической концентрации митотана достоверно связано с улучшением выживаемости без прогрессирования. Уровень Ki-67>20%, а также наличие 3 и более зон метастазирования являются наиболее важными неблагоприятными прогностическими факторами. На основании результатов исследования у больных с неблагоприятными прогностическими факторами следует рассмотреть назначение высокодозных режимов митотана с целью ускорения достижения его терапевтической концентрации.
Список литературы Эффективность химиотерапии по схеме EDP±митотан в лечении метастатического адренокортикального рака. Предиктивные и прогностические факторы эффективности
- Kerkhofs TM, Verhoeven RH, Van der Zwan JM, et al. Adrenocortical carcinoma: a population-based study on incidence and survival in the Netherlands since 1993. Eur J Cancer. 2013;49 (11):2579–2586. PMID: 23 561 851. DOI: 10.1016 / j.ejca. 2013.02.034
- Hermsen IG, Fassnacht M, Terzolo M, et al. Plasma concentrations of o, p’DDD, o, p’DDA, and o, p’DDE as predictors of tumor response to mitotane in adrenocortical carcinoma: results of a retrospective ENS@T multicenter study. J Clin Endocrinol Metab. 2011;96 (6):1844–1851. PMID: 21 470 991. DOI: 10.1210 / jc. 2010–2676
- Terzolo M, Angeli A, Fassnacht M et al. Adjuvant mitotane treatment for adrenocortical carcinoma. N Engl J Med. 2007; 356 (23):2372–2380. PMID: 17 554 118. DOI: 10.1056 / NEJMoa063 360
- Megerle F, Herrmann W, Schloetelburg W, et al. Mitotane Monotherapy in Patients With Advanced Adrenocortical Carcinoma. J Clin Endocrinol Metab. 2018;103 (4):1686–1695. PMID: 29 452 402. DOI: 10.1210 / jc. 2017–02 591.
- Hermsen IG, Fassnacht M, Terzolo M, et al. Plasma concentrations of DDD, DDA, and DDE as predictors of tumor response to mitotane in adrenocortical carcinoma: results of a retrospective ENS@T multicenter study. J Clin Endocrinol Metab. 2011;96 (6):1844–1851. PMID: 21 470 991. DOI: 10.1210 / jc. 2010–2676.
- ZGonzalez RJ, Tamm EP, Ng C, et al. Response to mitotane predicts outcome in patients with recurrent adrenal cortical carcinoma. Surgery. 2007;142 (6):867–875; discussion 867–875. PMID: 18 063 070. DOI: 10.1016 / j. surg. 2007.09.006.
- Terzolo M, Baudin AE, Ardito A, et al. Mitotane levels predict the outcome of patients with adrenocortical carcinoma treated adjuvantly following radical resection. Eur J Endocrinol. 2013;169 (3):263–270. PMID: 23 704 714. DOI: 10.1530 / EJE- 13–0242. Fassnacht M, Terzolo M, Allolio B, et al. Combination chemotherapy in advanced adrenocortical carcinoma. N Engl J Med. 2012;366 (23):2189–2197. PMID: 22 551 107. DOI: 10.1056 / NEJMoa1 200 966.
- Berutti A, Terzolo M, Sperone P, et al. Etoposide, doxorubicin and cisplatin plus mitotane in the treatment of advanced adrenocortical carcinoma: a large prospective phase II trial. Endocr Relat Cancer. 2005 Sep;12 (3):657–66. PMID: 16 172 198. DOI: 10.1677 / erc. 1.01 025.
- Laganа M, Grisanti S, Cosentini D, et al. Efficacy of the EDP-M Scheme Plus Adjunctive Surgery in the Management of Patients with Advanced Adrenocortical Carcinoma: The Brescia Experience. Cancers (Basel). 2020;12 (4). PMID: 32 290 298. DOI: 10.3390 / cancers12 040 941.
- Beuschlein F, Weigel J, Saeger W, et al. Major Prognostic Role of Ki67 in Localized Adrenocortical Carcinoma After Complete Resection. J Clin Endocrinol Metab. 2015; 100 (3): 841–849. PMID: 25 559 399. DOI: 10.1210 / jc. 2014–3182.
- Fassnacht M, Assie G, Baudin E, et al. Adrenocortical carcinomas and malignant phaeochromocytomas: ESMOEURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2020; 31 (11):1476–1490. DOI: 10.1016 / j. annonc. 2020.08.2099
- Kerkhofs TM, Baudin E, Terzolo M, et al. Comparison of two mitotane starting dose regimens in patients with advanced adrenocortical carcinoma. J Clin Endocrinol Metab. 2013;98 (12):4759–4767. PMID: 24 057 287. DOI: 10.1210 / jc.2013–2281.


