Эффективность и безопасность индукционной химиотерапии по схеме Folfirinox при погранично резектабельном и нерезектабельном раке поджелудочной железы
Автор: Покатаев И.А., Базин И.С., Попова А.С., Подлужный Д.В., Котельников А.Г., Сагайдак И.В., Кудашкин Н.Е., Файнштейн И.А., Валиев Р.К., Назаренко А.В., Алиева С.Б., Абгарян М.Г., Гладилина И.А., Федянин М.Ю., Сехина О.В., Чекини Д.А., Эльснукаева Х.Х., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Профилактика, диагностика и лечение онкологических заболеваний
Статья в выпуске: 1 т.8, 2018 года.
Бесплатный доступ
Цель исследования. Оценить эффективность и безопасность применения режима FOLFIRINOX в качестве индукционной терапии при погранично резектабельном и нерезектабельном раке поджелудочной железы. Материалы и методы. В проспективное исследование включались пациенты с погранично резектабельным и нерезектабельным раком поджелудочной железы без отдаленных метастазов. Пациенты получали до 6 курсов индукционной химиотерапии по схеме FOLFIRINOX (оксалиплатин 85 мг / м2 в / в, иринотекан 180 мг / м2 в / в, фолинат кальция 400 мг / м2 в / в, 5-фторурацил 400 мг / м2 в / в стр. и 2400 мг / м2 в / в 46-час. инфузия) каждые 14 дней. При достижении рентгенологических признаков резектабельности пациентов оперировали. В случае сохранения нерезектабельности пациентам назначалась поддерживающая химиотерапия. Основной конечной точкой была одногодичная выживаемость без прогрессирования. Результаты исследования. В исследование включено 32 пациента. Медиана длительности наблюдения составила 7,0 месяцев...
Погранично резектабельный рак поджелудочной железы, местнораспространенный рак поджелудочной железы, индукционная терапия
Короткий адрес: https://sciup.org/140243776
IDR: 140243776 | DOI: 10.18027
Текст научной статьи Эффективность и безопасность индукционной химиотерапии по схеме Folfirinox при погранично резектабельном и нерезектабельном раке поджелудочной железы
Согласно мировым данным, рак поджелудочной железы (РПЖ) остается одной из ведущих причин смерти пациентов со злокачественными новообразованиями [1]. Количество российских пациентов с впервые выявленным диагнозом РПЖ в 2016 г. составило 14 900, при этом летальность в течение года с момента установления диагноза достигла 68% [2]. Во многом это связано с высокой агрессивностью данного заболевания: РПЖ прогрессирует от I до IV стадии в среднем за 1,3 года [3]. Помимо этого, на данный момент отсутствуют методы ранней диагностики, а симптомы заболевания на ранних стадиях не являются специфичными, в связи с чем РПЖ диагностируется на резектабельной стадии менее чем в 20% случаев [4].
Достижение R0-резекции является основной целью операции, так как продолжительность жизни пациентов в случае ее выполнения значимо выше, чем при R1-резек-ции [5]. К сожалению, частота выполнения R0-резекций низка из-за ранней инвазии опухолью окружающих струк- тур и технической сложности операций [6, 7], вследствие чего растет интерес к индукционной терапии при данном заболевании.
Вплоть до 2011 г. в стандарты лечения погранично ре-зектабельного и местнораспространенного РПЖ входили режимы на основе гемцитабина с или без консолидирующей химиолучевой терапии, при этом общая продолжительность жизни пациентов составляла 9–15 месяцев, а хирургический этап лечения удавалось выполнить менее чем в 10% случаев [8–15].
Настоящим прорывом в лечении РПЖ стало внедрение в практику режима FOLFIRINOX, приводящего к увеличению продолжительности жизни пациентов почти в два раза по сравнению с гемцитабином в рандомизированном исследовании PRODIGE 4/ACCORD 11 [16]. Результаты исследования, опубликованные в 2011 г., сделали данный режим стандартом первой линии химиотерапии метастатического РПЖ. В настоящее время появились первые данные эффективности этого режима химиотерапии в рамках индукционной терапии неметастатического процесса, которые в большинстве представлены ретроспективными исследованиями [17– 19]. Целью настоящего проспективного исследования стала оценка эффективности и токсичности режима FOLFIRINOX при погранично резектабельном и нерезек-табельном РПЖ.
Методы
Дизайн исследования
В рамках данного проспективного исследования пациенты с погранично резектабельным и нерезектабельным РПЖ получали от 2 до 6 курсов химиотерапии по схеме FOLFIRINOX. Перед началом химиотерапии всем пациентам имплантировалась венозная порт-система. Минимальная премедикация включала в/в введение антагониста серотониновых 5-НТ3-рецепторов и дексаметазона, а также п/к введение 0,5–1,0 мл 0,1% раствора атропина перед началом инфузии иринотекана (при отсутствии противопоказаний). Расчет площади поверхности тела производился по формуле Мостеллера на реальную массу тела. После премедикации в течение двух часов в/в вводился оксалиплатин в дозе 85 мг/м2, разведенный на 500 мл 5%-го раствора декстрозы. После окончания инфузии оксалиплатина одновременно вводился иринотекан в дозе 180 мг/м2 в течение 90 мин. и фолинат кальция в дозе 400 мг/м2 в течение 120 мин. Далее следовало в/в болюсное введение 5-фторурацила 400 мг/м2 и в/в капельное введение 5-фторурацила в дозе 2400 мг/м2 в течение 46 ч. через центральный венозный доступ. Повторяемость курсов – каждые 14 дней.
Другие препараты сопроводительной терапии, такие как апрепитант и гранулоцитарные колониестимулирующие факторы (Г-КСФ), рутинно не применялись, однако рассматривались при возникновении осложнений на фоне предыдущего курса химиотерапии.
В случае возникновения неприемлемой токсичности допускалась редукция доз препаратов. Очередной курс химиотерапии начинался только при соответствии следующим критериям: абсолютное число нейтрофилов > 1 500 кл./мкл, абсолютное число тромбоцитов > 100 000 кл./мкл, проявления негематологической токсичности не выше 1 степени тяжести. В противном случае курс химиотерапии откладывался до снижения степени тяжести нежелательных явлений. В случае значительной длительности нежелательных явлений, потребовавших отсрочки начала очередного курса химиотерапии на более чем две недели, химиотерапия полностью отменялась.
В рамках исследования допускалось применение дистанционной лучевой терапии на первичную опухоль после окончания индукционной химиотерапии. Использовалась стереотаксическая лучевая терапия с пятидневным режимом фракционирования дозы излучения: разовая оча- говая доза (РОД) 7,5 Гр, 5 раз в нед., суммарная очаговая доза (СОД) – 37,5 Гр. При невозможности ограничения дозы облучения органов риска предписанная РОД снижалась до 6 Гр, СОД в этом случае составляла 30 Гр. При значительных размерах опухоли проводилась дистанционная лучевая терапия со стандартным фракционированием.
Пациенты оценивались в отношении хирургического лечения после окончания индукционной химиотерапии по схеме FOLFIRINOX и после лучевой терапии. Определение частоты достижения резектабельности являлось одной из задач настоящего исследования. После операции или после окончания индукционной терапии допускалось применение адъювантной/поддерживающей терапии, при этом чтобы общая продолжительность химиотерапии составляла не менее 6 месяцев.
Оценка эффекта лечения и сроков до прогрессирования выполнена по данным КТ-ангиографии брюшной полости. Оценка размеров и распространенности опухоли с помощью КТ производилась в течение 30 дней до начала лечения, после трех и после шести курсов химиотерапии. После окончания лечения динамика опухолевого процесса оценивалась по КТ каждые 12 недель до прогрессирования заболевания, оцениваемого по критериям RECIST 1.1. Степень тяжести побочных эффектов оценивалась согласно критериям токсичности NCI CTCAE v. 4.03.
Пациенты
Для включения в исследование пациенты должны были удовлетворять всем следующим критериям:
-
1. Возраст старше 18 лет.
-
2. Гистологически или цитологически верифицированный диагноз РПЖ.
-
3. Отсутствие отдаленных метастазов (М0).
-
4. Нерезектабельный опухолевый процесс согласно критериям Американской ассоциации по изучению заболеваний печеночно-дуоденальной зоны (American Hepato-Pancreato-Biliary Association, AHPBA) [20].
-
5. Отсутствие предшествующей химиотерапии, лучевой терапии.
-
6. Отсутствие других методов противоопухолевого лечения, включая значительные по объему хирургические вмешательства, по крайней мере за три недели до включения в исследование.
-
7. Общее состояние по шкале Карновского 80% или более.
-
8. Предполагаемая продолжительность жизни не менее 12 недель.
-
9. У женщин возможность забеременеть в течение исследования должна быть прервана применением усовершенствованного метода контрацепции (ВМС, пероральные противозачаточные препараты либо механические противозачаточные средства) в течение исследования и в течение трех месяцев после его окончания.
-
10. Адекватная функция костного мозга, выраженная в следующих показателях периферической крови: количество нейтрофилов > 1 500 х 10 6 /л, тромбоцитов > 100 000 х 106/л, гемоглобин ≥ 90 г/л.
-
11. Адекватная функция печени: общий билирубин < 2 х ВГН (пациенты с повышенным уровнем билирубина допускались при условии тенденции к снижению билирубина на фоне адекватного желчеотведения), АЛТ и АСТ < 2,5 х ВГН.
-
12. Отсутствие почечной недостаточности: креатинин < 115 ммоль/л и/или клиренс креатинина согласно формуле Кокрофта-Гоулта > 50 мл/мин.
-
13. Информированное согласие пациентов на участие в исследовании.
Статистический анализ
Первичной конечной точкой выбрана выживаемость без прогрессирования. Кроме того, исследование предполагало оценку частоты объективных эффектов, частоты резекций поджелудочной железы, общей выживаемости, а также безопасности химиотерапии.
Описательная статистика номинальных и порядковых переменных предусматривала расчет доли и представлена в виде n (%). Описательная статистика количественных переменных включала расчет медианы, а также минимального и максимального значений переменной. Использование такого способа представления результатов продиктовано небольшим числом пациентов в группе и ненормальным характером распределения при анализе количественных переменных. Статистический анализ полученных результатов выполнен с использованием программ Microsoft Excel 2007 и IBM SPSS Statistics v. 17.0.
Результаты
Таблица 1. Общая характеристика включенных в исследование пациентов (n=32)
|
Параметр |
Значение |
|
Мужской пол Женский пол |
13 (40,6%) 19 (59,4%) |
|
Возраст, лет Медиана (минимум – максимум) |
61 (40–75) |
|
Статус Карновского, n (%) 90–100% 80% 70% |
20 (62,5%) 11 (34,4%) 1 (3,1%) |
|
Стадия Т, n (%) Т2 Т3 Т4 |
3 (9,4%) 14 (43,8%) 15 (46,9%) |
|
Наличие метастазов в регионарных лимфоузлах, n (%) |
15 (46,9%) |
|
Резектабельность по AHPBA, n (%) Погранично резектабельный Нерезектабельный |
10 (31,2%) 22 (68,8%) |
|
Локализация первичной опухоли, n (%) Головка Тело или хвост |
23 (71,9%) 9 (28,1%) |
|
Диаметр первичной опухоли, мм Медиана (минимум – максимум) |
43 (20–70) |
|
СА 19–9, Ед/мл Медиана (минимум – максимум) |
313 (1–10000) |
|
Повышение уровня общего билирубина > ВГН, но < 2 х ВГН, n (%) |
6 (18,8%) |
|
Уровень альбумина, г/л Медиана (минимум – максимум) |
40,4 (36–47) |
|
Нейтрофильно-лимфоцитарное отношение (НЛО) Медиана (минимум – максимум) |
2,6 (1–6,5) |
|
Уровень гемоглобина, г/дл Медиана (минимум – максимум) |
13,4 (11–16) |
|
Уровень тромбоцитов, х 10 3 /мкл Медиана (минимум – максимум) |
245 (129–553) |
|
Процент снижения массы тела Медиана (минимум – максимум) |
13 (0–39) |
|
Употребление анальгетиков, n (%) Нет НПВС/трамадол Наркотические препараты Нет данных |
10 (31,3%) 20 (62,5%) 1 (3,1%) 1 (3,1%) |
|
Желчеразгрузочные процедуры, n (%) Нет Наложение анастомозов Стентирование Чрескожная чреспеченочная холангиостомия |
15 (46,9%) 7 (21,9%) 4 (12,5%) 6 (18,8%) |
Характеристика пациентов
В период с 2011 по 2017 г. в данное исследование включено 32 пациента, характеристика которых представлена в табл. 1.
В исследование были включены только пациенты с погранично резектабельными и нерезектабельными опухолями, в удовлетворительном общем состоянии, с нормальными показателями альбумина, билирубина, а также показателями форменных элементов периферической крови. Следует отметить, что трое пациентов с первичной опухолью стадии Т2 имели распространенный процесс из-за вовлечения в конгломераты регионарных лимфоузлов крупных кровеносных сосудов.
Медиана числа курсов химиотерапии составила 6 (2–6). В 26 (81,2%) случаях причиной прекращения химиотерапии было завершение всего запланированного объема лечения. Прогрессирование процесса послужило причиной прекращения химиотерапии у трех (9,4%) пациентов, токсичность лечения – также у трех (9,4%). После завершения химиотерапии в 21 (65,6%) случае проведена лучевая терапия: курс стереотаксической лучевой терапии – 19 пациентам, курс конформной лучевой терапии со стандартным фракционированием – двум.
После окончания индукционного лечения или после операции 9 (28,1%) пациентов получили от 3 до 6 курсов поддерживающей химиотерапии. Из них 7 (21,9%) пациентов получили капецитабин в монорежиме и 2 (6,3%) пациента – гемцитабин.
Эффективность
Объективный эффект, согласно критериям RECIST 1.1, был достигнут в пяти случаях (15,6%). В 24 (75%) случаях наблюдалась стабилизация процесса длительностью 12 недель или более. Прогрессирование заболевания зарегистрировано в трех (9,4%) случаях. В 15 (46,9%) случаях отмечено клиническое улучшение в виде уменьшения выраженности болевого синдрома и/или положительной динамики массы тела.
Медиана длительности наблюдения за пациентами составила 7,0 мес. (2,1–24,8 мес.). К моменту проведения анализа умерли 11 пациентов. В 17 случаях зарегистрировано прогрессирование заболевания по данным КТ. Медиана времени без прогрессирования составила 13 мес. (1,1–23 мес.), одногодичная выживаемость без прогрессирования – 55,3% (рис. 1). Расчетная медиана продолжительности жизни составила 24,8 мес., одногодичная общая выживаемость – 83,2% (рис. 2).
Таблица 2. Токсичность химиотерапии по схеме FOLFIRINOX
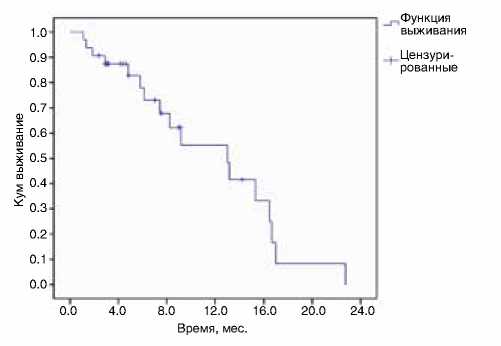
Рисунок 1. Кривая выживаемости без прогрессирования
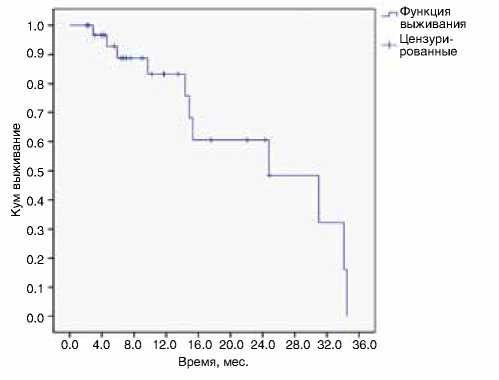
Рисунок 2. Кривая общей выживаемости пациентов
После индукционной терапии хирургическое лечение в объеме гастропанкреатодуоденальной резекции или дистальной субтотальной резекции поджелудочной железы удалось выполнить 8 (25%) пациентам. Из них пять пациентов прооперированы после окончания химиотерапии без использования лучевой терапии. Все они исходно имели погранично резектабельный процесс. Трое пациентов прооперированы после химиотерапии и лучевой терапии: один имел погранично резектабельный процесс и двое – местнораспространенный. В 7 случаях выполнена R0-резекция, в одном случае – R1-резекция.
Токсичность
В 7 (21,9%) случаях химиотерапия начата с исходной редукцией доз иринотекана или 5-фторурацила. Редукция доз препаратов обусловлена неблагоприятным состоянием пациентов на момент начала лечения. В 22 (68,8%) случаях потребовалась редукция доз препаратов в процессе терапии.
Г-КСФ были применены у 24 (75%) пациентов. У 19 (59,4%) пациентов Г-КСФ применяли начиная с первого курса химиотерапии в качестве первичной профилактики нейтропении. Еще в пяти (15,6%) случаях Г-КСФ использовали в качестве вторичной профилактики, если во время лечения отмечалась нейтропения, не позволившая начать очередной курс химиотерапии вовремя. Решение в пользу первичной профилактики нейтропении с использованием Г-КСФ принималось, исходя из общего состояния пациента, алиментарных нарушений, возраста,
|
Параметр |
Все степени |
3–4 степень |
|
Нейтропения |
18 (56,3%) |
15 (46,9%) |
|
Фебрильная нейтропения |
0 |
0 |
|
Тромбоцитопения |
10 (31,3%) |
0 |
|
Анемия |
6 (18,8%) |
1 (3,1%) |
|
Алопеция |
32 (100%) |
– |
|
Диарея |
17 (53,1%) |
4 (12,5%) |
|
Стоматит |
1 (3,1%) |
0 |
|
Тошнота |
11 (34,4%) |
0 |
|
Нейропатия |
9 (28,1%) |
0 |
|
Повышение уровня трансаминаз > ВГН |
5 (15,6%) |
4 (12,5%) |
|
Повышение уровня билирубина > ВГН |
3 (9,4%) |
0 |
|
Кожная токсичность |
1 (3,1%) |
0 |
|
Астения |
11 (34,4%) |
0 |
|
Холангит |
2 (6,3%) |
0 |
Примечание. ВГН – верхняя граница нормы.
наличия сопутствующей патологии, а также отклонений лабораторных показателей.
Токсичность химиотерапии по схеме FOLFIRINOX представлена в табл. 2. В основном явления токсичности были 1–2 степени выраженности и включали нейтропению (56,3%), тромбоцитопению (31,3%), анемию (18,8%), диарею (53,1%), тошноту (34,4%), периферическую сенсорную полинейропатию (28,1%), а также астению (34,4%). Среди токсичности 3–4 степени преобладали нейтропения (46,9%) и диарея (12,5%), которые явились основными причинами отсрочек начала очередного курса химиотерапии, редукции доз препаратов в 16 (50%) случаях, а также полной отмены химиотерапии у трех (9,4%) пациентов. Случаев фебрильной нейтропении не отмечено. У пациентов с холангиостомами и билиарными стентами наблюдались явления транзиторного повышения печеночных трансаминаз, а также два случая холангита на фоне обструкции стом.
Обсуждение
Задачей индукционной терапии при неметастатическом РПЖ является улучшение отдаленных результатов лечения и повышение вероятности выполнения радикальной операции в объеме R0. На данный момент неизвестно, какой режим химиотерапии наиболее эффективен в качестве индукционной терапии при погранично резек-табельных и нерезектабельных опухолях, вследствие отсутствия результатов рандомизированных исследований 2–3 фазы. В настоящей работе в качестве индукционной терапии при погранично резектабельном и нерезекта-бельном РПЖ использован режим FOLFIRINOX, показавший не только наилучшие отдаленные результаты, но и наибольшую частоту объективных эффектов среди всех режимов химиотерапии при метастатическом РПЖ [16, 21–23].
Эффективность режима FOLFIRINOX при неметастатическом опухолевом процессе оценивалась в нескольких небольших нерандомизированных исследованиях, большинство из которых носили ретроспективный характер. Результаты этих исследований обобщены в метаанализе, включившем информацию о 315 пациентах с местнораспространенным РПЖ. Метаанализ продемонстрировал высокую эффективность режима FOLFIRINOX: медиана времени без прогрессирования составила 15 месяцев, а медиана продолжительности – 24,2 месяца. Одногодичная общая выживаемость составила 80%. Помимо этого, были представлены высокие цифры достижения резекта-бельности опухоли после применения FOLFIRINOX: 25,9% пациентов были прооперированы, из которых в 78,4% случаев была достигнута R0-резекция [24]. Вероятно, высокая частота резектабельности связана с использованием современных методов лучевой терапии, которые были дополнительно применены в 57% случаев после окончания химиотерапии.
Результаты нашего исследования соответствуют опубликованным данным: одногодичная общая выживаемость составила 83,2%. Расчетная медиана продолжительности жизни в представленном исследовании составила 24,8 месяца. Однако ее интерпретация требует осторожности с учетом недостаточной зрелости результатов.
Эффективность режима FOLFIRINOX, продемонстрированная в данном исследовании, превосходит эффективность гемцитабин-содержащей химиотерапии, достигнутой в исследовании LAP07. Последнее является наиболее крупным из исследований, посвященных эффективности индукционной терапии неметастатического РПЖ [15]. В рамках клинического исследования LAP07 пациенты получали индукционную химиотерапию гемцитабином ± эрлотинибом с последующей хи-миолучевой терапией или продолжением химиотерапии в зависимости от результата рандомизации. По данным исследования, одногодичная выживаемость без прогрессирования болезни составила 23% для группы, получавшей монотерапию гемцитабином, и 19% для группы, получавшей комбинацию гемцитабина с эрлотинибом. В нашем исследовании одногодичная выживаемость без прогрессирования процесса оказалась выше и составила 55,3%. Следует отметить, что отчасти более высокая выживаемость без прогрессирования может быть связана с включением в наше исследование пациентов с погранично резектабельными опухолями, однако доля таких пациентов была невысока (31%).
К сожалению, значительная часть пациентов с погранично резектабельными карциномами оперируются в объеме R1/R2-резекций. По данным крупного японского исследования, из 375 пациентов неметастатическим РПЖ 137 расценены как резектабельные на дооперационном этапе. В 77% случаев им удалось выполнить R0-резекцию. В отличие от этого среди 142 пациентов с опухолями пограничной резектабельности частота выполнения R0-ре-зекций была существенно ниже: при вовлечении воротной вены – 70%, при вовлечении общей печеночной артерии – 48%, а при вовлечении верхней брыжеечной артерии – 37% [25].
Способность предоперационной терапии увеличивать частоту R0-резекций доказана во многих исследованиях. В 2011 г. опубликованы результаты метаанализа, который включил 2184 пациента с резектабельными и нерезекта-бельными карциномами поджелудочной железы. Метаанализ продемонстрировал существенное уменьшение риска положительных краев резекции при проведении предоперационной химиолучевой терапии (отношение рисков (ОР) 0,44, 95% доверительный интервал (ДИ) 0,29– 0,65) [26]. Увеличение частоты выполнения R0-резекций отразилось и на отдаленных результатах лечения. Продемонстрировано увеличение продолжительности жизни по сравнению с группой пациентов, не получавших химио-лучевую терапию (ОР=0,56, 95% ДИ 0,39–0,80). При этом продолжительность жизни пациентов при погранично резектабельных и нерезектабельных опухолях сравнялась с продолжительностью жизни пациентов при исходно ре-зектабельных опухолях.
Однако возможность индукционной терапии перевести исходно нерезектабельный процесс в резектабельный до сих пор вызывает сомнение у многих онкологов. Сравнительно невысокая эффективность консервативного лечения РПЖ не позволяет в большинстве случаев добиться уменьшения опухоли до размера, достаточного для выполнения радикального хирургического вмешательства. Несмотря на то, что отдельные ретроспективные анализы сообщают о вероятности выполнения R0-резекции более чем в 25% случаев нерезектабельной карциномы после индукционной терапии [27], в самом крупном исследовании LAP07 при местнораспространенном РПЖ было прооперировано только 4% пациентов [15]. В нашем исследовании хирургический этап лечения был выполнен 8 пациентам, что составило 25% случаев. В 7 случаях выполнена R0-резекция. Тем не менее 6 из 8 прооперированных случаев представлены погранично резектабельным процессом. Только двое из 22 (9%) пациентов, имевших нерезектабельный процесс на момент начала индукционной химиотерапии, были радикально прооперированы.
Значительную разницу в частоте выполненных операций следует объяснять не только интенсивностью индукционной химиотерапии, но и опытом хирургов конкретной клиники, а также отсутствием единого стандарта определения резектабельности опухоли. Так, на данный момент к наиболее часто применяемым критериям резектабель-ности опухоли относятся рекомендации Национальной всеобщей онкологической сети (National Comprehensive Cancer Network, NCCN), Американской ассоциации по изучению заболеваний печеночно-дуоденальной зоны (the Americas Hepato-Pancreato-Biliary Association, AHPBA), Общества хирургической онкологии (the Society of Surgical Oncology, SSO) и Общества хирургии пищевари- тельного тракта (the Society for Surgery of the Alimentary Tract, SSAT) [28]; помимо этого, в некоторых центрах имеются свои критерии, что может влиять на тактику лечения. Более того, после завершения химиотерапии пациенты зачастую получали дополнительную терапию, влияние которой на результаты лечения неясно. К примеру, по данным метаанализа, при исходно местнораспространенном РПЖ добавление лучевой терапии к химиотерапии по схеме FOLFIRINOX сопровождалось большей частотой хирургических вмешательств: 12% прооперированных пациентов – в результате применения только химиотерапии и 28% – при добавлении лучевой терапии [29]. В нашем исследовании оценить роль лучевой терапии в отношении достижения резектабельности не представляется возможным из-за небольшого числа пациентов.
Токсичность в нашем исследовании оказалась высокой, несмотря на строгие критерии отбора участников. Нейтропения 3–4 степени и диарея 3–4 степени являлись основными видами токсичности, повлиявшими на дозовую интенсивность химиотерапии и частоту применения Г-КСФ. В целом токсичность оказалась сопоставимой с таковой, опубликованной в рандомизированном исследовании ACCORD11/PRODIGE4 [16]. Частота применения Г-КСФ, включая первичную и вторичную профилактику, в нашем исследовании составила 75%, что выше, чем в исследовании ACCORD11/PRODIGE4, однако вполне согласуется с другими опубликованными данными [24, 30].
Таким образом, режим FOLFIRINOX, по данным нашего исследования, продемонстрировал высокую эффективность в качестве индукционной терапии при погранично резектабельном и местнораспространенном РПЖ. Основным ограничивающим фактором широкого применения режима FOLFIRINOX является его высокая токсичность и трудность реализации, заключающаяся в необходимости обеспечения центрального венозного доступа, двухсуточной инфузии 5-фторурацила и более интенсивной сопроводительной терапии. Тем не менее данный режим химиотерапии следует рассматривать как один из стандартов индукционной химиотерапии РПЖ.
Список литературы Эффективность и безопасность индукционной химиотерапии по схеме Folfirinox при погранично резектабельном и нерезектабельном раке поджелудочной железы
- Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M. et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer. 2015. Vol. 136. No. 5.
- Состояние онкологической помощи населению России в 2016 году. По ред. Каприна А. Д., Старинского В. В., Петровой Г. В. М.: МНИОИ им. П. А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2017. 236 с.
- Sostoyanie onkologicheskoy pomoshchi naseleniyu Rossii v 2016 godu. Eds. Kaprin A. D., Starinskiy V. V., Petrova G. V. Moscow: P. A. Hertsen Moscow Oncology Research Center -branch of FSBI NMRRC of the Ministry of Health of Russia. 2017. 236 p. (In Russ.)
- Yu J., Blackford A. L., Dal Molin M., Wolfgang C. L., Goggins M. Time to progression of pancreatic ductal adenocarcinoma from low-to-high tumour stages. Gut. 2015. Vol. 64. P. 1783-9.
- Stathis A., Moore M. J. Advanced pancreatic carcinoma: current treatment and future challenges. Nature reviews Clinical oncology. 2010. Vol. 7. No. 3. P. 163-172.
- Verbeke C. S., Menon K. V. Redefining resection margin status in pancreatic cancer. Hpb. 2009. Vol. 11. No. 4. P. 282-289.
- Schnelldorfer T., Ware A. L., Sarr M. G., Smyrk T. C., Zhang L., Qin R. et al. Long-term survival after pancreatoduodenectomy for pancreatic adenocarcinoma: is cure possible? Annals of surgery. 2008. Vol. 247. No. 3. P. 456-462.
- Esposito I., Kleeff J., Bergmann F., Reiser C., Herpel E., Friess H. et al. Most pancreatic cancer resections are R1 resections. Annals of surgical oncology. 2008. Vol. 15. No. 6. P. 1651-1660.
- Assifi M. M., Lu X., Eibl G., Reber H. A., Li G., Hines O. J. Neoadjuvant therapy in pancreatic adenocarcinoma: a meta-analysis of phase II trials. Surgery. 2011. Vol. 150. No. 3. P. 466-473.
- Loehrer Sr P. J., Feng Y., Cardenes H., Wagner L., Brell J. M., Cella D. Gemcitabine alone versus gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer: an Eastern Cooperative Oncology Group trial. Journal of Clinical Oncology. 2011. Vol. 29. No. 31. P. 4105-4112.
- Huguet F., Andre T., Hammel P., Artru P., Balosso J., Selle F. Impact of chemoradiotherapy after disease control with chemotherapy in locally advanced pancreatic adenocarcinoma in GERCOR phase II and III studies. Journal of Clinical Oncology. 2007. Vol. 25. No. 3. P. 326-331.
- Ammori J. B., Colletti L. M., Zalupski M. M., Eckhauser F. E., Greenson J. K., Dimick J. et al. Surgical resection following radiation therapy with concurrent gemcitabine in patients with previously unresectable adenocarcinoma of the pancreas. Journal of gastrointestinal surgery. 2003. Vol. 7. No. 6. P. 766-772.
- Cardenes H. R., Moore A. M., Johnson C. S., Yu M., Helft P., Chiorean E. G. et al. A phase II study of gemcitabine in combination with radiation therapy in patients with localized, unresectable, pancreatic cancer: a Hoosier Oncology Group study. American journal of clinical oncology. 2011. Vol. 34. No. 5. P. 460-465.
- Massucco P., Capussotti L., Magnino A., Sperti E., Gatti M., Muratore A. et al. Pancreatic resections after chemoradiotherapy for locally advanced ductal adenocarcinoma: analysis of perioperative outcome and survival. Annals of surgical oncology. 2006. Vol. 13. No. 9. P. 1201-1208.
- Small Jr W., Berlin J., Freedman G. M., Lawrence T., Talamonti M. S., Mulcahy M. F. et al. Full-dose gemcitabine with concurrent radiation therapy in patients with nonmetastatic pancreatic cancer: a multicenter phase II trial. Journal of Clinical Oncology. 2008. Vol. 26. No. 6. P. 942-947.
- Hammel P., Huguet F., van Laethem J. L., Goldstein D., Glimelius B., Artru P. et al. Effect of chemoradiotherapy vs chemotherapy on survival in patients with locally advanced pancreatic cancer controlled after 4 months of gemcitabine with or without erlotinib: the LAP07 randomized clinical trial. Jama. 2016. Vol. 315. No. 17. P. 1844-1853.
- Conroy T., Desseigne F., Ychou M., Bouche O., Guimbaud R., Becouarn Y. et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. New England Journal of Medicine. 2011. Vol. 364. No. 19. P. 1817-1825.
- Marthey L., Sa-Cunha A., Blanc J. F., Gauthier M., Cueff A., Francois E. et al. FOLFIRINOX for locally advanced pancreatic adenocarcinoma: results of an AGEO multicenter prospective observational cohort. Annals of surgical oncology. 2015. Vol. 22. No. 1. P. 295-301.
- Boone B. A., Steve J., Krasinskas A. M., Zureikat A. H., Lembersky B. C., Gibson M. K. et al. Outcomes with FOLFIRINOX for borderline resectable and locally unresectable pancreatic cancer. Journal of surgical oncology. 2013. Vol. 108. No. 4. P. 236-241.
- Hosein P. J., Macintyre J., Kawamura C., Maldonado J. C., Ernani V., Loaiza-Bonilla A. et al. A retrospective study of neoadjuvant FOLFIRINOX in unresectable or borderline-resectable locally advanced pancreatic adenocarcinoma. BMC cancer. 2012. Vol. 12. No. 1. P. 199.
- Callery M. P., Chang K. J., Fishman E. K., Talamonti M. S., Traverso L. W., Linehan D. C. Pretreatment assessment of resectable and borderline resectable pancreatic cancer: expert consensus statement. Annals of surgical oncology. 2009. Vol. 16. No. 7. P. 1727-1733.
- Moore M. J., Goldstein D., Hamm J., Figer A., Hecht J. R., Gallinger S. et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. Journal of clinical oncology. 2007. Vol. 25. No. 15. P. 1960-1966.
- Von Hoff D. D., Ervin T., Arena F. P., Chiorean E. G., Infante J., Moore M. et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. New England Journal of Medicine. 2013. Vol. 369. No. 18. P. 1691-1703.
- Cunningham D., Chau I., Stocken D. D., Valle J. W., Smith D., Steward W. et al. Phase III randomized comparison of gemcitabine versus gemcitabine plus capecitabine in patients with advanced pancreatic cancer. Journal of Clinical Oncology. 2009. Vol. 27. No. 33. P. 5513-5518.
- Suker M., Beumer B. R., Sadot E., Marthey L., Faris J. E., Mellon E. A. et al. A patient-level meta-analysis of FOLFIRINOX for locally advanced pancreatic cancer. The Lancet. Oncology. 2016. Vol. 17. No. 6. P. 801.
- Yamada S., Fujii T., Sugimoto H., Nomoto S., Takeda S., Kodera Y., Nakao A. Aggressive surgery for borderline resectable pancreatic cancer: evaluation of National Comprehensive Cancer Network guidelines. Pancreas. 2013. Vol. 42. No. 6. P. 1004-1010.
- Laurence J. M., Tran P. D., Morarji K., Eslick G. D., Lam V. W. T., Sandroussi C. A. systematic review and meta-analysis of survival and surgical outcomes following neoadjuvant chemoradiotherapy for pancreatic cancer. Journal of Gastrointestinal Surgery. 2011. Vol. 15. No. 11. P. 2059.
- Hosein P. J., Macintyre J., Kawamura C., Maldonado J. C., Ernani V., Loaiza-Bonilla A. et al. A retrospective study of neoadjuvant FOLFIRINOX in unresectable or borderline-resectable locally advanced pancreatic adenocarcinoma. BMC cancer. 2012. Vol. 12. No. 1. P. 199.
- Lopez N. E., Prendergast C., Lowy A. M. Borderline resectable pancreatic cancer: definitions and management. World Journal of Gastroenterology: WJG. 2014. Vol. 20. No. 31. P. 10740.
- Rombouts S. J., Walma M. S., Vogel J. A., van Rijssen L. B., Wilmink J. W., Mohammad N. H. et al. Systematic review of resection rates and clinical outcomes after FOLFIRINOX-based treatment in patients with locally advanced pancreatic cancer. Annals of surgical oncology. 2016. Vol. 23. No. 13. P. 4352-4360.
- Petrelli F., Coinu A., Borgonovo K., Cabiddu M., Ghilardi M., Lonati V. et al. FOLFIRINOX-based neoadjuvant therapy in borderline resectable or unresectable pancreatic cancer: a meta-analytical review of published studies. Pancreas. 2015. Vol. 44. No. 4. P. 515-521.


