Эффективность и безопасность эрибулина при различных подтипах рака молочной железы: данные из реальной клинической практики в России
Автор: Манзюк Людмила В., Коваленко Елена И., Горбунова Вера А., Болотина Лариса В., Семиглазова Татьяна Ю., Жиляева Лариса А., Мишина Юлия А.,
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 3 (24), 2017 года.
Бесплатный доступ
В статье представлен обобщенный опыт применения эрибулина в реальной клинической практике онкологических учреждений РФ при метастатическом раке молочной железы. Проанализирована эффективность препарата в монотерапии при HER2-отрицательном раке молочных желез, выделены группы больных в зависимости от локализации метастазов, линии терапии, в которых препарат оказался максимально эффективным. Описана эффективность препарата в комбинации с трастузумабом при HER2-положительном раке молочной железы, а также токсические реакции.
Метастатический рак молочной железы, химиотерапия, эрибулин
Короткий адрес: https://sciup.org/140223358
IDR: 140223358 | DOI: 10.18027/2224-5057-2017-7-3-46-56
Текст научной статьи Эффективность и безопасность эрибулина при различных подтипах рака молочной железы: данные из реальной клинической практики в России
Метастатический рак молочной железы (мРМЖ) – хроническое заболевание, основной целью терапии которого является увеличение продолжительности и улучшение или сохранение качества жизни пациенток. Выбор системного лекарственного лечения, как и при раннем РМЖ, основывается на молекулярно-биологических подтипах опухоли. При этом химиотерапия остается неотъемлемым и значимым этапом лечения при любом биологическом подтипе. Современная парадигма лекарственного лечения большинства больных мРМЖ заключается в последовательной смене препаратов в монорежиме, что позволяет максимально долго и эффективно контролировать симптомы заболевания, сохраняя при этом качество жизни больных на достаточно высоком уровне [1]. В существующих клинических рекомендациях не указывается, в какой именно последовательности следует применять различные препараты после терапии антрациклиновыми антибиотиками и таксанами, так как объем доказательных данных, позволяющих ответить на этот вопрос, крайне ограничен.
Эрибулин – аналог галихондрина B, подавляет полимеризацию микротрубочек, что приводит к секвестрации тубулина и образованию его неактивных агрегатов. В результате необратимой блокады митоза нарушается пролиферация опухоли. С 2010 г. эрибулин уверенно завоевывает свои позиции в терапии мРМЖ в мире, а с 2013 г. – и в России. Его потенциальная эффективность после антрациклинов и таксанов продемонстрирована в двух рандомизированных исследованиях III фазы (305, 301). В исследовании EMBRACE (305) эрибулин продемонстрировал достоверное увеличение медианы общей выживаемости (ОВ) у больных, получивших минимум 2 линии лечения, по сравнению с терапией по выбору врача (винорелбин, капецитабин, гемцитабин и др.): 13,2 мес. vs 10,5 мес. (p=0,014) [2]. В исследовании 301 при сравнении с капецитабином у пациенток, получивших ранее минимум 1 линию, преимущество эрибулина в ОВ в 1,4 мес. не достигло статистической значимости (р=0,056) [3]. По данным заранее спланированного поданализа в группе эрибулина отмечено достоверное улучше-
Таблица 1. Характеристика больных (n=168)
В настоящее время в литературе представлены результаты исследования II фазы по оценке эффективности комбинации эрибулина с трастузумабом в первой линии химиотерапии (ХТ) HER2-позитивного мРМЖ, включавшего 52 больных, прогрессирование заболевания у которых наступило в сроки более 12 мес. после окончания неоадъювантной ХТ [7]. Комбинация продемонстрировала потенциальную эффективность: объективный ответ достигнут в 71,2% наблюдений (полные регрессии – в 5,8%, частичные – в 65,4%). Частота клинической эффективности (ЧКЭ) составила 84,6%, медиана выживаемости без про- грессирования (ВБП) – 11,6 мес. Комбинация эрибулина и трастузумаба характеризуется приемлемым профилем безопасности, что отражено в обновленной инструкции по применению эрибулина [8].
В настоящей статье представлен обобщенный опыт применения эрибулина в ежедневной клинической практике 22-х лечебных учреждений России. Основной целью данного ретроспективного анализа явилась оценка эффективности и переносимости эрибулина у пациенток с мРМЖ, предлеченных антрациклинами и таксанами. Наблюдательные исследования, в отличие от рандомизированных, не требуют жесткого отбора пациентов, что помогает оценить эффективность и переносимость новых препаратов и лечебных режимов с позиций реальной клинической практики, и вследствие этого представляют большой интерес для практикующих врачей.
Материалы и методы
В анализ включены данные 168 пациенток с распространенным РМЖ, получивших минимум 2 курса лечения эрибулином в соответствии с зарегистрированными показаниями к применению препарата в России. Сбор данных больных мРМЖ, наблюдавшихся как в онкологических диспансерах, так и в федеральных научных центрах России, проводился с июля 2013 по февраль 2017 г.
Все больные имели морфологическую (гистологическую) верификацию диагноза, известный биологический подтип опухоли, определявшийся по результатам иммуногистохимического исследования (ИГХ), удовлетворительную функцию печени, почек и костного мозга (абсолютное содержание гранулоцитов более 1,5 тыс/мм3, тромбоцитов более 100 тыс/мм3, гемоглобина более 10,0 г/дл), печени и почек.
Характеристика больных и особенности опухолевого процесса представлены в табл. 1.
В данный анализ реальной клинической практики были включены больные мРМЖ в удовлетворительном состоянии (ECOG 0-2) и среднем возрасте 53 года (колебания от 25 лет до 71 года). Большинство пациенток (134, 79,8%) имело HER2-негативный подтип опухоли: у 78 (46,4%) опухоль была эстроген-положительной, у 56 (33,3%) – тройной-негативной. HER2-позитивный биологический подтип был зарегистрирован у 34 (20%) пациенток РМЖ. Висцеральные метастазы определялись у большинства больных (78%). Метастатическое поражение 1 зоны отмечалось у 45 (26,5%), 2-х зон – у 50 (30%), 3-х и более зон – у 73 (43,5%) больных. Поражение легких метастазами выявлено у 86 (51,2%) пациенток, печени – у 78 (46,4%), костей – у 79 (47%). В анализ также были включены 10 (6%) пациенток с метастатическим поражением головного мозга, ранее уже получивших лучевую терапию на эту область. Локализация метастазов представлена на рис. 1.
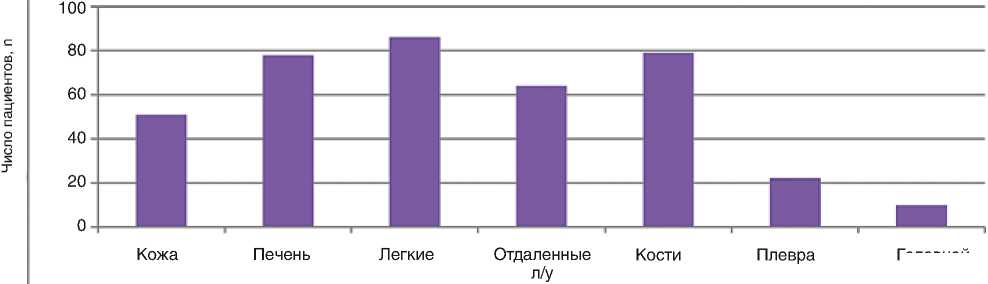
Рисунок 1. Локализация метастазов (n=168)
Головной мозг
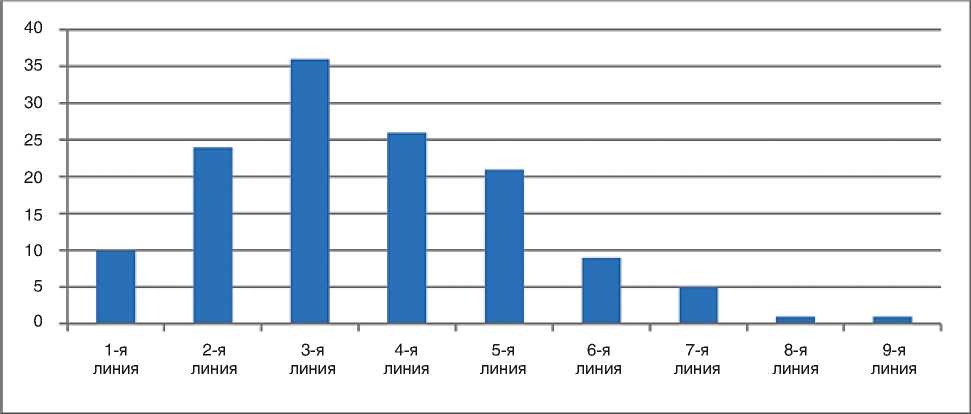
Рисунок 2. Распределение больных с HER2– опухолями в зависимости от линии лечения эрибулином (n=134)
Таблица 2.
Предшествующие режимы химиотерапии (n=168)
|
Предшествующая ХТ |
Значение |
|
|
n |
% |
|
|
Антрациклины и таксаны |
155 |
92,3* |
|
Только таксаны |
8 |
4,8 |
|
Только антрациклины |
5 |
3 |
|
Капецитабин |
69 |
41 |
*Эрибулин показан пациентам: с местно-распространенным или метастатическим раком молочной железы, получившим ранее не менее одного режима химиотерапии по поводу распространенного заболевания; предшествующая терапия должна включать антрациклины и таксаны в адъювантном режиме или в условиях метастатической формы заболевания, за исключением тех пациентов, которым не могли назначаться данные препараты
У включенных в исследование больных число предшествующих линий ХТ составило от 0 до 8 (медиана – 2). Варианты предшествующего лечения представлены в табл. 2.
Из табл. 2 видно, что практически все больные (92,3 %) ранее получали ХТ по поводу диссеминированного заболевания таксанами и антрациклинами, а 41 % получали также капецитабин. Во всех центрах химиотерапия эрибулином проводилась в стандартном режиме. Эрибулин назначался в дозе 1,4 мг /м2 в виде 2–5-минутной внутривенной инфузии в 1-й и 8-й дни 21-дневного цикла.
В 1-й линии лечение получили 10 (6 %) пациенток, во 2-й – 32 (19%), в 3-й – 46 (27,4%), в 4-й и более – 80 (47,6%) больных. Медиана числа циклов эрибулина составила 5 (диапазон 2–44). Все пациентки с HER2-положительным подтипом РМЖ получали эрибулин в комбинации с трастузумабом в стандартной дозе. При метастатическом поражении костей параллельно вводились остеомодифицирующие агенты в общепринятых режимах (бисфосфонаты, деносумаб).
Лечение эрибулином продолжалось до прогрессирования заболевания, развития неприемлемой токсичности или невозможности введения препарата по любой другой
Таблица 3. Эффективность эрибулина при HER2-отрицательном мРМЖ (n=134)
|
Параметр |
Вся группа, n=134 n (%) |
РЭ/РП+, n=78 n (%) |
ТН, n=56 n (%) |
|
Полная регрессия (ПР) |
4 (3) |
4 (5,1) |
0 |
|
Частичная регрессия (ЧР) |
23 (17,2) |
16 (20,5) |
7 (12,5) |
|
Стабилизация заболевания (СЗ) |
64 (47,8) |
41 (52,6) |
25 (44,6) |
|
Стабилизация заболевания >6 мес. |
22 (16,4) |
– |
– |
|
Прогрессирование (ПЗ) |
42 (31,3) |
17 (21,8) |
24 (42,9) |
|
ЧОО (ПР+ЧР) |
27 (20,1) |
20 (25,6) |
7 (12,5) |
|
КРО (ПР+ЧР+СЗ) |
91 (67,9) |
61 (78,2) |
32 (57,1) |
|
ЧКЭ (ПР+ЧР+СЗ>6 мес.) |
49 (36,6) |
– |
– |
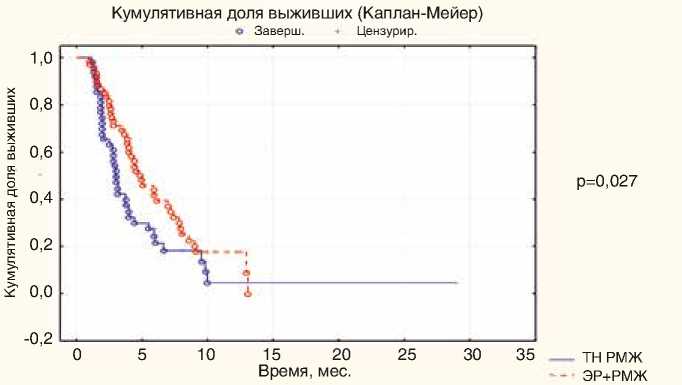
Рисунок 3. ВБП у пациенток с HER2-отрицательным мРМЖ в зависимости от фенотипа опухоли (n=134)
Результаты леченияHER2-отрицательного РМЖ
Большая часть пациенток с HER2-негативной опухолью (47%) получали лечение во 2-й, 3-й и 4-й линии (рис. 2).
Несмотря на интенсивную предшествующую ХТ, объективный эффект достигнут в 27 (20,1%) наблюдениях: полные регрессии – в 4 (3%), частичные – в 23 (17,2%). Чувствительными к лечению были метастазы в печень, легкие, кожу, головной мозг. Стабилизация болезни отмечалась у 64 больных (47,8%), из них у 22 (16,4%) – длительностью свыше 6 мес. Таким
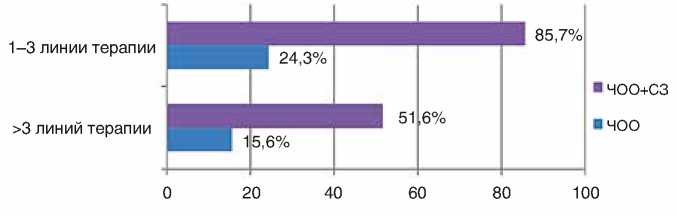
Рисунок 4. Эффективность эрибулина при HER2-отрицательном мРМЖ в зависимости от линии терапии (n=134)
причине, включая отказ от продолжения терапии или отсутствие препарата.
Эффективность оценивалась после каждых двух курсов химиотерапии эрибулином согласно критериям RECIST (версия 1.0–1.1). Отдельно оценена эффективность эрибулина при HER2-отрицательном и HER2-положительном мРМЖ. Также оценивалась выживаемость без прогрессирования болезни (ВБП), которая рассчитывалась по методу Каплан-Майера. Сравнение кривых выживаемости выполнялось при помощи лог-ранк теста. Оценка безопасности лечения осуществлялась согласно критериям NCI-CTC.
образом, контроль роста опухоли (КРО) (объективный ответ + стабилизация) составил 67,9%, а частота клинической эффективности (ЧКЭ) (объективный ответ + стабилизация более 6 мес.) – 36,6%. Прогрессирование заболевания отмечено у 42 (31,3%) больных.
Частота объективного ответа (ЧОО) была выше в группе люминального РМЖ по сравнению с тройным негативным: 25,6% vs 12,5%; КРО – 78,2% vs 57,1% соответственно. Прогрессирование заболевания отмечалось в 2 раза чаще при ТН РМЖ (42,9%), чем при люминальном подтипе (21,8%) (табл. 3).
Во всей группе HER2-отрицательного мРМЖ медиана ВБП составила 4,0 мес. (95% ДИ 2,02–7,85 мес.). В подгруппе люминального РМЖ – 4,47 мес. (95% ДИ 2,61–8,01), тройного-негативного – 3,0 мес. (95% ДИ 1,91–5,87), различия статистически достоверны (р=0,027) (рис. 3).
Эффективность эрибулина в зависимости от линии лечения была ожидаемо выше у больных, получавших препарат на более ранних этапах: ЧОО и КРО почти в 2 раза превосходили эти показатели по сравнению с пациентками, получавшими эрибулин в более поздних линиях (рис. 4).
1,0
-0,2
Кумулятивная доля выживших (Каплан-Мейер) Заверш. Цензурир.
0,8
0,6
0,4
0,2
0,0
15 20
Время, мес.
4-я и более линии 1–3-я линии
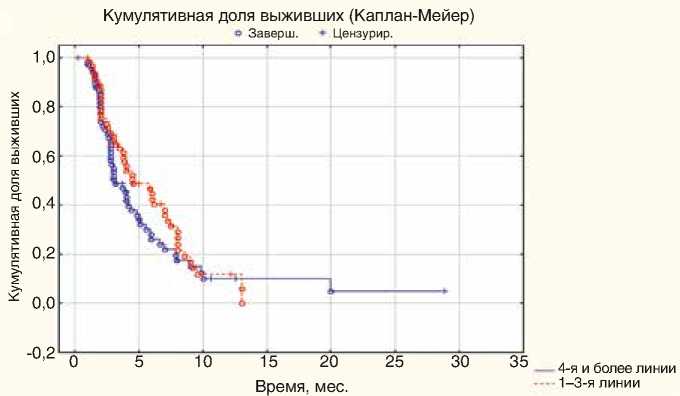
Рисунок 5. ВБП при HER2-отрицательном мРМЖ в зависимости от линии терапии (n=134)
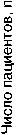
1-я 2-я 3-я 4-я 5-я 6-я 7-я 8-я 9-я линия линия линия линия линия линия линия линия линия
Рисунок 6. Распределение больных в зависимости от линии химиотерапии эрибули-ном у пациенток с HER2-положительным мРМЖ (n=34)
Медиана ВБП на ранних этапах лечения составила 4,46 мес. (95% ДИ 2,1–8,0) против 3,03 мес. на более поздних, но разница не достоверна (95% ДИ 2,0–6,2; р=0,28) (рис. 5).
Результаты леченияHER2-положительного РМЖ
В анализ включено 34 пациентки с HER2-положительным мРМЖ, из них 17 (50%) имели люминальный фенотип (РЭ/РП+HER2+), 17 (50%) – фенотип с гиперэкспрессией HER2 (РЭ-РП-HER2+). Распределение больных в зависимости от линии лечения представлено на рис. 6: во 2-й линии лечение получали 8 (23,5%) больных, в 3-й – 10 (29,4%), в 4-й и более – 16 (47,1%). Всего проведено 213 курсов ХТ эрибулином в комбинации с трастузумабом, медиана составила 5 курсов (диапазон 2–22).
Полные регрессии достигнуты у 2 (5,9%) больных, частичные – у 8 (23,5%), стабилизация – у 17 (50%), прогрессирование заболевания выявлено у 6 (17,6%). Таким образом, во всей группе ЧОО составила 29,5%, КРО – 79,4% (табл. 4). Объективный эффект отмечался у больных
Таблица 4. Эффективность комбинации эрибулина с трастузумабом при HER2-положительном мРМЖ (n=34)
Параметр
Вся группа, n=34 n (%)
РЭ/РП+HER2+, n=17 n (%)
|
ПР |
2 (5,9) |
1 (5,9) |
|
ЧР |
8 (23,5) |
6 (35,3) |
|
СЗ |
17 (50) |
8 (47,1) |
|
ПЗ |
6 (17,6) |
2 (11,8) |
|
ЧОО |
10 (29,5) |
7 (41,2) |
|
КРО |
27 (79,4) |
15 (88,2) |
Так, ЧОО при применении эрибулина в 1–3 линиях составила 24,3%, КРО – 85,7% против 15,6% и 51,6% соответственно в 4-й и более линиях лечения. Различия между показателями КРО статистически достоверны (р<0,05).
РЭ-РП-HER2+, n=17 n (%)
1 (5,9)
2 (11,8)
9 (52,9)
5 (29,4)
3 (17,6)
12 (70,6)
с метастазами в печень, легкие, отдаленные лимфоузлы, кости, головной мозг (1 больная). В группе люминального подтипа РЭ/РП+HER2+ ЧОО составила 41,2%, КРО – 88,2%, при HER2- экспрессирующих опухолях (РЭ-РП-HER2+) – 17,6% и 70,6% соответственно.
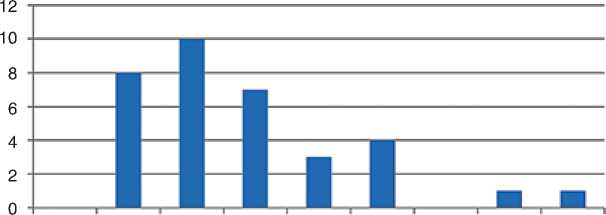
Медиана ВБП у пациенток с HER2+ мРМЖ составила 5 мес. (95%ДИ 2,6–8,2 мес.), при сравнении с ВБП у пациенток с HER2-отрицательным мРМЖ (медиана 4,0 мес.) статистически значимых различий не получено (р=0,218) (рис. 7).
Медиана ВБП при различных подтипах мРМЖ составила от 3,0 до 5 мес. Однако у 32 пациенток (19%) отмечен длительный контроль над болезнью с медианой ВБП, превосходящей 8 мес. В эту подгруппу вошли пациентки с различными молекулярными подтипами опухоли: 7 (21,9%) – с ТН РМЖ; 7 (21,9%) – с HER2-положительным, 18 (56,3%) –
Таблица 5. Нежелательные явления на терапии эрибулином (n=168)
|
Нежелательное явление |
n |
% |
|
Анемия |
12 |
7 |
|
Нейтропения 1–2 степени |
32 |
19 |
|
Нейтропения 3–4 степени |
22 |
13 |
|
Тромбоцитопения 1–2 степени |
7 |
4 |
|
Тромбоцитопения 3–4 степени |
15 |
9 |
|
Периферическая нейропатия 1–2 степени |
12 |
7 |
|
Астения |
32 |
19 |
|
Тошнота 1–2 степени |
30 |
11,9 |
Таблица 6. Причины отмены терапии эрибулином (n=168)
|
Параметр |
n |
% |
|
Прогрессирование заболевания |
116 |
69 |
|
Отсутствие препарата |
10 |
7 |
|
Нежелательное явление |
6 |
3,6 |
Перевод на гормональную терапию 2 2
с РЭ/РП+. Длительный контроль над болезнью наблюдался при любой локализации метастазов: кожа и мягкие ткани (6), плевра (7), кости (9), отдаленные лимфоузлы (10), легкие (14), печень (15) и головной мозг (4). Полная регрессия отмечена у 4 больных, частичная – у 13 (т. е. у 53% зарегистрирован объективный противоопухолевый ответ), стабилизация процесса наблюдались у 15 (46,9%) пациенток. Таким образом, 19% больных мРМЖ оказались высокочувствительны к лечению эрибулином и продемонстрировали возможность достижения длительного контроля над болезнью.
Переносимость эрибулина и причины отмены терапии
В рамках проведенного анализа лечение эрибули-ном или его комбинацией с трастузумабом проведено 168 больным, которые получили от 2 до 44 курсов ХТ. В целом лечение переносилось удовлетворительно. Общее число нежелательных явлений оказалось невелико, а их спектр весьма ограничен. Наиболее частым видом токсичности была гематологическая: нейтропения 3–4 степени зафиксирована у 22 (13%) больных, тромбоцитопения 3–4 степени – у 15 (9%), анемия любой степени – у 12 (7%). Фебрильной нейтропении не было. У 32 (19%) пациенток наблюдалась астения, у 30 (11,9%) – тошнота 1–2 степени. Периферическая полинейропатия 1–2 степени отмечалась у 12 (7%) пациенток (табл. 5). В группе HER2-позитивно-го РМЖ случаев кардиотоксичности не зафиксировано. 25 больным (16%) потребовалась редукция дозы препарата до 1,1 мг/м2 в связи с токсичностью.
Основной причиной отмены эрибулина стало прогрессирование заболевания (116 больных, 69%). Другими причинами отмены препарата были нежелательные явления (полинейропатия, тромбоцитопения – всего у 6 (3,6%) пациенток), а также отсутствие препарата в клинике (7%), что отражает ситуацию в реальной клинической практике (табл. 6).
Обсуждение полученных данных
В рамках российской реальной клинической практики была оценена эффективность и переносимость ХТ эрибулином у больных с различными биологическими подтипами мРМЖ (n=168). Известно, что до последнего времени эрибулин применялся в более поздних лечебных линиях. Более половины наших пациенток получали препарат в 3–5-й линиях после антрациклинов и/или так-санов. Несмотря на это, удалось достичь объективного ответа у 20% пациенток с HER2-отрицательным и у 29% с HER2-положительным подтипом опухоли. В подгруппе люминального (ЭР+) HER2-отрицательного РМЖ отмечалась большая частота объективных ответов на лечение и достоверно более длительная медиана ВБП (разница – 1,7 мес.), чем при тройном-негативном фенотипе. При этом неблагоприятном и трудно поддающемся лечению подтипе РМЖ удалось достичь контроля роста опухоли в 57% наблюдений.
Эффективность препарата была выше при назначении в более ранних, с 1 по 3, линиях при HER2-отрицательном РМЖ: ЧОО составила 24,3%, КРО – 85,7%, ВБП – 4,5 мес. Однако и в более поздних линиях частота объективного ответа достигала 15,6%, КРО – 51,6% и ВБП – 3,0 мес. Различия в частоте достижения контроля роста опухоли были статистически значимы. Этот факт свидетельствует о том, что наиболее активные препараты целесообразно назначать на ранних этапах течения болезни, тем самым обеспечивая более высокую вероятность достижения эффекта и его длительного сохранения. Это подтверждается результатами поданализа рандомизированного исследования 3-й фазы EMBRACE, в котором разница в общей выживаемости между эрибулином и группой контроля выше в более ранних линиях лечения [9].
В настоящем исследовании впервые проанализирован уникальный опыт применения комбинации эрибули-на с трастузумабом при HER2-положительном мРМЖ. Из 34 больных 17 имели люминальный фенотип (РЭ+ HER2+), 17 – фенотип с гиперэкспрессией HER2 (РЭ-РП-HER2+). Большая часть пациенток получали лечение в качестве 3-й и более линий. Несмотря на это, объективный эффект достигнут у 29,5% пациенток, КРО – у 79,4%, а медиана ВБП составила 5,0 мес., что на 1 мес. превосходит медиану ВБП при HER2-отрицательном РМЖ, хотя различия не достигли статистической значимости. При анализе эффективности, в зависимости от молекулярного подтипа опухоли, выявлено, что частота объективного ответа в 2 раза выше в группе люминального HER2+ РМЖ, чем при подтипе с гиперэкспрессией HER2 (ЧОО 41,2% vs 17,6%). Несмотря на относительно низкую ЧОО при гиперэкспрессирующем HER2 подтипе, КРО составил 70,6%. Переносимость комбинации в целом была удовлетворительной, наблюдаемые нежелательные явления оказались типичными для эрибулина. Случаев кардиотоксичности не отмечено. Комбинация эрибулина с трастузумабом может являться вариантом выбора при обоих подтипах HER2-положительного мРМЖ.
Медиана ВБП при различных подтипах РМЖ составила от 3,0 до 5,0 мес., что совпадает с данными меж- дународных рандомизированных и наблюдательных исследований. При анализе кривых выживаемости во всех исследованиях можно выделить группу больных (15–20%) с длительным ответом на эрибулин и ВБП 8–10 месяцев и более. По нашим данным, в 32 (19%) случаях ВБП превысила 8 мес., причем у пациенток со всеми подтипами РМЖ и самой разнообразной локализацией метастазов, в том числе и в головном мозге. Максимальное время до прогрессирования составило 44 мес., пациентка в настоящее время продолжает получать эрибулин в 5-й линии. Длительные ремиссии на эрибулине, по всей видимости, могут быть связаны не только с его прямым цитотоксическим действием, но и с рядом других описанных эффектов (ингибирование эпителиально-мезенхимального перехода в опухолевой клетке, влияние на сосудистую сеть опухоли, ангиогенез и др.) [10–13].
Проведенный анализ данных установил удовлетворительную переносимость препарата даже при его длительном применении. Основным видом токсичности была гематологическая, общая частота нейтропении составила 32%, III–IV степени – 13%, что значительно ниже, чем в рандомизированных исследованиях, и может быть связано с особенностями ведения и контроля пациентов в медицинских учреждениях вне рамок клинических исследований. Частота такой дозолимитирующей токсичности, как полинейропатия, составила 7%, что совпадает с международными данными. Редукция дозы потребовалась 16% пациентам, отмена терапии из-за токсичности – всего 3,6%.
Таким образом, в последние годы появление новых эффективных препаратов с цитотоксическим механизмом действия – явление редкое, но очень востребованное клиницистами, особенно для лечения диссеминированного рака молочной железы. Это расширяет арсенал лекарственных средств, последовательное применение которых позволяет улучшить результаты лечения многочисленного контингента больных.
Результаты нашего обобщенного опыта использования эрибулина свидетельствуют о его эффективности при мРМЖ при различных молекулярно-биологических подтипах и в разных линиях терапии. Целесообразно, однако, стремиться назначать эрибулин при РМЖ после ан-трациклинов и таксанов на более ранних этапах болезни, так как это повышает вероятность достижения длительного лечебного эффекта.
Данная публикация подготовлена при финансовой поддержке компании «Эйсай». Авторы несут полную ответственность за содержание публикации и редакционные решения.
Список литературы Эффективность и безопасность эрибулина при различных подтипах рака молочной железы: данные из реальной клинической практики в России
- Cardoso F., Harbeck N., Fallowfield L., Kyriakides S., Senkus E. Locally recurrent or metastatic breast cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up, Ann. Oncol., 2012, Vol. 23, pp. vii11-vii19.
- Cortes J., O'Shaughnessy J., Loesch D. et al. Eribulin monotherapy versus treatment of physician's choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study, Lancet, 2011, Vol. 377, pp. 914-923.
- Kaufman P. A., Awada A., Twelves C. et al. Phase III open-label randomized study of eribulin mesylate versus capecitabine in patients with locally advanced or metastatic breast cancer previously treated with an anthracycline and a taxane, J. Clin. Oncol., 2015, Vol. 33, pp. 594-601.
- Twelves C., Awada A., Cortes J., Yelle I., Velikova G., Olivo M., Song J., Dutcus C., Kaufman P. Subgroup Analyses from a Phase 3, Open-Label, Randomized Study of Eribulin Mesylate Versus Capecitabine in Pretreated Patients with Advanced or Metastatic Breast Cancer, Breast Cancer: Basic and Clinical Research, 2016, Vol. 10, pp 77-84.
- Twelves C., Cortes J., Vandat L. et al. Efficacy of eribulin in women with metastatic breast cancer: a pooled analysis of two phase 3 studies. Breast Cancer Res. Treat., 2014, Vol. 148, pp. 553-561.
- Pivot X., Marme F., Koenigsberg R., Guo M., Berrak E., Wolfer A. Pooled analyses of eribulin in metastatic breast cancer patients with at least one prior chemotherapy, Annals of Oncology, 2016, Vol. 27, pp. 1525-1531.
- Wilks Sh., Puhalla Sh., O'Shaughnessy J. et al. Phase 2, multicenter, single-arm study of eribulin mesylate with trastuzumab as first-line therapy for locally recurrent or metastatic HER2-positive Breast Cancer, Clin. Breast Cancer, 2014, Vol. 14, No. 6, pp. 405-412.
- Инструкция по медицинскому применению препарата Халавен® (РУ ЛП-001782 от 28.07.2012, с изменениями от 08.02.2017).
- Blum J. L., Twelves C. J., Dutcus C. et al. Impact of the number of prior chemotherapy regimens on overall survival (OS) among subjects with locally recurrent or MBC treated with eribulin mesylate: results from the Phase III EMBRACE study. Presented at the 33rd Annual San Antonio Breast Cancer Symposium (SABCS), December 8-12, 2010, San Antonio, TX, USA, P6-13-01.
- Towle M. J., Salvato K. A., Wels B. F. et al. Eribulin induces irreversible mitotic blockade: implications of cell-based pharmacodynamics for in vivo efficacy under intermittent dosing conditions, Cancer Res., 2011, Vol. 71. No. 2. pp. 496-505.
- Funahashi Y., Okamoto K., Adachi Y. et al. Eribulin mesylate reduces tumor microenvironment abnormality by vascular remodeling in preclinical human breast cancer models, Cancer Sci., 2014, Vol. 105. No. 10. pp. 1334-1342.
- Ueda S., Saeki T., Takeuchi H. et al. In vivo imaging of eribulin-induced reoxygenation in advanced breast cancer patients a comparison to bevacizumab, Br. J. Cancer, 2016, Vol. 114, pp. 1212-1218.
- Yoshida T., Ozawa Y., Kimura T. et al. Eribulin mesilate suppresses experimental metastasis of breast cancer cells by reversing phenotype from epithelial -mesenchymal transition (EMT) to mesenchymal-epithelial transition (MET) states, Br. J. Cancer, 2014, Vol. 110, pp. 1497-505


