Эффективность и безопасность лекарственных форм морфина гидрохлорида у онкологических пациентов с хроническим болевым синдромом
Автор: Зуков Руслан Александрович, Боброва Ольга Петровна, Гильдеева Гэлия Нязыфовна, Бутузова Дарья Владимировна, Ершова Екатерина Александровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.18, 2019 года.
Бесплатный доступ
Цель исследования - провести сравнительную оценку эффективности и безопасности морфина гидрохлорида в форме таблеток 10 мг, покрытых пленочной оболочкой, и 1 % раствора для инъекций у онкологических пациентов с хроническим болевым синдромом сильной интенсивности. Материал и методы. В исследование было включено 110 онкологических больных с хроническим болевым синдромом сильной интенсивности на базе 6 региональных исследовательских центров, охватывающих территорию Сибирского и Центрального федерального округов. Процедура проведения исследования соответствовала принципам Хельсинкской декларации, icH GcP, ГОСТ Р 52379-2005, а также российским законам, регламентирующим проведение клинических исследований и работу с НЛП. Пациенты были рандомизированы в соотношении 1:1. Группа I получала таблетки морфина 10 мг, покрытые пленочной оболочкой, по 1 таблетке перорально каждые 4 ч в течение 7 дней. Группа II получала раствор морфина для инъекций 1 % внутримышечно по 4 мг каждые 4 ч на протяжении 7 дней. Для оценки уровня боли использовали общепринятую 100 мм цифровую рейтинговую шкалу оценки боли (NRs). Оценка безопасности лечения проводилась на основании сбора данных о регистрации нежелательных явлений, в том числе опиоид-ассоциированных. Результаты. Энтеральная и парентеральные формы отечественного морфина продемонстрировали статистически значимое снижение интенсивности болевого синдрома на фоне 7-дневной терапии. Применение таблетированной формы морфина гидрохлорида способствует снижению числа назначений дополнительных анальгетиков у онкологических больных. Безопасность лекарственных форм морфина гидрохлорида в целом была сопоставима, обращает на себя внимание при оценке опиоид-ассоциированных нежелательных явлений статистически значимая разница между сравниваемыми группами по частоте запоров. Заключение. В проведенном исследовании было показано, что таблетированная и инъекционная лекарственные формы препаратов морфина гидрохлорида сопоставимы по эффективности и профилю безопасности, что может предопределять широкое клиническое применение препаратов отечественного производителя, согласно принципам терапии «Лестница обезболивания ВОЗ».
Хронический болевой синдром, онкология, морфина гидрохлорид, эффективность, безопасность
Короткий адрес: https://sciup.org/140254042
IDR: 140254042 | УДК: 616-006-009.7-036.12:615.212.7(470+571) | DOI: 10.21294/1814-4861-2019-18-4-27-33
Текст научной статьи Эффективность и безопасность лекарственных форм морфина гидрохлорида у онкологических пациентов с хроническим болевым синдромом
В России ежегодно от злокачественных новообразований (ЗНО) умирает более 300 тыс человек, и не менее 200 тыс больных с распространенными формами ЗНО страдают от болей различной интенсивности. По данным ВОЗ, около 70 % онкологических больных страдают от боли, при этом если на ранних стадиях ЗНО боль встречается у 30–40 %, то при генерализации процесса – у 90 % пациентов [1].
Фармакотерапия является основным методом лечения хронического болевого синдрома (ХБС) у онкологических пациентов, так как отвечает ряду требований: в первую очередь эффективности, удобству для длительного самостоятельного применения больными, а также неинвазивности [2]. Однако ХБС остается одной из трудно решаемых проблем современной онкофармакологии, несмотря на имеющееся разнообразие анальгетиков и множество зарубежных и отечественных рекомендаций [3–5]. «Лестница обезболивания» у пациен- тов с ЗНО, предложенная ВОЗ, предусматривает, что на начальном этапе при купировании ХБС следует использовать неопиоидные анальгетики (первая ступень), при их неэффективности дополнительно назначают слабые опиоиды, при их недостаточном эффекте применяют сильные наркотические анальгетики, такие как морфин.
Высокая распространенность ХБС в онкологии предопределяет проведение многочисленных исследований по совершенствованию анальгетической терапии, учитывая медико-социальный характер проблемы [6–8]. Результаты исследований, проведенных в России, свидетельствуют о том, что почти половина пациентов с ЗНО нуждаются в обезболивающей терапии сильными опиоидными анальгетиками [1].
Наркотические анальгетики традиционно занимают ведущее место в купировании ХБС у онкологических пациентов. При их выборе большую роль играет скорость наступления, степень и продолжительность обезболивающего эффекта, а также способ применения. Препарат быстрого действия назначают при подборе обезболивающей дозы, а препарат пролонгированного действия – после того, как суточная обезболивающая доза установлена. При этом препарат быстрого действия можно назначать одновременно с пролонгированным для быстрого купирования внезапно возникающих так называемых прорывных болей.
Неинвазивное введение лекарственных препаратов является одним из ключевых аспектов рациональной фармакотерапии ХБС. Однако по результатам оценки поставок наркотических анальгетиков в неинвазивных формах в аптечные учреждения России за 2002–12 гг. было выявлено, что обеспеченность данными препаратами составляет не более 5,2 % [1]. К началу 2016 г. в России было зарегистрировано 2 неинвазивных наркотических лекарственных препарата (НЛП) для терапии интенсивного ХБС: морфина сульфат в форме таблеток пролонгированного действия и трансдермальная терапевтическая система фентанила с продолжительностью действия 72 ч [9]. При изучении использования НЛП в ЛПУ 10 субъектов РФ неинвазивные НЛП применяли у 10–30 % онкологических больных [1].
Морфин быстрого действия является «золотым стандартом» для купирования болей сильной интенсивности и позволяет контролировать боль в течение 4–6 ч. Данную форму препарата используют для быстрого обезболивания и при подборе адекватной дозы в качестве основной и резервной терапии. С целью повышения доступности и совершенствования качества оказания паллиативной медицинской помощи населению отечественный производитель лекарственных препаратов ФГУП «Московский эндокринный завод» разработал таблетированную форму морфина гидрохлорида немедленного высвобождения (5 и 10 мг).
Цель исследования – сравнительная оценка эффективности и безопасности морфина гидрохлорида в форме таблеток, покрытых пленочной оболочкой, 10 мг и 1 % раствора для инъекций отечественного производителя ФГУП «Московский эндокринный завод» у онкологических больных с ХБС сильной интенсивности в России
Материал и методы
Проведено исследование препарата Морфин в таблетках 10 мг, покрытых пленочной оболочкой, в сравнении с ранее зарегистрированной формой морфина гидрохлорида Морфин в растворе для инъекций 1 % у 110 онкологических пациентов с ХБС сильной интенсивности в России. Оценку эффективности и безопасности новой лекарственной формы морфина гидрохлорида провели в многоцентровом открытом рандомизированном исследовании на базе 6 региональных исследовательских центров, охватывающих территорию Сибирского и Центрального федеральных округов.
Процедура проведения исследования соответствовала принципам Хельсинкской декларации, ICH GCP, ГОСТ Р 52379-2005, а также российским законам, регламентирующим проведение клинических исследований и работу с НЛП. До начала каких-либо процедур каждый пациент подписал форму информированного согласия на участие в исследовании, ранее одобренную регуляторными органами и локальными этическими комитетами клинических центров.
Критерии включения в исследование: мужчины и женщины в возрасте от 18 лет; наличие ХБС сильной интенсивности после онкологического заболевания или его осложнений (≥70 мм по цифровой оценочной шкале (NRS)); оценка по шкале ECOG ≤2 баллов; не менее одной нед с момента окончания активной противоопухолевой терапии (за исключением гормональной терапии); ожидаемая продолжительность жизни >1 мес.
Критерии невключения в исследование: повышенная чувствительность к любому из компонентов препарата; бронхообструктивные заболевания легких; тяжелая черепно-мозговая травма в анамнезе; паралитическая кишечная непроходимость; эпилепсия; тяжелая печеночная и/или почечная недостаточность; одновременный прием или период до 14 сут с момента начала или окончания приема ингибиторов моноаминооксидазы; инсульт; кахексия (ИМТ≤18 кг/м2). Данное исследование относится к III фазе с целью оценки терапевтической эквивалентности энтеральной и парентеральной короткодействующих форм морфина гидрохлорида, произведенных ФГУП «Московский эндокринный завод».
Для каждого пациента продолжительность участия в исследовании составляла не более 14 дней, при этом продолжительность скрининга составляла не более 7 дней, длительность периода терапии составляла 7 дней. По результатам скрининговых процедур в случае соответствия критериям вклю-чения/невключения пациенты были распределены в одну из двух терапевтических групп в соответствии со схемой рандомизации в соотношении 1:1 (по 55 пациентов в группе):
– группа I получала Морфин в таблетках 10 мг, покрытых пленочной оболочкой, от производителя ФГУП «Московский эндокринный завод» по 1 таблетке перорально каждые 4 ч на протяжении 7 дней;
– группа II получала Морфин в растворе для инъекций 1 % от производителя ФГУП «Московский эндокринный завод» внутримышечно по 4 мг каждые 4 ч на протяжении 7 дней.
Доза исследуемого препарата Морфин в таблетках (10 мг) была выбрана с учетом того, что эквианальгетическое соотношение перорального приема морфина гидрохлорида к внутримышечному пути введения (Морфин, инъекции, 4 мг) составляет примерно 2,5:1. В ходе исследования допускался пропуск приема очередной дозы препаратов исследования в ночные часы (на усмотрение пациента).
Для оценки уровня боли использовали общепринятую 100 мм цифровую рейтинговую шкалу оценки боли (NRS), где 0 мм – отсутствие боли, 100 мм – нестерпимая боль. При возникновении нестерпимой (прорывной) боли в случае недостаточной эффективности исследуемых препаратов допускалось использование дополнительных анальгетиков: препарата Дексалгин в дозе 50 мг в/м, в случае его недостаточной эффективности – препарата «Морфин» в дозе 5 мг внутривенно. В ходе исследования было запрещено использование любых других анальгезирующих наркотических средств, не входящих в список разрешенной сопутствующей терапии. В ходе исследования сохранялись проводимая адъювантная терапия и терапия сопутствующих заболеваний, при этом необходимо было учитывать возможность фармакодинамических взаимодействий с морфином гидрохлоридом.
Основным критерием оценки эффективности, подтверждающим неменьшую эффективность терапии препаратом Морфин в таблетках 10 мг (препарат Т) в сравнении с препаратом Морфин в 1 % (10 мг/мл) растворе для инъекций (препарат R), являлось среднее дневное значение уровня боли, измеренного пациентами по шкале NRS в 1-й и 7-й дни терапии.
Вторичные критерии оценки эффективности, подтверждающие неменьшую эффективность исследуемого препарата по сравнению с препаратом сравнения: среднее общее дневное значение по шкале NRS, измеренное во 2–6-е дни; общая оценка эффективности терапии на визите завершения лечения, оцениваемая пациентом/исследователем; среднее количество баллов по опроснику качества жизни EORTC QLQ-30, оцениваемое на визите завершения терапии (ВЗТ); суммарное количество доз исследуемого препарата/препарата сравнения, введенное в период лечения; суммарное количество доз дополнительного анальгетического препарата, введенное в период лечения исследуемым препаратом/препаратом сравнения; доля пациентов в каждой из групп, которым потребовалось хотя бы одно введение дополнительного анальгетика.
Оценка безопасности лечения проводилась на основании сбора данных о регистрации нежелательных явлений (НЯ), в том числе отдельно оценивали частоту развития и тяжесть опиоид-ассоциированных НЯ, а также данных физикального осмотра, основных жизненно важных показателей (АД, ЧСС, температура тела), результатов клинического, биохимического анализов крови, общего анализа мочи и ЭКГ в 12 отведениях.
Статистический анализ проводился с использованием программного комплекса NCSS 11.0. Нормальность распределения количественных показателей определялась по критерию Шапиро – Уилка. Межгрупповые сравнения двух выборок количественных показателей проведены с использованием t-критерия Стьюдента – при нормальном распределении и критерия Манна – Уитни при распределении, отличающемся от нормального. Сравнение категориальных переменных между группами было проведено с помощью критерия χ2 Пирсона или критерия Фишера. Статистически значимыми считали различия при значениях р<0,05.
Результаты и обсуждение
Пациенты сравниваемых групп соответствовали критериям включения/невключения и по результатам оценки демографических, антропометрических показателей, данным лабораторных и инструментальных методов обследования, проводимой сопутствующей и предшествующей терапии, морфо-функциональному состоянию органов элиминации лекарственных средств; выраженности ХБС, физическому и психическому статусу (табл. 1) значимо не различались (p < 0,05). Группы сравнения исходно также не различались по основным результатам измерений жизненно важных показателей (АД, ЧСС, ЧД, температура тела) и параметрам ЭКГ (p < 0,05).
Эффективность терапии
В качестве первичной переменной эффективности оценивалось среднее дневное значение по шкале NRS, измеренное в 1-й и 7-й дни. В результате проведенного дисперсионного анализа (ANOVA Repeated Measures) повторных измерений показателей среднего дневного значения по шкале NRS, измеренного в 1-й и 7-й дни, не выявлено значимых различий между группами пациентов, принимавших препарат T и R (p=0,460).
Внутри групп T и R были выявлены значимые различия по показателям средних дневных значений по шкале NRS во времени (1-й и 7-й дни) (значение p=0,000). Наблюдалось и значимое снижение значений NRS от 1-го дня терапии к 7-му дню. Рассчитанная нижняя граница 95 % ДИ для разности средних значений основной и контрольной групп составила 9,27 мм, данное значение не пересекает границу неменьшей эффективности 10 мм, что свидетельствует о неменьшей эффективности исследуемого препарата Морфин в таблетках 10 мг по сравнению с препаратом Морфин в 1 % растворе для инъекций в отношении показателя среднего значения NRS, измеренного в 1-й и 7-й дни (табл. 2).
По результатам оценки вторичного критерия эффективности: «Среднее общее дневное значение по шкале NRS, измеренное в дни 2–6» не было выявлено значимых различий между группами пациентов, принимавших препарат T и R (p=0,514). Однако внутри сравниваемых групп выявлены значимые различия по показателям средних дневных значений по шкале NRS во времени (2-й и
|
Характеристика групп больных |
Таблица 1 |
||
|
Показатели |
Группа T (n=55) |
Группа R (n=55) |
Уровень значимости |
|
Возраст, годы |
63,84 ± 11,07 (26–83) |
61,93 ± 11,15 (36–87) |
0,2831 |
|
ИМТ, кг/м2 |
25,82 ± 4,85 (18,51–49,13) |
24,81 ± 4,27 (18,37–38,95) |
0,1451 |
|
Мужчины |
30 (54,55 %) |
26 (47,27 %) |
0,5673 |
|
Женщины |
25 (45,45 %) |
29 (52,73 %) |
|
|
Интенсивность ХБС на скрининге, мм |
79,78 ± 7,22 (70–97) |
81,64 ± 8,14 (70–100) |
0,2881 |
|
Клиренс креатинина, мл/мин |
80,57 ± 27,5 (51,49–172,33) |
84,06 ± 33 (50,57–200,5) |
0,7861 |
|
АСТ, Ед/л |
26,95 ± 16,86 (5–86) |
30,4 ± 16,25 (10,6–93,8) 23,72 ± 12,66 |
0,0691 |
|
АЛТ, Ед/л |
21,03 ± 11,21 (7–68,3) |
(7–65,8) |
0,2671 |
|
Билирубин, мкмоль/л |
12,26 ± 5,83 (4,9–29,7) |
11,62 ± 4,89 (4,7–25,4) |
0,7241 |
|
Кол-во пациентов, прини- |
|||
|
мавших |
52 (94,55 %) |
54 (98,18 %) |
0,6184 |
|
предшествующую терапию |
|||
|
Гемоглобин (норма) |
34 |
32 |
0,8463 |
|
Общий белок (норма) |
41 |
38 |
0,6723 |
Примечание: 1 – критерий сравнения средних Манна – Уитни (Mann – Whitney, U-test), U; 2 – критерий сравнения средних Стьюдента (Student, T-test), T; 3– критерий сравнения Пирсона (χ2); 4– точный критерий Фишера (Fisher's Exact); ИМТ – индекс массы тела.
Таблица 2
Сравнительный анализ эффективности терапии по первичному критерию эффективности
Доля пациентов в каждой из групп, которым потребовалось хотя бы одно введение дополнительного анальгетика (ITT)
Доля пациентов в каждой из групп, которым потребовалось хотя бы одно введение дополнительного анальгетика (PP)
Частота возникновения НЯ у пациентов в сравниваемых группах
|
Группы больных |
Среднее значение NRS |
Разность средних значений NRS |
Нижняя граница 95 % ДИ для разности средних значений |
|
I (препарат T) |
24,88 ± 12,59 |
-4,26 |
-9,27 |
|
II (препарат R) |
29,14 ± 13,05 |
Примечание: критерий сравнения средних Стьюдента (Student, T-test).
Таблица 3
|
Группы больных |
Введение дополнительного анальгетика χ2 Да Нет |
|
I (препарат T) II (препарат R) |
12 (21,82 %) 43 (78,18 %) 21 (38,18 %) 34 (61,82 %) 0,096 |
Таблица 4
|
Группы больных |
Введение дополнительного анальгетика χ2 Да Нет |
|
I (препарат T) II (препарат R) |
11 (21,15 %) 41 (78,85 %) 21 (41,18 %) 30 (58,82 %) 0,056 |
Таблица 5
|
Группы больных |
Число пациентов с НЯ |
Критерий Фишера |
|
|
Да |
Нет |
||
|
I (препарат T) |
50 |
5 |
0,019 |
|
II (препарат R) |
38 |
17 |
|
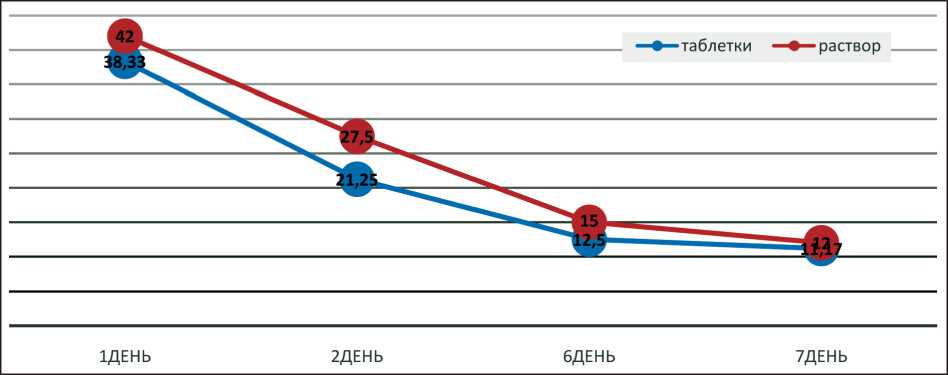
Рис. 1. Динамика изменения среднего дневного значения NRS в сравниваемых группах морфина гидрохлорида. Примечание: NRS – цифровая рейтинговая шкала оценки боли
6-й день) (p=0,000). Наблюдалось статистически значимое снижение значений NRS от 2-го к 6-му дню (рис. 1).
Анализ общей оценки эффективности терапии исследователем и пациентом на визите завершения терапии также не выявил значимых различий между группами пациентов, принимавших препарат T и R, как при оценке пациентом (р=0,316), так и при оценке исследователем (р=0,439). Сравнительный анализ среднего количества баллов по опроснику EORTC QLQ-30 на ВЗТ не выявил значимых различий между I и II группами (p=0,492).
Сравнительный анализ суммарного количества доз исследуемого препарата/препарата сравнения не выявил значимых различий между группами (p=0,829). Сравнительный анализ суммарного количества доз дополнительного анальгетического препарата не выявил значимых различий между I и II группами в популяции ITT (p=0,101), при этом в популяции PP различие по заданному показателю было статистически значимым (p=0,045). Среднее значение суммарного количества доз в исследуемой группе меньше, чем суммарное количество доз в группе контроля (табл. 3–4).
Всего в течение лечения хотя бы одно введение дополнительного анальгетика в популяции ITT потребовалось 32 пациентам: в группе T введение дополнительного анальгетика потребовалось 12 больным, в группе R – 21 пациенту, при этом значимых различий между количеством пациентов, которым потребовалось хотя бы одно введение дополнительного анальгетика, как в популяции ITT, так и PP не выявлено (p>0,05).
Оценка безопасности
За время проведения настоящего клинического исследования общее количество зарегистрированных НЯ составило 365, из них 170 было зарегистрировано в группе пациентов, принимавших таблетированную форму морфина гидрохлорида, и 195 – в группе пациентов, получающих морфин гидрохлорида в форме внутримышечных инъекций (табл. 5).
Всего НЯ были выявлены у 88 пациентов, из них в группе приема препарата T – у 50, в группе приема препарата R – у 38 больных.
Наблюдались статистически значимые различия между количеством пациентов с НЯ в группах сравнения T и R (p=0,019). Наиболее часто встречающимися НЯ были отклонения клиниколабораторных показателей (табл. 5). По мнению исследователей, эти отклонения в основном не имели связи или имели сомнительную связь с применением препаратов.
При оценке опиоид-ассоциированных НЯ, к которым относятся тошнота (рвота), снижение аппетита, седация (сонливость), слабость (адинамия), запоры, головокружение, нарушение сна, сухость во рту, дезориентация, галлюцинации, кожный зуд, затрудненное мочеиспускание, дисфория, выявлены значимые различия между группами только по количеству НЯ по показателю «запоры» (p=0,000). По влиянию на жизненно важные показатели (ЧСС, ЧД, САД, ДАД и температура тела) значимых различий между группами не выявлено (р>0,05).
Зарегистрировано 1 серьезное нежелательное явление (СНЯ) в группе больных, получавших инъекционную форму морфина. У этого пациента возникло желудочно-кишечное кровотечение, которое привело к смерти. Данное СНЯ, по мнению исследователей, имело сомнительную связь с приемом препарата.
Заключение
Энтеральная и парентеральные формы отечественного морфина продемонстрировали статистически значимое снижение интенсивности болевого синдрома на фоне 7-дневной терапии. Эффективность и профиль безопасности двух лекарственных форм морфина гидрохлорида (производитель – ФГУП «Московский эндокринный завод», Россия) сопоставимы, что может предопределять широкое клиническое применение препаратов отечественного производителя согласно ступеням анальгетической лестницы. Применение таблетированной формы морфина гидрохлорида способствует снижению числа назначений дополнительных анальгетиков у пациентов. Безопасность лекарственных форм морфина гидрохлорида в целом была сопоставима.
Список литературы Эффективность и безопасность лекарственных форм морфина гидрохлорида у онкологических пациентов с хроническим болевым синдромом
- Абузарова Г.Р., Алексеева Г.С., Нигматуллина З.Ш., Кузнецов С.В. Доступность наркотических анальгетиков для терапии болевого синдрома в онкологии. Российский журнал боли. 2013; 3: 48-54.
- Невзорова Д.В., Абузарова Г.Р. Клинические рекомендации: хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи. Терапия. 2017; 32: 69-75.
- Абузарова Г.Р., Алексеева Г.С., Сарманаева Р.Р., Душакова Л.В. Современные возможности импортозамещения в лечении болевых синдромов у онкологических больных. Исследования и практика в медицине. 2014; 1(1): 8-15.
- Палехов А.В., Введенская Е.С. Опиоидные анальгетики в терапии хронической боли: проблемы и перспективы. Российский журнал боли. 2015; 40(3): 56-63.
- Berezikova O., Usenko O., Berezikov V., Sharafutdinov M. Access to Opioids in Two Regions of Russia. Palliat. Med. 2012; 26(4): 458.
- Dowell D., Haegerich T.M., Chou R. CDC Guideline for Prescribing Opioids for Chronic Pain United States, 2016. JAMA. 2016 Apr 19; 315(15): 1624-45. DOI: 10.1001/jama.2016.1464
- Mercadante S. Pharmacotherapy for breakthrough cancer pain. Drugs. 2012 Jan 22; 72(2): 181-90. DOI: 10.2165/11597260-00000000000000
- Лебедева М.В., Кононова С.В. Фармакоэкономическое обоснование выбора пролонгированной лекарственной формы морфина для купирования хронического болевого синдрома у онкологических больных. Медицинский вестник Башкортостана. 2016; 11(3(63)): 58-61.


