Эффективность изоляции легочных вен и аблации очагов роторной активности у пациентов с персистирующей формой фибрилляции предсердий
Автор: Куликов А.А., Сапельников О.В., Ускач Т.М., Черкашин Д.И., Шлевков Н.Б., Гришин И.Р., Салами Х.Ф., Акчурин Р.С.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2021 года.
Бесплатный доступ
Цель. Оценить эффективность аблации очагов роторной активности, дополненной изоляцией легочных вен у пациентов с персистирующей формой фибрилляции предсердий в снижении частоты рецидивов после вмешательства в сравнении с классической методикой антральной изоляции легочных вен.Материал и методы. В исследование было включено 86 пациентов, которые были поделены на группу А - антральной изоляции легочных вен и группу В, в которой изоляция легочных вен была расширена абляцией роторных областей в левом предсердии. В группе В непосредственно перед аблацией проводилось неинвазивное картирование роторов с использованием системы АмиКард. В данной группе пациентов каждая процедура завершалась имплантацией кардиомонитора Reveal XT (Medtronic, USA). В течение 2 лет проводилось наблюдение пациентов с определением частоты развития рецидивов нарушений ритма по данным кардиомониторов и холтеровского мониторирования.Результаты. По данным неинвазивного картирования у 43 пациентов выявлено 98 роторных очагов (среднее количество на одного пациента составило 2.33±1.09). Так, 84 ротора левой локализации, из них 23 - в легочных венах и только 14 находились в правом предсердии. За два года наблюдения преимущество подхода аблации роторных очагов дополненной изоляцией легочных вен продемонстрировало статистическую достоверность (79% стабильного синусового ритма) по сравнению с антральной изоляцией легочных вен (58% эффективности).Заключение. Проведение неинвазивного картирования и аблации роторных областей с замыканием на анатомические ориентиры в дополнение к антральной изоляции легочных вен способствует повышению эффективности процедуры и позволяет снизить частоту рецидивов у пациентов с персистирующей формой фибрилляции предсердий.
Фибрилляция предсердий, катетерная аблация, изоляция легочных вен, неинвазивное активационное картирование сердца, роторные очаги
Короткий адрес: https://sciup.org/143176202
IDR: 143176202 | DOI: 10.38109/2225-1685-2021-2-70-76
Текст научной статьи Эффективность изоляции легочных вен и аблации очагов роторной активности у пациентов с персистирующей формой фибрилляции предсердий
Фибрилляция предсердий (ФП) является самой распространенной аритмией, приводящей к значительному снижению качества жизни и ассоциированной с повышенным риском инсульта и смертности. В лечении ФП катетерная аблация показала себя более эффективной методикой, чем антиаритми-ческая лекарственная терапия [1]. Краеугольным камнем аблации ФП является антральная или циркулярная электрическая изоляция устьев легочных вен (ЛВ) в левом предсердии, иногда дополняемая воздействиями на аритмогенный субстрат или триггеры за пределами легочных вен. В настоящее время оптимальная тактика для катетерной аблации ФП остается не выясненной. Долгосрочный клинический эффект, особенно в случае персистирующей и длительно персистирующей форм ФП, оказался разочаровывающим, особенно принимая во внимание стоимость и риск аблации легочных вен [2, 3]. Результаты недавних исследований также поставили под сомнение преимущества эмпирической аблации аритмогенного субстрата предсердий, помимо изоляции легочных вен, даже в случае длительно персистирующей формы ФП, при которой такие воздействия ранее считались необходимыми [4].
В попытках улучшить результаты вмешательства в настоящее время разрабатывается тактика индивидуального подхода к конкретному пациенту для выявления локализованных драйверов ФП. Применяются различные методики картирования ФП: выявление областей максимальных доминантных частот [5], высокой энтропии Шеннона [6] и идентификация фокусных или ри-энтри очагов с помощью поверхностного картирования сердца [7]. Одна из таких известных перспективных методик – FIRM (focal impulse and rotor modulation), запатентованный вычислительный алгоритм пространственно-временного фазового отображения, который позволяет определять потенциальные области роторной активности. Но хотя первые опубликованные клинические результаты аблаций с использованием FIRM продемонстрировали высокую эффективность, результаты независимых исследований долгосрочного прогноза оказались не столь оптимистичны [8–10]. Результаты FIRM варьируют от 17% до 80% эффективности через 1 год наблюдения. Во многих исследованиях описывались изменения предсердного ритма во время FIRM аблации, такие как увеличение средней продолжительности цикла тахикардии на 10% или более, упорядочивание цикла с последующим преобразованием в более регулярную предсердную тахикардию или купирование ФП с восстановлением синусового ритма. Однако эти результаты также сильно различаются в пределах от 40% до 100% [4–7] в зависимости от изучаемого параметра. Такое разнообразие результатов поставило под вопрос методологию, воспроизводимость и эффективность FIRM в лечении ФП и предотвращение рецидивов в долгосрочной перспективе.
Расчетные данные также предполагают несколько возможных сценариев развития после аблации роторных областей; такие сценарии варьируются от исчезновения ротора и восстановления синусового ритма до стабилизации ротора и дальнейшего персистирования аритмии [20]. Динамическая природа роторов и их сложное взаимодействие с окружающим миокардом [21] объясняют, почему роторы ведут себя так плохо предсказуемым образом, а также предполагает необходимость выработки определенных стандартов радиочастотных воздействий для эффективного купирования ФП. Точечные очаговые аблации могут закрепить и стабилизировать ротор, тогда как продленные линейные с замыканием на анатомические границы создают препятствия, с которыми роторная активность может столкнуться и угаснуть без образования новых фибрилляторных волн. В соответствии с этой теорией, мы сочли разумным, что радиочастотная аблация роторных областей с замыканием на анатомические ориентиры может повлиять на их способность индуцировать и поддерживать аритмию и, как минимум, существенно снизит общую устойчивость фибрилляции.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клиническая характеристика пациентов.
В исследовании были проанализированы результаты сравнительной двухлетней эффективности РЧА персистирующей и длительно персистирующей форм ФП. Всего в исследование было включено 86 пациентов, которые случайным образом были поделены на группу антральной изоляции легочных вен (А) и группу В, в которой изоляция легочных вен была расширена аблацией роторных областей в левом предсердии. Исследование было выполнено в рамках клинической апробации.
В группу А было включено 43 пациента, которым была выполнена антральная изоляция легочных вен с помощью трехмерной навигации (EnSite Velocity). Использовалось навигационное оборудование Ensite Velocity (St. Jude Medical, USA) и орошаемые аблационные катетеры Blazer Open Irrigated (Boston Scientific, USA). Рутинно использовалась внутрисердечная ЭхоКГ (AcuNav, Siemens). Эффективность процедуры оценивалась путем контрольных визитов пациентов, на которых производился подробный опрос больного, регистрация ЭКГ, установка суточного мониторинга ЭКГ по Холтеру. За эффективность принималось отсутствие жалоб на нарушения ритма, а также отсутствие пароксизмов ФП по данным суточного мониторирования ЭКГ по Холтеру. Рецидивом считался любой пароксизм ФП длительностью более 30 секунд.
Во вторую группу (В) вошло 43 пациента. Всем им непосредственно перед аблацией проведено неинвазивное картирование роторов с использованием системы АмиКард. Операция начиналась с аблации роторов путем линейных воздействий с замыканием линий на анатомических структурах ЛП, проходящих через центр очагов, и заканчивалась изоляцией легочных вен. В данной группе пациентов каждая процедура завершалась имплантацией кардиомонитора Reveal XT (Medtronic, USA).
Всем больным проводилось комплексное клиническое и инструментальное обследование, включавшее физикальный осмотр, цифровое электрокардиографическое исследование (ЭКГ), холтеровское мониторирование, рентгенографию в 2-х проекциях, трансторакальную эхокардиографию (ЭхоКГ), чреспищеводную ЭхоКГ. Эффективность процедуры оценивалась через 6, 12 и 24 месяца по результатам суточного мониторирования ЭКГ по Холтеру и данных петлевых регистраторов.
Всем пациентам ранее (до включения в исследование) проводились попытки подбора антиаритмической терапии в условиях кардиологических стационаров, однако медикаментозная терапия несколькими (два и более) антиаритмическими препаратами оказалась неэффективной.
Неинвазивное активационное картирование включало следующие этапы:
-
1. Проведение многоканальной регистрации ЭКГ: запись 240 однополюсных отведений с поверхности грудной клетки с использованием системы неинвазивного электрофизиологического картирования «Амикард 01К» (Россия).
-
2. Проведение спиральной компьютерной томографии грудной клетки (сканер «Imatron Evolution C-150») с внутривенным контрастированием пациентам с уже наложенными поверхностными электродами.
-
3. По данным компьютерной томографии построение реалистичных воксельных моделей сердца.
-
4. Выявление областей циркуляции фронта электрического возбуждения по типу ри-энтри (роторов)
Техника вмешательства при применении системы Ensite Velocity:
-
- Построение электроанатомический карты левого предсердия (ЛП) осуществляли циркулярным 20-полюсным электродом (в среднем около 300 точек), который применялся для картирования легочных вен.
-
- Непосредственно изоляцию ЛВ выполняли электродом с открытым контуром орошения Blazer Open Irrigated (Boston Scientific, USA) c параметрами 30-35 Вт, скоростью орошения 17 и 30 мл в мин. соответственно, минимальное время аблации в одной точке – 20 секунд. Изоляцию ЛВ выполняли единым монолатеральным блоком (антральную) точка за точкой. Изоляцию считали эффективной при отсутствии регистрации потенциалов вен на всех полюсах циркулярного электрода и наличии блока входа и выхода по ходу линии аблации, АТФ не применялся.
-
- При построении дополнительных линий (у пациентов в группе изоляции роторных очагов) использовали ту же технику (point-by-point) и электроды. По крыше ЛП – с параметрами 30 Вт и соответствующей скоростью орошения, по нижней части задней стенки – с параметрами 25 Вт. Проверку линии по крыше ЛП осуществляли приемами стимуляции по сторонам от линии и детекцией с задней стенки и в ушке ЛП с циркулярного электрода.
Статистическая обработка результатов.
Статистическая обработка данных исследования проведена с использованием программного обеспечения SPSS 21, STATISTICA 10.0 и Microsoft Excel.
При оценке статистической достоверности различий в группах для количественных признаков использовалось сравнение средних (M) с помощью двухвыборочного t-критерия.
Разность значений переменных между визитами рассчитывалась путём вычитания значения предыдущего визита от значения последующего визита по каждому пациенту. Положительная разность свидетельствовала об увеличении значения переменной в динамике визитов, отрицательная разность – о снижении значений переменной в динамике визитов. Доверительный интервал для частот и долей рассчитывался методом
Уилсона с учётом объёма выборки и поправки на непрерывность. Разность значений между визитами для качественных переменных рассчитывалась путём вычитания значения последующего визита от значения предыдущего визита по всей выборке.
Эффективность вмешательства оценивалась по методу Каплан-Мейера, для сравнения эффективности различных методик применялся логарифмический ранговый тест (log-rank test).
Результаты
Характеристика больных представлена в таблице 1.
В группе В всем пациентам перед процедурой аблации проводилось неинвазивное активационное картирования сердца. По данным неинвазивного картирования у 43 пациентов выявлено 98 роторных очагов (среднее количество на одного пациента составило - 2.33±1.09). Так, 84 ротора левой локализации, из них 23 – в легочных венах и только 14 находились в правом предсердии. Структура роторных очагов представлена в таблице 2 и рисунке 1.
Таблица 1. Клинико-демографическая характеристика пациентов
Table 1. Clinical and demographic characteristics of patients
|
А (43) |
В (43) |
р |
|
|
Женский пол, % |
42.1 |
43.5 |
0.81 |
|
Возраст, лет |
60.77±10.45 |
59.49±9.05 |
0.34 |
|
Длительность анамнеза ФП, мес. |
31.44±68.72 |
30.63±73.4 |
0.39 |
|
Длительно персистирующая форма ФП, % |
69.7 |
72.1 |
0.8 |
|
Длительность персистенции, месяцев |
6.2 ± 1.32 |
6.8 ± 1.24 |
0.86 |
|
Индекс массы тела |
28.68±5.31 |
29.80±4.66 |
0.84 |
|
CHA2DS2VASC, баллы |
2.36±1.49 |
2.42±1.33 |
0.87 |
|
ФК ФП по EHRA |
3.08±0.66 |
3.01±0.49 |
0.86 |
|
Объем ЛП, мл |
69.96±18.71 |
71.84±19.77 |
0.33 |
|
Размер ЛП, см |
4.09±0.42 |
4.20±0.49 |
0.88 |
|
КДР ЛЖ, см |
5.47±0.52 |
5.54±0.64 |
0.85 |
|
ФВ ЛЖ, % |
61.21±4.42 |
58.44±3.78 |
0.33 |
Примечание: ФК – функциональный класс, ЛП – левое предсердие, ЛЖ – левый желудочек, КДР – конечный диастолический размер, ФВ – фракция выброса, T-критерий Стьюдента использовался для непрерывных переменных, и критерий x 2 Пирсона использовался для категориальных переменных Note: FC – functional class, LA – left atrium, LV – left ventricle, EDD – end-diastolic size, EF – ejection fraction, Student’s t-test was used for continuous variables, and Pearson’s x 2 test was used for categorical variables.
Таблица 2. Локализация роторных очагов
Table 2. Localization of rotary foci
|
Локализация |
N 98 |
|
ЛВЛВ |
18 |
|
ЛНЛВ |
14 |
|
ПВЛВ |
10 |
|
ПНЛВ |
6 |
|
Крыша ЛП |
8 |
|
Область МК |
12 |
|
Задняя стенка ЛП |
8 |
|
Ушко ЛП |
8 |
|
ВПВ |
8 |
|
НПВ |
4 |
|
Коронарный синус |
2 |
В группе В процедура катетерной аблации начиналась с воздействий в областях очагов роторов с замыканием на анатомические ориентиры, а затем антральная изоляция легочных вен. У 80% больных после воздействия на области роторов отмечено увеличение среднего цикла ФП. У двух пациентов мы наблюдали трансформацию ФП в атипичное трепетание предсердий. В этих случаях выполнялось активационное картирование с выявлением области замедленного проведения, и аблация в этой зоне в обоих случаях привела к восстановлению синусового ритма.
В группе А всем пациентам была выполнена антральная изоляция легочн6ых вен по классической методике.
Таким образом, всем пациентам (n=96) была успешно выполнена антральная изоляция легочных вен, с контролем эффективности блоков входа и выхода.
Основные интраоперационные параметры представлены в таблице 3. Время операции, а также время флюороскопии было несколько выше в группе B (аблации роторных очагов), однако, при сравнении данная разница оказалась статистически недостоверной (р=0.4). Дополнительное воздействие на роторы было безопасным, сопоставимо с РЧА легочных вен (отсутствие осложнений в обеих группах). Также следует отметить, что вос- становление ритма на воздействии в группе А было отмечено лишь у одного пациента, в остальных случаях восстановление синусового ритма достигалось путем электрической кардиоверсии. Тогда как в группе В интраоперационно было проведено статистически значимо меньше кардиоверсий (р=0,01).
Данные двухлетнего наблюдения пациентов.
В группе A (антральной изоляции легочных вен) в первые шесть месяцев наблюдения было зарегистрировано 8 рецидивов нарушений ритма. Из них 6 ФП и в 2 случаях было выявлено трепетание предсердий (ТП).
За последующие шесть месяцев наблюдения зарегистрировано еще 7 рецидивов ФП. В сроки наблюдения от 12 до 24 месяцев было зарегистрировано еще 3 рецидива ФП. Таким образом, за два года наблюдения у 42% пациентов наблюдалось возобновление нарушений ритма после антральной изоляции легочных вен.
В группе В (аблации роторных областей) в течение шестимесячного наблюдения по данным имплантированных регистраторов зарегистрирован 1 рецидив ФП. По результатам 12-месячного наблюдения при опросе имплантированных кардиомониторов отмечено 3 рецидива ФП и 1 трепетание предсердий. Во всех остальных случаях регистрировался ста-
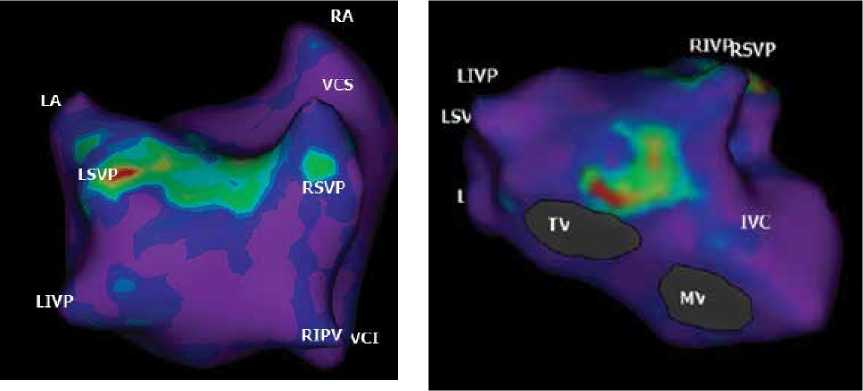
Рисунок 1. Картирование роторов с помощью системы АмиКард. Различные варианты локализации роторных очагов в предсердиях. На левом рисунке в проекции задней стенки левого предсердия красным цветом аннотирована область ранней активации роторного очага в устье левой верхней легочной вены. Аналогичным образом зона ранней активации наблюдается в области трикуспидального клапана на левом рисунке. LSPV – левая верхняя легочная вена, LIPV – левая нижняя легочная вена, RSPV – правая верхняя легочная вена, RIPV – правая нижняя легочная вена, TV – трикуспидальный клапан, MV – митральный клапан. Figure 1. Mapping of rotors using the AmiCard system. Various options for localization of rotary foci in the atria. In the left figure, in the projection of the posterior wall of the left atrium, the area of early activation of the rotary focus in the mouth of the left superior pulmonary vein is annotated in red. Similarly, the early activation zone is observed in the area of the tricuspid valve in the left figure. LSPV – left upper pulmonary vein, LIPV – left lower pulmonary vein, RSPV – right upper pulmonary vein, RIPV – right lower pulmonary vein, TV – tricuspid valve, MV – mitral valve.
Таблица 3. Основные интраоперационные данные и показатели
Table 3. Basic intraoperative data and indicators
|
Показатели |
А (43) |
В (43) |
р |
|
Время операции, мин. |
219±48 |
232±21 |
0.73 |
|
Время флюороскопии, мин. |
48±22 |
52±19 |
0.46 |
|
Восстановление ритма на воздействии |
0,43 (%) |
46,5 (%) |
0.75 |
|
Кардиоверсия |
99,57 (%) |
53,4 (%) |
0.01 |
|
Осложнения |
0 (0%) |
0 (0%) |
1 |
Примечание: T-критерий Стьюдента использовался для непрерывных переменных, и критерий x 2 Пирсона использовался для категориальных переменных.
Note: Student’s t-test was used for continuous variables and Pearson’s x 2 test was used for categorical variables.
бильный синусовый ритм. За второй год наблюдения зарегистрировано еще 4 рецидива ФП. Всего в этой группе за 2 года нарушения ритма были зафиксированы у 21% пациентов.
При оценке результатов годового наблюдения очевидно превосходство воздействия на роторы по сравнению с обычной РЧА легочных вен. Эффективность аблации роторных очагов в дополнение к изоляции устья ЛВ составила 88%. В то время как эффективность обычной изоляции устьев легочных вен всего 65%.
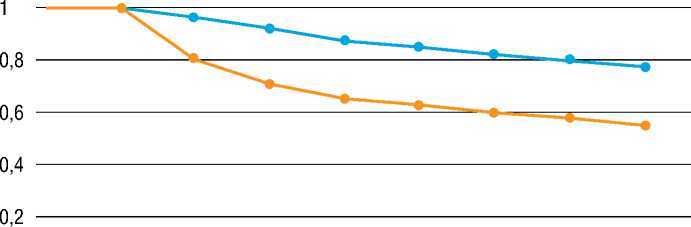
За второй год наблюдения преимущество подхода аблации роторных очагов дополненной изоляцией легочных вен становится статистически достоверно (79% стабильного синусового ритма) по сравнению с антральной изоляцией легочных вен (58% эффективности). Кривые эффективности представлены на рисунке 2.
Средняя продолжительность рецидивов не превышала суток, во всех случаях ритм был успешно восстановлен. У 8 пациентов было зарегистрировано более одного рецидива, но потребовалась только 1 госпитализация.
За 2 года в обеих группах при контроле ЭхоКГ не наблюдалось статистически значимой динамики фракции выброса левого желудочка.
Таким образом, можно сделать вывод, что процедура аблации роторных очагов с замыканием на анатомические ориентиры, расширенная антральной изоляцией легочных вен является эффективной и безопасной. Во время процедуры серьезных осложнений не зарегистрировано, также проведение аблации роторных областей не было связано с развитием каких-либо значимых побочных явлений, как во время госпитализации, так и при последующем двухлетнем наблюдении.
ОБСУЖДЕНИЕ.
По результатам нашего исследования с помощью методики неинвазивного картирования АмиКард во время регистрируемой ФП удается выявить области стабильной роторной активности (среднее количество на одного пациента составило 2.33±1.09), которые затем и становятся мишенью линейных воздействий с замыканием на анатомические ориентиры во время процедуры РЧА. Этот феномен логичным образом объясняет динамические свойства фибрилляторных фронтов активации, учитывая изменчивость проведения и иерархического распределения доминантных частот. Модификация областей роторов в ходе радиочастотной абляции приводит к очевидным изменениям в динамике ФП, что является предиктором восстановления синусового ритма [11], тогда как расширенные воздействия в других областях предсердий такого эффекта не вызывают. Несмотря на изменчивость природы роторов и их очевидное интермиттирование, стратегия, основанная на поверхностном картировании очагов роторов с их последующей аблацией, приводит к значимому эффекту. В нашем исследовании аблация роторных очагов дополненная изоляцией легочных вен продемонстрировала статистически достоверное преимущество (79% стабильного синусового ритма) по сравнению с антральной изоляцией легочных вен (58% эффективности).
Очаг роторной активности представляет собой постоянный источник фибрилляторных волн, в свою очередь приводящих к повторному образованию ротора [16]. По результатам картирования было выявлено 84 ротора левой локализации, из них 23 – в легочных венах и только 14 находились в правом предсердии. Таким образом, наши результаты согласуются с теорией неслучайного распределения драйверов во время пароксизма ФП и поддерживают идею о том, что относительно небольшое количество стабильных роторов лежит в основе устойчивого персистирования ФП даже в случае комплексного анатомо- и электрофизиологического ремоделирования ткани предсердий.
При пароксизмальной форме ФП область наиболее высоких доминантных частот обычно располагается в устье легочных вен [12]. В случае длительного персистирования ФП области высоких доминантных частот случайным образом распределяются по обоим предсердиям [13, 14]. Этот феномен интерпретируют в контексте сложной и сильно деструктурированной ткани предсердий с различной дисперсией фиброзированных тканей и рефрактерных периодов, что в комплексе очевидно способствует высокой частоте выявления областей ри-энтри практически в любом месте предсердий [15, 16]. Изменчивый характер аритмии, в особенности её частотный компонент, в моделях на животных стабильно является предиктором прогрессирования от пароксизмальной к постоянной форме [17]. Более того, результаты этих исследований позволяют предполагать, что как электрические, так и структурные изменения в предсердиях на самом деле и являются ключевыми в регуляции распределения частотных градиентов, которое ранее считалось следствием интермиттирующих функциональных пространственных блокад нелинейных фронтов возбуждения, возникающих как результат активности высокочастотных драйверов и приводящих к процессу, называемому фибрилля-торное проведение [18,19].
1,2
-
•--- Антральная изоляция
-
•--- Аблация роторов
0 3 6 9 12 15 18 21 24
Рисунок 2. Кривые двухлетней эффективности по Каплан-Мейеру. Для оценки использован критерий согласия Пирсона χ 2, р=0,016
Figure 2. Kaplan-Meier 2-year efficiency curves. Pearson’s χ 2 criterion of agreement was used for the assessment, p = 0.016
По нашим результатам очевидно, что аблация роторных очагов превосходит обычную изоляцию устья легочных вен и эффективность ее весьма высока: синусовый ритм сохранялся у 85% пациентов в течение первого года наблюдения, и за 2 года наблюдения только у одного пациента отмечен рецидив ФП, потребовавший госпитализации. Тем не менее, эффективность по-прежнему не 100%. Вероятно, это связано со сложностью локализации фокусов ответственных за развитие и поддержание ФП. По всей видимости, структурная перестройка миокарда может продолжаться несмотря на успешную аблацию. Развитие рецидивов после РЧА свидетельствует о неоднородности выявляемых фокусов и появлении новых участков миокарда способных поддерживать фокусную активность.
ЗАКЛЮЧЕНИЕ.
Наблюдение пациентов в наше исследовании после выполнения аблации роторных областей с замыканием на анатомические ориентиры, в дополнение к антральной изоляции легочных вен продемонстрировало высокую эффективность данной методики интервенционного лечения персистирующей ФП. В течение 2 лет показана статистически более низкая частота развития рецидивов нарушений ритма по сравнению с классической методикой антральной изоляции легочных вен. Также в ходе процедуры не было зафиксировано ни одного осложнения. Но разумно предположить необходимость дополнительных проспективных рандомизированных исследований этого подхода для уточнения его роли в качестве стратегии аблации.
Список литературы Эффективность изоляции легочных вен и аблации очагов роторной активности у пациентов с персистирующей формой фибрилляции предсердий
- January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol. 2014; 64:e1-e76. [DOI: 24685669]
- Weerasooriya R, Khairy P, Litalien J, et al. Catheter ablation for atrial fibrillation: are results maintained at 5 years of follow-up? J Am Coll Cardiol. 2011; 57:160-166. [DOI: 21211687]
- Cappato R, Calkins H, Chen SA, et al. Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol. 2010; 3:32- 38. [DOI: 19995881]
- Сапельников О.В., КуликовА.А., ЧеркашинД.И., Гришин И.Р., Николаева ОА, Акчурин Р.С. Фибрилляция предсердий: механизмы развития, подходы и перспективы терапии. Рациональная фармакотерапия в кардиологии. 2020. Т. 16. № 1. С. 118-125. [Sapelnikov O.V., KulikovAA, Cherkashin D.I., Grishin I.R., Nikolaeva O.A., Akchurin R.S. Atrial Fibrillation: Development Mechanisms, Approaches and Prospects of Therapy. Rational Pharmacotherapy in Cardiology. 2020;16(1):118-125. (In Russ.) https://doi.org/1020996/1819-6446-2020-02-15fm Russ.)].
- Atienza F, Almendral J, Ormaetxe JM, et al. Comparison of radiofrequency catheter ablation of drivers and circumferential pulmonary vein isolation in atrial fibrillation: a noninferiority randomized multicenter RADAR-AF trial. J Am Coll Cardiol. 2014; 64:2455-2467. [DOI: 25500229]
- Сапельников О.В., Черкашин Д.И., Шлевков Н.Б., Николаева ОА., Жамбеев А.А., Салами Х.Ф., Партигулова А.С., Булдакова НА., Гришин И.Р., Ардус Д.Ф., Стукалова О.В., Ускач Т.М., Жиров И.В., Терещенко С.Н., Терновой С.К., Акчурин Р.С. Сравнительная эффективность изоляции легочных вен и аблации фокусов роторной активности у пациентов с персистирующей формой фибрилляции предсердий: среднеотдаленные результаты. Кардиологический вестник. 2017. Т. 12. № 4. С. 38-43. [Sapelnikov O.V., Cherkashin D.I, Shlevkov N.B., Nikolaeva O.A., Zhambeev AA, Salami Kh.F., Partigulova A.S., Buldakova N.A., Grishin I.R., Ardus D.F., Stukalova O.V., Uskach T.M., Zhirov I.V., Tereshchenko S.N., Ternovoi S.N., Akchurin R.S. Comparative efficacy of pulmonary vein isolation vs rotor ablation in patients with persistent atrial fibrillation: mid-term results. Kardiologicheskij Vestnik № 4' 2017,38-43. (in Russ.)].
- Haissaguerre M, Hocini M, Denis A, et al. Driver domains in persistent atrial fibrillation. Circulation. 2014; 130:530-538. [DOI: 25028391]
- Benharash P, Buch E, Frank P, Share M, Tung R, Shivkumar K, Mandapati R. Quantitative analysis of localized sources identified by focal impulse and rotor modulation mapping in atrial fibrillation. Circ Arrhythm Electrophysiol. 2015; 8:554-561. [DOI: 25873718]
- Narayan SM, Krummen DE, Shivkumar K, Clopton P, Rappel WJ, Miller JM. Treatment of atrial fibrillation by the ablation of localized sources: CONFIRM (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation) trial. J Am Coll Cardiol. 2012; 60:628-636. [DOI: 22818076]
- Miller JM, Kowal RC, Swarup V, et al. Initial independent outcomes from focal impulse and rotor modulation ablation for atrial fibrillation: multicenter FIRM registry. J Cardiovasc Electrophysiol. 2014; 25:921929. [DOI: 24948520]
- Сапельников О.В., Черкашин Д.И., Гришин И.Р., Шлевков Н.Б., Жамбеев А.А., Салами Х.Ф., Ускач Т.М., Николаева О.А., Стукалова О.В., Чапурных А.В., Ширяев А.А., Акчурин Р.С., Ардус Д.Ф. Аблация роторных очагов по данным неинвазивного картирования у пациентов с персистирующей и длительно-персистирующей фибрилляцией предсердий: средне-отдаленные результаты. Медицинский альманах. 2017. № 3 (48). С. 89-92. УДК: 616.125-009.3-089. [Sapelnikov O.V., Cherkashin D.I., Grishin I.R., Shlevkov N.B., Zhambeyev A.A, SalamiKh.F, Uskach T.M., Nikolayeva O.A., Stukalova O.V., Chapurnykh A.V., Shiryaev A.A., Akchurin R.S., Ardus D.F. Ablation of rotor foci in accordance with the data of non-invasive mapping of patients having persistent and long-term persistent atrial fibrillation: medium-to-long-term results. Medicinskiy almanakh 2017. № 3 (48). 89-92. (in Russ.)].
- Lewis T, Drury AN, Iliescu CC. Further observations upon the state of rapid re-excitation of the auricles. Heart. 1921; 8:311-340.
- Schuessler RB, Grayson TM, Bromberg BI, Cox JL, Boineau JP. Cholinergically mediated tachyarrhythmias induced by a single extrastimulus in the isolated canine right atrium. Circ Res. 1992; 71:1254-1267. [DOI: 1394883].
- Schuessler RB, Kawamoto T, Hand DE, Mitsuno M, Bromberg BI, Cox JL, Boineau JP. Simultaneous epicardial and endocardial activation sequence mapping in the isolated canine right atrium. Circulation. 1993; 88:250-263. [DOI: 8319340].
- Spach MS, Dolber PC, Heidlage JF. Influence of the passive anisotropic properties on directional differences in propagation following modification of the sodium conductance in human atrial muscle. A model of reentry based on anisotropic discontinuous propagation. Circ Res. 1988; 62:811-832. [DOI: 2450697].
- Matiukas A, Mitrea BG, Qin M, Pertsov AM, Shvedko AG, Warren MD, Zaitsev AV, Wuskell JP, Wei MD, Watras J, Loew LM. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 2007; 4:1441-1451. [DOI: 17954405].
- Пиданов О.Ю., Богачев-Прокофьев А.В., Елесин Д.А., Иваницкий Э.А., Бобровский О.А., Шиленко П.А., Дурыгин П.А., Зотов А.С., Вачев СА., Вайкин В.Е., Мамчур С.Е., Сапельников О.В., Быстров Д.О. Торакоскопическая аблация в России для лечения пациентов с изолированной формой фибрилляции предсердий. Патология кровообращения и кардиохирургия. 2018. Т. 22. № 2. С. 14-21. [Pidanov O.Yu., Bogachev-ProkophievA.V., Elesin D.A., Ivanitskiy E.A., Bobrovskiy O.A., Shilenko P.A., Durygin P.A., Zotov A.S., Vachev S.A., Vaykin V.E., Mamchur S.E., Sapelnikov O.V., BystrovD.O. Thoracoscopic ablation for treatment of patients with lone atrial fibrillation in Russia. Patologiya krovoobrashcheniya i kardiokhirurgiya - Circulation Pathology and Cardiac Surgery. 2018; 22(2):14-21. (In Russ.). http:// dx.doi.org/10.21688/1681-3472-2018-2-14-21 (in Russ.)].
- Csepe TA, Hansen BJ, Fedorov VV. Atrial fibrillation driver mechanisms: Insight from the isolated human heart. Trends Cardiovasc Med. 2017 Jan; 27(1): 1-11. DOI: 10.1016/j.tcm.2016.05.008.
- Narayan Sm, Baykaner T, Clopton P, Schricker A, Lalani GG, Krummen DE, Shivkumar K, Miller JM. Ablation of Rotor and Focal Sources Reduces Late Recurrence of Atrial Fibrillation Compared With Trigger Ablation Alone: Extended Follow-Up of the CONFIRM Trial (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation). J Am Coll Cardiol. 2014; 63:1761-1768. [DOI: 24632280]
- Miller JM, Das MK, Dandamudi G, Jain R, Garlie J, Brewster J. SingleCenter Experience with Rotor Mapping and Ablation for Treatment of Atrial Fibrillation in 170 Patients. Heart Rhythm. 2016; 13:S116-117. Abstract.
- Tomassoni G, Duggal S, Muir M, Hutchins L, Turner K, McLoney AM, Hesselson A. Long-Term Follow-Up of FIRM-Guided Ablation of Atrial Fibrillation: A Single-Center Experience. The Journal of Innovations in Cardiac Rhythm Management. 2015; 6:2145-2151.


