Эффективность комбинации венетоклакса и гипометилирующих агентов при лечении пациентов с первичным, рецидивирующим и/или рефрактерным острым миелоидным лейкозом
Автор: Усикова Е.В., Капланов К.Д., Воробьев В.И., Лобанова Т.И., Ульянова М.А., Кисиличина Д.Г., Кобзев Ю.Н., Шихбабаева Д.И., Виноградова О.Ю., Птушкин В.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 (60), 2022 года.
Бесплатный доступ
Актуальность и цели. Лечение пациентов с острым миелоидным лейкозом традиционно является высокоинтенсивным и включает в себя индукционную терапию с использованием цитарабина и анатрациклинов. Помимо новых возможностей в лечении с острого миелоидного лейкоза, достаточно остро стоит проблема токсичности проводимой высокоинтенсивной терапии у пожилых и молодых соматически отягощённых пациентов. Международные клинические исследования I-III фаз продемонстрировали сочетание высокой эффективности и приемлемой гематологической токсичности комбинаций гипометилирующих агентов и венетоклакса в первой линии терапии, а также в терапии резистентных форм и рецидивов острого миелоидного лейкоза в старшей возрастной группе, что способствовало изучению эффективности комбинаций гипометилирующих агентов и венетоклакса в терапии аналогичных групп молодых коморбидных пациентов. В данной работе проведена оценка эффективности комбинации гипометилирующих агентов и венетоклакса и показателей общей и безрецидивной выживаемости у пациентов с острым миелоидным лейкозом в рутинной практике.Методы. В период с октября 2017 г. по декабрь 2021 г. на базе отделения гематологии № 11 и отделения трансплантации костного мозга и гемопоэтических стволовых клеток № 56 ГБУЗ «ГКБ имени С.П. Боткина» ДЗМ 33 пациента с острым миелоидным лейкозом получили терапию венетоклаксом в сочетании с децитабином или азацитидином: 14 (42 %) мужчин и 19 (58 %) женщин, медиана возраста - 60 лет (23-83 года). В 42 % (14 из 33) случаев режим назначен при резистентном течении или рецидиве острого миелоидного лейкоза и в 61 % (20 из 33) - в качестве индукционной терапии. Трое пациентов (15 %) из 19 из группы впервые диагностированного острого миелоидного лейкоза получили данную схему терапии в первой линии с учётом статуса ECOG 3-4. К августу 2022 г. живы 13 (39 %) пациентов, умерло 20 (61 %) человек. Проведена оценка общей выживаемости, частоты развития полной ремиссии и полной ремиссии с неполным восстановлением, скорости достижения негативности минимальной остаточной болезни, частоты гематологической токсичности и инфекционных осложнений. При статистической обработке данных использовались: частотный анализ с применением таблиц сопряжённости (точный критерий Фишера), анализ выживаемости по методу Каплана - Мейера.Результаты. Полная ремиссия и полная ремиссия с неполным восстановлением достигнуты у 72,72 % (24 из 33) пациентов. В группе первичного острого миелоидного лейкоза ремиссии констатированы в 80 % (16 из 20) случаев, в группе с резистентным течением или рецидивом острого миелоидного лейкоза - в 67 % (8 из 12) (р = 0,3). Определение минимальной остаточной болезни методом проточной цитометрии после 1-го курса выполнено для 54,54 % (18 из 33) пациентов, при этом негативность констатирована в 84,2 % (у 14 из 18 пациентов) случаев. В обеих группах частота развития гематологической токсичности и инфекционных осложнений сопоставимы с таковыми согласно литературным данным. Медиана наблюдения составила 9,5 месяцев (1-47). Медиана общей выживаемости составила 39 месяцев, общая двухлетняя выживаемость - 63 %, общая четырехлетняя выживаемость - 39 %. Безрецидивная выживаемость составила 33 %.Заключение. Комбинация гипометилирующих агентов и венетоклакса показала хорошую эффективность и достаточно высокие значения общей выживаемости у пациентов всех возрастных групп как для первичного острого миелоидного лейкоза, так и для рецидивов и резистентных форм вне зависимости от предшествующей терапии. Учитывая умеренную гематологическую токсичность, а также относительно низкие показатели инфекционных осложнений на фоне терапии, в том числе достаточно низкие цифры летальности в случае инфицирования COVID-19 в сравнении с таковыми на фоне высокоинтенсивных курсов терапии острого миелоидного лейкоза, данная схема может быть широко использована не только у пациентов старшей возрастной группы, но и у молодых коморбидных пациентов.
Острый миелоидный лейкоз, гипометилирующие агенты и венетоклакс, анализ эффективности и общей выживаемости, гематологическая токсичность, инфекционные осложнения, covid-19
Короткий адрес: https://sciup.org/143179602
IDR: 143179602 | УДК: 616-006.446.8 | DOI: 10.20340/vmi-rvz.2022.6.CLIN.5
Текст научной статьи Эффективность комбинации венетоклакса и гипометилирующих агентов при лечении пациентов с первичным, рецидивирующим и/или рефрактерным острым миелоидным лейкозом
Острый миелоидный лейкоз (ОМЛ) представляет собой клональное опухолевое заболевание кроветворной ткани, характеризующееся быстрой пролиферацией незрелых гемопоэтических клеток с разной степенью дифференцировки в сторону миелоидного ростка. Средний возраст при установке диагноза составляет 67 лет.
Индукционная терапия ОМЛ de novo основана на использовании стандартных доз цитарабина и антрациклинов и известна как протокол «7+3». В схемах консолидирующей терапии преобладают средние или высокие дозы цитарабина и трансплантация аллогенных гемопоэтических стволовых клеток (алло-ТГСК) [1]. National Comprehensive Cancer Network (NCCN) рекомендует гипометилирующие агенты (НМА), такие как децитабин (DEC) и азацитидин (AZA), в качестве терапии выбора у пожилых пациентов с ОМЛ, включая пациентов с неблагоприятными цитогенетическими и молекулярными маркерами, вторичным ОМЛ, а также рецидивами и рефрактерными формами.
Несмотря на высокие показатели достижения полной ремиссии (ПР) – более 80 % у молодых взрослых (моложе 65 лет) и 40–60 % у пожилых людей (старше 65 лет), показатели 5-летней выживаемости составляют всего 40–50 % для молодых взрослых и менее 10 % для пожилых людей [2–4].
Даже ввиду большого числа публикаций о высокоэффективных схемах лечения ОМЛ с использованием новых таргетных препаратов, одной из сложных задач остаётся выбор индукционной терапии ОМЛ для пожилых пациентов, а также соматически отягощённых молодых пациентов, проведение интенсивной терапии которым невозможно. По результатам последних мета-анализов по определению факторов риска, согласно Treatment Related Mortality score (TRM score), большую роль в структуре ассоциированной с лечением смертности играет не только возраст пациентов и интенсивность химиотерапевтического воздействия, но и общесоматический статус на момент начала терапии, включая избыточный вес, курение, а также социальный статус пациентов [5]. Так, пациенты моложе 60 лет с ECOG 3-4 имеют более высокую смертность на фоне высокоинтенсивных курсов химиотерапии, чем таковые с ECOG 0-2 [6, 7].
К настоящему времени широко известно, что гиперэкспрессия антиапоптотических белков BCL-2 и MCL-1 определенно связана с рефрактерностью клеток ОМЛ к цитостатической терапии [8]. Вене-токлакс (VEN) относится к группе ВН3-миметиков и представляет собой пероральный высокоселективный ингибитор BCL-2, который показал активность при BCL-2-зависимых гематологических злокачественных новообразованиях, особенно при хроническом лимфоцитарном лейкозе (ХЛЛ). Доклинические исследования продемонстрировали индукцию гибели клеток ОМЛ путем ингибирования BCL-2 в первичных образцах ОМЛ in vitro и в моделях ксенотрансплантатов in vivo, а также синергетическую противолейкемическую активность в сочетании с HMA с незначительным воздействием на тромбоциты по сравнению с предыдущими BH3-мимети-ками [9–11].
Результаты клинических исследований по оценке эффективности комбинации венетоклакса с низкими дозами цитарабина или с HMA у пожилых пациентов с de novo ОМЛ продемонстрировали высокую частоту достижения ПР и более длительную общую выживаемость (ОВ) в сравнении с таковыми показателями стандартной терапии цитарабином или НМА в монорежиме: 10–20 % ПР/ПР с неполным восстановлением и медианой ОВ 5–7 месяцев с низкими дозами цитарабина и 6–10 месяцев с HMA соответственно [12–18]. По результатам III фазы клинического исследования VIALE-A у ранее не леченных пожилых пациентов, которые не подходили для интенсивной химиотерапии, венето-клакс в комбинации с азацитидином не только значимо повышал общую выживаемость и частоту достижения ремиссий в сравнении с монотерапией азацитидином, но и продемонстрировал умеренную гематологическую токсичность [19]. Aldoss и соавт. сообщили об аналогичных результатах при применении венетоклакса в комбинации с HMA при рецидивирующем/рефрактерном (Р/Р) ОМЛ у пожилых пациентов [20, 21].
Эффективность комбинации венетоклакса с HMA или низкими дозами цитарабина дополнительно оценивали и для молодых пациентов при ре-цидивирующем/рефрактерном ОМЛ, миелодис-пластическом синдроме (МДС) и бластной плазмо-цитоидной дендритно-клеточной неоплазии (БПДКН), и, несмотря на весьма скромные показатели ПР и ОВ, была доказана безопасность, хорошая переносимость предложенных схем терапии, что является приемлемой альтернативой для пациентов всех возрастов с рецидивирующим/рефрак-терным ОМЛ, особенно с диплоидной цитогенети-кой/промежуточным цитогенетическим риском или IDH1, IDH2 или мутацией RUNX1 [22–25].
Цель работы: оценить эффективность комбинации VEN+НМА в группе пациентов с впервые выявленным и рецидивирующим/рефрактерным ОМЛ.
Материалы и методы
В исследование включены пациенты старше 18 лет с диагнозом ОМЛ (впервые диагностированный и случаи резистентного течения/рецидивов), госпитализированные в гематологическое отделение № 11 и отделение трансплантации костного мозга и гемопоэтических стволовых клеток № 56 ГБУЗ «ГКБ имени С.П. Боткина» ДЗМ.
Диагноз ОМЛ устанавливался на основании цитологического, иммунофенотипического (проточная цитометрия), цитогенетического (стандартное цитогенетическое исследование (СЦИ) и/или флуоресцентная гибридизация (FISH) in situ) и/или молекулярно-генетического исследования аспирата костного мозга с определением мутаций в генах FLT3 и их аллельной нагрузкой.
Всем пациентам выполнялось лабораторное обследование, оценка соматического статуса по шкале ECOG, а также компьютерная томография (КТ) органов грудной клетки, УЗИ и/или КТ органов брюшной полости и малого таза для уточнения наличия возможных инфекционных осложнений.
Исследование носило ретроспективный характер.
Стратификация проводилась согласно статусу ECOG и критериям классификации ELN [1]. Пациенты с лейкоцитозом более 50*109/л получали циторедуктивную терапию гидроксикарбамидом до начала основного этапа терапии. Все пациенты получали профилактику тумор-лизис синдрома во время курсов индукции: препараты для снижения уровня мочевой кислоты, пероральную/инфузион-ную гидратационную терапию. Программа лечения предусматривала применение венетоклакса внутрь 1 раз в сутки во время еды, в первом цикле доза венетоклакса составляла 100 мг в 1-й день, 200 мг – во 2-й день, 400 мг – на 3-й день. Приём венетоклакса в дозе 400 мг в день продолжали с 3-го по 28-й день. Во всех последующих 28-дневных циклах доза венетоклакса начиналась с 400 мг в сутки. Для коррекции цитопении и связанных с ней клинических последствий, приём венетоклакса прерывали между циклами после достижения ремиссии до восстановления показателей крови, а также применялась модификация доз в зависимости от использования препаратов сопроводительной терапии (антибактериальных, противогрибковых, противовирусных, дезагрегантных лекарственных средств) согласно клиническим показаниям. Также пациенты получали децитабин в дозе
20 мг на квадратный метр поверхности тела в виде часовой внутривенной инфузии 1 раз в день с 1-го по 10-й день каждого 28-дневного цикла или азацитидин в дозе 75 мг на квадратный метр поверхности тела подкожно или внутривенно с 1-го по 7-й день каждого 28-дневного цикла. Всем пациентам из группы высокого риска проводилась профилактика нейролейкемии с интракте-кальным введением цитостатиков (метотрексат – 15 мг, цитарабин – 30 мг, дексаметазон – 4 мг).
Эффективность терапии оценивалась на основании исследования аспирата костного мозга. Первое исследование выполнялось на 28-й день курса. Проводилось цитологическое исследование, имму-нофенотипирование (ИФТ), FISH in situ и/или молекулярно-генетическое исследование. В случае отсутствия восстановления показателей периферической крови повторная пункция костного мозга выполнялась после восстановления лейкоцитов 1,5*109/л и более.
В цели исследования входила оценка эффективности лечения (частота достижения ПР/ПР с неполным восстановлением), мониторинга минимальной остаточной болезни (МОБ) после 1-го и 2-го курсов (далее каждые два курса), частоты развития гематологической токсичности и инфекционных осложнений. При анализе долгосрочных результатов для всех пациентов оценивали ОВ. При расчете ОВ отсчитывали от первого дня начала лечения до дня смерти от любых причин. Точкой цензурирования служила дата последнего контакта с пациентом.
При статистической обработке данных использовались: частотный анализ с применением таблиц сопряжённости (точный критерий Фишера), анализ выживаемости по методу Каплана – Мейера. Для оценки эмпирического распределения по нормальному закону использовался критерий согласия Колмогорова – Смирнова. Альтернативная нулевой статистическая гипотеза принималась при уровне значимости р ≤ 0,05. Для обработки данных использовались статистические пакеты: SPSS (версия 10.0.5; SPSS Inc.) и Statistica (версия 6.0; StatSoft, Inc.).
Результаты
В период с октября 2017 г. по декабрь 2021 г. терапию венетоклаксом в сочетании с децитаби-ном или азацитидином получили 33 пациента с
ОМЛ: 14 (42 %) мужчин и 19 (58 %) женщин, медиана возраста – 60 лет (23–83 года).
Общая характеристика группы на момент окончания терапии (декабрь 2021 г.) представлена в таблице 1.
В 42 % (14 из 33) случаев терапия была назначена при Р/Р ОМЛ и в 58 % (19 из 33) – в качестве индукционной терапии у пациентов de novo ОМЛ. К группе первичных ОМЛ также были отнесены пациенты с ОМЛ из МДС/ХМПЗ – 30 % (10 из 33) случаев, а из группы Р/Р ОМЛ – у одного (3 %) пациента диагноз установлен одномоментно с ХЛЛ.
Циторедуктивная терапия до начала лечения проводилась 18 % (6 из 33) пациентам с учётом выявленного лейкоцитоза более 50*109/л.
Цитогенетическое исследование выполнено 96,96 % (32 из 33) пациентов, хромосомные аберра- ции определены в 56,25 % (18 из 32) случаев, комплексный кариотип – 19 % (6 из 32), моносомия – 7–16 % (5 из 32), трисомия – 8–9 % (3 из 32). Молекулярно-генетическое исследование выполнено 69,69 % (23 из 33) пациентов, мутация FLT3-ITD определена у 18 % (6 из 32) человек. У одного (3 %) пациента выявлена мутация ТР53.
Согласно классификации ELN к группе высокого риска среди пациентов с впервые диагностированным ОМЛ были отнесены 53 % (10 из 19) человек, к группе промежуточного риска – 47 % (9 из 19). Из группы впервые диагностированного ОМЛ 15 % (3 из 19) пациентов получили данную схему терапии в первой линии с учётом статуса ECOG 3-4. В группе Р/Р ОМЛ для 24 % (8 из 14) человек комбинация венетоклакса с НМА была назначена в качестве 2-й линии терапии и для 18 % (6 из 14) – в качестве 3-й линии и более.
Таблица 1. Общая характеристика группы на момент окончания терапии (декабрь 2021 г.)
Table 1. General characteristics of the group at the end of therapy (December 2021)
|
Характеристика |
Количество случаев, частота (%) |
||
|
Мужчины/женщины |
14 (42 %)/19 (58 %) |
||
|
Первичный ОМЛ (в т.ч. ОМЛ из МДС/ХМПЗ) |
19 (58 %) |
||
|
Рецидивы/рефрактерные формы ОМЛ |
14 (42 %) |
||
|
ECOG |
0-2 |
29 (88 %) |
|
|
3-4 |
4 (12 %) |
||
|
Лейкоциты |
<10*109/л |
23 (69 %) |
|
|
10–50*109/л |
4 (13 %) |
||
|
>50*109/л |
6 (18 %) |
||
|
СЦИ и/или FISH |
Нормальный кариотип |
14 (44 %) |
|
|
Moносомия 7 |
5 (16 %) |
||
|
Трисомия 8 |
3 (9 %) |
||
|
Комплесный кариотип |
6 (19 %) |
||
|
Другие аберрации* |
4 (12 %) |
||
|
Мутация FLT3-ITD |
6 (18 %) |
||
|
Мутация ТР53 |
1 (3 %) |
||
|
ПР/ПР с неполным восстановлением |
24 (72,72 %) |
||
|
МОБ методом ИФТ |
Всего |
18 (54,54 %) |
|
|
МОБ «–» |
14 (84 %) |
||
|
МОБ «+» |
4 (15,8 %) |
||
|
Живы |
21 (63 %) |
||
|
Умерло |
12 (37 %) |
||
|
COVID-19 |
10 (30 %) |
||
|
Алло-ТГСК |
5 (15 %) |
||
Примечание: * – к другим аберрациям отнесены del 5q, add 17, 8q22, 3q26.
Полная ремиссия и полная ремиссия с неполным восстановлением достигнуты у 72,72 % (24 из 33) пациентов. В группе первичного ОМЛ ремиссии констатированы в 80 % (16 из 19) случаев, в группе Р/Р ОМЛ – в 57 % (8 из 14) (р = 0,3). Определение МОБ методом проточной ИФТ после 1-го курса выполнено для 54,54 % (18 из 33) пациентов, при этом МОБ-негативность констатирована в 84,2 % (у 14 из 18 пациентов) случаев, МОБ-позитивный статус – в 15,8 % (у 4 из 18 пациентов).
Детальная характеристика подгрупп представлена в таблице 2.
К началу августа 2022 г. живы 13 (39 %) пациентов, умерло 20 (61 %) пациентов: из группы первичного ОМЛ – 10 из 19 (52 %) и 10 из 14 (71 %) в группе Р/Р ОМЛ. Аллогенная трансплантация выполнена 9 (27 %) пациентам: 3 (16 %) из группы первичного ОМЛ, 6 (21 %) из группы Р/Р ОМЛ. За время наблюдения развитие прогрессии/реци-дива констатировано у 6 (31 %) пациентов из группы первичного ОМЛ и у 7 (50 %) из группы Р/Р ОМЛ. Летальность от прогрессии/резистентного рецидива для первичного ОМЛ составила 50 % (5 из 10), а для пациентов с Р/Р ОМЛ – 60 % (6 из 10).
В структуре осложнений проводился анализ гематологической токсичности: частота развития нейтропении составила 47,3 % (9 из 19 случаев) для группы первичных ОМЛ и 50 % (7 из 14 случаев) для группы Р/Р ОМЛ, частота развития анемии и тромбоцитопении, требовавших заместительной гемокомпонентной терапии, – 42,1 % (8 из 19) и 52,6 % (10 из 19) для группы первичных ОМЛ, 50 % (7 из 14) и 64,2 % (9 из 14) для группы Р/Р ОМЛ соответственно. Следует также отметить относительно низкую частоту развития инфекционных осложнений: в группе первичных ОМЛ фебрильная нейтропения зафиксирована у 31,5 % (6 из 19) пациентов, пневмонии бактериальной и грибковой этиологии – у 10,5 % (2 из 19), инфекции кровотока – у 5,2 % (1 из 19), энтеропатия – у 10,5 % (2 из 19), другие осложнения, в частности мигренозные головные боли, – у 5,2 % (1 из 19) пациентов.
В группе Р/Р ОМЛ фебрильная нейтропения зафиксирована у 28,5 % (4 из 14) пациентов, пневмонии бактериальной и грибковой этиологии – у 21,4 % (3 из 14), инфекции кровотока – у 14,2 % (2 из 14), энтеропатия – у 7,1 % (1 из 14), другие осложнения (тромбоз вен нижних конечностей, внутримозговая гематома, инфекции мягких тканей) – у 21,4 % (3 из 14) человек. Развитие коронавирусной инфекции было констатировано в 30 % (10 из 33) случаев, из них у двух (20 %) пациентов стала причиной летального исхода.
Подробная информация о результатах лечения и структуре осложнений и смертности представлена в таблице 3.
Таблица 2. Детальная характеристика подгрупп
Table 2. Detailed characteristics of subgroups
|
Характеристика |
Первичный ОМЛ, n (%) |
Р/Р ОМЛ, n (%) |
|
|
Медиана возраста |
67 |
53 |
|
|
Мужчины |
8 (42 %) |
6 (42 %) |
|
|
Женщины |
11 (58 %) |
8 (58 %) |
|
|
ОМЛ из МДС/ХМПЗ |
10 (52 %) |
– |
|
|
ОМЛ + ХЛЛ |
– |
1 (7 %) |
|
|
ECOG |
0-2 |
16 (84 %) |
13 (93 %) |
|
3-4 |
3 (16 %) |
1 (7 %) |
|
|
Лейкоциты |
< 10*109/л |
14 (73 %) |
9 (65 %) |
|
10–50*109/л |
2 (11 %) |
2 (14 %) |
|
|
> 50*109/л |
3 (16 %) |
3 (21 %) |
|
|
СЦИ и/или FISH |
Нормальный кариотип |
7(40 %) |
7 (51 %) |
|
Moносомия 7 |
2 (11 %) |
3 (21 %) |
|
|
Трисомия 8 |
2 (11 %) |
1 (7 %) |
|
|
Комплексный кариотип |
5 (27 %) |
1 (7 %) |
|
|
Другие аберрации* |
2 (11 %) |
2 (14 %) |
|
|
Мутация FLT3-ITD |
1 (5 %) |
5 (35 %) |
|
|
Мутация ТР53 |
– |
1 (7 %) |
|
|
ELN-2017 для первичного ОМЛ |
Благоприятный прогноз |
– |
– |
|
Промежуточный прогноз |
9 (47) |
– |
|
|
Неблагоприятный прогноз |
10 (53) |
– |
|
Примечание: * – к другим аберрациям отнесены del 5q, add 17, 8q22, 3q26.
Таблица 3. Результаты лечения и структура осложнений и смертности Table 3. Treatment outcomes and structure of complications and mortality
|
Характеристика |
Первичный ОМЛ, n (%) |
Р/Р ОМЛ, n (%) |
|
|
Ven-НМА |
1 линия |
19 (100 %) |
– |
|
2 линия |
– |
8 (57 %) |
|
|
3 и более |
– |
6 (43 %) |
|
|
Осложнения |
Нейтропения WBC 0,5*109/л и менее |
9 (47 %) |
7 (50 %) |
|
Анемия Hb 70г/л и менее |
8 (42 %) |
7 (50 %) |
|
|
Тромбоцитопения PLT 20*109/л и менее |
10 (52 %) |
9 (64 %) |
|
|
Фебрильная нейтропения |
6 (31 %) |
4 (28 %) |
|
|
Бактериальные и грибковые пневмонии |
2 (10 %) |
3 (21 %) |
|
|
Инфекции кровотока |
1 (5 %) |
2 (14 %) |
|
|
Энтеропатия |
2 (10 %) |
1 (7 %) |
|
|
COVID-19 |
5 (26 %) |
5 (35 %) |
|
|
Другие осложнения |
1 (5 %) |
3 (21 %) |
|
|
Алло-ТГСК |
3 (16 %) |
6 (21 %) |
|
|
Прогрессия/рецидив |
6 (31 %) |
7 (50 %) |
|
|
Живы |
9 (48 %) |
4 (29 %) |
|
|
Умерло |
Всего |
10 (52 %) |
10 (71 %) |
|
Прогрессия/резистентный рецидив |
5 (50 %) |
6 (60 %) |
|
|
Инфекции |
2 (20 %) |
2 (20 %) |
|
|
COVID-19 |
1 (10 %) |
1 (10 %) |
|
|
Другие причины* |
2 (20 %) |
1 (10 %) |
|
Примечание: * – пароксизм фибрилляции предсердий, реакция трансплантат против хозяина, геморрагические осложнения.
К августу 2022 в группе первичного ОМЛ трансплантация аллогенных гемопоэтических стволовых клеток выполнена 16 % (3 из 19) пациентов, из них один (33 %) пациент погиб от реакции «трансплантат против хозяина» в постранспланта-ционном периоде. В группе Р/Р ОМЛ алло-ТГСК выполнена в 21 % (6 из 14) случаев, из них в пост-транплантационном периоде два (33 %) пациента погибли от инфекционных осложнений и реакции «трансплантат против хозяина», у одного (16,5 %) пациента констатирован рецидив заболевания.
Медиана наблюдения составила 9,5 месяцев (1–47). Медиана ОВ составила 39 месяцев, общая двухлетняя выживаемость – 63 % (рис. 1, 2), общая четырехлетняя выживаемость – 39 % (рис. 3, 4). Без-рецидивная выживаемость составила 33 % (рис. 5).
Обсуждение
Таким образом, комбинация VEN+НМА показала хорошую эффективность в подгруппах как с первичным ОМЛ, так и для рецидивов/резистент-ных форм вне зависимости от возраста пациентов и предшествующей терапии.
Достижение МОБ-негативных ремиссий после 1-го курса индукции констатировано не только для пациентов в первой линии терапии, но и при лечении рецидивов/резистентных ОМЛ, что может рассматриваться для молодых пациентов с вторичными ОМЛ как bridge-терапия перед выполнением трансплантации аллогенных гемопоэтических стволовых клеток.
Несмотря на статистический анализ относительно небольшой гетерогенной группы пациентов, показатели ремиссии и двухлетней ОВ, достигнутые с помощью данного низкоинтенсивного режима, соответствуют литературным данным и обнадеживают в свете традиционно более низких показателей для группы пожилых пациентов с ОМЛ (40–50 %) по сравнению с молодыми пациентами, получающими химиотерапию (60–70 %), и относительно короткой продолжительности этих ремиссий.
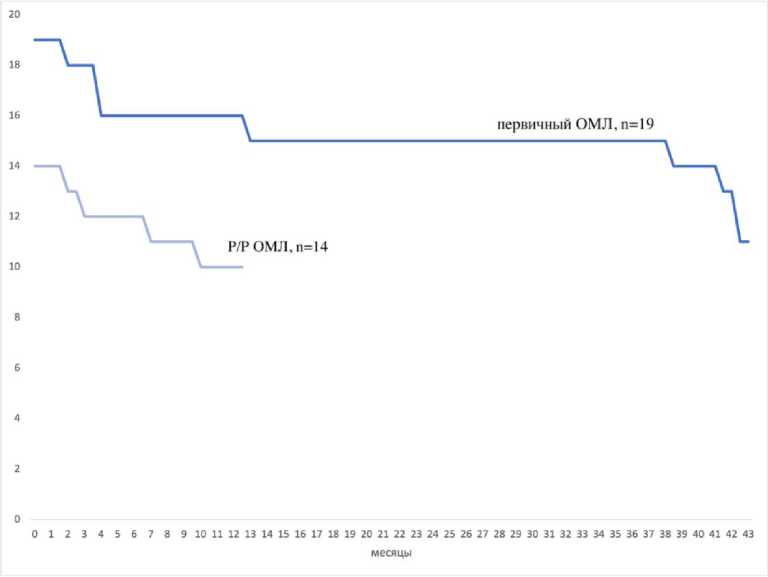
Рисунок 1. Двухлетняя общая выживаемость в группах первичного ОМЛ (n = 19) и Р/Р ОМЛ (n = 14)
Figure 1. Two-year overall survival in the primary AML (n = 19) and R/R AML (n = 14) groups

О 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 месяцы
Рисунок 2. Общая двухлетняя выживаемость (n = 33)
Figure 2. Overall 2-year survival (n = 33)
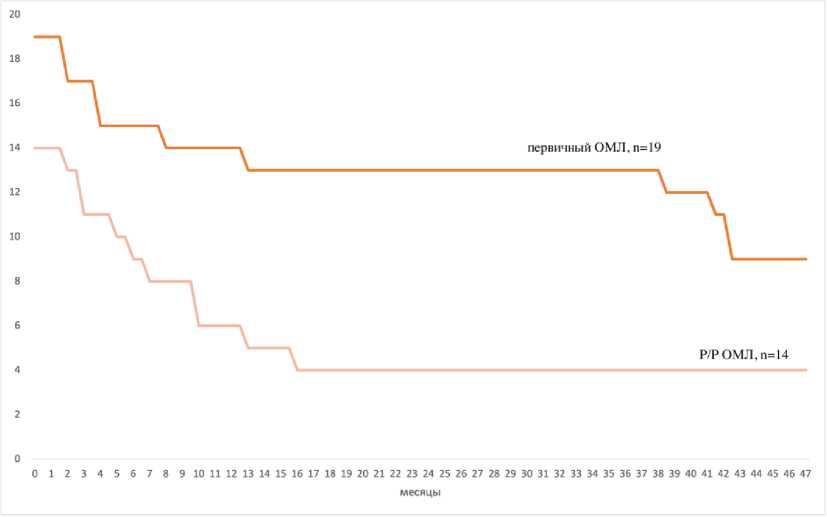
Рисунок 3. Четырёхлетняя общая выживаемость в группах первичного ОМЛ (n = 19) и Р/Р ОМЛ (n = 14)
Figure 3. Four-year overall survival in the primary AML (n = 19) and R/R AML (n = 14) groups
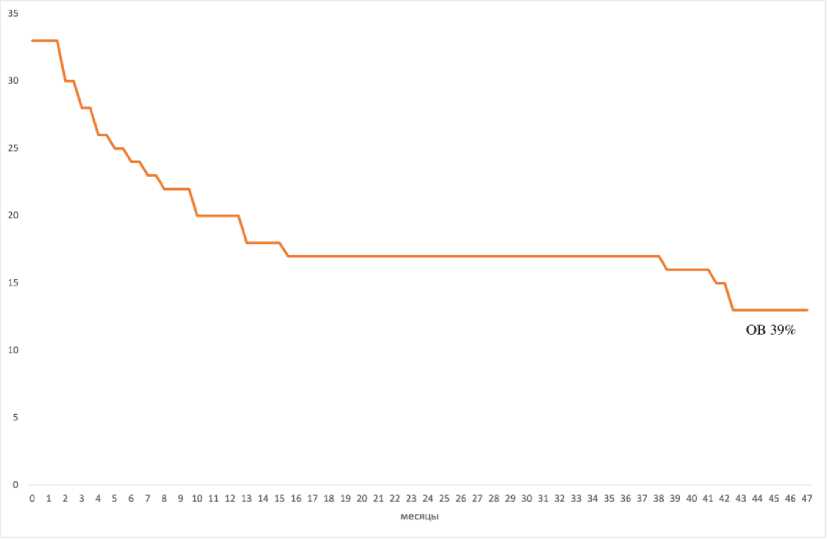
Рисунок 4. Общая четырёхлетняя выживаемость (n = 33)
Figure 4. Overall four-year survival (n = 33)
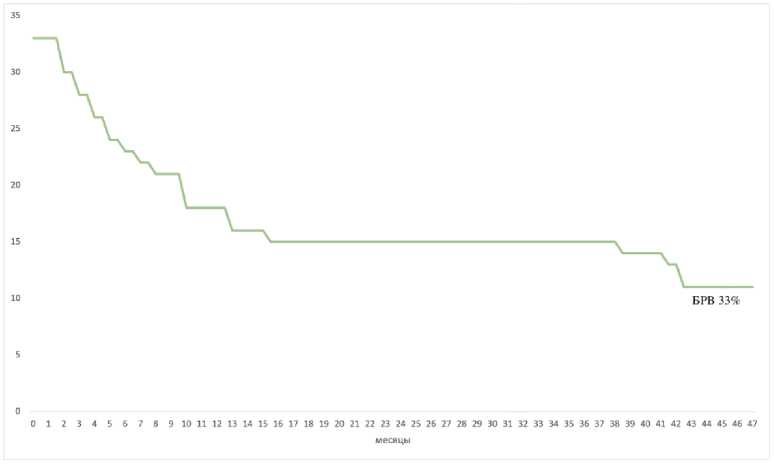
Рисунок 5. Безрецидивная выживаемость (n = 33)
Figure 5. Disease-free survival (n = 33)
Показатели безрецидивной выживаемости (БРВ), а также отсутствие плато на кривой ОВ и снижение показателей четырехлетней ОВ по сравнению с двухлетней ОВ, делают необходимым рассмотрение возможности выполнения трансплантации аллогенных гемопоэтических стволовых клеток у пациентов из группы промежуточного и неблагоприятного риска моложе 60–65 лет в первой ремиссии заболевания.
Учитывая малый процент пациентов в обеих группах, которым была проведена алло-ТГСК, хочется всё же акцентировать внимание на достаточно низкой частоте развития рецидива после алло-ТГСК, особенно в группе Р/Р ОМЛ, что может подчеркивать необходимость проведения алло-ТГСК во второй и последующих ремиссиях при условии сохранения удовлетворительного общесоматического статуса. Однако, данный вопрос требует большего количества наблюдений для статически достоверных заключений.
Наряду с умеренной гематологической токсичностью, продемонстрированной в международных исследованиях [26], комбинация венетоклакса и НМА может рассматриваться в качестве индукционного режима для соматически отягощенных пациентов моложе 60 лет с впервые диагностированным ОМЛ. Стоит также отметить относительно низкую летальность пациентов на фоне данной тера- пии в случае инфицирования COVID-19 в сравнении с летальностью на фоне высокоинтенсивных курсов химиотерапии. Так, по данным различных многоцентровых исследований, летальность от COVID-19 у молодых и пожилых пациентов с ОМЛ на фоне курсов терапии с цитарабином и антрацик-линами достигает 42–48 %, тогда как общая летальность у больных острыми лейкозами колеблется в пределах 20–52 % [27–31]. Такие различия в результатах с высокой вероятностью могут быть обусловлены снижением частоты развития глубокой нейтропении на фоне терапии пониженной интенсивности как одного из значимых факторов риска заболеваемости COVID-19 у больных острыми лейкозами [32, 33].
Заключение
Терапия ОМЛ у взрослых к настоящему времени часто требует индивидуального подхода с применением таргетной терапии, адаптированной к специфическим характеристикам лейкемии. Генетические изменения и паттерны мутаций не только позволяют лучше охарактеризовать прогноз заболевания, но и становятся определяющими факторами в лечении ОМЛ.
Необходимы дальнейшие исследования, чтобы определить роль венетоклакса, добавленного к высокоинтенсивной химиотерапии или, возможно, предтрансплантационному кондиционированию у молодых взрослых. Прямое или непрямое совместное воздействие на MCL-1, по-видимому, усиливает противолейкемический ответ на эти комбинации, что в настоящее время используется в клинических исследованиях эффективности сочетания венетоклакса с ингибиторами FLT3-ITD, MDM2, MEK и CDK9, а также с прямыми ингибиторами MCL-1 [27–30], недавно появившимися на фармацевтическом рынке. Сопутствующая блокировка экпрессии генов IDH1/IDH2 у пациентов с мутацией IDH1/2 может вызывать как дифференцировку, так и гибель бластов при ОМЛ, приводя к стойкому ответу на лечение [34–37].
Наконец, венетоклакс отдельно или в комбинации с HMA можно считать жизнеспособным и безопасным вариантом как индукционной терапии для пациентов всех возрастных групп, так и поддерживающей терапии у пациентов с высоким риском рецидива ОМЛ, завершивших консолидирующую терапию или после выполненной трансплантации аллогенных гемопоэтических стволовых клеток.
Список литературы Эффективность комбинации венетоклакса и гипометилирующих агентов при лечении пациентов с первичным, рецидивирующим и/или рефрактерным острым миелоидным лейкозом
- Döhner H, Estey E, Grimwade D, Amadori S, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood. 2017;129(4):424-48. https://doi.org/10.1182/blood-2016-08-733196
- Dombret H, Gardin C. An update of current treatments for adult acute myeloid leukemia. Blood. 2016;127(1):53-62. https://doi.org/10.1182/blood-2015-08-604520
- Tamamyan G, Kadia T, Ravandi F, et al. Frontline treatment of acute myeloid leukemia in adults. Crit Rev Oncol Hematol. 2017;110:20-34. https://doi.org/10.1016/j.critrevonc.2016.12.004
- Bose P, Vachhani P, Cortes JE. Treatment of Relapsed/Refractory Acute Myeloid Leukemia. Curr Treat Options in Oncol. 2017;18(17). https://doi.org/10.1007/s11864-017-0456-2
- Walter RB, Othus M, Borthakur G, et al.. Prediction of early death after induction therapy for newly diagnosed acute myeloid leukemia with pretreatment risk scores: a novel paradigm for treatment assignment. J Clin Oncol. 2011 ;29(33):4417-4423. https://doi.org/10.1200/JC0.2011.35.7525
- Appelbaum FR, Gundacker H, Head DR, et al. Age and acute myeloid leukemia. Blood. 2006;107:3481-3485. https://doi.org/10.1182/blood-2005-09-3724
- Estey E, Smith TL, Keating MJ, et al. Prediction of survival during induction therapy in patients with newly diagnosed acute myeloblastic leukemia. Leukemia. 1989;3:257-263.
- Carter BZ, Mak PY, Tao W, et al. Mcl- 1/CDK9 Targeting By AZD5991/AZD4573 Overcomes Intrinsic and Acquired Venetoclax Resistance in Vitro and In Vivo in PDX Model of AML through Modulation of Cell Death and Metabolic Functions. Blood. 2018;132(Suppl 1):768-768. https://doi.org/10.1182/blood-2018-99-113491
- Pan R, Hogdal LJ, Benito JM, et al. Selective BCL-2 inhibition by ABT-199 causes on-target cell death in acute myeloid Leukemia. CancerDiscov. 2014;4(3):362-675. https://doi.org/10.1158/2159-8290.CD-13-0609
- Bogenberger JM, Delman D, Hansen N, et al. Ex vivo activity of BCL-2 family inhibitors ABT-199 and ABT-737 combined with 5-azacytidine in myeloid malignancies. LeukLymphoma. 2015;56(1):226-229. https://doi.org/10.3109/10428194.2014.910657
- Tsao T, Shi Y, Kornblau S, et al. Concomitant inhibition of DNA methyltransferase and BCL-2 protein function synergistically induce mitochondrial apoptosis in acute myelogenous leukemia cells. Ann Hematol. 2012;91(12):1861-70. https://doi.org/10.1007/s00277-012-1537-8
- Wei A, Strickland SA, Hou J-Z, et al. Venetoclax with Low-Dose Cytarabine Induces Rapid, Deep, and Durable Responses in Previously Untreated Older Adults with AML Ineligible for Intensive Chemotherapy. Blood. 2018;132(Suppl 1):284LP - 284. https://doi.org/10.1182/blood-2018-99-118729
- Dinardo CD, Pratz K, Pullarkat V, et al. Venetoclax combined with decitabine or azacitidine in treatment-naive, elderly patients with acute myeloid leukemia. Blood. 2019;133(1):7-18. https://doi.org/10.1182/blood-2018-08-868752
- Burnett AK, Milligan D, Prentice AG, et al. A comparison of low-dose cytarabine and hydroxyurea with or without all-trans retinoic acid for acute myeloid leukemia and high-risk myelodysplastic syndrome in patients not considered fit for intensive treatment. Cancer. 2007;109(6):1114-24. https://doi.org/10.1002/cncr.22496
- Heiblig M, Elhamri M, Tigaud I, et al. Treatment with Low-Dose Cytarabine in Elderly Patients (Age 70 Years or Older) with Acute Myeloid Leukemia: A Single Institution Experience. Mediterr J Hematol Infect Dis. 2016;8(1):e2016009. https://doi.org/10.4084/MJHID.2016.009
- Kantarjian HM, Thomas XG, Dmoszynska A, et al. Multicenter, randomized, open-label, phase III trial of decitabine versus patient choice, with physician advice, of either supportive care or low-dose cytarabine for the treatment of older patients with newly diagnosed acute myeloid leukemia. J Clin Oncol. 2012;30(21):2670-7. https://doi.org/10.1200/JCO.2011.38.9429
- Seymour JF, Butrym A, Wierzbowska A, et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with > 30 % blasts. Blood. 2015;126(3):291-300. https://doi.org/10.1182/blood-2015-01-621664
- Cortes JE, Heidel FH, Hellmann A, et al. Randomized comparison of low dose cytarabine with or without glasdegib in patients with newly diagnosed acute myeloid leukemia or high-risk myelodysplastic syndrome. Leukemia. 2018;33:379-89. https://doi.org/10.1038/s41375-018-0312-9
- DiNardo CD, Jonas BA, Pullarkat V, et al.. Azacitidine and venetoclax in previously untreated acute myeloid leukemia. N Engl J Med. 2020;383(7):617-629. https://doi.org/10.1056/NEJMoa2012971
- Aldoss I, Yang D, Pillai R, et al. Response to Venetoclax and Hypomethylating Agents Among Prognostic Risk Groups and Genetic Subtypes of Acute Myeloid Leukemia. Blood. 2018;132(Suppl 1):334 LP - 334. https://doi.org/10.1182/blood-2018-99-113670
- Aldoss I, Yang D, Aribi A, et al. Efficacy of the combination of venetoclax and hypomethylating agents in relapsed/refractory acute myeloid leukemia Venetoclax. Haematologica. 2018;103(9):407-9. https://doi.org/10.3324/haematol.2018.188094
- Dinardo CD, Kadia T, Rausch CR, et al. Clinical experience with the BCL2-inhibitor venetoclax in combination therapy for relapsed and refractory acute myeloid leukemia and related myeloid malignancies. Am J Hematol. 2018;93:401-7. https://doi.org/10.1002/ajh.25000
- Tenold M, Moskoff B, Benjamin D, Jonas BA. Retrospective Analysis of Adults with Acute Myeloid Leukemia Treated with Venetoclax Plus Hypomethylating Agents at a Comprehensive Cancer Center. Blood. 2018;132(Suppl 1):1424 LP - 1424. https://doi.org/10.1182/blood-2018-99-119593
- Goldberg AD, Horvat TZ, Hsu M, et al. Venetoclax Combined with Either a Hypomethylating Agent or Low-Dose Cytarabine Shows Activity in Relapsed and Refractory Myeloid Malignancies. Blood. 2017;130(Suppl 1):1353 LP - 1353. https://doi.org/10.1182/blood .V130.Suppl_1.1353.1353
- Ram R, Amit O, Zuckerman T, et al. Addition of Venetoclax to Patients with Acute Myeloid Leukemia Relapsing after Treatment with Hypomethylating Agents. Multicenter Historical Prospective Study. Blood. 2018;132(Suppl 1):4046 LP - 4046. https://doi.org/10.1182/blood-2018-99-113596
- Menzin J, Lang K, Earle CC, Kerney D, Mallick R. The outcomes and costs of acute myeloid leukemia among the elderly. Arch Intern Med. 2002;162(14):1597-1603. https://doi.org/10.1001/archinte.162.14.1597
- Boffo S, Damato A, Alfano L, Giordano A. CDK9 inhibitors in acute myeloid leukemia. J Exp Clin Cancer Res. 2018;37(1):1-10. https://doi.org/10.1186/s13046-018-0704-8
- Vidacs E, Hilton JJ, Lee EM, et al. The CDK9 Inhibitor Dinaciclib Exerts Potent Apoptotic and Antitumor Effects in Preclinical Models of MLL-Rearranged Acute Myeloid Leukemia. Cancer Res. 2015;76(5):1158-69. https://doi.org/10.1158/0008-5472.CAN-15-1070
- Tsai CH, Hou HA, Tang JL, et al. Genetic alterations and their clinical implications in older patients with acute myeloid leukemia. Leukemia. 2016;30(7):1485-92. https://doi.org/10.1038/leu.2016.65
- Padua RA, Sarda-Mantel L, Chiquet M, et al. BCL-2 Inhibitor Venetoclax (ABT-199) and MEK Inhibitor GDC-0973 Synergise to Target AML Progenitors and Overcome Drug Resistance with the Use of PET Scanning in a Mouse Model of HR-MDS to Monitor Response to Treatment. Blood. 2018;132(Suppl 1):5497 LP - 5497. https://doi.org/10.1182/blood-2018-99-114212
- Chan SM, Thomas D, Corces-Zimmerman MR, et al. Isocitrate dehydrogenase 1 and 2 mutations induce BCL-2 dependence in acute myeloid leukemia. Nat Med. 2015;21(2):178-84. https://doi.org/10.1038/nm.3788
- Cathelin S, Sharon D, Subedi A, et al. Combination of Enasidenib and Venetoclax Shows Superior Anti-Leukemic Activity Against IDH2 Mutated AML in Patient-Derived Xenograft Models. Blood. 2018;132(Suppl 1):562 LP - 562. https://doi.org/10.1182/blood-2018-99-119688
- Quivoron C, David M, Straley K, et al. AG-221, an Oral, Selective, First-in-Class, Potent IDH2-R140Q Mutant Inhibitor, Induces Differentiation in a Xenotransplant Model. Blood. 2014;124(21):3735 LP - 3735. https://doi.org/10.1182/blood.V124.21.3735.3735
- Franziska Modemann, Susanne Ghandili, Stefan Schmiedel, et al. COVID-19 and Adult Acute Leukemia. Cancers (Basel). 2022 Aug; 14(15): 3711. https://doi.org/10.3390/cancers14153711
- Marchesi F., Salmanton-Garcia J., Emarah Z., et al. COVID-19 in adult acute myeloid leukemia patients: A long-term followup study from the European Hematology Association survey (EPICOVIDEHA) Haematologica. 2022 https://doi.org/10.3324/haema-tol.2022.280847
- Pagano L., Salmanton-Garcia J., Marchesi F., et al. COVID-19 infection in adult patients with hematological malignancies: A European Hematology Association Survey (EPICOVIDEHA) J. Hematol. Oncol. 2021;14:168. https://doi.org/10.1186/s13045-021-01177-0
- Palanques-Pastor T., Megias-Vericat J.E., Martinez P., et al. Characteristics, clinical outcomes, and risk factors of SARS-CoV-2 infection in adult acute myeloid leukemia patients: Experience of the PETHEMA group. Leuk Lymphoma. 2021;62:2928-2938. https://doi.org/10.1080/10428194.2021.1948031
- Martinez P., Palanques Pastor T., Lopez Lorenzo J.L., et al. Impact of SARS-CoV-2 Infection in Acute Myeloid Leukemia Patients: Experience of the Pethema Registry. Blood. 2020;136:7-8. https://doi.org/10.1182/blood-2020-138471
- Mitrovic M., Pantic N., Sabljic N., et al. Acute leukemia and SARS-CoV-2 infection: Clinical characteristics and risk factors for mortality. Leuk Lymphoma. 2021;62:3516-3520. https://doi.org/10.1080/10428194.2021.1964026
- Lidsay Wilde, Alessandro Isidori, Gina Keiffer, Neil Palmisiano, Margaret Kasner. Caring for AML Patients During the COVID-19 Crisis: An American and Italian Experience. Front Oncol. 2020 Sep 2;10:1689. https://doi.org/10.3389/fonc.2020.01689
- Ward PS, Mason CE, Yen K, et al. Combination Targeted Therapy to Disrupt Aberrant Oncogenic Signaling and Reverse Epigenetic Dysfunction in IDH2 - and TET2 -Mutant Acute Myeloid Leukemia. Cancer Discov. 2017;7(5):494-505. https://doi.org/10.1158/2159-8290.CD-16-1049
- Fathi AT, DiNardo CD, Kline I, et al. Differentiation syndrome associated with enasidenib, a selective inhibitor of mutant isocitrate dehydrogenase 2 analysis of a phase 1/2 study. JAMA Oncol. 2018;4(8):1106-10. https://doi.org/10.1001/jamaoncol.2017.4695
- Farnoud NR, Bernard OA, Levine RL, et al. Enasidenib induces acute myeloid leukemia cell differentiation to promote clinical response. Blood. 2017;130(6):732-41. https://doi.org/10.1182/blood-2017-04-779447
- Stein EM, DiNardo CD, Pollyea DA, et al. Enasidenib in mutant IDH2 relapsed or refractory acute myeloid leukemia. Blood. 2017;130(6):722-31. https://doi.org/10.1182/blood-2017-04-779405


