Эффективность комбинированного лечения больных раком пищевода с применением неоадъювантной химиотерапии
Автор: Рудык Ю.В., Афанасьев Сергей Геннадьевич, Тузиков Сергей Александрович, Добродеев Алексей Юрьевич, Самцов Евгений Николаевич, Фролова Ирина Георгиевна, Савельев И.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (58), 2013 года.
Бесплатный доступ
Проведен анализ непосредственной и отдаленной эффективности комбинированного лечения больных раком пищевода II–III стадии с применением неоадъювантной химиотерапии. В основной группе (n=18) больным назначалось 2 курса химиотерапии по схеме гемзар + цисплатин с последующей радикальной операцией, в контрольной группе (n=20) проводилось хирургическое лечение. В результате неоадъювантного лечения непосредственная эффективность химиотерапии составила 38,9 %, полная регрессия наблюдалась у 1 (5,6 %) больного. Лечение отличалось удовлетворительной переносимостью и низкой токсичностью. Уровень послеоперационных осложнений в основной и контрольной группах значимо не отличался – 22,2 % и 25,0 % соответственно (p>0,05). Комбинированное лечение рака пищевода с применением неоадъювантной химиотерапии позволило значимо увеличить показатели двухлетней общей и безрецидивной выживаемости – 87,5 ± 8,2 % и 87,5 ± 8,2 % по сравнению с группой контроля – 63,2 ± 11,1 % и 47,4 ± 11,4 % соответственно (р
Рак пищевода, комбинированное лечение, неоадъювантная химиотерапия, непосредственные и отдаленные результаты лечения
Короткий адрес: https://sciup.org/14056344
IDR: 14056344 | УДК: 616.329-006.6-059:615.28
Текст научной статьи Эффективность комбинированного лечения больных раком пищевода с применением неоадъювантной химиотерапии
В последние годы в России отмечается рост заболеваемости раком пищевода, с 2005 по 2010 г. абсолютное число вновь выявленных больных раком пищевода (РП) у мужчин выросло на 5,3 %, у женщин – на 0,4 %. Наиболее часто РП развивается в возрасте 50–60 лет, мужчины заболевают в 6,7 раза чаще. При этом, несмотря на совершенствование методов диагностики, в большинстве случаев выявляется местнораспространенный рак пищевода, что негативно сказывается на результатах лечения. Так, в 2012 г. в нашей стране зарегистрировано 6970 первичных больных РП, из них II–III стадия процесса диагностирована в 61,2 % случаев, IV стадия – в 29,2 %, общая одногодичная летальность достигла 59,4 % [4, 5].
В России подавляющее число больных имеют плоскоклеточный рак (70–95 %). Однако в зарубежных странах, прежде всего в США и в государствах Западной Европы, последние 10–15 лет наблюдается тенденция к росту доли аденокарцином, что большинство авторов объясняют увеличением частоты встречаемости пищевода Барретта и связывают с эпидемией ожирения и высокой заболеваемостью рефлюкс-эзофагитом. В результате в верхней и средней третях пищевода преимущественно диагностируются плоскоклеточные опухоли (56 %), а в нижней трети – аденокарцинома (43 %) [3, 6].
Лечение рака пищевода до настоящего времени остается актуальной проблемой современной онкологии. Хирургическое вмешательство остается основным эффективным методом лечения РП. Частота радикальных операций пищевода при выполнении трансторакальной эзофагэктомии составляет 60–90 %, послеоперационная летальность – 1,5–23 %. Результаты хирургического лечения в первую очередь зависят от распространенности опухолевого процесса, наличие регионарных метастазов снижает 5-летнюю выживаемость с 40–45 % до 10–25 %, а при выходе опухоли за пределы стенки органа ни один больной не доживает до 5 лет после оперативного лечения [2, 8].
Представленные данные свидетельствуют о том, что рассчитывать на улучшение результатов лечения рака пищевода возможно за счет комбинированного лечения с применением различных вариантов неоадъювантной терапии. Основной целью предоперационной химиотерапии при операбельном РП являются уменьшение размеров опухоли и создание условий для выполнения операции меньшего объема, а также воздействие на первичный очаг и микрометастазы для улучшения прогноза заболевания [7]. При раке пищевода наиболее часто используются 5-фторурацил, паклитаксел, иринотекан в комбинации с препаратами платины, при этом лечебные эффекты регистрируются у 44–55 % больных. Причем частота опухолевой регрессии не зависит от гистотипа опухоли. По данным М.И. Давыдова с соавт. [2], при проведении предоперационной химиотерапии по схеме FLEP (5-фторурацил, этопозид, цисплатин, лейковорин) у большинства больных отмечалась полная и частичная регрессия опухоли (80,6 %), что позволило повысить частоту радикальных резекций (R0) до 86,7 %, в контрольной группе – 63,6 %, без увеличения послеоперационной летальности. Представляет интерес мета-анализ, в котором сравнивается эффективность предоперационной химиотерапии и оперативного лечения в самостоятельном варианте у 2051 больного раком пищевода [11]. В группах предоперационной химиотерапии в разных исследованиях частота объективного эффекта колебалась от 15 до 60 %, а полная регрессия опухоли, подтвержденная морфологически, отмечена у 4–7 % больных, что сочеталось с достоверным увеличением продолжительности жизни. Таким образом, на основании вышеизложенного представляется крайне актуальным развитие комбинированных методов лечения местнораспространенного рака пищевода за счет использования системных видов противоопухолевого воздействия.
Цель исследования – изучить эффективность и переносимость комбинированного лечения рака пищевода с использованием неоадъювантной химиотерапии и радикальной операции.
Материал и методы
В торакоабдоминальном отделении ФГБУ «НИИ онкологии» СО РАМН проведено лечение 38 больных раком пищевода II–III стадии с морфологически верифицированным диагнозом. Основную группу составили 18 больных, у которых было проведено комбинированное лечение, включающее 2 курса неоадъювантной химиотерапии по схеме гемцитабин/цисплатин и радикальную операцию. Контрольную группу составили 20 больных, которым выполнялась радикальная операция. Распределение больных по группам проводилось методом «случай-контроль».
Наибольшее число больных было в возрасте от 55 до 65 лет (88,5 %). Соотношение заболевших мужчин и женщин составило 6:1. В основной и контрольной группах наиболее часто отмечалось поражение среднегрудного отдела пищевода – 18 (47,4 %), затем нижнегрудного – 11 (28,9 %) и абдоминального отдела пищевода – 9 (23,7 %) (табл. 1). Окончательная стадия заболевания устанавливалась после операции в соответствии с классификацией Международного противоракового союза по системе TNM: IIА стадия – 9 (23,7 %), IIВ стадия – 12 (31,6 %), III стадия – 17 (44,7 %) больных (табл. 1). По гистологической структуре преобладал плоскоклеточный рак – 35 (92,1 %), аденокарцинома – 3 (7,9 %). Необходимо отметить, что аденокарцинома во всех случаях выявлялась в абдоминальном отделе пищевода. По основным прогностическим признакам группы были сопо- ставимы. Имеющиеся различия в группах были статистически не значимы, что позволило провести сравнительный анализ результатов лечения.
Больным основной группы на первом этапе комбинированного лечения проводилось 2 курса неоадъювантной химиотерапии (НАХТ) по схеме гемцитабин – 1250 мг/м 2 в/в в 1-й и 8-й дни, цисплатин – 80 мг/м 2 в/в в 1-й день. Интервал между курсами химиотерапии и хирургическим лечением составлял 3–4 нед. Далее у всех больных в основной и контрольной группах выполнялась радикальная операция – расширенная субтотальная резекция пищевода с 2-зональной (2F) лимфодис-секцией из комбинированного лапаротомного и правостороннего торакотомного доступа с одномоментной эзофагопластикой. При выполнении реконструктивного этапа операции выбор метода пластики зависел от уровня поражения и резекции пищевода, а также индивидуальных особенностей больного. Наиболее часто использовался широкий желудочный стебель (операция типа Льюиса) – 27 (71,0 %), значительно реже изоперистальтическая пластика проводилась левой половиной толстой кишки – 8 (21,1 %) или тонкой кишкой – 3 (7,9 %) (табл. 2).
Непосредственный объективный ответ опухоли на проведение НАХТ определялся по шкале
RECIST, токсичность химиотерапии – по шкале CTC-NCIC. Для изучения особенностей течения послеоперационного периода использовался комплекс инструментальных исследований, клинических данных и лабораторных показателей. Для статистического анализа применялись стандартные методы медико-биологической статистики. Сравнительный анализ проводился с использованием критерия Стьюдента (t). Оценка эффективности методов лечения дана на основании изучения сроков и частоты появления рецидивов и метастазов. Кривые наблюдаемой 2-летней выживаемости строились по методу Каплана – Майера. Значимость различий в выживаемости между группами оценена по F-критерию Кокса.
Результаты и обсуждение
В основной группе непосредственная общая эффективность НАХТ по схеме гемцитабин/ цисплатин составила 38,9 %, из них частичная регрессия – 6 (33,3 %) больных, полная регрессия – 1 (5,6 %) больной. Стабилизация процесса была самой частой формой ответа опухоли на химиотерапию, она зафиксирована в 9 (50,0 %) случаях, прогрессирование опухолевого процесса наблюдалось у 2 (11,1 %) больных. Следует отметить, что гистотип опухоли у больных с прогрессированием в 1 случае был представлен аденокарциномой, в
Таблица 1
|
Параметры |
НАХТ + операция (n=18) |
Операция (n=20) |
Всего (n=38) |
|
Локализация опухоли |
|||
|
Среднегрудной отдел |
9 (50,0 %) |
9 (45,0 %) |
18 (47,4 %) |
|
Нижнегрудной отдел |
5 (27,8 %) |
6 (30,0 %) |
11 (28,9 %) |
|
Абдоминальный отдел |
4 (22,2 %) |
5 (25,0 %) |
9 (23,7 %) |
|
Стадия процесса |
|||
|
IIА (T2–3N0M0) |
4 (22,2 %) |
5 (25,0 %) |
9 (23,7 %) |
|
IIВ (T1–2N1M0) |
5 (27,8 %) |
7 (35,0 %) |
12 (31,6 %) |
|
III (T3N1M0, T4NлюбаяM0) |
9 (50,0 %) |
8 (40,0 %) |
17 (44,7 %) |
|
Гистотип опухоли |
|||
|
Плоскоклеточный рак |
17 (94,4 %) |
18 (90,0 %) |
35 (92,1 %) |
|
Аденокарцинома |
1 (5,6 %) |
2 (10,0 %) |
3 (7,9 %) |
Таблица 2
Методика эзофагопластики в сравниваемых группах
1 случае – низкодифференцированным плоскоклеточным раком. По данным литературы [3, 10, 12, 13], при проведении химиотерапии по поводу рака пищевода показатели общей эффективности варьируют в пределах 37,1–80,6 %, что в целом согласуется с результатами, полученными в нашем исследовании.
Из непосредственных побочных реакций химиотерапии наиболее часто встречалась тошнота/ рвота – 10 (55,5 %) случаев. Гематологическая токсичность была представлена тромбоцитопенией в 9 (50,0 %) случаях, в том числе I–II степени – в 7 (38,9 %), III степени – в 2 (11,1 %) и лейкопенией I–II степени – в 4 (22,2 %). Из негематологических осложнений чаще регистрировалась нефротоксичность – 4 (22,2 %) случая. Аллергические реакции зафиксированы у 8 (44,4 %) больных. Таким образом, при проведении химиотерапии по схеме гем-цитабин/цисплатин отмечен приемлемый профиль токсичности, удовлетворительная переносимость и безопасность данной комбинации. Развившиеся осложнения носили кратковременный, нестойкий характер и достаточно хорошо купировались назначением симптоматической терапии, что согласуется с данными литературы [12, 13].
Несмотря на то, что в основной группе хирургическое лечение проводилось после НАХТ, интраоперационных осложнений в сравниваемых группах не было. Значительное внимание уделялось особенностям течения послеоперационного периода. В среднем послеоперационный период в обеих группах длился 12–14 сут. Нахождение в отделении интенсивной терапии, как правило, не превышало 5 сут. Отделяемое по дренажам из плевральной и брюшной полости (200–250 мл) носило серозно-геморрагический характер и наблюдалось в течение 2–3 сут. Гематологических особенностей в сравниваемых группах отмечено не было.
В оценке непосредственных результатов комбинированного лечения больных раком пищевода важным критерием является характеристика послеоперационных осложнений и летальности. Количество послеоперационных осложнений в основной группе (22,2 %) значимо не отличалось от группы контроля (25,0 %) (p>0,05). Следует отметить, что общее количество осложнений превышало общее число больных, так как у некоторых больных развилось несколько осложнений (табл. 3).
При анализе структуры осложнений отмечено, что наиболее грозными осложнениями являлись недостаточность внутригрудного анастомоза или нарушения трофики интраторакальных трансплантатов с последующим частичным и/или тотальным некрозом, в 3 (7,9 %) случаях это привело к развитию эмпиемы плевры на стороне поражения (табл. 3). Эти неблагоприятные явления мы связываем, в первую очередь, с нарушением микроциркуляции в трансплантате, что служило причиной возникновения острых трофических эрозий и язв в трансплантате. Этим больным (n=5) потребовалось повторное оперативное вмешательство с целью санации плевральной полости и дополнительного дренирования, 3 случая были купированы, 2 больных (по одному в каждой группе) погибли от развившихся осложнений. В итоге послеоперационная летальность в основной группе составила 11,1 %, умерло 2 больных (второй пациент скончался от сердечно-сосудистой недостаточности, обусловленной сопутствующей кардиальной патологией), в контрольной – 5,0 % (умер 1 больной). Статистически значимых различий в сравниваемых группах не отмечено (p>0,05). При анализе особенностей
Таблица 3
|
Послеоперационные осложнения |
НАХТ + операция (n=18) |
Операция (n=20) |
|
Больных с осложнениями |
4 (22,2 %) |
5 (25,0 %) |
|
Недостаточность внутригрудного анастомоза |
- |
1 (5,0 %) |
|
Апикальный некроз тонкокишечного трансплантата |
1 (5,5 %) |
1 (5,0 %) |
|
Острая перфоративная язва гастротрансплантата |
- |
1 (5,0 %) |
|
Некроз гастротрансплантата |
1 (5,5 %) |
- |
|
Эмпиема плевры |
1 (5,5 %) |
2 (10,0 %) |
|
Послеоперационная пневмония |
2 (11,1 %) |
2 (10,0 %) |
|
Острая сердечно-сосудистая недостаточность |
1 (5,5 %) |
- |
|
Нагноение раны |
1 (5,5 %) |
1 (5,0 %) |
Частота и характер послеоперационных осложнений
Общая выживаемость (Kaplan-Meier) о Complete t- Censored
100%
90%
80%
70%
60%
50%
Время
---НАХТ и операция
30---Операция
Безрецидивная выжие о Complete
□=0.00525
---НАХТи операция
--- Операция
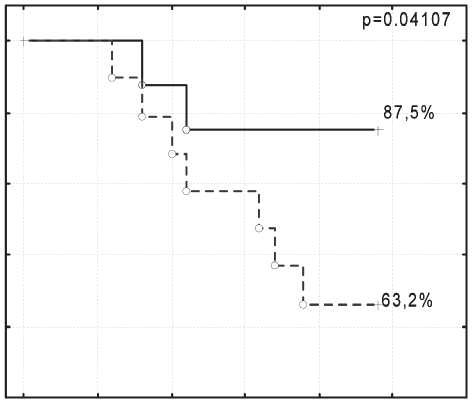
Рис. 2. Показатели безрецидивной 2-летней выживаемости больных раком пищевода II–III стадии в зависимости от метода лечения
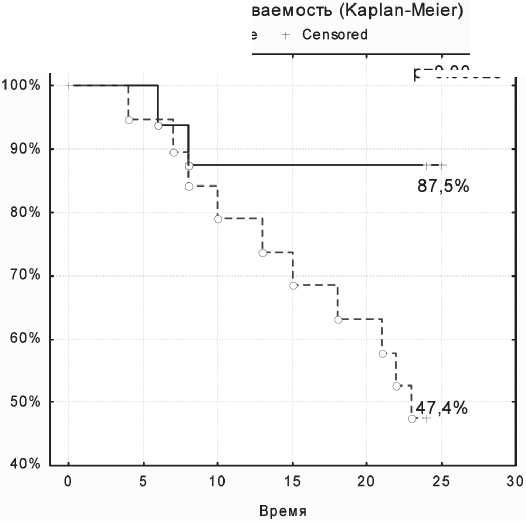
Рис. 1. Показатели общей 2-летней выживаемости больных раком пищевода II–III стадии в зависимости от метода лечения послеоперационного периода в зависимости от способа эзофагопластики обращает на себя внимание высокий уровень апикальных некрозов тонкокишечного трансплантата, которые возникли в 2 из 3 выполненных операций. В дальнейшем мы отказались от подобных вмешательств в пользу гастро- или колоэзофагопластики, что позитивно сказалось на результатах оперативного этапа лечения. В целом полученные непосредственные результаты соответствуют литературным данным о частоте послеоперационных осложнений и летальности в России и за рубежом и находятся в рамках среднестатистического показателя [1, 6, 11].
Одним из важнейших критериев эффективности проводимого лечения больных раком пищевода являются частота и сроки появления рецидивов и метастазов. Прослежены двухлетние результаты у 35 из 38 больных, получивших лечение, в основной группе – у 16 из 18 больных, в контрольной – у 19 из 20. В основной группе прогрессирование заболевания выявлено в 2 (12,5 %) случаях, оно было обусловлено отдаленным метастазированием в печень и легкие. Оба пациента умерли в течение первого года наблюдения. Длительность безрецидивного периода составила 21,9 мес. В контрольной группе прогрессирование опухолевого процесса выявлено у 10 (52,6 %) больных: в 3 случаях (15,8 %) за счет местных рецидивов, в 7 (36,8 %) – обнаружены отдаленные метастазы. Длительность безрецидивного периода – 18,7 мес. В результате прогрессирования в первый год наблюдения умерло 4 больных, во 2-й год – 3 больных. В итоге, общая 2-летняя выживаемость больных раком пищевода II–III стадии в основной и контрольной группах составила 87,5 ± 8,2 % и 63,2 ± 11,1 % (рис. 1), безрецидивная выживаемость – 87,5 ± 8,2 % и 47,4 ± 11,4 % (рис. 2) соответственно. Различия статистически значимы (р<0,05).
Таким образом, накопленный опыт в НИИ онкологии СО РАМН показал, что комбинированное лечение больных раком пищевода II–III стадии с применением НАХТ по схеме гемцитабин/циспла-тин и радикальной операции при удовлетворительной переносимости обеспечивает надежный локорегионарный контроль и сводит к минимуму количество отдаленных метастазов. Результаты хирургического лечения, полученные в нашем исследовании и по данным разных авторов [2, 6, 9], свидетельствуют о том, что в настоящее время, несмотря на развитие хирургической техники и совершенствование анестезиологического обеспечения, выполнение только одной радикальной операции у больных раком пищевода является недостаточным. Применение НАХТ с использованием противоопухолевых препаратов (гемцитабин и цисплатин) позволило получить общую непосредственную эффективность в 38,9 %. При этом наблюдаются приемлемый профиль токсичности и удовлетворительная переносимость химиотерапии. После проведения НАХТ хирургический этап лечения был реализован у всех больных раком пи- щевода в запланированном объеме, что обеспечило обнадеживающие результаты.
Заключение
При раке пищевода II–III стадии проведение комбинированного лечения с неоадъювантной химиотерапией и радикальной операцией позволяет значимо увеличить двухлетнюю общую выживаемость (87,5 %) относительно только хирургического лечения (63,2 %) (р < 0,05). Неоадъювантная химиотерапия по схеме гемцитабин/цисплатин показала высокую непосредственную эффективность (38,9 %) и в комбинации с хирургическим лечением повысила эффективность локорегионарного контроля и обеспечила профилактику отдаленного метастазирования, однако отдаленные результаты требуют дальнейшего изучения.


