Эффективность комбинированной иммунотерапии в комплексном лечении злокачественных глиом головного мозга
Автор: Черных Е.Р., Ступак В.В., Центнер М.И., Тихонова М.А., Никонов С.Д., Останин А.А., Хонина Н.А., Леплина О.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2-3 (10-11), 2004 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14054154
IDR: 14054154
Текст статьи Эффективность комбинированной иммунотерапии в комплексном лечении злокачественных глиом головного мозга
ГУ НИИ клинической иммунологии СО РАМН, г. Новосибирск
НИИ травматологии и ортопедии МЗ РФ', г. Новосибирск
Первичные злокачественные опухоли головного мозга (ЗОГМ), к которым относят анапластические астроцитомы (АА) и глиобластомы (ГБ), несмотря на комплексное лечение, имеют неблагоприятный прогноз. Продолжительность жизни в послеоперационном периоде у больных с данной патологией составляет в среднем 14 мес [8,11]. Неудовлетворительные результаты лечения объясняют несколькими причинами: инфильтрирующим характером роста внутримозговых опухолей, относительно высокой радио-и химиорезистентностью опухолевых клеток [\, 2]. Кроме того, быстропрогрессирующий и рецидивирующий характер опухолевого роста во многом обусловлен слабым иммунным ответом. Поэтому перспективы повышения эффективности лечения связывают с разработкой иммунотерапевтических методов. Установлено, что иммунная система способна самостоятельно распознать и элиминировать опухоль, когда количество клеток не превышает IxlO5 клеток. В то же время после радикальной операции остается 1-5х109 опухолевых клеток, а радио/ химиотерапия позволяет в лучшем случае уменьшить их количество до IxlO7 [9]. Таким образом, чтобы ожидать выздоровления, нужно еще как минимум на 2 порядка уменьшить число опухолевых клеток. И здесь методы иммунотерапии представляются вполне уместными.
Ранее считалось, что головной мозг не доступен для иммунного надзора. Однако наличие в опухолях Аимфоилной инфильтрации, в том числе цитотоксических Т-лимфоцитов, показало, что злокачественные глиомы распознаются и против них генерируется иммунный ответ. Однако этот ответ является слабым в силу отно- сительной изолированности головного мозга, дефекта антигенпрезентирующей активности опухолевых клеток и развития опухольассоци-ированной иммунодепрессии, обусловленной продукцией опухолевыми клетками факторов с иммуносупрессивной активностью — простагландина Е2, интерлейкина-10 (ИЛ-10), трансформирующей рост фактора-р и Fas-лиганда [4, 6, 12].
Для усиления иммунного ответа используются различные подходы, которые условно разделяют на две категории. — методы неспецифической и антигенспецифической иммунотерапии (ИТ). К первой относится применение цитокинов (интерфероны, интерлейкин-2) как вариант активной ИТ и лимфокин-активированных киллерных (ЛАК) клеток как вариант адоптивной ИТ. Ко второй категории принадлежат различные протоколы иммунизации опухолевыми антигенами (в качестве активной ИТ) или введение антигенспецифических цитотоксических Т-клеток в качестве адоптивной ИТ. На сегодняшний день наибольшее распространение в лечении злокачественных глиом получили методы адоптивной иммунотерапии [5, 7]. При этом выяснилось, что эффективность ИТ зависит от многих факторов: исходного состояния иммунитета, возможности эффекторных клеток проникать через гематоэнцефалический барьер и преодолевать супрессию со стороны опухоли. Поэтому дальнейшие перспективы ИТ связывают с использованием комбинированных подходов [10].
В рамках этого направления нами был апробирован собственный протокол комбинированной иммунотерапии (КИТ), который включал 3 этапа. На первом этапе с помощью комплекса
_____________ Е.Р.ЧЕРНЫХ, В.В.СТУПАК, М.И. ЦЕНТНЕР, НА. ХОНИНА, О.Ю. ЛЕПЛИНА И ДР.
нативных цитокинов в виде препарата "Лейкин-ферон" (НПФ "Интекор ", г. Москва) проводили индукторную фазу КИТ, направленную на коррекцию иммунных дисфункций. Второй этап представлял собственно адоптивную ИТ и включал введение ЛАК и цитотоксических Т-клеток в комбинации с ИЛ-2 в ложе удаленной опухоли с целью элиминации оставшихся опухолевых клеток. В качестве ИЛ-2 использовали препарат "Ронколейкин" (ООО "Биотех", г. Санкт-Петербург). На завершающем этапе пациентам вводили комплекс аутологичных цитокинов, полученных при культивировании лимфоцитов больного с опухолевыми антигенами в присутствии TL-2 с целью поддержания противоопухолевой активности сенсибилизированных Т-клеток.
Предложенная схема была разработана с учетом данных литературы, а также полученных нами ранее следующих фактов:
-
1) течение злокачественных глиом сопряже но с развитием выраженной иммунодепрессии, которая проявляется не только дефектом НК-клеток и Т-лимфоцитов, но и нарушением фун кциональной активности моноцитов;
-
2) иммун о депрессия носит стойкий характер;
-
3) наряду с прямым супрессивным действием опухолевых клеток, важную роль в развитии им мунодепрессии играют моноциты, которые, с одной стороны, приобретают супрессорнуго активность, а с другой, в силу дефекта костиму-ляторных молекул способствуют усилению активационного апоптоза Т-клеток [3],
Поскольку на этом фоне эффективность генерации эффекторных клеток может быть снижена, первый этап КИТ был посвящен коррекции иммунных дисфункций. Использование с этой целью лейкинферона, содержащего в своем составе провоспалительные и ТЫ цитокины, представлялось вполне обоснованным, поскольку указанные цнтокины активируют клетки моноцитарного ряда, НК-клетки и протектиру-ют развитие активационного апоптоза Т-клеток.
Сочеганное использование ЛАК и цитотоксических клеток на втором этапе терапии было предложено в силу следующих обстоятельств. Известно, что цитоксический потенциал и резистентность к супрессорному влиянию опухолевых клеток выше у цитотоксических Т-лим- фоцитов. С другой стороны, продуцируемый НК-клетками IFN-у подавляет в опухолевых клетках продукцию IL-10, ослабляя тем самым супрессорное действие опухоли. Поэтому совместное использование ЛАК и цитотоксических Т-клеток может иметь синергический эффект. Наконец, целью третьего этапа стало поддержание противоопухолевой активности сенсибилизированных Т-лимфоцитов.
Чтобы оценить клиническую эффективность предложенного подхода, мы проанализировали результаты лечения 155 человек, среди которых у 58% диагностировалась АА и у 42% - ГБ. Все больные были разделены на две группы. Пациенты первой (контрольной группы) получали стандартное лечение, т.е. хирургическое удаление опухоли и лучевую терапию. Пациентам второй (основной) группы дополнительно проводилась комбинированная иммунотерапия. Сформированные группы больных были однородны по большинству параметров - возрасту, соотношению пациентов с АЛ и ГБ, показателям уровня качества жизни и локализации опухоли (табл. 1). Имеющиеся различия проявлялись в преобладании в основной клинической группе мужчин и в большей частоте пациентов, оперированных повторно по поводу рецидива ЗОГМ. Кроме того, больные основной группы характеризовались несколько большим объемом опухолевого субстрата. Учитывая худший прогноз выживаемости у пациентов с рецидивирующими формами ЗОГМ и данные о сопряженности иммунодепрессии с размером опухоли, выявленные различия свидетельствовали о большей тяжести группы больных, комплексное лечение которых было дополнено проведением КИТ.
Первоначально мы оценили переносимость КИТ и ее влияние на общее состояние и качество жизни больных. Проведение КИТ не сопровождалось развитием выраженных цитоки- : новых реакций и нарастанием отека головного мозга по данным МРТ. Более того, оценка качества жизни показала, что при равных исходных показателях индекса качества жизни (ШОК) в контрольной и основной группах (55,2 ± 1,5 и 55,6 ± 1,9 балла, соответственно) через 1 мес после оперативного лечения больные, получив-
Таблица 1
Сравнительная характеристика больных исследуемых групп
Оценка показателей выживаемости в контрольной и основной группах (рис. 1) выявила, что на фоне КИТ уровень 1- 2- и 3-летней выживаемости больных был значимо выше. Сравнительный анализ эффективности лечения у больных с АА и ГБ показал, что выраженные различия в уровне выживаемости у больных ГБ (табл. 2) регистрировались уже к исходу 12 мес и были максимально выраженными через 24 и 36 мес. Так, если к исходу 24 мес в контрольной группе выжило 5,12% больных, то в основной группе - 55,5%, причем 25% больных пережили 3-летний период наблюдения. У больных с АА различия в уровне выживаемости между контрольной и основной группой через 12 мес наблюдения были менее выражены. Однако к исходу 3 лет показатели выживаемости у больных основной группы в 8 раз превышали таковые у больных контрольной группы. Суммируя полученные данные, можно заключить, что предложенный нами протокол комбинированной им-
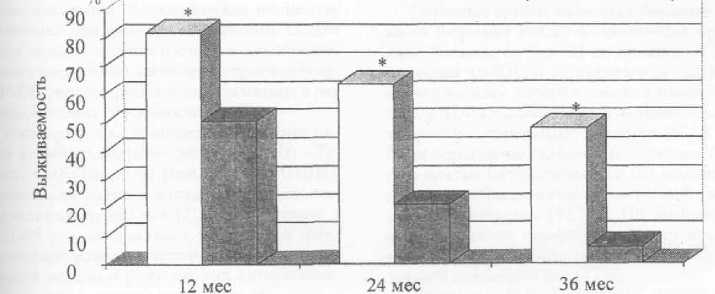
Основная группа ■ Контрольная группа
Рис. 1 . Показатели 1-, 2- и 3-летней выживаемости у больных контрольной и основной групп
Примечание.- * - статистически достоверное отличие двух групп (р<0,05).
мунотерапии является хорошим дополнением к комплексному лечению злокачественных глиом, позволяет повысить качество жизни паци- ентов в послеоперационном периоде и увеличить сроки выживаемости больных.
Таблица 2
Показатели 1-3 2- и 3-летней выживаемости больных ЗОГМ (% выживших больных)
|
Период наблюдения |
Анапластическая астро цггома |
Глиобластома |
||
|
Основная группа |
Контрольная труппа |
Основная группа |
Когпроль* пая группа |
|
|
12 мес |
86,8 |
68,6*- |
74 |
28»=*- |
|
24 мес |
71 |
33** |
55,5 |
5,12** |
|
36 мес |
65,8 |
7,8** |
25 |
2,56“ |
Примечание: ** - достоверность различий методом X2 (р<0,01)


