Эффективность лизиноприла и лозартана у больных с инфарктом миокардом при недостаточности левого желудочка
Автор: Шамухамедова Н.Ш., Нурмухамедова .К., Арипходжаева Ф.З.
Журнал: Форум молодых ученых @forum-nauka
Статья в выпуске: 11 (15), 2017 года.
Бесплатный доступ
Проанализированы результаты стресс-эхокардиографии с добутамином на фоне лечения лизиноприлом (n=30) и лозартаном (n=30) больных с Q передним Инфаркт Миокарда. Выявлено, что лизиноприл более эффективно влиял на зоны обратимой дисфункции миокарда, чем лозартан, приводя к улучшению показателей глобальной, регионарной систолической функции и раннего ремоделирования левого желудочка.
Стресс-эхокардиография с добутамином, лизиноприл, лозартан, обратимая дисфункция миокарда
Короткий адрес: https://sciup.org/140277202
IDR: 140277202
Текст научной статьи Эффективность лизиноприла и лозартана у больных с инфарктом миокардом при недостаточности левого желудочка
Введение.
У больных, перенесших острый инфаркт миокарда (ОИМ), гибель части функционирующего миокарда левого желудочка (ЛЖ) инициирует компенсаторные в своей основе изменения сердца, затрагивающие его размеры, геометрию и функцию. Комплекс этих изменений объединяется понятием постинфарктного ремоделирования [1,4,6].
При ОИМ миокард характеризуется мозаичным поражением, очаги некроза чередуются с участками жизнеспособного миокарда, зоной ишемии. Наличие жизнеспособного миокарда после адекватной терапии поддерживает насосную функцию в условиях уменьшения сокращающейся части миокарда. При поражении более 20% массы левого желудочка компенсация будет неадекватной. Увеличение полости левого желудочка помогает восстановить ударный объем на фоне снижения фракции выброса. Дилатация увеличивает миокардиальный стресс, порочный круг замыкается. В качестве компенсации наступает гипертрофия миоцитов: до 78% от исходного объема [3].
Развитие сердечной недостаточности (СН) после инфаркта сопровождается ухудшением качества жизнии значительным снижением выживаемости больных (2,3,5). Несмотря на серьезные успехи достигнутые за последние годы в лечении ОИМ, уровень смертности у пациентов с СН в течение первого года после перенесенного ОИМ практически не снизился (Spencer F., 1999). Поскольку ремоделирование ЛЖ является основным фактором, определяющим развитие СН после инфаркта миокарда (Cohn J.N., 2000), представляется важным изучить возможность прогнозирования развития СН на основании анализа показателей, влияющих на характер постинфарктного ремоделирования [6].
Известно, что увеличение размеров ЛЖ после ОИМ, или ремоделирование ЛЖ, приводит к нарушению насосной функции сердца и увеличению частоты развития осложнений и смертности. Установлено, что в ремоделировании ЛЖ участвует активация ренин-ангиотензиновой системы (РАС) сердца [1,7]. Результаты многих клинических испытаний свидетельствуют о том, что при применении ингибиторов ангиотензинпревращающего фермента (АПФ) замедляется ремоделирование ЛЖ и снижается смертность больных ОИМ. Первым крупным исследованием по использованию ингибиторов АПФ у пациентов, перенесших ОИМ, был протокол SAVE с каптоприлом. В этом исследовании впервые было показано, что каптоприл (по 50 мг 3 раза в сутки) при лечении пациентов, имевших после ОИМ дисфункцию левого желудочка (фракция выброса - ФВ<40%), достоверно снижает общую (на 19%), сердечнососудистую смертность (на 21%), число госпитализаций из-за обострения ХСН (на 22%) и частоту повторных ОИМ (на 25%) [1,9].
Несмотря на столь явный эффект каптоприла, открытым оставался вопрос, а можно и нужно ли назначать ингибиторы АПФ больным, которые не имеют нарушения функции левого желудочка после ОИМ? А ведь именно такие пациенты составляют большинство. Ответ на этот вопрос был частично получен в самом крупном исследовании ISIS-4, включившем около 58000 больных. Всем больным, поступавшим в клинику с подозрением на ОИМ, независимо от его локализации и величины (присутствие патологического зубца Q на ЭКГ, наличие или отсутствие признаков декомпенсации или дисфункции левого желудочка), начиная с 1-го дня на 5 недель назначали каптоприл (по 50 мг 2 раза в сутки). В итоге, лечение каптоприлом больных даже с подозрением на ОИМ позволило снизить риск смерти на 7% и предотвратить 6 смертей при лечении 1000 больных. Именно после завершения этого исследования каптоприл первым из ИАПФ был зарегистрирован для лечения ОИМ. Затем последовали успешные исследования с рамиприлом (AIRE), лизиноприлом (GISSI - 3), зофеноприлом (SMILE) и трандолаприлом (TRACE). Проводится исследование PRE - AMI c периндоприлом. Отдельный интерес представляет исследование FAMIS, в котором фозиноприл применяли у больных, перенесших ОИМ и не имевших никаких признаков левожелудочковой дисфункции (ФВ>45%). Даже в этой группе пациентов наименьшего риска фозиноприл оказался весьма эффективным и достоверно снижал риск смерти и развитие выраженной ХСН (III-IV ФК) на 36,2% [1,2].
АРА появились несколько позже, чем похожие на них ингибиторы АПФ, поэтому их преимущества перед ингибиторами АПФ, как правило, пытались доказать в сравнении именно с этой группой препаратов, которые первыми доказали свою роль в снижении риска сердечно-сосудистых осложнений у конкретных категорий больных. В тех же областях, где ингибиторы АПФ еще не успели проявить себя в качестве препаратов, снижающих риск сердечно-сосудистых осложнений, АРА в ряде случаев завоевали лидирующие позиции. Прямые сравнения АРА и ингибитора АПФ в крупных РКИ немногочисленны, ни одно из них (ELITE-2, OPTIMAAL, VALIANT) не выявило достоверных различий во влиянии этих двух групп препаратов на вероятность сердечно-сосудистых осложнений, однако практически всегда переносимость АРА была несколько лучше, чем переносимость ингибиторов АПФ [4,9].
Однако в исследовании ELITE II (Evaluation of Losartan in the Elderly II), проведенном у больных с хронической сердечной недостаточностью, не выявлено статистически значимых различий в общей смертностимежду группами применения блокатора рецепторов ангиотензина II лозартана и ингибитора АПФ каптоприла. Результаты исследования OPTIMAAL (Optimal Trial in Myocardial Infarction with the Angiotensin II
AntagonistLosartan) свидетельствуют о более высокой смертности у больных с ОИМ вследствие осложнений сердечно-сосудистых заболеваний при использовании лозартана, чем при применении каптоприла (1). Выбор блокатора рецепторов ангиотензина II или ингибитора АПФ в качестве препарата первого ряда для подавления РАС при ОИМ может основываться также на данных о влиянии их на ремоделирование ЛЖ [4,6].
Цель исследования: диагностика обратимой дисфункции миокарда у больных с Q передним ИМ методом стресс-эхокардиографии с добутамином и сравнительная оценка влияния блокатора рецепторов ангиотензина II лозартана и ингибитора АПФ лизиноприла на дисфункцию ЛЖ.
Материал и методы. Обследованы 60 больных с острым коронарным синдромом с элевацией сегмента SТ (ОКС+ST) в возрасте от 34 до 68 лет (средний возраст 48,2±3,3 года). Больные госпитализированы в отделение кардиореанимации РНЦЭМП в первые 6 часов с момента появления жалоб. У всех обследованных подъем сегмента ST наблюдалась в отведениях I, AVL, V1-V6 от 2 до 12 мм от изолинии, реципрокные изменения в отведениях II, III, AVF. Стандартное лечение включало антикоагулянты, антиагреганты, статины, бета-адреноблокаторы, нитраты. Всем больным проведена успешная реваскуляризация миокарда, из них тромболитическая терапия (ТЛТ)–у 28 (46,7%), транслюминальная баллонная ангиопластика (ТЛБАП) — у 32 (53,3%). Больные рандомизированы в две группы. В 1-ю группу включены 30 больных (группа А), получавших стандартную терапию с включением препарата лозартан 50-100мг/сут (Лозап, Зентива) и реваскуляризации миокарда (ТЛТ - 14, ТЛБАП – 16 больных). Во 2-ю группу (группа В) вошли также 30 больных, которым дополнительно к стандартной терапии с момента поступления назначали лизиноприл 5-10 мг/сут (Диротон, Гедеон Рихтер) и проводили реваскуляризацию миокарда (ТЛТ - 14, ТЛБАП – 16 больных). Всем 60 больным в 1-е cутки и через 2 месяца выполнена эхокардиография и стресс-эхокардиография с добутамином после стабилизации состояния на 7-10 сутки. Использовался эхокардиограф Siemens Omnia (Германия). Определяли конечно-диастолические и конечносистолические размеры и объемы (КДР ЛЖ, КДО ЛЖ, КСР ЛЖ, КСО ЛЖ), ударный объем (УО), а также фракцию выброса (ФВ) и фракцию укорочения (ФУ) ЛЖ по методу Тейгольц. Стресс-эхокардиография (ЭхоКГ) с добутамином осуществлялась для оценки жизнеспособности миокарда, выявления дополнительных зон ишемии и оценки эффективности лечения. Протокол проведения стресс-ЭхоКГ включал определение прироста систолического утолщения стенки ЛЖ в зонах диссинергии на малых дозах препарата или выявление двухфазного ответа (повышение прироста систолического утолщения с последующим его снижением) и/или появление новыхнарушений региональной сократимости на больших дозах введения добутамина. Использована специальная программа для оценки функционального состояния миокарда-патент РУз № DGU 01428 [5]. Индивидуальные дозы добутамина рассчитывали с учетом массы тела больного, определяли субмаксимальную частоту сердечных сокращений (ЧСС). Добутамин вводился с помощью автоматического инфузомата Terumo (Германия) по общепринятой схеме. Одновременно проводилось ЭхоКГ-мониторирование глобальной и региональной сократимости миокарда ЛЖ, ЭКГ, а также АД и ЧСС с помощью монитора Nihon (Япония). Критериями прекращения пробы служили использование максимально возможной дозы добутамина, достижение субмаксимальной ЧСС, развитие стенокардии, ишемического (более 1 мм) снижения или подъема сегмента ST на ЭКГ и/или появление или усугубление диссинергий на ЭхоКГ, повышение систолического артериального давления (САД) более 220 мм рт. ст. или снижение САД более чем на 20 мм рт. ст. от исходного, выраженных аритмий (частой желудочковой экстрасистолии, желудочковой и наджелудочковой пароксизмальной тахикардии). При отсутствии указанных проявлений и ЧСС менее субмаксимальной на последней ступени фармакологической нагрузки (40 мкг/кг/мин) на фоне продолжающейся инфузии добутамина вводили 0,1% раствор атропина по 0,25 мг каждую минуту до максимальной дозы (1 мг). При развитии побочных явлений для быстрого их купирования вводили внутривенно 5 мл обзидана на 5 мл физиологического раствора сразу после прекращения инфузии добутамина. Для оценки региональной сократительной функции сердца использовалась классификация сегментарного деления ЛЖ, предложенная Американским обществом эхокардиографистов. Анализ нарушений локальной сократимости миокарда ЛЖ в 16 сегментах до и в процессе пробы проводился по 4-балльной шкале: гиперкинез – 0 баллов, нормокинез – 1 балл, гипокинез - 2 балла, акинез – 3 балла и дискинез – 4 балла [3]. Далее рассчитывался индекс нарушения регионарной сократимости (ИНРС) как соотношение суммы баллов анализируемых сегментов к общему их количеству. Критериями жизнеспособности (обратимой дисфункции) миокарда, по данным стресс-ЭхоКГ, были появление двухфазной реакции сократимости миокарда в зоне формирующегося рубца (повышение его сократимости на один балл и более и прирост систолического утолщения >3 мм на малых дозах добутамина (5–10 мкг/кг/мин) с последующим ухудшением сократимости на высоких дозах (>25мкг/кг/мин)) или постоянное повышение локальной сократимости в той же зоне на протяжении всей фармакологической пробы.
Статистическая обработка данных проводилась с помощью программы STATISTICA 5.0 (StatSoft). При анализе материала рассчитывались средние величины, стандартные ошибки и доверительный 95% интервал. Гипотеза о равенстве средних оцениваласьпо t-критерию Стьюдента. Статистические различия выборок устанавливались при р<0,05.
Результаты и обсуждение. У всех больных показатель систолического утолщения межжелудочковой перегородки (УМЖП) был достоверно (р<0,05) снижен (24,3±1,7% в группе лозартана и 25,5±1,9 в группе лизиноприла), по сравнению с систолическим утолщением задней стенки ЛЖ (УЗСЛЖ) (43,9±1,7% в группе лозартана и 45±1,5% в группе лизиноприла) (таблица 1). Между группами А и В достоверных различий по этим показателем не было выявлено (р>0,01). Существенной разницы между группами по показателю УЗСЛЖ не выявлено, так как он был сохранным у всех больных. Показатели КДР ЛЖ, КСР ЛЖ, КДО ЛЖ и КСО ЛЖ у больных обеих групп также достоверно не различались (p>0,01). ФВ ЛЖ была сниженной у больных обеих групп, составляла соответственно 45,6±0,9 и 46,5±1,1% (p>0,01).
Сегментарная фракция выброса ЛЖ после проведения реваскуляризации миокарда была сниженной у всех больных. По передним и перегородочным сегментам ФВ была ниже, чем по боковым и задним. Сегментарная ФВ по всем стенкам на верхушечном уровне была ниже, чем по средним и базальным. При детальной оценке сегментарной сократительной способности ЛЖ достоверных межгрупповых различий не выявлено. Более высокие показатели сегментарной ФВ отмечались по задним сегментам. Сегментарная сократимость вне зоны ИМ была снижена, особенно в группе А. Для качественного анализа сегментарной сократимости ЛЖ изучено 960 сегментов, из них 466 (48,5%) были нормокинетичными, 346 (36%)- гипокинетичными и 148 (15,4%)-акинетичными. ИНРС в среднем составил 1,68±0,04.
По исходным показателям глобальной и сегментарной сократимости группы были сопоставимы, на ЭхоКГ наблюдалось снижение показателей глобальной и регионарной систолической функции ЛЖ. В таблице 1 представлены данные о распределении сегментов ЛЖ в зависимости от выраженности степени асинергии. У больных группы А и В количество нормокинетичных, гипокинетичных и акинетичных сегментов были сопоставимы. Показатель ИНРС в группах А и В составил соответственно 1,63±0,04 и 1,64±0,03 (p>0,01). При малых дозах добутамина (7,5±0,5
мкг/кг/мин) в группе В показатель УМЖП увеличился до 43,2±1,9%, УЗСЛЖ - до 49,5±1,65% (Р<0,01). ФУ выросла с 22,5±0,7 до 33±0,7% (Р<0,01). Инотропная стимуляция привела к уменьшению КСР и КСО соответственно на 12,6 и 27,5% (Р<0,01), а конечно-диастолические показатели существенно не менялись (Р>0,05). Общая ФВ возросла с 46,5±1,1 до 60,2±1,8 (Р<0,05). На малых дозах добутамина сегментарная ФВ ЛЖ во всех отделах достоверно увеличивалась, причем более выражено по передним и перегородочным сегментам. На малых дозах добутамина сегменты с нормокинезией увеличились до 450 (94%), сгипокинезией и акинезией резко уменьшились до 10 (2%) и 20 (4%). ИНРС достоверно уменьшился с 1,64±0,03 до 1,1±0,02 (p<0,01). Из всех 240 исходно асинэргичных сегментов 210 стали нормокинетичными, то есть исходная дисфункция была обратима. У больных группы В сегментов с обратимой дисфункцией было 87,5% (таблица 1). Остальные 30 (12,5%) сегментов не реагировали на введение добутамина, составили зону необратимой дисфункции миокарда.
При высоких дозах добутамина систолическое утолщение стенок уменьшилось не только в области зоны некроза, но и в неинфарктной зоне. УМЖП снизилось до 28,6±1,7%, УЗСЛЖ до 37,2±3,2% (р<0,01). При продолжении инфузии добутамина КДР не менялся, отмечалась тенденция к увеличению КДО. Размер и объем ЛЖ в систолу существенно увеличивались по сравнению со значениями на малых дозах добутамина (КСР 4,3±0,02 см, КСО 83±3,1 мл). ФУ снизилась до 24,6±0,7%, ОФВ до 48,1±1,1% (р<0,01). На высоких дозах добутамина отмечается резкое уменьшение сегментарной ФВ во всех 16 сегментах, особенно по передним и перегородочным сегментам. На высоких дозах добутамина количество нормокинетичных сегментов резко уменьшилось до 250 (52%), увеличилось количество гипо163 (34%) и акинетичных - 67 (14%) сегментов. ИНРС увеличился до 1,62±0,04 (Р<0,01) (таблица 1). Из 210 сегментов с обратимой дисфункцией
200 сегментов на высоких дозах стали асинергичными, то есть показали «двухфазный» ответ, что свидетельствует обих гибернации.
У больных группы А на малых дозах добутамина (7,5±0,5 мкг/кг/мин) УМЖП достоверно увеличилось с 24,3±1,8 до 39,3±1,7%, УЗСЛЖ - с 43,9±2,0 до 48,9±1,8% (р<0,01). ФУ выросла с 23,5±0,6% до 30,3±0,4% (р<0,01). Инотропная стимуляция добутамином приводила к уменьшению КСР (р<0,01) и КСО. Конечно-диастолические показатели существенно не изменялись (р>0,05). Общая ФВ выросла с 45,6±0,9 до 60,5±1,2% (р<0,01). В группе А из всех диссинэргичных 238 сегментов на малых дозах добутамина 30 (12,6%) сегментов остались асинергичными, то есть исходная дисфункция в них оказалась необратимой. Только 208 (87,4%) сегментов имели обратимую дисфункцию. ИНРС достоверно уменьшился с 1,63±0,04 до 1,11±0,02 (р<0,01). При высоких дозах добутамина УМЖП снизилось до 26±1,67%, УЗСЛЖ - до 36,9±1,7% (р<0,01). Систолическое утолщение значительно ухудшилось, в большей степени по переднее перегородочной стенке, чем по нижней. Отмечена тенденция к увеличению КДР, КДО и достоверное увеличение КСР и КСО ЛЖ (Р<0,01) по сравнению со значениями на малых дозах добутамина (КСР 4,3±0,01 см, КСО 83,6±4,0 мл). ФУ снизилась до 25±0,6% (р<0,01). ФВ ЛЖ уменьшилась до 48,7±1,0% (р<0,05). Сегментарная ФВ ЛЖ на данном этапе исследования была ниже исходного уровня. На высоких дозах добутамина количество нормокинетичных сегментов резко уменьшилось до 240 (50%), количество гипокинетичных сегментовувеличилось до 182 (38%), акинетичных до 58 (12%) (таблица 1). ИНРС достоверно увеличился до 1,62±0,01 (р<0,01). Зону риска ишемии составили 238 (49,6%) сегменов. Из 208 (43,3%) сегментов с обратимой дисфункцией 182 показали «двухфазный» ответ, то есть дисфункция ЛЖ обусловлена гибернацией.
В группе лозартана проведение стресс-ЭхоКГ с добутамином позволило установить, что дисфункция миокарда ЛЖ в 6,25% сегментов была необратима, а в 43,3% - обратима. В группе лизиноприла сегменты с обратимой дисфункцией составили 43,75% , с необратимой дисфункцией 6,25%.
8,2 8 7,8 7,6 7,4 7,2 7 6.8 6.6 6,4 6,2
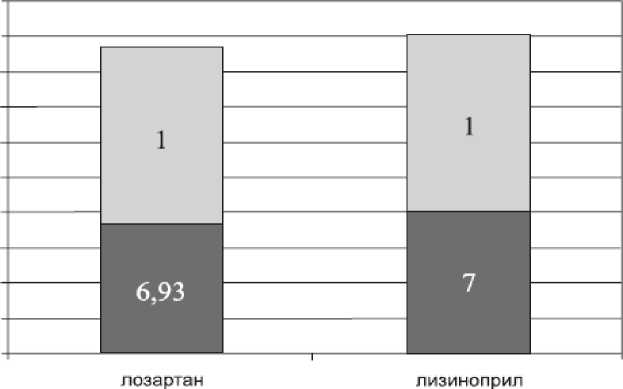
II обратимая дисфункция необратимая дисфункция
Рисунок 1. Количество сегментов с обратимой и необратимой дисфункцией при малых дозах добутамина на 7-10 сутки заболевания (* р>0,01).
В среднем количество добутамин реагированных сегментов в группе лозартана составляло 6,93±0,02, а в группе лизиноприла 7,0±0,02 (р>0,01), что показывает, что среди количества добутаминреагированных сегментов в обеих группах превалировала зона обратимой дисфункции (рисунок 1). Достоверных межгрупповых различий не выявлено. Результаты стресс эхокардиографии с добутамином показали, что основные показатели глобальной и локальной систолической функции ЛЖ достоверно улучшились в обеих группах. В обеих группах больных через 2 месяца отмечается улучшение систолических показателей (таблица 1). При этом у пациентов, принимавщих лизиноприл, отмечается более достоверное улучшение показателей систолической функции ЛЖ. Через 2 месяца у больных группы А и В отмечается достоверное уменьшение КСО ЛЖ до 74,2±4,1 и 66,0±3,1 мл по сравнению с с исходными показателями. Более достоверно уменьшение КСО ЛЖ отмечалось в группе больных, получавших лизиноприл (р<0,05). Соответственно отмечалось достоверное увеличение ФВ ЛЖ до 54,5±0,7 и 58,3±1,8% в группах А и В по сравнению с исходными значениями ФВ ЛЖ (р<0,05). Показатель КДО ЛЖ в обеих группах существенно не менялся (р>0,05). На 2 месяце наблюдения более достоверное повышение показателя ФВ ЛЖ отмечалось в группе ингибитора АПФ лизиноприла (р<0,01). В группах А и Вотмечается увеличение количества нормокинетичных сегментов до 86% и 92%, соответственно, и резкое уменьшение гипокинетичных (до 6 и 2%), акинетичных сегментов (до 8 и 6%), что показывает о восстановления контрактильности в жизнеспособных участках миокарда, которые были определены при проведении стресс-эхокардиографии с малыми дозами добутамина на 7-10 сутки заболевания. Восстановление контрактильности в жизнеспособны сегментах через 2 месяца была достоверно больше (р>0,05) в группе лизиноприла. У больных с дисфункцией ЛЖ, обусловленной наличием крупноочаговых изменений миокарда в передне перегородочной области, проведение добутаминовой пробы с малыми дозами показало его жизнеспособность. Это указывало на эффективность проведения реваскуляризации в системе нарушенного коронарного кровообращения на фоне применения лизиноприла. У больных с передним Q ИМ, подвергшихся реваскуляризации миокарда, назначение ИАПФ лизиноприла в ранние сроки положительно влияло на показатели центральной гемодинамики. Отмечено замедление развития дилатации полости ЛЖ, вследствие чего конечнодиастолические размеры в течение 2 месяцев достоверно не изменялись. Фракция выброса ЛЖ в динамике увеличивалась в обеих группах, но ее прирост на 2 месяце в группе ингибитора АПФ лизиноприла был более значительным.
Полученные нами данные подтверждают мнение о целесообразности применения ингибиторов АПФ и АРА в лечении жизнеспособного миокарда у больных ОИМ. Положительные свойства ингибиторов АПФ при лечении
ОИМ доказаны результатами крупных многоцентровых исследований, которые показали достоверность уменьшения прогрессирования дилатации и гипертрофии левого желудочка, а также приостановку процессов ремоделирования на фоне терапии различными ингибиторами АПФ. Все это позволило предположить возможность воздействия препаратов этой группы на поддержание жизнеспособности и восстановление сократимости диссинергичного миокарда. Ингибиторы АПФ, предупреждая развитие миокардиального фиброза, влияют на локальный синтез ангиотензина II непосредственно в миокарде, уменьшают миокардиальный стресс и тем самым увеличивают резерв миокардиальной сократимости, положительно влияют на зоны обратимой дисфункции миокарда (гибернации и оглушения).
Выводы: 1. Дисфункция миокарда при остром Q-переднем инфаркте миокарда обусловлена обратимыми (гибернацией, оглушением) и необратимыми (некроз, рубец) изменениями миокарда, которые можно дифференцировать при проведении стресс-эхокардиографии с малыми дозами добутамина. 2. По данным стресс-эхокардиографии и динамической эхокардиографии, лизиноприл более эффективно влиял на зоны обратимой дисфункции миокарда, чем лозартан, приводя к улучшению показателей глобальной, регионарной систолической функции и раннего ремоделирования ЛЖ.
Список литературы Эффективность лизиноприла и лозартана у больных с инфарктом миокардом при недостаточности левого желудочка
- Лутай М.И., Немчина Е.А., Цыж А.В. Стресс-эхокардиография, ее значение в диагностике ишемической болезни сердца и определении жизнеспособности миокарда. //Укр. кардiол. журн. - 2004 г.- № 2. - С. 26-28.
- Верткин А.Л., Скотников А.С. Исследование ингибиторов ангиотензинпревращающего фермента у пациентов, перенесших острый инфаркт миокарда. // Журнал "Кардиология" №7, 2008. С. 14 - 17.
- Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. Медикаментозные пути улучшения прогноза больных хронической сердечной недостаточностью. -М.: Инсайт, 1997. -с. 77.
- Феррари Р. Дисфункция левого желудочка после инфаркта миокарда: оглушение, гибернация и реконструкция. -М.: Медикография, 1997.-с.53-57.
- Кенжаев М. Л., Аляви Б. А. Программа для оценки функционального состояния миокарда и прогнозирования сердечной недостаточности // Государственное патентное ведомство РУз. Свидетельство № DGU 01428 от 13.11.07.
- Onodera H., Matsunaga T., Tamura Y., et al. Enalapril suppresses ventricular remodeling more effectively than losartan in patients with acute myocardial infarction. // Am Heart J 2005;150: 689.e11-689.e16.
- Smart S.C., Sawada S., Ryan T. et al. Low-dose dobutamine echocardiography detects reversible dysfunction after thrombolytic therapy of acute myocardial infarction//Circulation.-2005.-Vol.88.-P.405-415.
- Zaret B.I., Wackers F.J.T., Terrin M.I. et al. Assessment of global and ventricular perfomance at rest and during exercise after thrombolitic therapy for acute myocardial infarction: results of the thrombolysis in myocardial infarction (TIMI) II Study//Amеr.J.Cardiol.- 2004.-Vol.69.-P.1-9.
- Nijland F, Kamp O, Verhorst PM et al. Myocardial viability: impact on left ventricular dilatation after acute myocardial infarction// Heart.- 2002.-vol.87, N1.-P.17-22.


