Эффективность локального трансгенеза клеток яйцевода кур под воздействием гормональной стимуляции
Автор: Белоглазов Д.В., Волкова Н.А., Волкова Л.А., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетические основы маркерной селекции, трансгенез
Статья в выпуске: 6 т.50, 2015 года.
Бесплатный доступ
Создание трансгенных кур-биореакторов - перспективное направление биотехнологии. Однако, несмотря на заметные успехи в области трансгенеза птиц, эта задача представляет сегодня определенную проблему, что требует поиска и разработки альтернативных методов направленного переноса генов, один из которых - генетическая трансформация отдельных органов, в частности яйцевода кур (соматический трансгенез). Этот метод позволяет значительно сократить затраты средств и времени на получение трансгенных организмов по сравнению с использованием для адресной доставки ДНК других клеток-мишеней (клеток бластодермы, примордиальных зародышевых клеток, эмбриональных стволовых клеток), проведение генно-инженерных манипуляций с которыми возможно только на эмбриональном материале. Целью настоящей работы было изучение эффективности доставки рекомбинантной ДНК в клетки яйцевода кур in vivo и разработка методических подходов, позволяющих при этом повысить результативность трансгенеза. В работе использовали ретровирусный вектор pLN-GFP, полученный на основе вируса лейкемии мышей Молони (Mo-MuLV), в состав которого была клонирована последовательность маркерного гена GFP (зеленый флюоресцирующий белок). Для упаковки ретровирусного вектора pLN-GFP применяли пакующую клеточную линию GP+envAM12. Оптимальный срок введения генных конструкций определяли на основании анализа пролиферативной активности клеток яйцевода кур кросса Птичное в возрасте 1; 2; 3; 4; 4,5 и 5 мес, а также в возрасте 2 мес через 24 и 48 ч после гормональной стимуляции 0,1 % раствором синэстрола. Введение ретровирусного вектора осуществляли посредством инъекции раствора генной конструкции непосредственно в белковую часть яйцевода кур в возрасте 4 мес без предварительной гормональной стимуляции (I группа) и в возрасте 2 мес через 24 ч после введения синэстрола (II группа). Анализ интеграции и экспрессии рекомбинантной ДНК в клетках яйцевода кур осуществляли в возрасте 6 мес. При гистологическом исследовании максимальную пролиферативную активность клеток белковой части яйцевода наблюдали в период от 4 до 4,5 мес: относительное содержание ДНК в клетках повысилось на 3,4 отн. ед., что было равнозначно увеличению этого показателя за весь предыдущий период с 1-го по 4-й мес. У 2-месячных кур через 24 ч после инъекции синэстрола выявлено значительное изменение структуры яйцеводов, характерное для белковой части этого органа у кур в возрасте 4 мес. Через 48 ч гистоструктура яйцевода соответствовала таковой у половозрелой курицы. Средняя эффективность генетической трансформации клеток яйцевода кур, оцененная по отношению числа трансформированных клеток яйцевода к общему числу исследованных клеток этого типа, составила 17,2±3,1 % в I группе и 57,3±6,3 % во II группе. Таким образом, использование гормональной обработки позволило в 3,3 раза повысить результативность локального трансгенеза клеток яйцевода кур.
Куры, ретровирусные векторы, трансфекция, трансгенные животные
Короткий адрес: https://sciup.org/142133636
IDR: 142133636 | УДК: 636.52/.58:573.6.086.83:636.082 | DOI: 10.15389/agrobiology.2015.6.729rus
Текст научной статьи Эффективность локального трансгенеза клеток яйцевода кур под воздействием гормональной стимуляции
Использование трансгенной сельскохозяйственной птицы в качестве биореакторов — один из альтернативных методов получения рекомбинантных белков (1-9). Птицы иммунны к потенциальным терапевтическим протеинам (например, эритропоэтину человека), экспрессия которых может негативно влиять на состояние здоровья трансгенных млекопитающих при их использовании в качестве коммерческих продуцентов лекарств. Кроме того, появляется возможность существенно снизить стоимость рекомбинантных продуктов по сравнению с другими методами производства, основанными на использовании в качестве продуктивной платформы Escherichia coli , дрожжей или клеток млекопитающих (10).
Работа выполнена при финансовой поддержке государства в лице ФАНО, номер госрегистрации НИР 01201455101. При проведении исследований было использовано оборудование ЦКП «Биоресурсы и биоинженерия сельскохозяйственных животных» ВИЖ им. академика Л.К. Эрнста.
Несмотря на значительный прогресс в трансгенезе птиц, эффективность получения трансгенных кур лимитируют факторы, которые обусловлены особенностями их воспроизводства и онтогенеза. Вследствие ранней инициации эмбрионального развития в репродуктивных органах самки эмбрион к моменту яйцекладки состоит в среднем из 60000 клеток (11). Это значительно снижает эффективность традиционного метода введения экзогенной ДНК в клетки животных — микроинъекции, что ограничивает использование трансгенных технологий в птицеводстве.
В качестве альтернативного методического подхода можно рассматривать генетическую трансформацию отдельных органов, в частности яйцевода кур (соматический трансгенез). Она позволяет значительно сократить затраты средств и времени на получение трансгенных организмов по сравнению с использованием для адресной доставки ДНК других клеток-мишеней (клеток бластодермы, примордиальных зародышевых клеткок), генно-инженерные манипуляции с которыми возможны только на эмбриональном материале. В качестве перспективной системы для доставки рекомбинатной ДНК в клетки кур in vivo рассматривается использование векторных систем на основе рекомбинантных ретровирусов, в том числе лентивирусов (12-21).
Мы впервые изучили влияние полового гормона на пролиферативную активность и гистологические особенности клеток белковой части яйцевода у неполовозрелых кур кросса Птичное в связи с возможностью их генетической трансформации in vivo при помощи ретровирусных векторов и показали, что гормональная обработка позволила повысить результативность локального трансгенеза клеток яйцевода в 3,3 раза.
Нашей целью была оптимизация условий и определение эффективности доставки рекомбинантной ДНК в клетки яйцевода кур in vivo на основе разработанной ретровирусной векторной системы при применении гормональной стимуляции.
Методика. Объектом исследований служили куры кросса Птич-ное. Птица получала стандартные комбикорма и содержалась в условиях физиологического двора Всероссийского НИИ животноводства им. академика Л.К. Эрнста с соблюдением необходимых санитарно-технологических требований. Отбор образцов яйцевода кур ( n = 30) для гистологических исследований осуществляли в возрасте 1; 2; 3; 4; 4,5 и 5 мес. Для гормональной стимуляции клеток яйцевода в качестве эстрогена использовали 0,1 % раствор синэстрола в объеме 0,1 мл/гол. Препарат вводили подопытным курам в возрасте 2 мес подкожно, после чего через 24 и 48 ч отбирали образцы ткани белковой части яйцевода для гистологических исследований. Их фиксировали в 10 % растворе формалина в течение 24 ч, осуществляли проводку и заливали в парафин по общепринятой методике (22-23).
Гистологические срезы толщиной 4-5 мкм готовили на ротационном микротоме. Препараты просматривали под микроскопом («Nikon», Япония; объектив ½40, окуляры ½10, ½16), используя компьютерную программу Image Scope (ООО «Системы для микроскопии и анализа», Россия). ДНК в ядрах клеток выявляли окрашиванием по Фельгену (22). От каждой особи проанализировали не менее 30 ядер. Относительное количество ДНК (N) в ядрах клеток определяли по формуле: N = 100 ½ (1/В) ½ S, где В — средняя яркость ядер; 100 ½ (1/В) — относительная плотность ядер; S — площадь ядра. Интенсивность окрашивания и площадь ядер клеток яйцевода кур оценивали под микроскопом.
В работе использовали ретровирусный вектор pLN-GFP, полученный на основе вируса лейкемии мышей Молони (Mo-MuLV), в состав которого была клонирована последовательность маркерного гена GFP (зеле-730
ный флуоресцирующий белок). Для упаковки ретровирусного вектора pLN-GFP применяли пакующую клеточную линию GP+envAM12, преимуществом которой было отсутствие вируса дикого типа, а также возможность введения клонированных генов во многие клетки-хозяева.
Введение ретровирусного вектора (вирусный препарат) в яйцевод кур in vivo осуществляли в возрасте 4 мес без предварительной гормональной стимуляции (I группа, n = 3) и в возрасте 2 мес через 24 ч после гормональной стимуляции (II группа, n = 3) посредством инъекции препарата в белковый отдел яйцевода. Хирургическое вмешательство проводили с соблюдением правил асептики и антисептики, на всей птице применяли одинаковую общую анестезию и послеоперационную терапию. Оперативный доступ к белковому отделу яйцевода осуществляли через разрез за последним ребром и параллельно ему. За 24-36 ч до операции птицу полностью ограничивали в питании с сохранением доступа к воде. Перед операцией кур фиксировали в боковом положении. По линии намечаемого разреза выщипывали перья, кожу обрабатывали йодированным спиртом. Доступ открывали позади реберной стенки, делали разрез длиной 3-4 см, начиная от контура длиннейшего мускула спины на расстоянии 0,4-0,5 см от последнего ребра. Кожу предварительно слегка смещали. После рассечения кожи и мышечных слоев края раны отводили в стороны ранорасши-рителем. Затем зондом или инъекционной иглой раскрывали брюшину и смещали вниз кишечник для получения доступа к яйцеводу. Генные конструкции инъецировали в стенку яйцевода курицы. Операцию заканчивали наложением одноэтажного шва по Садовскому-Плахотину.
Ткани яйцевода отбирали в возрасте 6 мес для изучения интеграции и экспрессии рекомбинантной ДНК. ДНК выделяли солевым методом (24). Наличие рекомбинантной ДНК определяли с помощью ПЦР (12). Экспрессию рекомбинантных белков в клетках эпителия изучали иммуногистохимическим методом с использованием первых антител, специфичных к выявляемому белку (GFP). Для детекции продукта иммуногистохимической реакции применяли тетрахлорат 3,3-диаминобензидина (ДАБ) («Sigma», США). С целью визуализации гистоструктуры яйцевода после иммуногистохимического окрашивания исследуемые препараты докрашивали гематоксилином. От каждой курицы исследовали не менее 30 срезов толщиной 4-5 мкм.
Статистическую обработку проводили с использованием методов вариационной статистики в программе Microsoft Excel.
Результаты. Интенсивный рост и высокую пролиферативную активность клеток эпителиального слоя отмечали в возрасте от 4 до 5 мес (табл. 1). В этот период высота клеток увеличивалась на 65 %, количество ДНК в них — на 25 %. С учетом того, что резкое повышение содержания ДНК наблюдалось в возрасте 4-4,5 мес, этот возрастной период был выбран нами как оптимальный для введения ретровирусных векторов.
Введение генных конструкций в яйцевод кур в раннем возрасте, когда он имеет небольшие размеры, — один из приемов, способных повысить эффективность трансгенеза. Однако в этом возрасте клетки эпителиального слоя белкового отдела яйцевода характеризовались низкой пролиферативной активностью, что лимитировало результативность использования ретровирусных векторов для переноса рекомбинантной ДНК (см. табл. 1). Известно, что пролиферация клеток желез эпителиального слоя происходит через 24 ч после начала введения эстрогена, но в таких клетках синтез лизоцима и овальбумина достигает необходимого уровня только после 2-3 сут гормональной терапии. Работа трубчатых желез зависит от постоянного присутствия эстрогена, а его отсутствие приводит к быстрому подавлению функции яйцевода и последующей инволюции, которая сопровождается потерей массы и снижением синтеза лизоцима (25).
1. Морфофункциональные показатели клеток эпителиального слоя яйцеводов у кур кросса Птичное разного возраста ( M ± m ; Всероссийский НИИ животноводства им. академика Л.К. Эрнста, Московская обл.)
|
Возраст, мес |
Высота эпителиального слоя, мкм |
Площадь, мкм2 |
Ядерно-цитоплазма-тическое отношение |
Содержание ДНК в клетках, отн. ед. |
|
|
ядра |
цитоплазмы |
||||
|
1 |
9,50±0,16 |
7,56±0,26 |
7,12±0,43 |
1,14±0,12 |
11,5±0,3 |
|
2 |
12,64±0,15 |
8,34±0,34 |
8,91±0,44 |
0,95±0,03 |
13,0±0,5 |
|
3 |
14,18±0,17 |
12,14±0,17 |
13,09±0,11 |
0,93±0,01 |
13,7±0,4 |
|
4 |
16,95±0,16 |
15,91±0,22 |
20,29±0,19 |
0,78±0,01 |
14,9±0,3 |
|
4,5 |
17,37±0,26 |
14,77±0,31 |
21,44±0,67 |
0,70±0,02 |
18,3±0,4 |
|
5 |
27,93±0,52 |
23,01±0,61 |
49,05±0,64 |
0,47±0,01 |
18,6±0,2 |
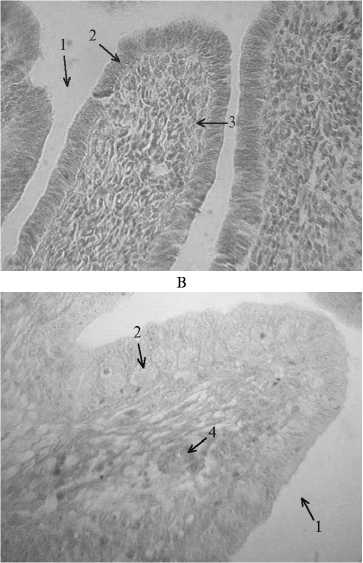
Мы наблюдали значительные изменения структуры яйцевода через 24 ч после инъекции 0,1 % синэстрола: увеличивался эпителиальный слой, появлялись складки, клетки мигрировали в подслизистый слой, что соответствовало гистоструктуре белковой части яйцевода у кур в возрасте 4 мес (рис. 1, Б). Микроскопия яйцевода птицы через 48 ч после введения эстрогена выявила многочисленные трубчатые железы, что соответствовало гистоструктуре яйцевода половозрелой курицы (см. рис. 1, В).
А
Б
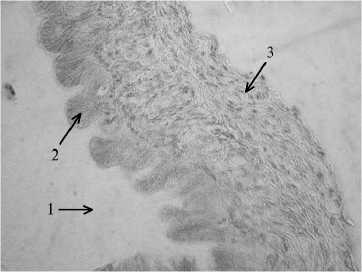
Рис. 1. Гистологическая структура яйцевода курицы кросса Птичное в возрасте 2 мес без гормональной обработки (А) , через 24 ч (Б) и через 48 ч после гормональной обработки (В) : 1 — просвет яйцевода, 2 — эпителий, 3 — собственная пластинка слизистой оболочки, 4 — трубчатые железы. Окраска гематоксилином и эозином, увеличение ½400 (микроскоп «Nikon», Япония).
Результаты сравнения эффективности генетической трансформации клеток эпителиального слоя из белковой части яйцевода кур (табл. 2) показали, что в I группе частота была относительно низкой и варьировала от 3,6±2,4 до 19,1±6,4 %, что, по всей видимости, связано с введением генных конструкций в яйцевод кур в период активного роста этого органа и значительного увеличения площади клеток-мишеней.
Введение генных конструкций в яйцевод в раннем возрасте после гормональной стимуляции (II группа) способствовало существенному повышению эффективности трансгенеза клеток (рис. 2). Число срезов яйцевода, в которых было выявлено наличие трансформированных клеток, уве-732
личилось в 1,9 раза. Эффективность трансформации клеток эпителиального слоя белковой части яйцевода, оцененная по отношению числа трансформированных клеток яйцевода к общему числу исследованных, увеличилась в 3,3 раза (см. табл. 2).
-
2. Эффективность генетической трансформации клеток яйцевода кур кросса Птичное in vivo генной конструкцией pLN-GFP (M±m, Всероссийский НИИ животноводства им. академика Л.К. Эрнста, Московская обл.)
А
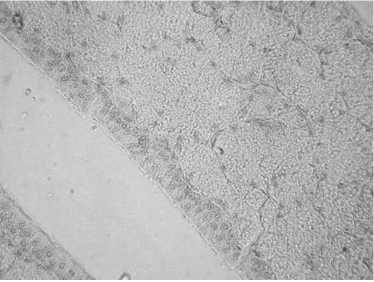
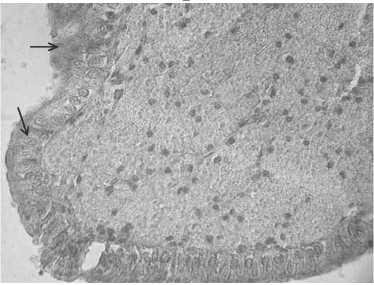
Рис. 2. Белковый отдел яйцевода курицы кросса Птичное в возрасте 6 мес после генетической трансформации клеток in vivo генной конструкцией pLN-GFP, экспрессирующей зеленый флуоресцентный белок GFP: А — без гормональной обработки (контроль), Б — с предварительной гормональной обработкой. Стрелками отмечены трансформированные клетки. Для визуализации гистоструктуры после иммуногистохимического окрашивания (хромоген — 3,3-диаминобензидин, «Sigma», США) препараты докрашивали гематоксилином, увеличение ½400 (микроскоп «Nikon», Япония).
|
Показатель |
Без гормональной стимуляции |
С гормональной стимуляцией |
|
Возраст введения ретровирусного вектора, мес |
4 |
2 |
|
Исследовано кур, гол. |
3 |
3 |
|
Исследовано срезов от каждой птицы, n Доля срезов с трансформированными клетками1, %: |
20 |
20 |
|
минимальная |
30 |
75 |
|
максимальная |
55 |
90 |
|
средняя по группе Эффективность трансформации клеток яйцевода2, %: |
43,3±7,3 |
83,3±4,4 |
|
минимальная |
3,6±2,4 |
49,9±6,8 |
|
максимальная |
19,1±6,4 |
65,2±9,5 |
|
средняя по группе |
17,2±3,1 |
57,3±6,3 |
|
Исследовано проб ДНК от каждой птицы, n |
10 |
10 |
|
Доля положительных ПЦР-проб, % |
54,3±2,4 |
83,3±6,7 |
П р им еч а ни е. 1 — отношение числа срезов с трансформированными клетками яйцевода к общему числу исследованных срезов, выраженное в процентах; 2 — отношение числа трансформированных клеток яйцевода к общему числу исследованных клеток этого типа, выраженное в процентах.
Таким образом, подтверждена перспективность использования ретровирусных векторов для генетической трансформации клеток яйцевода у взрослой птицы in vivo. Анализ гистоструктуры и пролиферативной активности показал, что у кур оптимальным для генно-инженерных манипуляций с клетками этого органа можно считать возраст 4-4,5 мес. Однако эффективность трансгенеза при введении ретровирусного вектора в яйцевод в этот период была относительно низкой (17,2±3,1 %), что обусловлено достаточно большими размерами органа. При гормональной стимуляции неполовозрелых 2-месячных кур 0,1 % раствором синэстрола пролиферативная активность повышалась и, как следствие, эффективность трансгенеза клеток-мишеней увеличивалась в 3,3 раза (до 57,3±6,3 %).
Список литературы Эффективность локального трансгенеза клеток яйцевода кур под воздействием гормональной стимуляции
- Зиновьева Н.А., Волкова Н.А., Багиров В.А., Брем Г. Трансгенные сельскохозяйственные животные: современное состояние исследований и перспективы. Экологическая генетика, 2015, XIII(2): 58-76.
- Byun S.J., Kim S.W., Kim K.W., Kim J.S., Hwang I.S., Chung H.K., Kan I.S., Jeon I.S., Chang W.K., Park S.B., Yoo J.G. Oviduct-specific enhanced green fluorescent protein expression in transgenic chickens. Biosci. Biotechnol. Biochem., 2011, 75(4): 646-649 ( ) DOI: 10.1271/bbb.100721
- Lillico S.G., Sherman A., McGrew M.J., Robertson C.D., Smith J., Haslam C., Barnard P., Radcliffe P.A., Mitrophanous K.A., Elliot E.A., Sang H.M. Oviduct-specific expression of two therapeutic proteins in transgenic hens. PNAS, 2007, 104(6): 1771-1776 ( ) DOI: 10.1073/pnas.0610401104
- Kodama D., Nishimiya D., Nishijima K., Okino Y., Inayoshi Y., Kojima Y., Ono K., Motono M., Miyake K., Kawabe Y., Kyogoku K., Yamashita T., Kamihira M., Iijima S. Chicken oviduct-specific expression of transgene by a hybrid ovalbumin enhancer and the Tet expression system. J. Biosci. Bioeng., 2012, 113(2): 146-153 ( ) DOI: 10.1016/j.jbiosc.2011.10.006
- Harvey A.J., Speksnijder G., Baugh L.R., Morris J.A., Ivarie R. Expression of exogenous protein in the egg white of transgenic chickens. Nat. Biotechnol., 2002, 20(4): 396-399 ( ) DOI: 10.1038/nbt0402-396
- Kwon M.S., Koo B.C., Choi B.R., Park Y.Y., Lee Y.M., Suh H.S., Park Y.S., Lee H.T., Kim J.H., Roh J.Y., Kim N.H., Kim T. Generation of transgenic chickens that produce bioactive human granulocyte-colony stimulating factor. Mol. Reprod. Dev., 2008, 75(7): 1120-1126 ( ) DOI: 10.1002/mrd.20860
- Kwon S.C., Choi J.W., Jang H.J., Shin S.S., Lee S.K., Park T.S., Choi I.Y., Lee G.S., Song G., Han J.Y. Production of biofunctional recombinant human interleukin 1 receptor antagonist (rhIL1RN) from transgenic quail egg white. Biol. Reprod., 2010, 82: 1057-1064 ( ) DOI: 10.1095/biolreprod.109.081687
- Rapp J.C., Harvey A.J., Speksnijder G.L., Hu W., Ivarie R. Biologically active human interferon a-2b produced in the egg white of transgenic hens. Transgenic Res., 2003, 12(5): 569-575 ( ) DOI: 10.1023/A:1025854217349
- Scott B.B., Velho T.A., Sim S., Lois C. Applications of avian transgenesis. ILAR J., 2010, 51(4): 353-361 ( ) DOI: 10.1093/ilar.51.4.353
- Ivarie R. Avian transgenesis: progress towards the promise. Trends Biotechnol., 2003, 21: 14-19 ( ) DOI: 10.1016/S0167-7799(02)00009-4
- Petitte J.N., Mozdziak P.E. Production of transgenic poultry. In: Transgenic animal technology (2nd edition)/C.A. Pinkert (ed.). NY, 2002: 279-306 ( ) DOI: 10.1016/B978-0-08-057480-6.50015-0
- Волкова Н.А., Волкова Л.А., Фомин И.К., Зиновьева Н.А., Горелик Л.Ш., Лоцманова Н.С. Интеграция и экспрессия маркерных генов в эмбрионах кур при использовании ретровирусных экспрессирующих векторов. Сельскохозяйственная биология, 2013, 2: 58-61 ( , 10.15389/agrobiology.2013.2.58eng) DOI: 10.15389/agrobiology.2013.2.58rus
- Волкова Н.А., Томгорова Е.К., Багиров В.А., Белоглазов Д.В., Зиновьева Н.А., Волкова Л.А., Эрнст Л.К. Генетическая трансформация клеток кур in vitro и in vivo с использованием ретровирусных векторов. Сельскохозяйственная биология, 2009, 6: 44-48.
- Kamihira M., Ono K., Esaka K., Nishijima K., Kigaku R., Komatsu H., Yamashita T., Kyogoku K., Iijima S. High-level expression of single-chain Fv-Fc fusion protein in serum and egg white of genetically manipulated chickens by using a retroviral vector. J. Virol., 2005, 79(17): 10864-10874 ( ) DOI: 10.1128/JVI.79.17.10864-10874.2005
- Smith C.A., Roeszler K.N., Sinclair A.H. Robust and ubiquitous GFP expression in a single generation of chicken embryos using the avian retroviral vector, RCASBP. Differentiation, 2009, 77(5): 473-482 ( ) DOI: 10.1016/j.diff.2009.02.001
- Scott B.B., Lois C. Generation of tissue-specific transgenic birds with lentiviral vectors. PNAS, 2005, 102(45): 16443-16447 ( ) DOI: 10.1073/pnas.0508437102
- Mizuarai S., Ono K., Yamaguchi K., Nishijima K.-I., Kamihira M., Iijima S. Production of transgenic quails with high frequency of germ-line transmission using VSV-G pseudotyped retroviral vector. Biochem. Biophys. Res. Commun., 2001, 286(3): 456-463 ( ) DOI: 10.1006/bbrc.2001.5422
- McGrew M.J., Sherman A., Ellard F.M., Lillico S.G., Gilhooley H.J., Kingsman A.J., Mitrophanous K.A., Sang H. Efficient production of germline transgenic chickens using lentiviral vectors. EMBO Rep., 2004, 5(7): 728-733 ( ) DOI: 10.1038/sj.embor.7400171
- Scott B.B., Lois C. Generation of tissue-specific transgenic birds with lentiviral vectors. PNAS USA, 2005, 102(45): 16443-16447 ( ) DOI: 10.1073/pnas.0508437102
- Chapman S.C., Lawson A., Macarthur W.C., Wiese R.J., Loechel R.H., Burgos-Trinidad M., Wakefield J.K., Ramabhadran R., Mauch T.J., Schoenwolf G.C. Ubiquitous GFP expression in transgenic chickens using a lentiviral vector. Development, 2005, 132: 935-940 ( ) DOI: 10.1242/dev.01652
- Mozdziak P.E., Borwornpinyo S., McCoy D.W., Petitte J.N. Development of transgenic chickens expressing bacterial β-galactosidase. Dev. Dyn., 2003, 226(3): 439-445 ( ) DOI: 10.1002/dvdy.10234
- Микроскопическая техника: Руководство/Под ред. Д.С. Саркизова, Ю.П. Перова. М., 1996.
- Ромейс Б. Микроскопическая техника. М., 1953.
- Зиновьева Н.А., Попов А.Н., Эрнст Л.К., Марзанов Н.С. Методические рекомендации по использованию метода полимеразной цепной реакции в животноводстве. Дубровицы, 1998.
- Kusuhara S., Ohashi T. Immunohistochemical detection of estrogen receptors in the magnum and shell gland of the chicken oviduct. Japanese Poult. Sci., 1991, 28: 328-334 ( ) DOI: 10.2141/jpsa.28.328


