Эффективность локальной гипертермии при химиотерапевтическом и/или лучевом лечении рецидивов лимфомы Ходжкина
Автор: Курпешев О.К., Павлов В.В., Шкляев С.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (58), 2013 года.
Бесплатный доступ
Проанализированы результаты применения локальной гипертермии (ЛГТ) в комбинированном лечении 25 пациентов с химио-и радиорезистентными рецидивами лимфомы Ходжкина. ЛГТ (41,5–42,6°С в течение 40–60 мин) осуществляли на поверхностно расположенные опухоли и сочетали с химиотерапией, лучевой или химиолучевой терапией. Лучевую терапию осуществляли по 2 Гр ежедневно или с расщеплением дневной дозы на 2 фракции (1 + 1 Гр) до СОД 20–30 Гр. После завершения основного лечения всем больным продолжали поддерживающие курсы химиотерапии. В течение 4-6 мес полный ответ опухоли по всей группе наблюдали в 65,0 % случаях, частичный – в 15,0 %, прогрессирование заболевания – в 20,0 %. После термохимиотерапии локальный контроль для 12–30-месячного срока наблюдения равнялся 16,7 %, при термолучевой терапии – для 30–60-месячного срока наблюдения составил 35,4 %. Таким образом, локальная гипертермия повышает непосредственные и отдаленные результаты (местный контроль) лучевой и химиотерапии больных с химио- и радиорезистентными рецидивами лимфомы Ходжкина.
Лимфома ходжкина, гипертермия, химиотерапия, лучевая терапия
Короткий адрес: https://sciup.org/14056346
IDR: 14056346 | УДК: 616-006.441-036.65-036.8:615.28:615.849
Текст научной статьи Эффективность локальной гипертермии при химиотерапевтическом и/или лучевом лечении рецидивов лимфомы Ходжкина
Последнее десятилетие ознаменовалось важными успехами в лечении злокачественных гемобластозов, в том числе и лимфомы Ходжкина (ЛХ). Однако, несмотря на применение современных лекарственных препаратов и интенсификацию программ комбинированной терапии, частота рецидивов ЛХ остается относительно высокой, и, в зависимости от стадии заболевания, она колеблется в пределах от 10 до 30 % [2, 4]. У большинства больных рецидивы становятся резистентными к химиолучевому лечению [10]. СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 4 (58)
Причиной развития резистентности ЛХ является измененное функционирование апоптотического пути в клетках Березовского–Штернберга, что связано с делецией или мутацией гена р53 и/или выраженной экспрессией генов Bcl-2, MDR-1, а также активацией ядерного фактора каппа В (NF-kB) [1]. По данным Th.P. Miller el al. [8], после нескольких курсов химиотерапии у 21 % больных с ЛХ обнаруживается экспрессия трансмембранного белка P-gp, являющегося одним из основных механизмов развития множественной лекарственной
ЭФФЕКТИВНОСТЬ ЛОКАЛЬНОЙ ГИПЕРТЕРМИИ ПРИ ХИМИОТЕРАПЕВТИЧЕСКОМ И/ИЛИ ЛУЧЕВОМ ЛЕЧЕНИИ ...
устойчивости (МЛУ) клеток. Одним из возможных путей преодоления МЛУ опухолевых клеток является применение гипертермии. Гипертермическое воздействие ингибирует экспрессию P-gp, топоизомераз, подавляет активность ферментов системы глютатиона и индуцирует апоптоз опухолевых клеток [3, 9, 11, 13]. Эти данные нашли подтверждение в клинике при комбинированном лечении радио- и химиорезистентных опухолей с использованием как локальной, так и общей гипертермии [5, 6].
Цель исследования заключалась в изучении эффективности локальной гипертермии в преодолении химио- и радиорезистентности рецидивов ЛХ при различных методах комбинированного лечения.
Материал и методы
Исследование основано на результатах лечения 25 больных с рецидивирующим течением ЛХ5и резистентных к химиотерапевтическому и/или лучевому лечению. Возраст пациентов колебался от 17 до 50 лет (медиана 28,4 года), стадия заболевания от IA до IVB, мужчин было 10, женщин – 15. Локальную гипертермию (ЛГТ) проводили на поверхностно расположенные опухолевые узлы, доступные к нагреванию. При этом ЛГТ у 5 больных сочеталась с химиотерапией (термохимиотерапия – TXT), у 17 – с лучевой терапией (термолучевая терапия – ТЛТ), у 3 – с химиолучевой терапией (термохимиолучевая терапия – ТХЛТ).
Ранее пациенты получили от 3 до 27 циклов химиотерапии (в среднем – 6,2 цикла) и/или 1–3 курса лучевой терапии (ЛТ) в СОД от 20 Гр до 63 Гр (в среднем – 31,6 Гр). Для выявления возможного действия нагревания на механизмы развития резистентности ЛГТ сочетали с химиопрепаратами, которые больные без эффекта получали на последних 2–3 курсах химиотерапии.
Лучевую терапию проводили дробнопротяженным методом, по 2 Гр ежедневно или с расщеплением дневной дозы по схеме «1+1 Гр» до СОД 20–30 Гр. ЛГТ осуществляли на гипертермических установках «Яхта-3» (915 МГц), «Яхта-4» (434 МГц), «Супертерм ЭП-40» (40,68 Мгц). Максимальная температура в опухоли колебалась в пределах 41,5–42,6°С. ЛГТ при TXT проводили сразу после введения ХП, при ТЛТ – непосредственно перед облучением, при ТХЛТ – после XT и перед ЛТ. В дальнейшем больным продолжали поддерживающие курсы ПХТ.
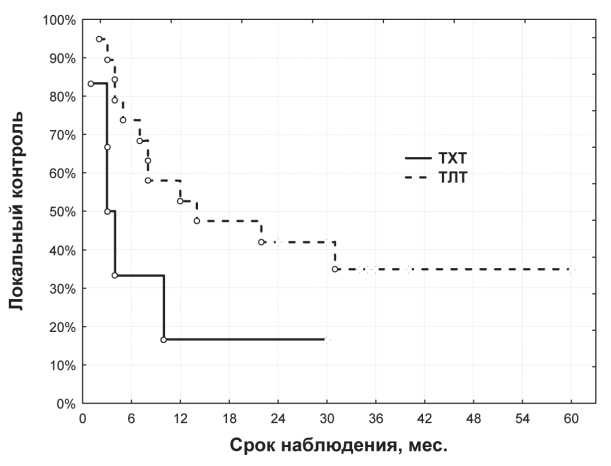
Рис. 1. Показатели локального контроля у больных с резистентными рецидивами лимфомы Ходжкина после ТХТ и ТХЛТ
Непосредственную реакцию опухоли оценивали по методике RECIST [12], отдаленные результаты – по локальному контролю. Кривые выживаемости по этому критерию рассчитывали по методу Каплан–Мейер [7] с использованием программы Statistica. Точкой отсчета выживаемости служило начало курса лечения с использованием ЛГТ.
Результаты и обсуждение
Полная регрессия (ПР) опухолевых очагов в течение 1–3 мес наблюдалась у 15,4 % больных, частичная (ЧР) – у 73,0 %, стабилизация (Ст) – у 7,7 %, у 1 больного отмечено прогрессирование (ПР) опухолевого процесса. В последующие сроки, в течение 4–6 мес, частота ПР по сравнению с контрольной точкой (1–3 мес) возросла от 16 до 68,4 % (у 13 из 19 больных), за счет дальнейшей регрессии опухолей с ЧР. Однако у 1 больного со стабилизацией и у 1 с ЧР опухоли начали прогрессировать.
В целом 5-летний локальный контроль составил 32,0 %, медиана этого показателя – 10,0 мес, 25-й процентиль – 4 мес. Отдельный анализ результатов TXT и ТЛТ (3 больных с TXJIT в этот анализ не включены) показал, что их эффективность значительно различается (рис. 1). Как при TXT, так и при ТЛТ рецидив заболевания в основном наблюдался в течение первого года после лечения. Локальный контроль при TXT в течение 12–30 мес оставался неизменным и равнялся 16,7 %, в то время как после ТЛТ этот показатель был значительно выше – через 30–60 мес после лечения он составил
O.K. КУРПЕШЕВ, В.В. ПАВЛОВ, С.С. ШКЛЯЕВ
-
35,4 %. Из 3 больных, подвергшихся ТХЛТ, у двоих на фоне общего прогрессирования заболевания имели место местная стабилизация и ЧР опухоли, третий пациент наблюдается без рецидива в течение 24 мес.
Непосредственно после завершения ТЛТ со стороны кожи на фоне эритемы наблюдалось сухое шелушение в виде отдельных или местами сливающихся между собой островков (I–II степень). При последующих наблюдениях (в течение года и более) лучевые изменения кожи у некоторых пациентов несколько усилились, что проявилось атрофией и появлением телеангиоэктазий.
Полученные результаты носят предварительный характер, но они показывают перспективность дальнейших исследований с учетом характеристик роста опухоли (нодальные, экстранодальные) и вариантов комбинированного лечения. Повышение эффективности JIT и XT у больных с резистентными формами рецидивов ЛХ при использовании ЛГТ, возможно, связано не только с ее радио- и химиосенсибилизирующим эффектом, но и влиянием на некоторые механизмы развития множественной лекарственной устойчивости. Учитывая, что при ЛХ чаще всего наблюдается диссеминация процесса, меры воздействия, способствующие преодолению лекарственной устойчивости, должны носить системный характер. При этом наиболее перспективным может быть использование химио- и/или лучевого лечения в сочетании с общей гипертермией.
Выводы
-
1. Локальная гипертермия снижает химио- и радиорезистентность рецидивов ЛХ и способствует повышению эффективности как лучевой, так и химиотерапии.
-
2. Частота полного ответа при рецидивах ЛХ в течение 4–6 мес после TXT, ТЛТ и ТХЛТ в целом составляет 68,4 %, частичного ответа – 15,8 %, прогрессирования – 20,0 %.
-
3. При радио- и химиорезистентных рецидивах ЛХ через 12–30 мес после TXT локальный контроль равнялся 16,7 %, при ТЛТ этот показатель через 30–60 мес после лечения составлял 35,4 %.


