Эффективность микросимбионтов чины болотной (Lathyrus palustris L.) и горошка мышиного(Vicia cracca L.), произрастающих в арктической Якутии
Автор: Карлов Д.С., Гуро П.В., Сазанова А.Л., Кузнецова И.Г., Тихомирова Н.Ю., Лащинский Н.Н., Павлов И.С., Белимов А.А., Сафронова В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Агросистемы будущего - от эксперимента к практике микробиопрепараты
Статья в выпуске: 3 т.58, 2023 года.
Бесплатный доступ
Формирование высокопродуктивных пастбищных фитоценозов, основу которых составляют бобовые растения, образующие азотфиксирующий симбиоз с клубеньковыми бактериями, - необходимое условие распространения и устойчивого роста численности травоядных сельскохозяйственных животных в условиях изменения климата и кардинальной перестройки растительных экосистем в Арктике. В то же время вопросы биоразнообразия клубеньковых бактерий на арктических территориях и эффективность их симбиотического взаимодействия с бобовыми растениями в настоящее время остаются в России практически не изученными. В настоящей работе впервые описаны 12 штаммов, изолированных из клубеньков чины болотной и горошка мышиного, произрастающих в Арктической Якутии: изучено их таксономическое положение, а также показана способность формировать эффективный симбиоз как с традиционными бобовыми культурами, так и с дикорастущими растениями, которые более адаптированы к условиям Крайнего Севера и могут использоваться для создания высокопродуктивных пастбищных фитоценозов. Целью работы было изучение генетического разнообразия ризобиальных изолятов из популяций арктических дикорастущих бобовых растений Lathyrus palustris L. и Vicia cracca L., а также оценка их способности формировать азотфиксирующие клубеньки на корнях кормовых пастбищных бобовых культур в условиях микровегетационного опыта. Корневые клубеньки дикорастущих популяций бобовых растений V. cracca и L. palustris были собраны в 2021 году на острове Самойловский и в поселке Тикси в ходе российско-немецкой экспедиции в дельту реки Лены. Ризобиальные штаммы из клубеньков бобовых выделяли по стандартной методике с использованием маннитно-дрожжевой питательной среды YMA. Таксономическое положение 12 изолятов определяли посредством секвенирования 16S рДНК ( rrs ). Для постановки микровегетационных опытов (МВО) использовали семена V. cracca , V. sativa , L. sativus и L. pratensis . Растения культивировали в стерильных стеклянных сосудах объемом 300 мл, содержащих 50 мл агаризованной среды Красильникова-Кореняко. Проростки были инокулированы суспензиями индивидуальных штаммов в количестве 106 клеток/сосуд. В качестве положительного контроля использовали коммерческие штаммы Rhizobium leguminosarum bv. viciae RCAM2802, RCAM2806 и RCAM0626 из Сетевой биоресурсной коллекции в области генетических технологий для сельского хозяйства (ФГБНУ ВНИИСХМ, г. Санкт-Петербург). Неинокулированные растения служили отрицательным контролем. По окончании культивирования проводили подсчет и описание клубеньков, образовавшихся на корнях растений. Азотфиксирующую активность клубеньков определяли ацетиленовым методом с помощью газового хроматографа GC-2014 («Shimadzu», Япония). В условиях отдельного МВО семена V. cracca и L. pratensis дополнительно были инокулированы почвенной вытяжкой из образца, отобранного с острова Котельный (Новосибирские о-ва, Арктическая Якутия). Всего из корневых клубеньков популяций L. palustris и V. cracca было выделено 12 ризобиальных изолятов, отнесенных к родам Rhizobium , Mesorhizobium и Bosea . Штаммы Mesorhizobium sp. 33-3/1 и 32-2/1 были выделены только из популяций, произрастающих в пос. Тикси. Штамм Rhizobium sp. 32-5/1 показал низкое сходство по гену rrs с ближайшим типовым штаммом (менее 98,0 %), что позволяет предположить его принадлежность к новому виду микроорганизмов. При постановке МВО клубеньки формировались только в вариантах инокуляции штаммами Rhizobium sp. 19-1/1, 20-1/1, 33-1/1 и Mesorhizobium sp. 32-2/1. Штамм Rhizobium sp. 19-1/1 формировал неактивные клубеньки на корнях сразу трех видов бобовых (кроме V. cracca ). Штамм Rhizobium sp. 20-1/1 при инокуляции V. cracca сформировал большее число клубеньков и показал более высокую азотфиксирующую активность по сравнению с коммерческим штаммом для обработки вики посевной Rhizobium leguminosarum bv. viciae RCAM0626, однако различия по числу клубеньков между вариантами опыта были недостоверными из-за значительной вариации параметра.
Арктическая якутия, дельта реки лены, бобовые растения, азотфиксирующие клубеньковые бактерии
Короткий адрес: https://sciup.org/142238887
IDR: 142238887 | УДК: 579.841.3:579.64:579.262:582.736 | DOI: 10.15389/agrobiology.2023.3.403rus
Текст научной статьи Эффективность микросимбионтов чины болотной (Lathyrus palustris L.) и горошка мышиного(Vicia cracca L.), произрастающих в арктической Якутии
Глобальное изменение климата сопровождается существенной перестройкой всей арктической экосистемы, что связано с активным продвижением растительных сообществ на Север, заполнением новых экологических ниш и вытеснением аборигенной флоры (1, 2). На таких территориях могут формироваться пастбищные фитоценозы, существенную часть которых составляют бобовые растения, вступающие в симбиотические взаимоотношения с азотфиксирующими клубеньковыми бактериями (ризобиями). Эта взаимовыгодная стратегия позволяет бобовым осваивать новые территории благодаря широкой экологической пластичности и устойчивости к стрессовым факторам окружающей среды, в том числе низкому содержанию азота в почве. Бобовые растения — основной источник белка как для травоядных сельскохозяйственных животных, так и для диких северных оленей и овцебыков (3, 4).
Первое и единственное описание клубеньковых бактерий, выделенных из корневых клубеньков дикорастущих бобовых растений Oxytropis ni-grescens (Pall.) Fisch., O. maydelliana Trautv., Astragalus alpinus L., A. umbellatus Bunge и Hedysarum obscurum L., которые произрастают в азиатской части Арктики в тундре Чукотского полуострова, о-ва Колючин и Врангеля, приводится в работе А.Е. Крисс с соавт. (5). Авторы изолировали 8 бактериальных штаммов, не способных в вегетационных опытах образовывать клубеньки на корнях сельскохозяйственных бобовых растений клевера, донника, люцерны, гороха и вики. В то же время наблюдалась способность некоторых штаммов образовывать клубеньки на бобовых растениях H. al-pinum L., H. sibiricum Poir. и A. trautvetteri Bunge . , при этом азотфиксирующая активность клубеньков не изучалась.
Виды чина болотная Lathyrus palustris L. и горошек мышиный Vicia cracca L. относятся к трибе виковые Vicieae (Adans.) Bronn семейства Fabaceae . Многие представители родов Lathyrus и Vicia служат ценными кормовыми пастбищными и сенокосными культурами, входящим в рацион питания крупного и мелкого рогатого скота, лошадей (6, 7), а также диких травоядных животных Центральной Якутии (8). В частности, вид L. palustris обладает высокими кормовыми достоинствами и считается особенно перспективной культурой для введения в пастбищные агрофитоценозы Восточной Сибири (6, 9), тогда как V. cracca входит в Государственный реестр селекционных достижений, допущенных к использованию, и активно культивируется в качестве ценной кормовой травы в пастбищных и сенокосных фитоценозах (10).
Основные микросимбионты бобовых растений родов Vicia и Lathy-rus — штаммы вида Rhizobium leguminosarum bv . viciae (11-13). Помимо них, из корневых клубеньков различных видов Vicia и Lathyrus выделяются также не типичные для этих родов симбионты, родственные как другим видам Rhizobium (14, 15), так и представителям рода Phyllobacterium (11). Было показано, что штамм Mesorhizobium alhagi CCNWXJ12-2T, выделенный из верблюжьей колючки Alhagi sparsifolia , произрастающей в северовосточном Китае, был способен формировать клубеньки на корнях V. cracca (16).
Арктические ризобии представляют интерес для изучения эволюционного развития азотфиксирующих бактерий и их адаптации к низким температурам, а также дают возможность анализировать функциональные отношения между ризобиями и бобовыми растениями в изолированных аборигенных популяциях Севера (17). Перспективно использование арктических штаммов клубеньковых бактерий при производстве микробных препаратов с целью создания высокопродуктивных пастбищных фитоценозов в условиях Заполярья (18). Однако вопросы биоразнообразия клубеньковых бактерий арктических территорий и эффективность их симбиотического взаимодействия с бобовыми растениями остаются в России практически не изученными.
В настоящей работе впервые описаны 12 штаммов, изолированных из клубеньков чины болотной и горошка мышиного, произрастающих в Арктической Якутии: изучено их таксономическое положение, а также показана способность формировать эффективный симбиоз как с традиционными бобовыми культурами, так и с дикорастущими растениями, которые более адаптированы к условиям Крайнего Севера и могут использоваться для создания высокопродуктивных пастбищных фитоценозов.
Целью работы было изучение генетического разнообразия ризоби-альных изолятов из популяций арктических дикорастущих бобовых растений Lathyrus palustris L. и Vicia cracca L., а также оценка их способности формировать азотфиксирующие клубеньки на корнях кормовых пастбищных бобовых культур в условиях микровегетационного опыта.
Методика. Корневые клубеньки дикорастущих популяций бобовых растений V. cracca и L. palustris были собраны в 2021 году на острове Са-мойловский и в поселке Тикси в ходе российско-немецкой экспедиции в дельту реки Лены (Арктическая Якутия).
Ризобиальные штаммы выделяли по стандартной методике с использованием маннитно-дрожжевой питательной среды YMA (19) после стерилизации клубеньков в течение 1 мин в 96 % этаноле. Выделение гДНК из чистых культур осуществляли с помощью наборов DNeasy Blood & Tissue kit («QIAGEN», Германия) и Monarch® («New England Biolabs», США). Первичную идентификацию штаммов проводили методом ПЦР с последующим секвенированием последовательностей маркерного гена 16S рРНК. Для амплификации использовали пары праймеров fD1 5´-AGAGTTTGATCCTGGCTCAG-3´ и rD1 5´-AAGGAGGTGATCCAGCC-3´ (20). Условия ПЦР для амплификации гена 16S рРНК были следующими: 3 мин 30 с при 95 ° С (первичная денатурация); 1 мин 10 с при 94 ° С (денатурация), 40 с при 56 ° С (отжиг праймеров), 2 мин 10 с при 72 ° С (элонгация) (35 циклов); 6 мин 10 с при 72 ° С (финальная элонгация). Состав реакционной смеси для ПЦР: 38 мкл milli-Q H 2 O («Евроген», Россия), 5 мкл буфера («Хеликон», Россия), 5 мкл набора dNTP («Promega», США), по 0,5 мкл праймеров («Евроген», Россия), 0,5 мкл Taq-полимеразы («Хеликон», Россия) и 1 мкл (50-100 нг) мДНК. Амплификацию проводили на приборе T100 Thermal Cycler («Bio-Rad», США). Количество ДНК оценивали визуально с помощью электрофореза в 1,0 % агарозном геле в 0,5½ TАE-буфере с использованием маркера молекулярной массы MassRuler («Fermentas», Литва). Очистку ПЦР-продукта из агарозного геля осуществляли с помощью набора Cleanup S-Cap («Евроген», Россия). Очищенную ДНК секве-нировали на генетическом анализаторе ABI PRISM 3500xl («Life Technologies», США) на базе Центра коллективного пользования «Геномные технологии, протеомика и клеточная биология» Всероссийского НИИ сельскохозяйственной микробиологии (ЦКП ГТПиКБ ФГБНУ ВНИИСХМ).
Полученные последовательности ДНК анализировали с помощью программы Chromas Lite 2.6.4 . Для множественного выравнивания и сравнения нуклеотидных последовательностей использовали программу ClustalOmega . Поиск последовательностей близкородственных типовых штаммов осуществляли в базе данных GenBank . Нуклеотидные последовательности депонированы в базу данных GenBank под номерами OQ685989-OQ686000.
Для постановки микровегетационных опытов (МВО) семена V. cracca , V. sativa , L. sativus и L. pratensis скарифицировали и поверхностно стерилизовали посредством обработки в 98 % H 2 SO 4 в течение 10 мин, тщательно промывали стерильной водопроводной водой и проращивали на фильтровальной бумаге в чашках Петри при 25 ° С в темноте в течение 3-5 сут (в зависимости от вида растений). Семена V. sativa и L. sativus были любезно предоставлены сотрудниками ФГБНУ Всероссийский институт генетических ресурсов растений имени Н.И. Вавилова (ВИР, г. Санкт-Петербург). Вид L. pratensis был использован вместо L. palustris в качестве объекта инокуляции ввиду отсутствия семян.
Растения культивировали в стерильных стеклянных сосудах объемом 300 мл, содержащих 50 мл агаризованной среды Красильникова-Кореняко следующего состава: K 2 HPO 4 — 1,0 г/л; MgSO 4 •7H 2 O — 1,0 г/л; Ca 3 (PO 4 ) 2 — 0,2 г/л; FeSO 4 — 0,02 г/л; смесь микроэлементов по М.В. Федорову, включая H 3 ВО 3 — 0,05 г/л; (NH 4 ) 2 MoO 4 — 0,05 г/л; KCl — 0,005 г/л; NaBr — 0,005 г/л; ZnSO 4 •7H 2 O — 0,003 г/л; MnSO 4 — 0,002 г/л). Каждый МВО проводили в трех повторностях (3 сосуда по 1 проростку на каждый вариант инокуляции).
Проростки были инокулированы суспензиями индивидуальных штаммов в количестве 106 клеток/сосуд. В качестве положительного контроля использовали коммерческие штаммы Rhizobium leguminosarum bv. viciae RCAM2802, RCAM2806 и RCAM0626 из Сетевой биоресурсной коллекции в области генетических технологий для сельского хозяйства (ФГБНУ ВНИИСХМ, г. Санкт-Петербург). Неинокулированные растения служили отрицательным контролем. Растения выращивали в фитотроне при 18-22 ° С в течение 30 сут при относительной влажности 50 % и четырехуровневом режиме освещения/температуры: ночь (18 ° С, 8 ч), утро (200 мкмоль• м - 2•с - 1, 20 ° С, 2 ч), день (400 мкмоль• м - 2•с - 1, 23 ° С, 12 ч), вечер (200 мкмоль • м - 2 • с - 1, 20 ° С, 2 ч). Освещение осуществлялось лампами L36W/77 FLUORA («Osram», Германия).
По окончании культивирования проводили подсчет и описание клубеньков, образовавшихся на корнях растений. Азотфиксирующую активность клубеньков определяли ацетиленовым методом с помощью газового хроматографа GC-2014 («Shimadzu», Япония).
В условиях отдельного МВО семена V. cracca и L. pratensis дополнительно были инокулированы почвенной вытяжкой из образца, отобранного с острова Котельный (Новосибирские острова, Арктическая Якутия). Для приготовления почвенной вытяжки 1 г образца добавляли в стерильную колбу с 50 мл жидкой среды Красильникова-Кореняко. Колбу помещали на качалку и инкубировали в течение 1 ч при комнатной температуре. Проростки инокулировали почвенной вытяжкой из расчета 1 мл вытяжки на сосуд.
Статистический анализ выполняли с использованием программы STATISTICA 10 («StatSoft, Inc.», США). Для каждого варианта инокуляции были подсчитаны средние значения ( M ) и стандартные отклонения (±SD). Для оценки значимости различий между средними величинами использовали однофакторный дисперсионный анализ и критерий НСР Фишера.
Результаты. Остров Самойловский (72 ° 22 ‘ 00" с.ш., 126 ° 30 ‘ 01" в.д.) расположен в южной части дельты реки Лены в подзоне типичных тундр (рис. 1). В геоморфологическом отношении остров отчетливо делится на две части, различные по возрасту и генезису. На две трети остров занимает 406
поверхность первой террасы, а одну треть в западной части острова составляет поверхность высокой поймы, подверженной сезонным подтоплениям речными водами (21). Поселок Тикси (71°38‘12" с.ш., 128°52‘04" в.д.) расположен на берегу одноименной бухты, приуроченной к южной части моря Лаптевых (см. рис. 1). Преобладающие элементы рельефа окрестностей поселка — невысокие сопки и межгорные заболоченные седловины. Основу растительного покрова составляют различные варианты тундр и низинные мелкозалежные болота. Почвы мерзлотные, щебнисто-каменистые. Флора горная, умеренно-арктическая (22).
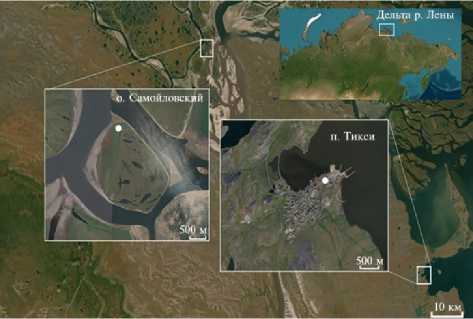
Рис. 1. Места сбора растений Vicia cracca L. и Lathyrus palustris L. на о. Самойловский (дельта р. Лены) и пос. Тикси (отмечены белыми точками) .
пуляции V. cracca и L. palustris произрастают западной части острова, сложенной песками подтоплениям речным половодьем (24).

Рис. 2. Растения Lathyrus palustris L. (а) и Vicia cracca L. (б) , произрастающие на о. Самойловский (дельта р. Лены)
(фото И.А. Алехиной) .
О находках бореальных видов чины болотной Lathyrus palustris L. и горошка мышиного Vicia crac-ca L. на территории пос. Тикси сообщалось относительно недавно (23). Вид V. cracca (рис. 2, Б) на острове Самойловский впервые был обнаружен Н.Н. Ла-щинским (устное сообщение) в 2017 году, а растения L. palustris (рис. 2, А) — им же во время российско-немецкой экспедиции в дельту реки Лены в 2021 году. По-преимущественно в северо-и подверженной сезонным
Из корневых клубеньков L. palustris и V crac-ca всего было выделено соответственно 8 и 4 ризоби-альных изолята (табл. 1): из клубеньков двух популяций L. palustris — по 4 изолята, из клубеньков популяций V. cracca — по 2. Большинство изолятов образовывали колонии на 3-и-4-е сут, исключение составил штамма 33-5/1, формировавший колонии на 5-е сут. На осно вании анализа гена rrs изоляты были отнесены к родам Rhizobium (сем. Rhizobiaceae), Mesorhizobium (сем. Phyllobacteriaceae) и Bosea (сем. Boseaceae) порядка Rhizobiales (Hyphomicrobiales). Отметим, что из клубеньков популяции L. palustris, произрастающей на о. Самойловский, были выделены только представители Rhizobium, тогда как популяция из пос. Тикси оказалась представлена более широким составом микросимбионтов (Rhizobium, Mesorhizobium и Bosea), что, по-видимому, связано с различными почвенноклиматическими особенностями этих районов (см. табл. 1).
Изоляты из клубеньков L. palustris (19-1/1, 19-3/1, 19-4/1, 19-5/1,
33-1/1) и V. cracca (20-1/1) показали 100 % сходство rrs гена сразу к четырем типовым штаммам: R. leguminosarum bv. viciae LMG 14904T, R. anhuiense CCBAU 23252T, R. sophorae LMG 27901T и R. laguerreae FB206T (см. табл. 1). Как результат, полученные изоляты не были идентифицированы до вида. Для уточнения их видовой принадлежности необходимо секвенирование и анализ генов «домашнего хозяйства» ( rec A, atp D, dna K, gyr B и rpo B).
Известно, что штамм R. leguminosarum bv. viciae LMG 14904T способен образовывать эффективный симбиоз с бобовыми растениями из родов Pisum , Vicia , Lathyrus , Lens и Vavilovia из трибы Fabeae (25, 26). Штамм R. anhuiense CCBAU 23252T был выделен из бобового растения V. faba , произрастающего в Китае. Он образовывал азотфиксирующие клубеньки на корнях V. faba и Pisum sativum (27). В опытах по кросс-нодуляции этот штамм формировал неэффективный симбиоз с Phaseolus vulgaris и был не способен образовывать клубеньки на пищевых и кормовых бобовых культурах Glycine max , Arachis hypogaea , Medicago sativa , Trifolium repens , Lablab purpureus (27).
1. Изоляты, выделенные из клубеньков Lathyrus palustris L. и Vicia cracca L., собранных на о. Самойловский (дельта реки Лены) и в пос. Тикси (2021 год)
|
Место сбора растений |
¹ штамма |
Сходство гена rrs , % |
Ближайший типовой штамм |
Результат идентификации |
|
о. Самойловский |
19-1/1 |
Lathyrus pa lustris L. 100 Rhizobium leguminosarum bv. viceae LMG |
Rhizobium sp. |
|
|
пос. Тикси о. Самойловский |
19-3/1 19-4/1 19-5/1 33-1/1 33-3/1 33-4/1 33-5/1 20-1/1 |
100 99,72 99,21 Vic 100 |
14904, R. sophorae LMG 27901, R. an-huiense CCBAU 23252, R. laguerreae FB206 Mesorhizobium norvegicum 10.2.2, M. loti LMG 6125 Bosea lathyri R-46060 B. lathyri R-46060 ia cracca L. R. leguminosarum bv. viceae LMG 14904, |
Mesorhizobium sp. Bosea lathyri Bosea sp. Rhizobium sp. |
|
пос. Тикси |
20-5/1 32-2/1 |
99,21 100 |
R. sophorae LMG 27901, R. anhuiense CCBAU 23252, R. laguerreae FB206 B. lathyri R-46060 M. norvegicum 10.2.2, M. loti LMG 6125 |
Bosea sp. Mesorhizobium sp. |
|
32-5/1 |
97,85 |
R. giardinii H152 |
Rhizobium sp. |
|
Известно, что представители вида R. anhuiense служат основными микросимбинтами вида Lathyrus maritimus , произрастающего вдоль морской береговой линии в Китае (15). Штамм R. sophorae LMG 27901T был выделен из клубенька лекарственного бобового Sophora flavescens , также отобранного в Китае (28). Было показано, что штамм LMG 27901T способен формировать активные клубеньки на корнях S. flavescens и P. vulgaris , тогда как другие штаммы R. sophorae могли образовывать эффективный симбиоз с растениями V. sativa и P. sativum , произрастающими в Северном Китае (29). Штамм R. laguerreae FB206T был выделен из эффективного клубенька V. faba в Тунисе (30), причем представители этого вида ризобий служат эффективными симбионтами многих видов Pisum , Vicia , Lens и Phase-olus , встречающихся в различных регионах мира (31-34), и обладают рост-стимулирующими свойствами, улучшая продуктивность сельскохозяйственных культур (35, 36).
Изоляты 33-3/1 и 32-2/1 были выделены соответственно из популяций L. palustris и V. cracca, произрастающих в пос. Тикси. Изоляты показали 100 % сходство rrs гена с типовыми штаммами Mesorhizobium norvegicum 10.2.2T и M. loti LMG 6125T, выделенными из корневых клубеньков бобового растения Lotus corniculatus, произрастающего соответ- ственно в Новой Зеландии (37) и Норвегии (38). Отметим, что из популяций L. palustris и V. cracca с о. Самойловский бактерий рода Mesorhizobium выделить не удалось.
Изоляты 33-4/1, 33-5/1 и 20-5/1 показали наибольшее сходство rrs гена (33-4/1 — 99,72 %; 33-5/1 и 20-5/1 — 99.21 %) с типовым штаммом B. lathyri R-46060T, выделенным из Lathyrus latifolius , произрастающего в Бельгии (39). Изоляты, родственные Bosea , имели разное происхождение: штаммы 33-4/1 и 33-5/1 были выделены из растений L. palustris в пос. Тикси, тогда как изолят 20-5/1 выделили из V. cracca на о. Самойловский. Следует отметить, что род Bosea представлен в настоящее время 12 видами, из которых только 6 видов ( B. lupini , B. lathyri , B. robiniae, B. caraganae, B. vaviloviae и B. spartocytisi ) выделены из клубеньков бобовых растений родов Lupinus , Lathyrus , Robinia , Caragana , Vavilovia и Spartocytisus (39-42). Однако способность этих штаммов к самостоятельному формированию клубеньков до сих пор не описана. Штамм Rhizobium sp. 32-5/1 показал низкое сходство по гену rrs с ближайшим типовым штаммом (менее 98,0 %), что позволяет предположить его принадлежность к новым видам микроорганизмов.
2. Эффект инокуляции растений Lathyrus palustris L. и Vicia cracca L. коммерческими штаммами Rhizobium leguminosarum bv. viciae RCAM2806, RCAM0626 и арктическими изолятами в условиях стерильного микровегетационного опыта ( n = 3, M ±SD)
|
Вариант инокуляции |
Число клубеньков, шт/сосуд |
Ацетиленредуктазная активность, мкмоль C 2 H 4 •сосуд - 1•сут - 1 |
|
Lathyrus palustris |
L. |
|
|
R. leguminosarum RCAM2806 |
5,5±2,1a |
0,37±0,08 |
|
Без инокуляции |
0 |
0 |
|
Rhizobium sp. 19-1/1* |
2,6±1,1a |
0 |
|
Rhizobium sp. 20-1/1 |
0 |
н/о |
|
Bosea sp. 20-5/1 |
0 |
н/о |
|
Mesorhizobium sp. 32-2/1 |
0 |
н/о |
|
Rhizobium sp. 32-5/1 |
0 |
н/о |
|
Rhizobium sp. 33-1/1* |
4,0±2,0a |
0 |
|
Mesorhizobium sp. 33-3/1* |
0 |
н/о |
|
Bosea lathyri 33-4/1* |
0 |
н/о |
|
Bosea sp. 33-5/1* |
0 |
н/о |
|
Vicia cracca L. |
||
|
R. leguminosarum RCAM0626 |
5,3±1,5a |
0,05±0,01a |
|
Без инокуляции |
0 |
0 |
|
Rhizobium sp. 19-1/1* |
0 |
н/о |
|
Rhizobium sp. 20-1/1 |
7,3±0,5a |
0,68±0,35b |
|
Bosea sp. 20-5/1 |
0 |
н/о |
|
Mesorhizobium sp. 32-2/1 |
КО |
0 |
|
Rhizobium sp. 32-5/1 |
0 |
н/о |
|
Rhizobium sp. 33-1/1* |
КО |
0 |
|
Mesorhizobium sp. 33-3/1* |
0 |
н/о |
|
Bosea lathyri 33-4/1* |
0 |
н/о |
|
Bosea sp. 33-5/1* |
0 |
н/о |
Примечание. КО— клубенькоподобные образования, н/о — не определялось. Семена L. pratensis были собраны в Иркутской области, семена V. cracca — на о. Самойловский (дельта р. Лены). Звездочкой (*) отмечены штаммы, изолированные из клубеньков L. palustris, остальные штаммы выделены из V. cracca. a, b Разными латинскими буквами отмечены варианты, различия между которыми статистически значимы (критерий НСР Фишера, p < 0,05).
Способность изолятов нодулировать бобовые растения изучали в условиях двух стерильных МВО с использованием 9 ризобиальных штаммов разного таксономического положения (три рода — Rhizobium, Mesorhizobium и Bosea) и 4 видов сельскохозяйственных кормовых бобовых растений: V. cracca, V. sativa, L. sativus и L. pratensis (табл. 2, 3). В первом МВО клубеньки на L. pratensis образовались только при инокуляции штаммами Rhizobium sp. 19-1/1 и 33-1/1, хотя симбиоз в обоих случаях не был азот- фиксирующим (см. табл. 2). Клубеньки на V. cracca образовались только в варианте с инокуляцией штаммом Rhizobium sp. 20-1/1, который сформировал эффективный симбиоз с более высокой азотфиксирующей активностью, чем при инокуляции коммерческим штаммом R. leguminosarum bv. viciae RCAM0626 (различия между вариантами опыта по параметру азот-фиксации были достоверны, p < 0,05). В вариантах инокуляции V. cracca штаммами Mesorhizobium sp. 32-2/1 и Rhizobium sp. 33-1/1 на корнях растений были обнаружены опухолевидные клубенькоподобные образования (см. табл. 2).
3. Эффект инокуляции растений Lathyrus sativus L. и Vicia sativa L. коммерческими штаммами Rhizobium leguminosarum bv. viciae RCAM2806, RCAM0626 и арктическими изолятами в условиях стерильного микровегетационного опыта ( n = 3, M ±SD)
|
Вариант инокуляции |
Число клубеньков, шт/сосуд |
Ацетиленредуктазная активность, мкмоль C 2 H 4 •сосуд - 1•сут - 1 |
|
La thyrus sativus L. |
||
|
R. leguminosarum RCAM2802 |
21,0±2,8a |
5,20±0,03 |
|
Без инокуляции |
0 |
0 |
|
Rhizobium sp. 19-1/1* |
29,3±9,5a |
0 |
|
Rhizobium sp. 20-1/1 |
0 |
н/о |
|
Bosea sp. 20-5/1 |
0 |
н/о |
|
Mesorhizobium sp. 32-2/1 |
0 |
н/о |
|
Rhizobium sp. 32-5/1 |
0 |
н/о |
|
Rhizobium sp. 33-1/1* |
0 |
н/о |
|
Mesorhizobium sp. 33-3/1* |
0 |
н/о |
|
Bosea lathyri 33-4/1* |
0 |
н/о |
|
Bosea sp. 33-5/1* |
0 Vicia sativa L. |
н/о |
|
R. leguminosarum RCAM0626 |
110,0±41,0ab |
3,70±2,00a |
|
Без инокуляции |
0 |
0 |
|
Rhizobium sp. 19-1/1* |
122,0±13,0b |
0 |
|
Rhizobium sp. 20-1/1 |
0 |
0 |
|
Bosea sp. 20-5/1 |
0 |
н/о |
|
Mesorhizobium sp. 32-2/1 |
68,0±30,0a |
0 |
|
Rhizobium sp. 32-5/1 |
0 |
н/о |
|
Rhizobium sp. 33-1/1* |
107,0±8,0ab |
0,20±0,10b |
|
Mesorhizobium sp. 33-3/1* |
0 |
н/о |
|
Bosea lathyri 33-4/1* |
0 |
н/о |
|
Bosea sp. 33-5/1* |
0 |
н/о |
Примечани е. н/о — не определялось. Семена L. pratensis были собраны в Иркутской области, семена V. cracca — на о. Самойловский (дельта р. Лены). Звездочкой (*) отмечены штаммы, изолированные из клубеньков L. palustris, остальные штаммы выделены из V. cracca.
a, b Разными латинскими буквами отмечены варианты, различия между которыми статистически значимы (критерий НСР Фишера, p < 0,05).
Во втором МВО при инокуляции L. sativus штаммом Rhizobium sp. 19-1/1 на корнях растений были сформированы округлые неактивные клубеньки, как и в случае с L. pratensis (см. табл. 2, 3). Клубеньки на V. sativa образовались в трех вариантах инокуляции, но только в варианте со штаммом Rhizobium sp. 33-1/1 симбиоз был эффективным: показана незначительная азотфиксирующая активность по сравнению с коммерческим штаммом R. leguminosarum bv. viciae RCAM0626 (см. табл. 3). Интересно, что штаммы Mesorhizobium sp. 32-2/1 и Rhizobium sp. 33-1/1, выделенные соответственно из клубеньков V. cracca и L. palustris, образовывали на корнях V. cracca только клубенькоподобные структуры, тогда как на корнях V. sativa оба штамма формировали детерминированный тип клубеньков округлой формы. Причина этого, вероятно, связана с достаточно высокой степенью специфичности растения-хозяина к микросимбионту. Образовавшиеся клубеньки были в основном округлые, белые, неэффективные, детерминированного типа, за исключением вариантов инокуляции V. cracca с изолятом Rhizobium sp. 20-1/1 и V. sativa с изолятом Rhizobium sp. 33-1/1, где часть сформировавшихся клубеньков отличалась продолговатой формой и розоватым оттенком, свидетельствующим об их азотфиксирующей активности.
В результате инокуляции растений V. cracca и L. pratensis почвенной вытяжкой из образца, отобранного на о. Котельный, клубеньки на корнях обнаружены не были, что, скорее всего, связано с отсутствием в почве соответствующих микросимбионтов, поскольку в настоящее время присутствие бобовых на о. Котельный не выявлено.
Таким образом, из клубеньков арктических дикорастущих бобовых растений L. palustris и V. cracca было выделено 12 ризобиальных изолятов, относящихся к родам Rhizobium, Mesorhizobium и Bosea. Большинство изо-лятов относилось к роду Rhizobium. Штаммы Mesorhizobium sp. 33-3/1 и 322/1 были выделены соответственно из популяций Lathyrus palustris и Vicia cracca, произрастающих в пос. Тикси, тогда как из популяций на о. Самой-ловский бактерии этого рода выделить не удалось. Присутствие вида L. pal-ustris на о. Самойловский было описано впервые. Штамм Rhizobium sp. 325/1 показал низкое сходство по гену rrs с ближайшим типовым штаммом (менее 98,0 %), что позволяет предположить его принадлежность к новым видам микроорганизмов. При постановке микровегетационных опытов для изучения кросс-нодуляции с участием сельскохозяйственных кормовых бобовых растений Vicia cracca, Vicia sativa, Lathyrus sativus и Lathyrus pratensis клубеньки формировались только в вариантах инокуляции штаммами Rhi-zobium sp. 19-1/1, 20-1/1, 33-1/1 и Mesorhizobium sp. 32-2/1. Штамм Rhizobi-um sp. 19-1/1 был единственным, который формировал неэффективные клубеньки на корнях сразу трех видов бобовых, за исключением варианта с V. cracca, что может свидетельствовать о его широкой специфичности по отношению к различным родам и видам растений-хозяев. Отметим, что штамм Rhizobium sp. 20-1/1 в варианте инокуляции растений V. cracca сформировал большее число клубеньков (различия между вариантами опыта не были достоверными из-за значительной вариации этого параметра) и показал более высокую азотфиксирующую активность по сравнению с коммерческим штаммом R. leguminosarum bv. viciae RCAM0626, что делает его перспективным для разработки новых высокоэффективных микробных препаратов с целью создания продуктивных пастбищных фитоценозов на арктических территориях России. Для дальнейшего изучения хозяйской специфичности и симбиотической эффективности полученных штаммов будут проведены микровегетационные опыты с расширенной выборкой кормовых сельскохозяйственных и дикорастущих арктических бобовых растений.
Выражаем благодарность руководству и координаторам экспедиции «Лена 2021» за организацию и проведение экспедиции в район дельты реки Лены. Искренне благодарим Сергея Александровича Правкина (ААНИИ) за помощь в сборе и транспортировке семян бобовых культур. Выражаем благодарность коллективу научно-исследовательской станции «Остров Самойловской» и лично Федору Виссанионовичу Селяхову за предоставленный транспорт. Работа проводилась с использованием оборудования ЦКП «Геномные технологии, протеомика и клеточная биология» ФГБНУ ВНИИСХМ.
Список литературы Эффективность микросимбионтов чины болотной (Lathyrus palustris L.) и горошка мышиного(Vicia cracca L.), произрастающих в арктической Якутии
- Белоновская Е.А., Тишков А.А., Вайсфельд М.А., Глазов П.М., Кренке-мл. А.Н., Морозова О.В., Покровская И.В., Царевская Н.Г., Тертицкий Г.М. «Позеленение» Российской Арктики и современные тренды изменения ее биоты. Известия Российской академии наук. Серия географическая, 2016, 3: 28-39 (doi: 10.15356/0373-2444-2016-3-28-39).
- Тишков А.А., Белоновская Е.А., Вайсфельд М.А., Глазов П.М., Кренке А.Н., Тертиц-кий Г.М. «Позеленение» тундры как драйвер современной динамики арктической биоты. Арктика: экология и экономика, 2018, 2(30): 31-44 (doi: 10.25283/2223-4594-2018-2-31-44).
- Парахин Н.В., Петрова С.Н. Симбиотически фиксированный азот в агроэкосистемах. Вестник аграрной науки, 2009, 3(18): 41-45.
- Прядильщикова Е.Н., Калабашкин П.Н., Коновалова С.С. Формирование пастбищных фитоценозов на основе новых видов бобовых трав в условиях Европейского Севера России. Владимирский земледелец, 2018, 1(83): 32-35 (doi: 10.24411/2225-2584-2018-00008).
- Крисс А.Е., Кореняко А.И., Мигулина В.М. Клубеньковые бактерии в Арктике. Микробиология, 1941, 10(1): 61-71.
- Вишнякова М.А., Бурляева М.О. Потенциал хозяйственной ценности и перспективы использования российских видов чины. Сельскохозяйственная биология, 2006, 6: 85-97.
- Вишнякова М.А. Виды вики из коллекции ВИР-кормовые растения, перспективные для введения в культуру в Российской Федерации (обзор). Сельскохозяйственная биология, 2007, 42(4): 3-19.
- Аргунов А.В., Степанова В.В. Структура рациона сибирской косули в Якутии. Экология, 2011, 2: 144-147.
- Кормовые растения сенокосов и пастбищ СССР. Том 2 /Под ред. И.В. Ларина. Л., 1951.
- Государственный реестр селекционных достижений, допущенных к использованию. Том 1. Сорта растений (официальное издание). М., 2021.
- Баймиев А.Х., Птицын К.Г., Мулдашев А.А., Баймиев А.Х. Генетическая характеристика клубеньковых бактерий бобовых рода Lathyrus, произрастающих на территории Республики Башкортостан. Экологическая генетика, 2011, 9(2): 3-8.
- Ampomah O.Y., Huss-Danell K. Genetic diversity of rhizobia nodulating native Vicia spp. in Sweden. Systematic and Applied Microbiology, 2016, 39(3): 203-210 (doi: 10.1016/j.syapm.2016.02.002).
- Villadas P.J., Lasa A.V., Martínez-Hidalgo P., Flores-Félix J.D., Martínez-Molina E., Toro N., Velázquez E., Fernández-López M. Analysis of rhizobial endosymbionts of Vicia, Lathyrus and Trifolium species used to maintain mountain firewalls in Sierra Nevada National Park (South Spain). Systematic and Applied Microbiology, 2017, 40(2): 92-101 (doi: 10.1016/j.syapm.2016.11.008).
- Aoki S., Kondo T., Prévost D., Nakata S., Kajita T., Ito M. Genotypic and phenotypic diversity of rhizobia isolated from Lathyrus japonicus indigenous to Japan. Systematic and Applied Microbi-ology, 2010, 33(7): 383-397 (doi: 10.1016/j.syapm.2010.07.001).
- Li Y., Wang E.T., Liu Y., Li X., Yu B., Ren C., Liu W., Li Y., Xie Z. Rhizobium anhuiense as the predominant microsymbionts of Lathyrus maritimus along the Shandong Peninsula seashore line. Systematic and Applied Microbiology, 2016, 39(6): 384-390 (doi: 10.1016/j.syapm.2016.07.001).
- Chen W.M., Zhu W.F., Bontemps C., Young J.P.W., Wei G.H. Mesorhizobium alhagi sp. nov., isolated from wild Alhagi sparsifolia in north-western China. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(4): 958-962 (doi: 10.1099/ijs.0.014043-0).
- Caudry-Reznick S., Prevost D., Schulman H.M. Some properties of arctic rhizobia. Archives of Microbiology, 1986, 146(1): 12-18.
- Рябова О.В. К вопросу разработки микробиологических препаратов (фунгицидов и удобрений) для условий Северо-Востока европейской части Российской Федерации. Аграрная наука Евро-Северо-Востока, 2016, 1(50): 31-40.
- Novikova N., Safronova V. Transconjugants of Agrobacterium radiobacter harbouring sym genes of Rhizobium galegae can form an effective symbiosis with Medicago sativa. FEMS Microbiology Letters, 1992, 93(3): 261-268 (doi: 10.1111/j.1574-6968.1992.tb05107.x).
- Weisburg W.G., Barns S.M., Pelletier D.A., Lane D.J. 16S ribosomal DNA amplification for phylogenetic study. Journal of Bacteriology, 1991, 173(2): 697-703 (doi: 10.1128/jb.173.2.697-703.1991).
- Лащинский Н.Н. Использование беспилотных летательных аппаратов в ландшафтно-экологических исследованиях в Арктике. Мат. Всерос. науч.-практ. конф. «Итоги и перспективы геоботанических исследований в Сибири». Новосибирск, 2019: 64-65.
- Секретарева Н.А., Сытин А.К. Мониторинг флоры окрестностей бухты Тикси (арктическая Якутия). Ботанический журнал, 2006, 91(1): 3-22.
- Николин Е.Г., Якшина И.А. Внедрение бореальных элементов флоры в арктическую Якутию (пос. Тикси). Экологический вестник Северного Кавказа, 2017, 13(3): 36-37.
- Большиянов Д.Ю., Макаров А.С., Шнайдер В., Штоф Г. Происхождение и развитие дельты реки Лены. СПб, 2013.
- Safronova V.I., Kimeklis A.K., Chizhevskaya E.P., Belimov A.A., Andronov E.E., Pinaev A.G., Pukhaev A.R., Popov K.P., Tikhonovich I.A. Genetic diversity of rhizobia isolated from nodules of the relic species Vavilovia formosa (Stev.) Fed. Antonie Leeuwenhoek, 2014, 105(2): 389-399 (doi: 10.1007/s10482-013-0089-9).
- Andrews M., Andrews M.E. Specificity in Legume-Rhizobia symbioses. International Journal of Molecular Sciences, 2017, 18(4): 705-744 (doi: 10.3390/ijms18040705).
- Zhang Y.J., Zheng W.T., Everall I., Young J.P.W., Zhang X.X., Tian C.F., Sui X.H., Wang E.T., Chen W.X. Rhizobium anhuiense sp. nov., isolated from effective nodules of Vicia faba and Pisum sativum. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(9): 2960-2967 (doi: 10.1099/ijs.0.000365).
- Jiao Y.S., Yan H., Ji Z.J., Liu Y.H., Sui X.H., Wang E.T., Guo B.L., Chen W.X., Chen W.F. Rhizobium sophorae sp. nov. and Rhizobium sophoriradicis sp. nov., nitrogen-fixing rhizobial sym-bionts of the medicinal legume Sophora flavescens. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(2): 497-503 (doi: 10.1099/ijs.0.068916-0).
- Zhang J., Li S., Wang N., Yang T., Brunel B., Andrews M., Zong X., Wang E. Rhizobium sophorae is the dominant rhizobial symbiont of Vicia faba L. in North China. Systematic and Applied Mi-crobiology, 2022, 45(1): 126-291 (doi: 10.1016/j.syapm.2021.126291).
- Saïdi S., Ramírez Bahena M.-H., Santillana N., Zúniga D., Álvarez Martínez E., Peix A., Mhamdi R., Velázquez E. Rhizobium laguerreae sp. nov. nodulates Vicia faba on several conti-nents. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(1): 242-247 (doi: 10.1099/ijs.0.052191-0).
- Taha K., Berraho El B., El Attar I., Dekkiche S., Aurag J., Béna G. Rhizobium laguerreae is the main nitrogen-fixing symbiont of cultivated lentil (Lens culinaris) in Morocco. Systematic and Applied Microbiology, 2018, 41(2): 113-121 (doi: 10.1016/j.syapm.2017.09.008).
- Zhang J., Shang Y., Peng S., Chen W., Wang E., de Lajudie P., Li B., Guo C., Liu C. Rhizobium sophorae, Rhizobium laguerreae, and two novel Rhizobium genospecies associated with Vicia sativa L. in Northwest China. Plant and Soil, 2019, 442(1): 113-126 (doi: 10.1007/s11104-019-04168-w).
- Flores-Félix J.D., Sánchez-Juanes F., García-Fraile P., Valverde A., Mateos P.F., Gónzalez-Buitrago J.M., Velázquez E., Rivas R. Phaseolus vulgaris is nodulated by the symbiovar viciae of several genospecies of Rhizobium laguerreae complex in a Spanish region where Lens culinaris is the traditionally cultivated legume. Systematic and Applied Microbiology, 2019, 42(2): 240-247 (doi: 10.1016/j.syapm.2018.10.009).
- Flores-Félix J.D., Carro L., Cerda-Castillo E., Squartini A., Rivas R., Velázquez E. Analysis of the interaction between Pisum sativum L. and Rhizobium laguerreae strains nodulating this Legume in Northwest Spain. Plants, 2020, 9(12): 1755 (doi: 10.3390/plants9121755).
- Jiménez-Gómez A., Flores-Félix J.D., García-Fraile P., Mateos P.F., Menéndez E., Veláz-quez E., Rivas R. Probiotic activities of Rhizobium laguerreae on growth and quality of spinach. Scientific Reports, 2018, 8(1): 295 (doi: 10.1038/s41598-017-18632-z).
- Ayuso-Calles M., García-Estévez I., Jiménez-Gómez A., Flores-Félix J.D., Escribano-Bailón M.T., Rivas R. Rhizobium laguerreae improves productivity and phenolic compound con-tent of lettuce (Lactuca sativa L.) under saline stress conditions. Foods, 2020, 9(9): 1166 (doi: 10.3390/foods9091166).
- Kabdullayeva T., Crosbie D.B., Marín M. Mesorhizobium norvegicum sp. nov., a rhizobium iso-lated from a Lotus corniculatus root nodule in Norway. International Journal of Systematic and Evolutionary Microbiology, 2020, 70(1): 388-396 (doi: 10.1099/ijsem.0.003769).
- Jarvis B.D.W., Pankhurst C.E., Patel J.J. Rhizobium loti, a new species of legume root nodule bacteria. International Journal of Systematic and Evolutionary Microbiology, 1982, 32(3): 378-380 (doi: 10.1099/00207713-32-3-378).
- De Meyer S.E., Willems A. Multilocus sequence analysis of Bosea species and description of Bosea lupini sp. nov., Bosea lathyri sp. nov. and Bosea robiniae sp. nov., isolated from legumes. International Journal of Systematic and Evolutionary Microbiology, 2012, 62(10): 2505-2510 (doi: 10.1099/ijs.0.035477-0).
- Safronova V.I., Kuznetsova I.G., Sazanova A.L., Kimeklis A.K., Belimov A.A., Andronov E.E., Pinaev A.G., Chizhevskaya E.P., Pukhaev A.R., Popov K.P., Willems A., Tikhonovich I.A. Bosea vaviloviae sp. nov., a new species of slow growing rhizobia isolated from nodules of the relict species Vavilovia formosa (Stev.) Fed. Antonie van Leeuwenhoek, 2015, 107(4): 911-920 (doi: 10.1007/s10482-015-0383-9).
- Sazanova A.L., Safronova V.I., Kuznetsova I.G., Karlov D.S., Belimov A.A., Andronov E.E., Chirak E.R., Popova J.P., Verkhozina A.V., Willems A., Tikhonovich I.A. Bosea caraganae sp. nov., a new species of slow-growing bacteria isolated from root nodules of the relict species Caragana jubata (Pall.) Poir. originating from Mongolia. International Journal of Systematic and Evolutionary Microbiology, 2019, 69(9): 2687-2695 (doi: 10.1099/ijsem.0.003509).
- Pulido-Suárez L., Flores-Félix J.D., Socas-Pérez N., Igual J.M., Velázquez E., Péix Á., León-Barrios M. Endophytic Bosea spartocytisi sp. nov. coexists with rhizobia in root nodules of Spar-tocytisus supranubius growing in soils of Teide National Park (Canary Islands). Systematic and Applied Microbiology, 2022, 45(6): 126374 (doi: 10.1016/j.syapm.2022.126374).


