Эффективность мониторинга безопасности лекарственных средств в регионе
Автор: Смусева О.Н., Горбатенко B.C., Соловкина Ю.В., Шаталова О.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Клиническая фармакология
Статья в выпуске: 4 т.8, 2012 года.
Бесплатный доступ
Цель: провести сравнительный анализ зарегистрированных неблагоприятных побочных реакций лекарственных средств в Волгограде и области за 2010 и 2011 гг. Материал и методы. Работа выполнена в дизайне ретроспективного фармакоэпидемиологического исследования. В качестве материала для исследования использованы карты-извещения о неблагоприятных побочных реакциях, поданные в Волгоградский региональный центр мониторинга безопасности лекарственных средств за 2010 и 2011 гг. Степень достоверности причинно-следственной связи «лекарство — неблагоприятная побочная реакция» оценивалась по алгоритму Наранжо. Использован метод спонтанных сообщений. Результаты. Установлено, что в 2011 г. в 3 раза увеличилась частота выявления и регистрации неблагоприятных побочных реакций в сравнении с 2010 г. Выявлена структура лекарственных препаратов, наиболее часто вызывающих побочные реакции. Заключение. На протяжении двух исследуемых лет врачи мало сообщают о побочных реакциях типа А, что позволяет предположить о наличии трудностей в установлении связи «лекарство — неблагоприятная побочная реакция». Обнаружены случаи повторного назначения препаратов больным, на которые уже имелись побочные реакции в анамнезе.
Лекарственные средства, метод спонтанных сообщений, нежелательная побочная реакция, побочное действие
Короткий адрес: https://sciup.org/14917652
IDR: 14917652
Текст научной статьи Эффективность мониторинга безопасности лекарственных средств в регионе
-
1Вв едение. Качественная современная фармакотерапия должна быть эффективной и безопасной. Если эффективность лекарственных средств (ЛС) всегда была основным показателем для их практического применения, то безопасность стала активно исследоваться только после катастрофы с талидомидом. Именно в 60-е гг. XX в. в Европе начала формироваться система мониторинга безопасности ЛС, пионером в этом вопросе считается Великобритания, которая в 1964 г. создала Схему желтой карты. Это позволило врачам и исследователям сообщать о любых предполагаемых нежелательных побочных реакциях (НПР) лекарств в Национальное агентство по контролю за лекарствами и продуктами здравоохранения. В 1968 г. был принят закон «О лекарствах», который регламентировал в том числе вопросы допуска лекарственных препаратов на рынок с позиции их безопасности.
Ежегодно регистрируются десятки новых лекарственных препаратов, которые проходят клинические испытания [1], где подтверждается их эффективность, безопасность, определяется оптимальный режим дозирования. Однако при проведении клинических исследований имеются ограничения по численности и длительности испытаний, репрезентативности: обычно в исследование не включают больных с сопутствующими патологиями, детей, беременных женщин, пожилых людей. К тому же есть достаточно редкие, но очень тяжелые НПР, которые просто невозможно выявить в ходе клинических исследований. Изучение профиля безопасности ЛС — постоянно развивающийся процесс, поэтому крайне необходимы постмаркетинговые исследования, а также выявление и регистрация НПР ЛС при их применении в клинической практике. Существуют несколько каналов поступления информации о НПР. Наиболее систематизированной является информация от компаний-производителей ЛС, подобная система хорошо работает в развитых странах. Фармкомпании, работающие в Евросоюзе, обязаны представлять в регулирующие органы периодические отчеты по без-
Адрес: 400087, Волгоград, ул. Чапаева, 18, кв. 42.
Тел.: (8442) 4796034; 89023800796.
опасности [2]. Подобная ситуация наблюдается и в Японии: 89% сообщений о возникновении НПР поступают от фармпроизводителей [3].
В реальной клинической практике ключевым инструментом мониторинга безопасности ЛС во всем мире является метод спонтанных сообщений (МСС). Основным преимуществом метода является возможность регистрации редких (рабдомиолиз и синдром Стивенса — Джонсона [4]), а также выявление и регистрация неожиданных НПР. Недостаток метода — низкая сообщаемость о выявленных НПР, обусловленная нехваткой времени у практических врачей, непониманием важности подобных сообщений, а также трудностью установления связи между реакцией и приемами ЛС [5]. Исходя из международного опыта, кроме врачей о НПР могут сообщать фармацевты [6], средний медперсонал [7], пациенты [8, 9].
В дополнение к МСС может использоваться вторичное изучение медицинской документации. Однако для этого необходимо внедрение тотального электронного медицинского документооборота, а также введение больших электронных баз [10]. Кроме того, история болезни содержит минимальное количество информации о переносимости, безопасности ЛС и развитии неблагоприятных побочных реакций [11].
До 2010 г. в электронную информационно-аналитическую систему регистрации НПР Федеральной службы по надзору в сфере здравоохранения и социального развития по Волгоградской области поступали единичные сообщения о подозреваемых НПР. В феврале 2010 г. в регионе организован Волгоградский региональный центр мониторинга безопасности лекарственных средств (РЦ МБЛС), основной задачей которого стала оптимизация выявления и регистрации НПР лекарственных средств в регионе.
Цель исследования : провести сравнительный анализ зарегистрированных неблагоприятных побочных реакций лекарственных средств в Волгограде и области за 2010 и 2011 гг.
Методы. Работа выполнена в дизайне ретроспективного фармакоэпидемиологического исследования. Использованы карты-извещения о подозреваемой НПР или неэффективности лекарственного средства, полученные Волгоградским РЦ МБЛС. Проводился анализ 88 карт за 2010 г. и 265 карт за 2011 г.
Сообщения о возникновении нежелательной лекарственной реакции подавали врачи из учреждений как Волгограда, так и области. Группы ЛС представлены в соответствии с анатомо-терапевтически-химиче-ской (АТХ) классификацией. Степень достоверности причинно-следственной связи «ЛС — НПР» оценивалась по алгоритму Наранжо, в соответствии с которым устанавливаются категории степеней достоверности взаимосвязи «ЛС — НПР» в результате ответов на 10 вопросов определяются: «определенная» (9 и более баллов), «вероятная» (8 баллов), «возможная» (1–4 балла), «сомнительная» (0 и менее баллов). Все полученные результаты обработаны с использованием пакета статистических программ Microsoft Office Excel 2010 и Statistica 6.0 (Stat-Soft, USA). Данные обрабатывали методами математической статистики путем расчета медианы, а также верхнего и нижнего квантилей Ме (U-Qnt; L-Qnt). С целью проверки гипотезы о различии двух выборок за 2010 г. и 2011 г. использовались двусторонний точный критерий Фишера (с), критерий кси-квадрат (χ2).
Результаты. В 2010 г. нежелательные лекарственные реакции были выявлены у 67 женщин, что составило 76% от общего числа случаев, выявленных за год, и у 21 (24%) мужчины. Медиана по возрасту женщин Ме = 54 (36; 67,25), мужчин Ме = 60,5 (46,5; 68,75). Кроме того, выявлено 5 НПР у детей (6%): 3 реакции у детей до года и 2 случая у школьников. В 2011 г большинство (167-64%) НПР также отмечались у женщин. У мужчин выявлены 94 нежелательные лекарственные реакции, что составило 36%. Медиана по возрасту женщин Ме = 48 (32,5; 59,5), мужчин Ме = 51,5 (38,5; 64). В четырех картах пол не был указан.
В 2011 г. количество выявленных НПР у детей возросло в 10 раз до 52 случаев (21 девочка и 31 мальчик). У детей до 1 года выявлено 30 НПР, у дошкольников 13 случаев и 9 зарегистрированы у школьников.
Чаще всего НПР возникали в стационарах: в 2010 г 53 случая (62%) и 146 (56%) в 2011 г Однако в сравнении с общим числом зарегистрированных НПР в 2010 и 2011 гг. соответственно значимых различий нет (χ2=0,735). При амбулаторном лечении в 2011 г выявлено 100 (39%) НПР, что достоверно больше, чем в 2010 г., — 17 (20%) НПР (х2=0,027). Кроме того, были получены карты-извещения о подозреваемой НПР, возникшей в результате самоле- чения. Так, в 2010 г таких случаев было 15 (18%), а в 2011 г. 13 (50). В 10 картах не указывалось место проведения фармакотерапии подозреваемым ЛС.
На рисунке представлено распределение количества НПР за 2 года по группам классификации АТХ.
Среди конкретных ЛС чаще всего НПР вызывали в 2010 г. препараты йопромид, диклофенак и метами-зол натрия — по 5 случаев. В 2011 г. наиболее частой причиной развития НПР стали цефотаксим — 17, цефтриаксон — 13, цефазолин — 13 и ципрофлоксацин — 11 случаев.
Процентное отношение количества побочных реакций типа «А» к общему количеству побочных реакций в 2010 г. — 11%, в 2011 г. — 12%. Остальные НПР, зарегистрированные на территории Волгоградской области за 2 года, были типа «В». Если сравнить выборки за 2010 г. и 2011 г. по отношению количества НПР типа А к общему количеству побочных реакций согласно двустороннему точному критерию Фишера, то значимых различий нет (с=0,196).
В 2010 г. чаще всего регистрировались ангионевротический отек (41%), крапивница (24%), сыпь (16%), токсикодермия (3%). В 2011 г. преобладали крапивница (30% карт), ангионевротический отек (16%). Кроме того, зафиксировано 28 случаев гриппоподобного синдрома при лечении интерферонами, что составило 14% от всех реакций типа В.
В 2011 г. в РЦ МБЛС поступило 15 сообщений о неэффективности лекарств.
В большинстве полученных региональным центром за два года карт нежелательная побочная реакция с высокой степенью достоверности связывалась с применением ЛС. Так, в 2010 г. достоверность причинно-следственной связи «ЛС — НПР» расценивалась как «определенная» — 6 случаев (7%), «вероятная» — 51 случай (59%), «возможная» — 25 случаев (29%), «сомнительная» — 4 случая (5%). В 2011 г. степень достоверности «НПР — ЛС» была следующей: «определенная» в 3 случаях (1 %), «вероятная» в 147 случаях (57%), «возможная» в 105 случаях (40%), «сомнительная» в 6 случаях (2%).
В 2010 г. при выявлении НПР лечащими врачами проведены следующие мероприятия: в 6% случаев произошла отмена лекарственного средства, в 3% проводилась только лекарственная терапия, в 2% производилась лекарственная терапия, отмена ЛС и немедикаментозная терапия; в 2% случаев осуществлялась лекарственная терапия, отмена ЛС, отмена
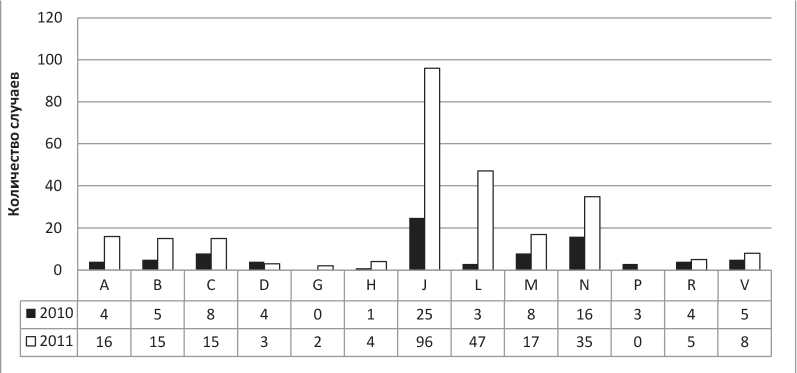
Группы ЛС, ставших причиной НПР (АТХ классификация)
сопутствующего лечения; в 87% случаев производилась отмена подозреваемого ЛС и лекарственная терапия. В 2011 г. в 22% случаев производилась отмена ЛС; в 1 % случаев снижалась доза ЛС; в 4% случаев применялась только лекарственная терапия; в 69% случаев — лекарственная терапия и отмена подозреваемого ЛС; в 4% случаев — лекарственная терапия, отмена ЛС и отмена сопутствующего лечения. В качестве лекарственной терапии применялись ГКС и антигистаминные, а также проводилась симптоматическая терапия по показаниям.
Обсуждение. Исследование показало, что организация регионального центра мониторинга безопасности лекарственных средств способствовала повышению активности врачей по выявлению и регистрации НПР в регионе. Общее количество сообщений увеличилось в 3 раза в 2011 г. по сравнению с 2010 г. Подобные данные регистрируются и в других регионах РФ. Так, по данным Омской области, с момента организации Регионального центра по изучению побочных действий лекарств отмечается тенденция к увеличению спонтанных сообщений по сравнению с предыдущими годами (215 сообщений в 2008 г., 288 в 2009 г., 559 в 2010 г.) [13]. Особенно стоит отметить активную работу врачей амбулаторного звена. В 2011 г. в стационарах в 2,5 раза, а в поликлиниках в 5 раз чаще стали выявляться и регистрироваться НПР.
Наиболее частой причиной развития НПР по-прежнему остаются антибактериальные средства. Большинство выявленных НПР с высокой степенью достоверности связаны с подозреваемым ЛС. Однако следует отметить, что процент зарегистрированных реакций типа А является стабильно невысоким. Это позволяет предположить, что у врачей возникают трудности при выявлении НПР типа А.
Количество спонтанных сообщений о НПР в результате самолечения в 2011 г. не изменилось, это одно из направлений, по которому РЦ стоит наладить работу. Необходимо привлечь внимание пациентов к риску возникновения НПР при применении ЛС, особенно при самолечении, и при развитии НПР обратиться к лечащему врачу.
Впервые в 2011 г. зарегистрированы случаи неэффективности ЛС.
Заключение. Волгоградским региональным центром мониторинга безопасности лекарственных средств проведена серьезная работа по внедрению системы безопасного применения ЛС в клинической практике, в результате чего в несколько раз увеличилась частота выявления и регистрации НПР в регионе. Однако еще сохраняются направления по вопросам безопасности ЛС, не достаточно эффективно работающие в регионе, в связи с чем необходимо провести образовательные семинары для врачей по темам: «Выявление нежелательных побочных реакций типа А и увеличение доли выявленных нежелательных побочных реакций типа А в общем объеме сообщений»; «Назначение лекарственных средств пациентам с нежелательными побочными реакциями в анамнезе».
Список литературы Эффективность мониторинга безопасности лекарственных средств в регионе
- Об обращении лекарственных средств: Федеральный закон от 12 апр. 2010 г. № 61-ФЗ//Рос. газ. 2010. № 5157.
- Impicciatore P., Mucci М. Completeness of Published Case Reports on Suspected Adverse Drug Reactions: Evaluation of 100 Reports from a Company Safety Database//Drug Saf. 2010. Vol.33. P. 765-773
- Pharmacovigilance systems and databases in Korea, Japan, and Taiwan/T. Kimura, Y. Matsushita, Y. H. Yang [et al.]//Pharmacoepidemiol. Drug Saf. 2011. Vol. 20. P. 1237-1245
- Current movements of four serious adverse events induced by medicinal drugs based on spontaneous reports in Japan/С Sudo, Y Azuma, K. Maekawa [et al.]//Kokuritsu lyakuhin Shokuhin Eisei Kenkyusho Hokoku. 2011. Vol. 129. P. 111-117
- Смусева O.H., Соловкина Ю.В. Мониторинг безопасности лекарственных средств: оценка роли практических врачей//Астрахан. мед. журн. 2012. Т. 7, № 1. С. 104-107
- Gavaza P., Brown СМ., Khoza S. Texas pharmacists» opinions on reporting serious adverse drug events to the Food and Drug Administration: a qualitative study//Pharm. World Sci. 2010. Vol.32. P. 651-657
- Awareness among nurses about reporting of adverse drug reactions in Sweden/E. Ekman, G. Petersson, S. Tegerud [et al.]//Drug Health Patient Saf. 2012. Vol. 2012. P. 61-66
- The importance of direct patient reporting of suspected adverse drug reactions: a patient perspective/С Anderson, J. Krska, E. Murphy [et al.]//Br.J. Clin. Pharmacol. 2011. Vol. 72. P. 806-822
- Experiences with adverse drug reaction reporting by patients: an 11-country survey/F. van Hunsel, L. Ндгтагк, S. Pal [et al.]//Drug Saf. 2012. Vol. 35. P. 45-60
- Secondary use of electronic health record data: spontaneous triggered adverse drug event reporting/J. A. Linder, J.S. Haas, A Iyer, [et al.]//Pharmacoepidemiol. Drug Saf. 2010. Vol. 19, №12. P. 1211-1215
- Регистрация нежелательных лекарственных реакций в первичной медицинской документации/О.Н. Смусева, О.В. Шаталова, Ю.В. Соловкина, Н.А. Воронкова//Вестник ВолГМУ. 2011. № 4 (40). С. 37-39
- Об утверждении Порядка осуществления мониторинга безопасности лекарственных препаратов для медицинского применения, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении лекарственных препаратов для медицинского применения: приказ Минздравсоцразвития России № 757н от 26 авг. 2010 г.//Рос. газ. 2010. № 5285
- Портал правительства Омской области [Электронный ресурс]: министерство здравоохранения Омской области: Фармацевтическая деятельность: Лекарственное обеспечение. URL: http://mzdr.omskportal.ru/ru/RegionalPublicAuthorities/executivelist/MZDR/farm/lek_obesp. html (дата обращения: 15.11.2012).


