Эффективность поддерживающей терапии олапарибом у пациенток с BRCA‑ассоциированным раком яичников: ретроспективный анализ данных реальной клинической практики
Автор: Орлова Р.В., Андросова А.В., Топузов Э.Э., Авраменко И.В., Беляк Н.П., Кутукова С.И., Муратова К.И., Коркина А.А., Варанкина А.А., Алборов А.Э.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.15, 2025 года.
Бесплатный доступ
Цель: Оценить эффективность поддерживающей терапии олапарибом в реальной клинической практике у пациенток с BRCA ассоциированным раком яичников. Задачи: Оценить выживаемость без прогрессирования (ВБП) в зависимости от линии назначения олапариба. Определить предиктивную значимость уровня опухолевого маркера СА 125 перед началом терапии. Проанализировать частоту нежелательных явлений, потребовавших редукции дозы или отмены препарата. Материалы и методы: Проведен ретроспективный анализ данных 110 пациенток с серозным раком яичников высокой степени злокачественности I–IV стадий с мутацией в генах BRCA1 / 2, получавших поддерживающую терапию олапарибом в СПб ГБУЗ «Городской клинический онкологический диспансер» в период с 2020 по 2024 гг. Пациентки были стратифицированы на три группы: назначение олапариба в первой линии (1L, n = 64), после первого рецидива (ПР1, n = 24) и после двух и более рецидивов (ПР2+, n = 22). Статистический анализ включал оценку выживаемости по методу Каплана — Мейера и многофакторный анализ с использованием регрессии Кокса. Результаты: Медиана ВБП в группе 1L не была достигнута. В группах ПР1 и ПР2+ медиана ВБП составила 49 и 20 месяцев соответственно (p < 0,001). Исходно повышенный уровень СА 125 (- 35 Ед / мл) перед началом терапии олапарибом был ассоциирован со статистически значимым увеличением риска прогрессирования в 3,2 раза (отношение рисков [ОР] 3,2; 95 % ДИ 1,5–6,8; p = 0,003). Токсичность, потребовавшая коррекции дозы, зарегистрирована у 14,1 %, 12,5 % и 13,6 % пациенток в группах 1L, ПР1 и ПР2+ соответственно. Выводы: Поддерживающая терапия олапарибом продемонстрировала высокую клиническую эффективность и управляемый профиль безопасности в условиях реальной практики. Наибольшая польза от терапии наблюдается при ее назначении в первой линии. Повышенный уровень СА 125 (- 35 Ед / мл) перед началом лечения является неблагоприятным прогностическим маркером.
Рак яичников, олапариб, поддерживающая терапия, BRCA, СА‑125, выживаемость без прогрессирования, токсичность
Короткий адрес: https://sciup.org/140313473
IDR: 140313473 | DOI: 10.18027/2224-5057-2025-063
Текст научной статьи Эффективность поддерживающей терапии олапарибом у пациенток с BRCA‑ассоциированным раком яичников: ретроспективный анализ данных реальной клинической практики
Эпителиальный рак яичников (РЯ) высокой степени злокачественности характеризуется агрессивным течением и неблагоприятным прогнозом, что во многом обусловлено диагностикой на поздних стадиях. В глобальной структуре онкологической заболеваемости у женщин РЯ занимает седьмое место по распространенности и восьмое — по смертности, при этом пятилетняя общая выживаемость не превышает 45% [1]. По данным GLOBOCAN, в 2020 году в мире было зарегистрировано 313959 новых случаев РЯ и 207252 летальных исхода [4]. В Российской Федерации РЯ является ведущей причиной смертности от онкоги-некологических заболеваний: ежегодно регистрируется около 14000 новых случаев и 7500 смертей [2]. Более 70% пациенток имеют на момент постановки диагноза распространенное заболевание (III–IV стадия), а излечения удается достичь менее чем у 40% из них [3].
Стандартный подход к лечению распространенного РЯ включает максимальную циторедуктивную операцию и химиотерапию на основе препаратов платины, с возможным добавлением бевацизумаба. Несмотря на успехи, высокая частота рецидивов (до 70%) стимулировала поиск новых подходов, в частности, внедрение поддерживающей таргетной терапии после завершения химиотерапии. Целью поддерживающей терапии является максимальное отсрочивание прогрессирования заболевания и увеличение продолжительности жизни пациенток [4].
Ключевым достижением в лечении РЯ стало понимание роли нарушений в системе репарации ДНК. При- мерно у 50% пациенток с серозным РЯ высокой степени злокачественности выявляется дефицит гомологичной рекомбинации (Homologous Recombination Deficiency, HRD), обусловленный герминальными или соматическими мутациями в генах BRCA1/2 и других генах пути HRR [4,10]. Это открытие легло в основу применения PARP-ингибиторов, таких как олапариб.
Согласно современным клиническим рекомендациям, поддерживающая терапия олапарибом показана пациенткам с мутациями в генах BRCA1/2 после эффективной платиносодержащей химиотерапии первой линии [5,11]. Эффективность данной стратегии была убедительно продемонстрирована в исследовании SOLO-1. Кроме того, исследование PAOLA-1 показало, что комбинация олапа-риба с бевацизумабом в поддержке значительно увеличивает ВБП по сравнению с монотерапией бевацизумабом, особенно у пациенток с HRD-положительным статусом (включая как BRCA-мутированных, так и BRCA-дикого типа с геномной нестабильностью) [7–9]. В этой популяции добавление олапариба снизило риск прогрессирования или смерти на 59% (медиана ВБП 46,8 против 17,6 мес.) и привело к клинически значимому увеличению общей выживаемости (75,2 против 57,3 мес.) [8,9].
Таким образом, тестирование на мутации в генах BRCA1/2 и определение HRD-статуса является обязательным компонентом диагностики РЯ для персонализации лечения [10,11]. Несмотря на наличие данных крупных рандомизированных исследований, анализ результатов применения олапариба вусловиях рутинной клинической практики представляет значительный интерес для подтверждения и дополнения имеющихся сведений.
ЦЕЛЬ И ЗАДАЧИ ИССЛЕДОВАНИЯ
Цель: Оценить эффективность поддерживающей терапии олапарибом в реальной клинической практике у пациенток с BRCA-ассоциированным раком яичников.
Задачи: Оценить выживаемость без прогрессирования (ВБП) в зависимости от линии назначения олапариба; определить предиктивную значимость уровня опухолевого маркера СА-125 перед началом терапии; проанализировать частоту нежелательных явлений, потребовавших редукции дозы или отмены препарата.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования и популяция пациентов
Проведен ретроспективный анализ медицинских данных 110 пациенток с морфологически верифицированным серозным раком яичников высокой степени злокачественности (high-grade) I–IV стадий. Все пациентки имели подтвержденную патогенную или вероятно патогенную мутацию в генах BRCA1 или BRCA2 и получали поддерживающую терапию олапарибом в СПб ГБУЗ «Городской клинический онкологический диспансер» в период с января 2020 по август 2024 гг.
В зависимости от линии терапии, в которой был назначен олапариб, пациентки были стратифицированы на три группы:
-
• группа 1L (n = 64): поддерживающая терапия после химиотерапии первой линии;
-
• группа ПР1 (n = 24): поддерживающая терапия после химиотерапии по поводу первого платиночувствительного рецидива;
-
• группа ПР2+ (n = 22): поддерживающая терапия после химиотерапии по поводу второго и последующих рецидивов.
Методы
Молекулярно-генетическое исследование на наличие мутаций в генах BRCA1/2 проводилось методом полимеразной цепной реакции (ПЦР) в лаборатории СПб ГБУЗ ГКОД и/или методом секвенирования нового поколения (NGS) в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Собирались следующие данные: возраст, стадия заболевания по FIGO, статус мутации BRCA, тип и объем циторедуктивной операции, ответ на предшествующую химиотерапию по критериям RECIST 1.1, уровень СА-125 перед началом приема олапариба, данные о прогрессировании и токсичности. Повышенным считался уровень СА-125 > 35 Ед/мл, нормальным —≤35 Ед/мл.
Статистический анализ
Статистическая обработка данных проводилась с использованием программного обеспечения StatTech
-
v. 4.6.1. Количественные переменные представлены в виде медианы (Me) и интерквартильного размаха [Q1; Q3]. Категориальные переменные описаны с указанием абсолютных чисел и процентов (%). Для сравнения групп использовались U-критерий Манна—Уитни (для количественных данных) и критерий хи-квадрат Пирсона (для качественных данных).
Выживаемость без прогрессирования (ВБП) анализировали с использованием метода Каплана—Мейера. ВБП определялась как время от начала приема олапариба до даты прогрессирования заболевания или смерти от любой причины. Для сравнения кривых выживаемости использовался лог-ранговый тест. Для выявления факторов, влияющих на ВБП, применялась многофакторная регрессионная модель пропорциональных рисков Кокса. Различия считались статистически значимыми при уровне p < 0,05.
РЕЗУЛЬТАТЫ
В анализ были включены данные 110 пациенток. Распределение по группам было следующим: 64 (58,2%) пациентки в группе 1L, 24 (21,8%) — в группе ПР1 и 22 (20,0%) — в группе ПР2+. Основные клинико-патологические характеристики пациенток представлены в таблице 1. Группы были сопоставимы по возрасту. В группе 1L преобладали пациентки с IV стадией заболевания (29,7%) по сравнению с группами рецидивов. Статус заболевания на момент старта приема олапариба представлен на рисунке 1.
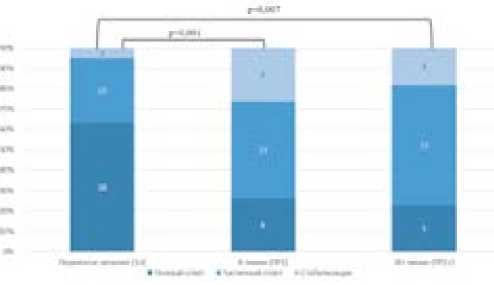
Рисунок 1. Статус заболевания на момент старта приема олапариба
Figure 1. Disease status at the time of initiation of olaparib treatment
Эффективность терапии
Анализ выживаемости по методу Каплана—Мейера показал статистически значимые различия в ВБП между тремя группами (p < 0,001, лог-ранговый тест). В группе 1L медиана ВБП на момент анализа не была достигнута. В группе ПР1 медиана ВБП составила 49 месяцев, а в группе ПР2+— 20 месяцев (рис. 2).
Таблица 1. Клинико-патологические характеристики пациенток в исследуемых группах
Table 1. Clinical and pathological characteristics of patients in the study groups
|
Показатель |
Категории |
Группа 1L (n = 64) |
Группа ПР1 (n = 24) |
Группа ПР2+ (n = 22) |
|
Возраст на момент начала терапии, лет, Me [Q1; Q3] |
55 [46; 66] |
57 [50; 65] |
57 [53; 64] |
|
|
Стадия по FIGO, n (%) |
I–II |
4 (6,3%) |
4 (16,7%) |
4 (18,1%) |
|
III |
41 (64,1%) |
15 (62,5%) |
15 (68,2%) |
|
|
IV |
19 (29,7%) |
5 (20,8%) |
3 (13,6%) |
|
|
Статус мутаций в генах HRR, n (%) |
BRCA1 |
44 (68,8%) |
18 (75,0%) |
12 (54,5%) |
|
BRCA2 |
5 (7,8%) |
3 (12,5%) |
4 (18,2%) |
|
|
BRCA1 + BRCA2 |
1 (1,6%) |
0 (0,0%) |
0 (0,0%) |
|
|
Другие (HRD+, PALB2) |
14 (21,9%) |
3 (12,5%) |
6 (27,3%) |
|
|
Тип циторедукции, n (%) |
Первичная |
19 (29,7%) |
7 (29,2%) |
2 (9,1%) |
|
Интервальная |
34 (53,1%) |
0 (0,0%) |
0 (0,0%) |
|
|
Вторичная/при рецидиве |
1 (1,6%) |
15 (62,5%) |
18 (81,8%) |
|
|
Отсутствие циторедукции |
10 (15,6%) |
2 (8,3%) |
2 (9,1%) |
|
|
Объем циторедукции, n (%) |
Оптимальная |
45 (86,5%) |
12 (85,7%) |
7 (87,5%) |
|
Неоптимальная |
7 (13,5%) |
2 (14,3%) |
1 (12,5%) |
|
|
Ответ на предшествующую ХТ, n (%) |
Полный ответ |
38 (63,3%) |
6 (26,1%) |
5 (22,7%) |
|
Частичный ответ |
19 (31,7%) |
11 (47,8%) |
13 (59,1%) |
|
|
Стабилизация |
3 (5,0%) |
6 (26,1%) |
4 (18,2%) |
|
|
Уровень СА-125 перед олапарибом, n (%) |
Норма (≤ 35 Ед/мл) |
35 (76,1%) |
17 (81,0%) |
10 (62,5%) |
|
Повышен (> 35 Ед/мл) |
11 (23,9%) |
4 (19,0%) |
6 (37,5%) |
|
|
Прогрессирование на олапарибе, n (%) |
Да |
12 (18,8%) |
6 (25,0%) |
12 (54,5%) |
|
Токсичность (коррекция дозы), n (%) |
Да |
9 (14,1%) |
3 (12,5%) |
3 (13,6%) |
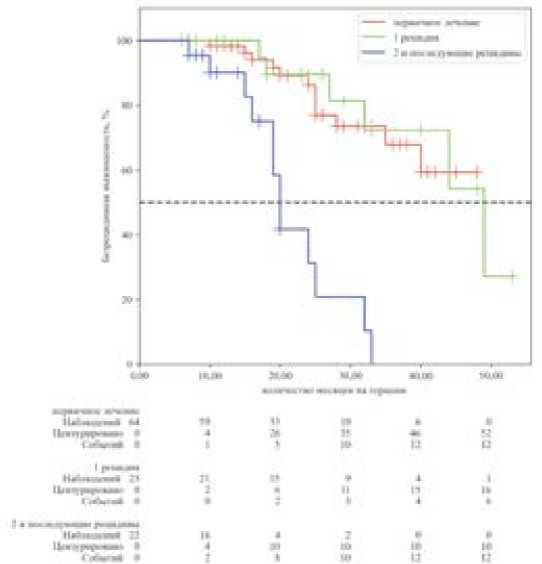
Рисунок 2. Выживаемость без прогрессирования (ВБП) в зависимости от линии назначения олапариба (метод Каплана—Мейера)
Figure 2. Progression-free survival (PFS) by olaparib administration line (Kaplan-Meier method)
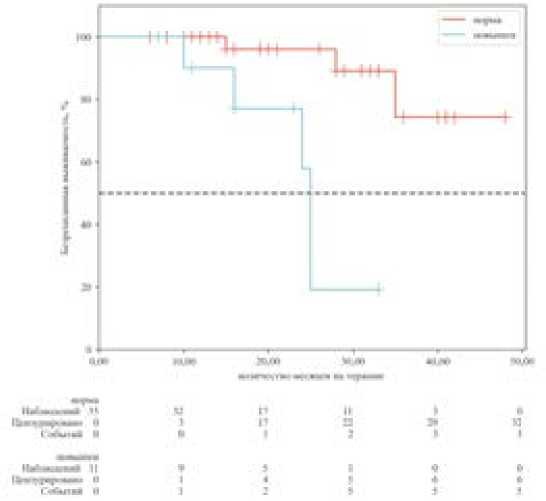
Рисунок 3. Выживаемость без прогрессирования (ВБП) в зависимости от исходного уровня СА-125 (≤35 Ед/мл против >35 Ед/мл) перед началом терапии олапарибом (метод Каплана—Мейера)
Figure 3. Progression-free survival (PFS) according to baseline CA-125 level
(≤35 U/mL vs >35 U/mL) before starting olaparib therapy (Kaplan-Meier method)
Прогностическая роль СА-125
Был проведен анализ влияния исходного уровня СА-125 (перед началом терапии олапарибом) на риск прогрессирования. Пациентки с нормализовавшимся уровнем СА-125 (≤ 35 Ед/мл) после химиотерапии имели значительно более высокую ВБП по сравнению с пациентками, у которых маркер оставался повышенным (> 35 Ед/мл) (медиана ВБП не достигнута против 24 месяца; p < 0,001, лог-ранговый тест, рис. 3).
При проведении многофакторного анализа по модели Кокса установлено, что исходно повышенный уровень СА-125 (> 35 Ед/мл) является независимым неблагоприятным прогностическим фактором. Риск прогрессирования заболевания у пациенток с повышенным уровнем маркера был в 3,2 раза выше по сравнению с пациентками с нормальным уровнем СА-125 (ОР 3,2; 95% ДИ 1,5–6,8; p = 0,003).
ОБСУЖДЕНИЕ
Наш ретроспективный анализ данных реальной клинической практики подтверждает высокую эффективность поддерживающей терапии олапарибом у пациенток с BRCA-ассоциированным раком яичников. Полученные результаты согласуются с данными регистрационных исследований. Так, в первой линии терапии медиана ВБП в нашей когорте не была достигнута, что сопоставимо с результатами исследования SOLO-1. При назначении олапариба в комбинации с бевацизумабом в исследовании PAOLA-1 медиана ВБП у BRCA-позитивных пациенток составила 46,8 месяцев. В нашем исследовании в группах платиночувствительных рецидивов (ПР1 и ПР2+) медианы ВБП составили 49 и 20 месяцев соответственно, что демонстрирует закономерное снижение эффективности PARP-ингибитора в более поздних линиях терапии.
Важной задачей нашего исследования была оценка прогностической роли СА-125. Мы показали, что повышенный уровень маркера (> 35 Ед/мл) перед началом приема олапариба является независимым фактором неблагоприятного прогноза, увеличивая риск прогрессирования более чем в 3 раза. Это может свидетельствовать о большей остаточной опухолевой массе или о наличии резистентных к платине клонов, что снижает последующую эффективность поддерживающей терапии.
Профиль безопасности олапариба в нашей работе оказался управляемым: частота нежелательных явлений, потребовавших редукции дозы, составила 13,5% в общей когорте и не имела значимых различий между группами, что подтверждает возможность длительного применения препарата в рутинной практике.
ВЫВОДЫ
-
1. Поддерживающая терапия олапарибом является высокоэффективным методом лечения пациенток с BRCA-ассоциированным раком яичников в условиях реальной клинической практики.
-
2. Наилучшие показатели выживаемости без прогрессирования достигаются при назначении олапариба в первой линии терапии (медиана ВБП не достигнута), тогда как в группах первого и последующих рецидивов медиана ВБП составила 49 и 20 месяцев соответственно.
-
3. Исходно повышенный уровень СА-125 (> 35 Ед / мл) перед началом поддерживающей терапии олапа-рибом является независимым неблагоприятным
-
4. Олапариб продемонстрировал приемлемый и управляемый профиль безопасности: частота редукции дозы из-за токсичности не превышала 15% во всех исследуемых группах, что подтверждает возможность его длительного применения.
прогностическим фактором, ассоциированным со значительным увеличением риска прогрессирования заболевания.


