Эффективность поддерживающей терапии после окончания первой линии лечения больных метастатическим раком толстой кишки - результаты популяционного исследования
Автор: Федянин М.Ю., Алиева Ш.А., Владимирова Л.Ю., Иванов А.Н., Катков А.А., Кузьмина Е.С., Кулик В.В., Матюшина Е.И., Никитина Л.Ю., Орлова Р.В., Повышев А.Ю., Пшеволоцкий Э.М., Рамазанова М.С., Смирнова Е.В., Ткачук А.Д., Уланова Н.В., Шалофаст О.В., Эрдниев С.П., Тюляндин С.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Профилактика, диагностика и лечение онкологических заболеваний
Статья в выпуске: 3 т.8, 2018 года.
Бесплатный доступ
Цель. Оценить эффективность различных режимов поддерживающей терапии после окончания первой линии лечения больных метастатическим раком толстой кишки. Материалы и методы. Проведен анализ индивидуальных карт 432 пациентов 17 клиник 14 регионов РФ, которые начали терапию по поводу метастатического рака в 2013 г. Основным критерием отбора в исследование являлось отсутствие прогрессирования в течение первых 16 нед. терапии первой линии. Проведено сравнение четырех групп пациентов в зависимости от характера поддерживающей терапии: получавших фторпиримидины, комбинацию фторпиримидинов с бевацизумабом, бевацизумаб в монорежиме и анти-EGFR антитела. Основными критериями оценки эффективности лечения считались выживаемость без прогрессирования и общая выживаемость. Статистический анализ проводился в пакете программ SPSS 20.0. Результаты. Поддерживающая терапия после завершения первой линии лечения была назначена 126 пациентам, большинству проводилась терапия фторпиримидинами (53,1 %)...
Рак толстой кишки, популяционное исследование, поддерживающая химиотерапия
Короткий адрес: https://sciup.org/140243797
IDR: 140243797 | DOI: 10.18027/2224-5057-2018-8-3-57-67
Текст научной статьи Эффективность поддерживающей терапии после окончания первой линии лечения больных метастатическим раком толстой кишки - результаты популяционного исследования
В среднем 60–70 % больных метастатическим раком толстой кишки завершают первые 16–24 нед. химиотерапии с бевацизумабом или анти-EGFR антителами без прогрессирования [1–4]. В соответствии с современными рекомендациями в дальнейшем пациентов переводят на поддерживающую химиотерапию с до- бавлением таргетных препаратов [5, 6]. Такой подход значимо увеличивает выживаемость больных в сравнении с наблюдением и является менее токсичной опцией в сравнении с продолжением полноценной первой линии терапии до прогрессирования [7–19]. И если комбинация фторпиримидинов с бевацизумабом стала стандартом такого лечения, то о применении поддерживающей терапии анти-EGFR антителами по результатам небольших исследований однозначного вывода сделать невозможно [20, 21].
Однако следует отметить, что ни в одном из проведенных к настоящему времени исследований, посвященных поддерживающей терапии, не проводилось сравнения монотерапии фторпиримидинами и комбинации фтор-пиримидинов и таргетных препаратов. В небольших исследованиях медиана продолжительности жизни при назначении фторпиримидинов в поддерживающей терапии колеблется от 21,6 до 31 мес. или не достигается в ряде работ, что сравнимо с показателями продолжительности жизни при назначении комбинации бевацизумаба и фтор-пиримидинов или цетуксимаба в монорежиме [22]. Поэтому явно существует пробел в исследованиях: отсутствуют сравнительные исследования этих трех вариантов поддерживающей терапии. Второй момент, отмечаемый многими авторами, – это выбор правильного критерия эффективности при оценке данной стратегии ведения больных. Лучшим критерием является, конечно же, общая выживаемость.
Учитывая вышесказанное, мы приняли решение сравнить эффективность различных режимов поддерживающей терапии после окончания первой линии лечения больных метастатическим раком толстой кишки в реальной клинической практике различных регионов РФ.
Материалы и методы
Проведен анализ индивидуальных карт больных метастатическим раком толстой кишки 17 клиник 14 регионов РФ:
-
• НИИ Онкологии им. Н. Н. Петрова;
-
• Спб ГБУЗ «Городская больница № 9»;
-
• Спб ГБУЗ Городской клинический онкологический диспансер;
-
• ГУ «Коми республиканский онкологический диспансер»;
-
• ФГБУ «Ростовский научно-исследовательский онкологический институт» МЗ РФ;
-
• КОГБУЗ «Кировский областной клинический онкологический диспансер»;
-
• ГБУЗ «Оренбургский областной клинический онкологический диспансер»;
-
• ГУЗ «Областной онкодиспансер № 2», г. Саратов;
-
• БУЗ УР «Республиканский клинический онкологический диспансер им. С. Г. Примушко МЗ УР», г. Ижевск;
-
• БУ «Республиканский клинический онкологический диспансер», г. Чебоксары;
-
• Сургутская окружная клиническая больница;
-
• Окружной онкологический центр окружной клинической больницы, г. Ханты-Мансийск;
-
• Региональный онкологический центр Салехардской окружной клинической больницы;
-
• ГАУЗ МКМУ «Медицинский город», г. Тюмень;
-
• БУЗ «Клинический онкологический диспансер», г. Омск;
-
• ГКБУЗ «Алтайский клинический онкологический диспансер»;
-
• ГБУЗ «Приморский краевой онкологический диспансер».
Критерии включения в исследование: больные метастатическим раком толстой кишки, диагностированным не позднее 2013 г., и обязательно начавшие первую линию химиотерапии в 2013 г. Если такой пациент на текущий момент умер, то на него тоже могла быть заполнена карта.
Критерии объединения данных в группы для последующего анализа:
По режимам химиотерапии пациенты были объединены в три группы:
-
• оксалаплатин-содержащие режимы (XELOX, FOLFOX, FLOX);
-
• иринотекан-содержащие режимы (FOLFIRI, XELIRI, IFL, иринотекан в монорежиме);
-
• фторпиримидины в монорежиме (капецитабин в монорежиме, инфузия фторурацила, струйный фторурацил). Для анализа эффективности таргетной терапии сравнивались данные по трем группам:
-
• бевацизумаб – пациенты на бевацизумабе;
-
• анти-EGFR – пациенты на панитумумабе или цетуксимабе;
-
• отсутствие таргетной терапии – пациенты, не получавшие таргетную терапию.
Проводилось сравнение четырех групп пациентов в зависимости от режима поддерживающей терапии:
-
• монотерапия фторпиримидинами;
-
• комбинация фторпиримидинов с бевацизумабом;
-
• бевацизумаб в монорежиме;
-
• анти-EGFR антитела.
Основными критериями оценки эффективности лечения считались выживаемость без прогрессирования и общая выживаемость. Выживаемость без прогрессирования на каждой из линий терапий и общая выживаемость анализировались с использованием метода Каплана – Мейера с указанием медианы выживаемости. Выживаемость без прогрессирования считалась от даты начала терапии на каждой линии, при этом наступление события фиксировалось в двух случаях: при прогрессировании заболевания или при смерти пациента. Общая выживаемость считалась от даты начала первой линии химиотерапии. Оценка влияния факторов (пол, возрастная группа, стадия заболевания, локализация первичной опухоли, статус гена KRAS и т. д.) на выживаемость без прогрессирования на каждой из линий терапий и на общую выживаемость проводилась с использованием регрессионной модели пропорциональных рисков Кокса (ОР c 95 % ДИ). Достоверность различия выживаемости в группах пациентов оценивалась с использованием критериев Вилкоксона – Гехана, лог-рангового теста и критерия Кокса. Для проверки однородности групп пациентов в зависимости от режимов химиотерапии и различных факторов использовались
Таблица 1. Характеристика пациентов, вошедших в популяционное исследование, которым проводилась системная терапия по поводу метастатического процесса
Исследование было проведено на основе информации из индивидуальных карт 432 больных метастатическим раком толстой кишки. Характеристика больных представлена в табл. 1.
Из табл. 1 видно, что у менее половины пациентов, которые получали лечение по поводу метастатического заболевания, определялся мутационный статус гена KRAS. Среди пациентов, кому он был определен, в 38 % наблюдений отмечена мутация в гене. Рассматривая характер лечения пациентов ранних стадий, следует отметить, что адъювантная химиотерапия ограничивалась назначением фторпиримидинов у 65 % пациентов. При IV стадии заболевания первичная опухоль была удалена у 81 % больных. В качестве первой линии терапии практически каждому пятому пациенту (19 %) проводилось лечение фторпиримидинами в монорежиме, 27 % больных получали таргетную терапию в первой линии.
Результаты
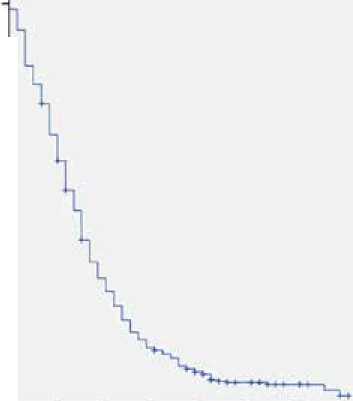
При медиане наблюдения 32 мес. медиана выживаемости без прогрессирования в первой линии терапии составила 8 мес., а продолжительности жизни – 23 мес. (рис. 1, 2).
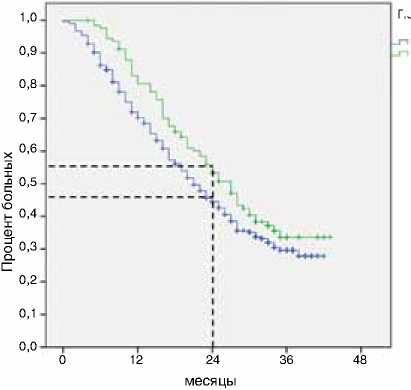
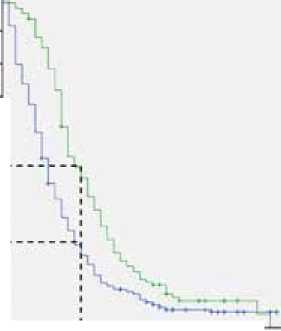
Поддерживающая терапия после завершения первой линии лечения была назначена 29 % (126/432) пациентов. При этом большинству – в виде терапии фторпири-мидинами в монорежиме: 53 % (67/126). Отмечено влияние проведения поддерживающей терапии на общую выживаемость пациентов: медиана продолжительности жизни в группе поддерживающей терапии составила 27 против 21 мес. (р=0,07 по анализу Cox, р=0,01 по Breslow, ОР=0,78, 95 % ДИ 0,6–1,02) (рис. 3). А также и на выживаемость без прогрессирования: медиана в группе поддерживающей терапии составила 11 против 7 мес. (p<0,001 по Breslow, ОР=0,6, 95 % ДИ 0,5–0,8) (рис. 4).
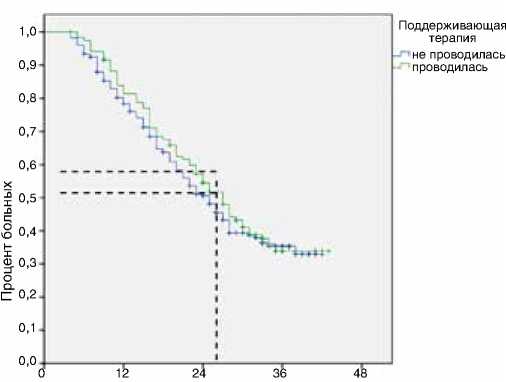
Однако данная группа без поддерживающей терапии включала пациентов, быстро прогрессирующих, в связи с чем было решено с целью изучения влияния поддерживающей терапии на общую выживаемость отобрать подгруппу больных без прогрессирования в течение первых 16 нед. терапии первой линии (n=346, из них 120 (34,7 %) пациентов получали поддерживающую терапию). В данной группе эффект поддерживающей химиотерапии сохранялся, но был не столь выраженным: медиана продолжительности жизни в группе поддерживающей терапии (n=120/346, 34,7 %) составила 27 мес. против 25 мес. (р=0,3 по Breslow, ОР=0,9, 95 % ДИ 0,7–1,2) (рис. 5) в группе наблюдения (n=226/346, 65,3 %). При этом сохранялся значимым эффект от проведения поддерживающей терапии на выживаемость без прогрессирования:
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0,0
Illi-Illi 6 12 18 24 30 36 42 48
месяцы
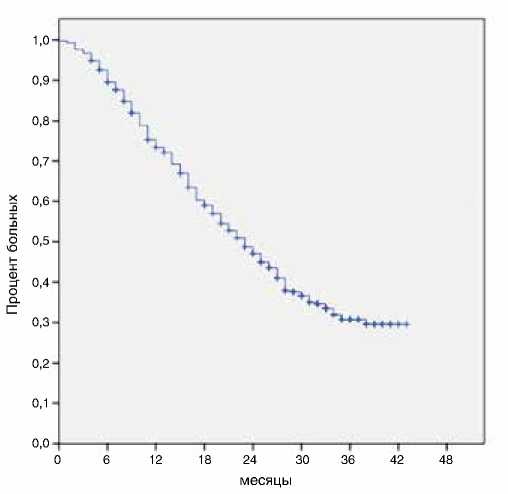
Рисунок 2. Общая выживаемость в первой линии
Рисунок 1. Выживаемость без прогрессирования в первой линии
Поддерживающая терапия не проводилась проводилась
Рисунок 3. Влияние проведения поддерживающей терапии на общую выживаемость пациентов
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
-T-
0 12 24
месяцы
0,0
—Г
Поддерживающая терапия не проводилась проводилась
Рисунок 4. Влияние проведения поддерживающей терапии на выживаемость без прогрессирования пациентов
месяцы
Рисунок 5. Влияние проведения поддерживающей терапии на общую выживаемость пациентов в группе без прогрессирования в течение первых 16 нед. первой линии
Поддерживающая терапия не проводилась проводилась
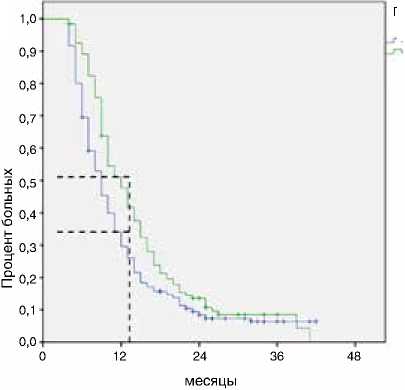
Рисунок 6. Влияние проведения поддерживающей терапии на выживаемость без прогрессирования в группе без прогрессирования в течение первых 16 нед. первой линии
Таблица 2. Выживаемость пациентов
|
в зависимости от характера режима терапии в поддерживающем лечении |
||||
|
Режим поддерживающей терапии |
n |
Медиана, мес. |
Р (регрессия Cox) |
ОР (95 %ДИ)* |
|
Общая выживаемость |
||||
|
Фторпиримидины |
64 |
28 |
||
|
Бевацизумаб + фторпи-римидины |
26 |
33 |
0,4 |
1,1 |
|
(0,9–1,3) |
||||
|
Бевацизумаб |
11 |
20 |
||
|
Анти-EGFR |
19 |
28 |
||
|
Выживаемость без прогрессирования |
||||
|
Фторпиримидины |
64 |
12 |
||
|
Бевацизумаб + фторпи-римидины |
26 |
11 |
0,9 |
1,0 |
|
(0,9–1,2) |
||||
|
Бевацизумаб |
11 |
10 |
||
|
Анти-EGFR антитела |
19 |
14 |
||
*ОР – отношение рисков, ДИ – доверительный интервал отношения рисков медиана в группе поддерживающей терапии составила 12 против 9 мес. (p<0,001 по Breslow, ОР=0,7, 95 % ДИ 0,6– 0,9) (рис. 6).
В данной группе также отмечено различие в выживаемости пациентов в зависимости от режима поддерживающей терапии. Сравнивались четыре группы пациентов, получавших фторпиримидины, комбинацию фторпири-мидинов с бевацизумабом, бевацизумаб в монорежиме и анти-EGFR антитела. Наихудшие результаты общей выживаемости наблюдались в группе поддерживающего лечения только бевацизумабом (рис. 7, 8, табл. 2).
С целью подтверждения независимого влияния данного фактора было проведено сравнение характеристик пациентов без прогрессирования в течение 16 нед. первой линии, которым назначалась или не назначалась поддерживающая терапия (табл. 3).
Как видно из табл. 3, по основным характеристикам заболевания пациенты не различались в сравниваемых группах. И хотя число с не тестированным мутационным статусом гена KRAS было выше в группе без назначения поддерживающей терапии (61,1 % (n=138) против 39,2 % (n=47), р<0,01), по числу больных с диким типом в гене KRAS группы не различались (21,2 % (n=48) против 39,2 % (n=47), p=0,2). В тоже время следует отметить, что поддерживающая терапия чаще назначалась в случае применения бевацизумаба в первой линии (40,0 % (n=48) против 14,6 % (n=33), р<0,01). И такой фактор неблагоприятного прогноза, как проведение адъювантной химиотерапии, в анамнезе также чаще встречался в группе поддерживающего лечения (46,7 % (n=56) против 31,9 % (n=72), р<0,01).
Обсуждение
Нами изучена эффективность различных режимов поддерживающей терапии после окончания первой линии лечения больных метастатическим раком толстой кишки в реальной клинической практике различных регионов РФ. Мы подтвердили эффективность поддерживающей терапии. В первую очередь необходимо подчеркнуть, что общая выживаемость при монотерапии фторпири-мидинами в качестве поддерживающего лечения после завершения 16 нед. первой линии терапии была высокоэффективной опцией лечения. Это подтверждается и результатами опубликованного в 2016 г. первого рандомизированного исследования III фазы, сравнивающего поддерживающую терапию капецитабином и наблюдение после окончания 18–24 нед. индукционной химиотерапии режимами mFOLFOX6 или XELOX. Исследователи отметили
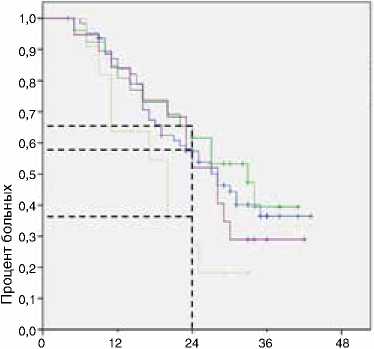
Режимы поддерживающей терапии фторпиримидины фторпиримидины+ бевацизумаб бевацизумаб анти_EGFR месяцы
Рисунок 7. Влияние режима поддерживающей терапии на общую выживаемость в группе без прогрессирования в течение первых 16 нед. первой линии
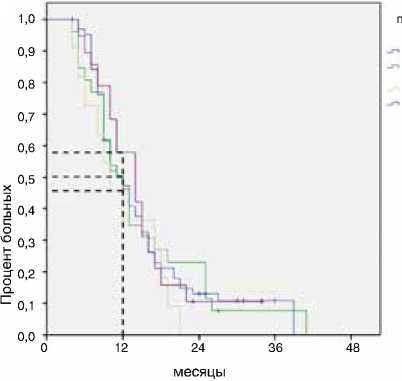
Режимы поддерживающей терапии фторпиримидины фторпиримидины+ бевацизумаб бевацизумаб анти_EGFR
Рисунок 8. Влияние режима поддерживающей терапии на выживаемость без прогрессирования в группе без прогрессирования в течение первых 16 нед. первой линии
Таблица 3. Сравнение характеристик пациентов без прогрессирования в течение 16 нед. первой линии в зависимости от проведения поддерживающей терапии
Поддерживающая терапия
Выявленные нами находки по низкой эффективности монотерапии бевацизумабом в качестве поддерживающего лечения подтверждаются опубликованными в 2018 г. результатами проспективного рандомизированного исследования III фазы PRODIGE9. В данной работе авторы сравнили поддерживающую терапию бевацизумабом в монорежиме с отсутствием поддерживающей терапии после окончания 12 курсов первой линии терапии по схеме «FOLFIRI + бевацизумаб». Оказалось, что медианы выживаемости без прогрессирования и медианы продолжи- тельности жизни в сравниваемых группах не различались: 9,2 против 8,9 мес. (ОР=0,91, 95 % ДИ 0,76–1,09, р=0,3) и 21,7 против 22 мес. (ОР=1,07, 95 % ДИ 0,88–1,29, р=0,5) соответственно [24].
В нашей работе в качестве первой линии чаще назначались оксалиплатин-содержащие режимы, поэтому правильнее ориентироваться на исследования III фазы по изучению монотерапии бевацизумабом в качестве поддерживающей терапии после окончания индукционного этапа с включением оксалиплатина, фторпиримидинов и бевацизумаба. В настоящее время доступны результаты только двух таких исследований. Одной из первых работ, посвященных поддерживающей терапии бевацизумабом, является исследование MACRO. Пациенты при отсутствии прогрессирования после 6 курсов терапии по схеме «XELOX + бевацизумаб» были рандомизированы на две группы. В первой группе проводилась поддерживающая терапия бевацизумабом в монорежиме, во второй продолжили режим «XELOX + бевацизумаб» до прогрессирования. В исследование было включено 480 больных метастатическим раком толстой кишки. Статистическая гипотеза исходила из не меньшей эффективности монотерапии бевацизумабом в сравнении с режимом «XELOX + бевацизумаб» на поддерживающем этапе лечения. Формально авторы не достигли заявленной ими статистической гипотезы, и монотерапия бевацизумабом не является не меньшей по эффективности поддерживающей опцией в сравнении с продолжением полноценной химиотерапии режимом «XELOX + бевацизумаб» [13]. Кроме того, недостоверные различия в медианах продолжительности жизни в 5 мес. заставляют задуматься об эффективности поддерживающей терапии бевацизумабом в монорежиме. Во втором исследовании – SAKK 41/06 – проведен анализ не меньшей эффективности отсутствия поддерживающей терапии в сравнении с поддерживающей терапией бевацизумабом после 4–6 мес. химиотерапии в сочетании с бевацизумабом при условии отсутствия прогрессирования заболевания. Было рандомизировано 262 пациента. При медиане наблюдения более 28 мес. выживаемость без прогрессирования в группе с бевацизумабом составила 9,5 мес. против 8,5 мес. в группе наблюдения, а медиана продолжительности жизни – 24,9 против 22,8 мес. Осложнения на фоне поддерживающей терапии бевациз-умабом были не значимы [15]. Авторы исследования пришли к выводу, что, хотя не меньшая эффективность отсутствия поддерживающей терапии статистически доказана не была, принимая во внимание отсутствие влияния бева-цизумаба в качестве поддержки на общую выживаемость, высокую стоимость препарата, такой подход не является терапевтически оправданным.
Высокие показатели выживаемости без прогрессирования в группе поддерживающей терапии с включением анти-EGFR антител в нашем исследовании могут быть объяснены как более благоприятным прогнозом больных с диким типом гена KRAS, так и небольшим числом больных, включенных в исследование. Тем не менее всем пациентам в данной группе проводилась монотерапия анти-EGFR антителами. Тогда как в настоящее время требуется проведение сочетанной поддерживающей терапии анти-EGFR антителами и фторпиримидинами – именно такой подход является наиболее эффективным по результатам поданализа двух проспективно проведенных рандомизированных исследований (PRIME и PEAK). Так, медиана выживаемости без прогрессирования и общей выживаемости в исследовании PRIME в группе комбинации панитумумаба и внутривенных 46-часовых инфузий фторурацила составила 16,6 и 40,2 мес. против 12,6 и 24,1 мес. в группе монотерапии фторпиримидинами [25].
Следует отметить и недостатки нашей работы. В первую очередь – ее ретроспективный характер, а также небольшое число больных, которым проводилась таргетная терапия. Тем не менее подтверждение полученных нами находок результатами других исследований, во-первых, позволяет не рекомендовать монотерапию бевацизума-бом в качестве поддерживающего лечения – пациентов следует оставлять либо на терапии фторпиримидинами, либо на комбинации фторпиримидинов с бевацизумабом, если он назначался на индукционном этапе. Во-вторых, в случаях применения в первой линии комбинации химиотерапии и анти-EGFR антител после 16–24 нед. можно перейти на поддерживающую терапию панитумумабом или цетуксимабом в сочетании с внутривенными 46-часовыми инфузиями фторурацила.
Заключение
Таким образом, можно прийти к заключению, что общая выживаемость при монотерапии фторпиримидинами в качестве поддерживающего лечения после завершения 16 нед. первой линии терапии была аналогична выживаемости больных, которым проводилась комбинация фтор-пиримидинов с таргетными препаратами. В то же время монотерапия бевацизумабом в поддерживающем лечении была ассоциирована с наименьшими показателями как выживаемости без прогрессирования, так и продолжительности жизни.
Список литературы Эффективность поддерживающей терапии после окончания первой линии лечения больных метастатическим раком толстой кишки - результаты популяционного исследования
- de Gramont A., Figer A., Seymour M. et al. Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J. Clin. Oncol. 2000. Vol. 18. P. 2938-2947.
- Van Cutsem E., Kohne C. H., Lang I. et al. Cetuximab plus irinotecan, fluorouracil, and leucovorin as first-line treatment for metastatic colorectal cancer: updated analysis of overall survival according to tumor KRAS and BRAF mutation status. J. Clin. Oncol. 2011. Vol. 29. P. 2011-2019.
- Cassidy J., Clarke S., Diaz-Rubio E. et al. Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer. J. Clin. Oncol. 2008. Vol. 26. P. 2006-2012.
- Saltz L. B., Clarke S., Diaz-Rubio E. et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J. Clin. Oncol. 2008. Vol. 26. P. 2013-2019.
- https://www.nccn.org/professionals/physician_gls/pdf/colon_blocks. pdf.
- Van Cutsem E., Cervantes A., Adam R. et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann. Oncol. 2016. Vol. 27 (8). P. 1386-1422.
- Maughan T. S., James R. D., Kerr D. J. et al. Comparison of intermittent and continuous palliative chemotherapy for advanced colorectal cancer: a multicenter randomised trial. Lancet. 2003. Vol. 361. P. 457-464.
- Labianca R., Sobrero A., Isa L. et al. Intermittent versus continuous chemotherapy in advanced colorectal cancer: a randomised "GISCAD" trial. Ann. Oncol. 2011. Vol. 22. P. 1236-1242.
- Tournigand C., Cervantes A., Figer A. et al. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-go fashion in advanced colorectal cancer -a GERCOR study. J. Clin. Oncol. 2006. Vol. 24. P. 394-400.
- Adams R. A., Meade A. M., Seymour M. T. et al. Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet Oncol. 2011. Vol. 12. P. 642-653.
- Chibaudel B., Maindrault-Goebel F., Lledo G. et al. Can chemotherapy be discontinued in unresectable metastatic colorectal cancer? The GERCOR OPTIMOX2 Study. J. Clin. Oncol. 2009. Vol. 27. P. 5727-5733.
- Tournigand C., Chibaudel B., Samson B. et al. Bevacizumab with or without erlotinib as maintenance therapy in patients with metastatic colorectal cancer (GERCOR DREAM
- OPTIMOX3): a randomised, open-label, phase 3 trial. Lancet Oncol. 2015. Vol. 16. P. 1493-1505.
- Diaz-Rubio E., Gomez-Espana A., Massuti B. et al. First-line XELOX plus bevacizumab followed by XELOX plus bevacizumab or single-agent bevacizumab as maintenance therapy in patients with metastatic colorectal cancer: the phase III MACRO TTD study. Oncologist. 2012. Vol. 17. P. 15-25.
- Hegewisch-Becker S., Graeven U., Lerchenmuller C. A. et al. Maintenance strategies after first-line oxaliplatin plus fluoropyrimidine plus bevacizumab for patients with metastatic colorectal cancer (AIO 0207): a randomised, non-inferiority, openlabel, phase 3 trial. Lancet Oncol. 2015. Vol. 16. P. 1355-1369.
- Koeberle D., Betticher D. C., von Moos R. et al. Bevacizumab continuation versus no continuation after first-line chemotherapy plus bevacizumab in patients with metastatic colorectal cancer: a randomized phase III non-inferiority trial (SAKK41/06). Ann. Oncol. 2015. Vol. 26. P. 709-714.
- Simkens L. H., van Tinteren H., May A. et al. Maintenance treatment with capecitabine and bevacizumab in metastatic colorectal cancer (CAIRO3): a phase 3 randomised controlled trial of the Dutch Colorectal Cancer Group. Lancet. 2015. Vol. 385. P. 1843-1852.
- Wasan H., Meade A. M., Adams R. et al. Intermittent chemotherapy plus either intermittent or continuous cetuximab for first-line treatment of patients with KRAS wild-type advanced colorectal cancer (COIN-B): a randomised phase 2 trial. Lancet Oncol. 2014. Vol. 15. P. 631-639.
- Johnsson A., Hagman H., Frodin J. E. et al. A randomized phase III trial on maintenance treatment with bevacizumab alone or in combination with erlotinib after chemotherapy and bevacizumab in metastatic colorectal cancer: the Nordic ACT Trial. Ann. Oncol. 2013. Vol. 24. P. 2335-2341.
- Stein A., Atanackovic D., Hildebrandt B. et al. Upfront FOLFOXIRI+bevacizumab followed by fluoropyrimidin and bevacizumab maintenance in patients with molecularly unselected metastatic colorectal cancer. Br. J. Cancer. 2015. Vol. 113. P. 872-877.
- Garcia Alfonso P., Benavides M., Sanchez Ruiz A. et al. Phase II study of first-line mFOLFOX plus cetuximab (C) for 8 cycles followed by mFOLFOX plus C or single agent (S/A) C as maintenance therapy in patients (P) with metastatic colorectal cancer (mCRC): The MACRO-2 trial (Spanish Cooperative Group for the Treatment of Digestive Tumors ). Ann. Oncol. 2014. Vol. 25. Suppl. 4. Abstr. 499O.
- Tveit K. M., Guren T., Glimelius B. et al. Phase III trial of cetuximab with continuous or intermittent fluorouracil, leucovorin, and oxaliplatin (Nordic FLOX) versus FLOX alone in fi rst-line treatment of metastatic colorectal cancer: the NORDIC-VII study. J. Clin. Oncol. 2012. Vol. 30. P. 1755-1762.
- Федянин М. Ю., Трякин А. А., Тюляндин С. А. Поддерживающее лечение больных с метастатическим раком толстой кишки после завершения первой линии химиотерапии. Эффективная фармакотерапия: онкология, гематология, радиология. 2013. № 3. C. 44-54.
- Fedyanin M. Yu., Tryakin A. A., Tjulandin S. A. Podderzhivayushchee lechenie bol’nykh s metastaticheskim rakom tolstoi kishki posle zaversheniya pervoi linii khimioterapii (Supportive treatment of patients with metastatic colon cancer after completion of the first line of chemotherapy). Effektivnaya farmakoterapiya: onkologiya, gematologiya, radiologiya. 2013. No. 3. P. 44-54 (In Russ.)
- Luo H. Y., Li Y. H., Wang W. et al. Single-agent capecitabine as maintenance therapy after induction of XELOX (or FOLFOX) in first-line treatment of metastatic colorectal cancer: randomized clinical trial of efficacy and safety. Ann. Oncol. 2016. Vol. 27 (6). P. 1074-1081.
- Aparicio T., Ghiringhelli F., Boige V. et al. Bevacizumab Maintenance Versus No Maintenance During Chemotherapy-Free Intervals in Metastatic Colorectal Cancer: A Randomized Phase III Trial (PRODIGE 9). J. Clin. Oncol. 2018. Vol. 36 (7). P. 674-681.
- Rivera Herrero F., Bachet J., Modest D. P. et al. Outcomes in patients receiving maintenance therapy in two panitumumab (Pmab) first-line trials for metastatic colorectal cancer (mCRC). Ann. Oncol. 2017. Vol. 28. Suppl 5. P. v158-v208.


