Эффективность предоперационной терапии в группах с высоким и низким риском гематогенного метастазирования при плоскоклеточном раке и аденокарциноме легкого
Автор: Панкова О.В., Таширева Л.А., Родионов Е.О., Миллер С.В., Геращенко Т.С., Письменный Д.С., Завьялова М.В., Денисов Е.В., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.21, 2022 года.
Бесплатный доступ
Для подбора оптимального лечения немелкоклеточного рака легкого (НМРЛ) важно прогнозировать риск отдаленного метастазирования и эффективность терапии. Влияние неоадъювантной химиотерапии (НАХТ) на гематогенное метастазирование остается малоизученным. В исследовании оценивали возможность прогнозирования и эффективность различных вариантов пред- и интраоперационной терапии в группах больных с высоким и низким риском гематогенного метастазирования НМРЛ, разделенных на основании оценки морфологических изменений эпителия бронхов мелкого калибра, расположенных вблизи первичной опухоли. Материал и методы. У 171 больного НМРЛ (T1-4N0-3M0) в бронхах мелкого калибра, взятых на расстоянии 3-5 см от опухоли, определяли различные варианты морфологических изменений бронхиального эпителия (изолированная базальноклеточная гиперплазия (БКГ+ПМ-Д-), базальноклеточная гиперплазия в сочетании с плоскоклеточной метаплазией (БКГ+ПМ+Д-), плоскоклеточная метаплазия с дисплазией (БКГ-ПМ+Д+)). В предварительных исследованиях показано, что маркерами высокого риска гематогенного метастазирования НМРЛ является обнаружение БКГ+ПМ-Д-или БКГ-ПМ+Д в мелких бронхах, низкого - БКГ+ПМ+Д- и БКГ-ПМ-Д-. В предоперационном периоде 52,6 % больных (90/171) получили 2-3 курса НАХТ и 41,1 % (37/90) больных получили однократную интраоперационную лучевую терапию (ИОЛТ) в дозе 10-15 Гр. В послеоперационном периоде 47,4 % (81/171) больных получали адъювантную химиотерапию (АХТ) препаратами платины. Результаты. Оба варианта лечения (НАХТ+ИОЛТ+ и НАХТ+ИОЛТ-) эффективно снижали частоту гематогенных метастазов в группе высокого риска в течение первых 2 лет наблюдения по сравнению с группой высокого риска, в которой не проводилась терапия. За время наблюдения в группе низкого риска гематогенные метастазы возникали редко, независимо от варианта лечения. Адъювантная химиотерапия не влияет на частоту гематогенных метастазов. Безметастатическая и общая выживаемость были лучше в группе с низким риском гематогенного метастазирования или при использовании схемы НАХТ+ИОЛТ+. Заключение. Увеличение безметастатической и общей выживаемости связано с сочетанием варианта терапии НАХТ и ИОЛТ.
Нмрл, метастазирование, нахт, иолт, базальноклеточная гиперплазия, дисплазия
Короткий адрес: https://sciup.org/140296691
IDR: 140296691 | УДК: 616.24-006.61-033.2-08:611-018.5 | DOI: 10.21294/1814-4861-2022-21-6-25-37
Текст научной статьи Эффективность предоперационной терапии в группах с высоким и низким риском гематогенного метастазирования при плоскоклеточном раке и аденокарциноме легкого
Несмотря на совершенствование хирургических и терапевтических методов лечения и активные исследования в области молекулярной диагностики рака легкого, он по-прежнему занимает ведущее место в структуре онкологической заболеваемости [1], а 5-летняя выживаемость составляет всего 10–20 % [2]. 5-летняя выживаемость у пациентов с резектабельным немелкоклеточным раком легкого (НМРЛ) составляет от 25 до 75 % [3].
Существуют рандомизированные исследования и метаанализы, обобщающие эффективность различных стратегий терапии рака легкого. Химиотерапия улучшает выживаемость пациентов с НМРЛ IB–III стадии, независимо от того, назначается она до или после операции. Однако при адъювантной химиотерапии выживаемость составляет около 5 % в течение 5 лет [4]. В шести рандомизированных исследованиях, посвященных изучению результатов сочетанной и последовательной терапии у пациентов с местнораспространенным
НМРЛ, было установлено, что сочетанная терапия увеличивает 3-летнюю общую выживаемость (ОВ) на 5,7 % и 5-летнюю ОВ на 4,5 %.
Частота местных рецидивов оказалась значительно ниже, когда после неоадъювантной терапии была добавлена резекция [5]. Роль резекции в ведении пациентов со стадией IIIA после неоадъювантной терапии является предметом широких дебатов. На данный момент проведено лишь несколько рандомизированных исследований, сравнивающих хирургическое вмешательство с радиотерапией после неоадъювантной химиотерапии [5–8]. Их результаты широко обсуждались в двух недавних метаанализах [9, 10]. Ни один из них не показал улучшения 2- и 4-летней ОВ. Более того, при добавлении радиотерапии к неоадъювантному лечению [5, 7] значительно увеличилась только 3-летняя выживаемость без прогрессирования (PFS). Интересно, что медиана выживаемости и показатели 5-летней ОВ увеличивались с годами, начиная с 19,4 против 17,4 мес в самом раннем опубликованном исследовании [8] до 49,4 против 34,6 мес в последнем [7].
Отдельно существует проблема выделения прогностических групп пациентов с НМРЛ с высокой и низкой вероятностью достижения хорошего эффекта НАХТ. В настоящее время НАХТ рекомендуется операбельным пациентам с IIIA стадией со статусом N2 в качестве этапа комбинированного лечения [11]. При использовании химиотерапии в неоадъювантном режиме наблюдается лучшая переносимость, чем в послеоперационном периоде, повышается ее эффективность при неизмененном кровоснабжении опухоли до операции, а также повышается возможность проведения всех запланированных курсов химиотерапии, что позволяет использовать НАХТ и при более ранних стадиях [12]. Что касается значимости НАХТ для увеличения безметастатической и общей выживаемости, в проведенном метаанализе 15 рандомизированных контролируемых исследований продемонстрировано снижение относительного риска смерти на 13 % (ОР 0,87; 95 % ДИ 0,78–0,96, р=0,007), что представляет собой абсолютное улучшение выживаемости на 5 % в течение 5 лет (от 40 до 45 %) для пациентов с резектабельным НМРЛ IB–IIIA стадии, независимо от режима химиотерапии (в большинстве на основе препаратов платины). В этом же исследовании было установлено, что безрецидивная выживаемость (ОР 0,85; 95 % ДИ 0,76–0,94, р=0,002) и общая выживаемость (ОР 0,69; 95 % ДИ 0,58–0,82, р<0,0001) были улучшены за счет предоперационной химиотерапии [13].
Неоадъювантная химиотерапия (НАХТ) показала преимущество в выживаемости, хотя доказательств этому гораздо меньше, чем в случае адъювантной химиотерапии. Lim et al. [14] опубликовали метаанализ для косвенного сравнения влияния предоперационной и послеоперационной химиотерапии у пациентов с операбельным раком легкого. Они включили 32 исследования (22 с послеоперационной и 10 с пери- или предоперационной химиотерапией), в которые были включены пациенты с НМРЛ IA–IV стадии. Результаты показали отсутствие различий в общей выживаемости и выживаемости, свободной от болезни.
Ранее мы обнаружили, что пациентов с НМРЛ возможно разделить на группы с высоким и низким риском развития гематогенных метастазов (ГМ) на основе оценки морфологических изменений в эпителии бронхов мелкого калибра, расположенных на расстоянии 3–5 см от первичной опухоли [15].
Представляет интерес анализ эффективности предоперационной терапии с нескольких позиций. Во-первых, какова эффективность комбинации НАХТ и интраоперационной лучевой терапии? Во-вторых, какова значимость клинических и морфологических характеристик НМРЛ для достижения положительного эффекта предоперационной терапии? И, наконец, зависит ли эффективность предоперационной терапии НМРЛ от принадлежности пациентов к разным группам риска развития гематогенных метастазов. Данное исследование посвящено решению этих задач.
Материал и методы исследования
Дизайн исследования представлен на рис. 1.
В исследование был включен 171 больной НМРЛ (Т1–4N0–3M0). Гистологический диагноз рака легкого был поставлен в соответствии с классификацией аденокарциномы легкого IASLC/ ATS/ERS [16] и критериями ВОЗ [17] и был подтвержден иммуногистохимическим исследованием с использованием панели антител: TTf-1 (clone 8G7G3/1, Dako), Napsin А (Rabbit Polyclonal), p63 (Rabbit Polyclonal, Leica), СК7 (clone OV-TL 12/30, Dako), СЕА (clone AMT28, Dako) and СК20 (clone Ks 20.08, Dako). Срок наблюдения за пациентами составил 10 лет либо меньше, если пациент погиб.
Распространенность опухолевого процесса определяли согласно международной классификации по системе TNM [18]. Клиникоморфологические параметры пациентов с НМРЛ в зависимости от наличия или отсутствия гематогенных метастазов представлены в табл. 1.
В предоперационном периоде 52,6 % больных (90/171) получали НАХТ по схеме: паклитаксел 175 мг/м2 внутривенно 1 день/карбоплатин AUC 6 внутривенно 1 день. Проводилось 2–3 курса с интервалом в 3 нед. Во время проведения радикальной операции 41,1 % (37/90) пациентов однократно получали ИОЛТ в дозе 10–15 Гр.
В послеоперационном периоде 47,4 % (81/171) пациентов получили АХТ препаратами платины: 37,0 % (30/81) – винорелбин/карбоплатин, 32,1 % (26/81) – паклитаксел/карбоплатин, 23,5 % (19/81) – гемцитабин/карбоплатин, 4,9 % (4/81) – иринотекан/карбоплатин, 2,5 % (2/81) – этопозид/ цисплатин.
Для оценки варианта изменений бронхиального эпителия при НМРЛ исследовали фрагменты ткани удаленного легкого с бронхом мелкого калибра (d=0,5–2 мм), взятого на расстоянии 3–5 см от опухоли. Ткани опухоли фиксировали в 10 % нейтральном формалине в течение 24 ч, промывали смесью изопропанола и заливали в парафин. Срезы толщиной 5–6 мкм окрашивали гематоксилином и эозином. Морфологический анализ проводили на световом микроскопе Axio Scope A1 (Carl Zeiss). Выявление базальноклеточной гиперплазии (БКГ), плоскоклеточной метаплазии (ПМ) и дисплазии (Д) в бронхиальном эпителии (рис. 2) проводили с использованием стандартных рекомендаций.
Все анализы проводились с использованием Prizm 9 (GraphPad, США). Различия между группами пациентов оценивали с помощью t-критерия Стьюдента, скорректированного критерия χ2 Йейтса и точного критерия Фишера. Метод
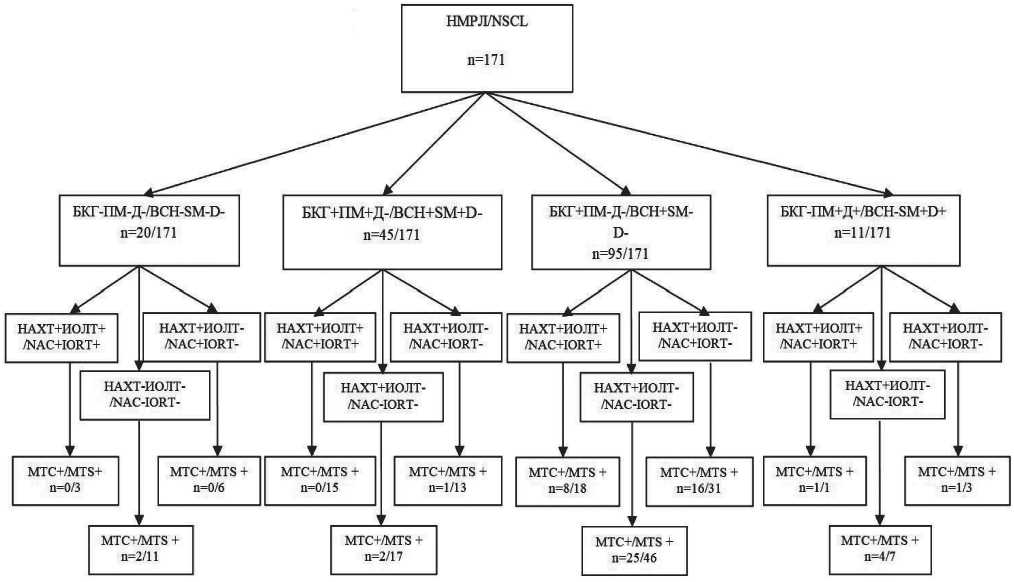
Рис. 1. Дизайн исследования. Примечание: БКГ – базальноклеточная гиперплазия; Д – дисплазия; ИОЛТ – интраоперационная лучевая терапия; НАХТ – неоадъювантная химиотерапия; НМРЛ – немелкоклеточная карцинома легкого; МТС – метастазы; ПМ – плоскоклеточная метаплазия
Fig. 1. Study design. Note: BCH – basal cell hyperplasia; D – dysplasia; IORТ – intraoperative radiation therapy; NAC – neoadjuvant chemotherapy; NSCLC – non small cell lung cancer; МТS – metastasis; SМ – squamous cell metaplasia
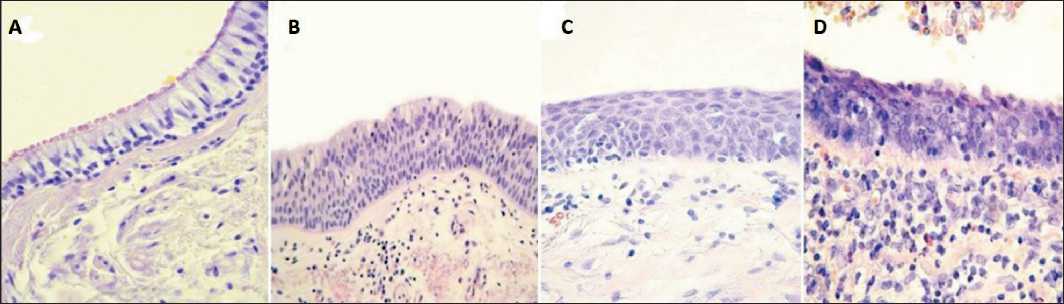
Рис. 2. Различные типы изменений бронхиального эпителия: А – нормальный бронхиальный эпителий; B – базальноклеточная гиперплазия; C – плоскоклеточная метаплазия; D –дисплазия III степени. Окраска гематоксилином и эозином, ×200 Fig. 2. Normal bronchial epithelium and premalignant lesions: А – normal bronchial epithelium; B – basal cell hyperplasia;
C – squamous cell metaplasia. D – dysplasia grade III. Hematoxylin-eosin staining, ×200
Каплана–Мейера был использован для построения кривых выживаемости и расчета общей выживаемости и выживаемости без метастазов. Для проверки различий в выживаемости использовали логарифмический ранговый критерий. Модель пропорциональных рисков Кокса использовалась для выявления факторов риска, связанных с выживаемостью. Результаты считались статистически значимыми при p<0,05.
Результаты
Сопоставление вариантов морфологических изменений бронхов мелкого калибра, смежных с опухолью, с частотой развития гематогенных метастазов позволило выделить группы высокого и низкого риска. По результатам проведенного исследования гематогенные метастазы НМРЛ были выявлены в 35,1 % (60/171) случаев. При плоскоклеточном раке они возникли у 39,4 % (41/104), а при аденокарциноме легкого – у 28,3 % (19/67); р=0,13) больных. Как при плоскоклеточном раке, так и при аденокарциноме легкого чаще всего гематогенные метастазы наблюдались тогда, когда в бронхах мелкого калибра определялась «изолированная» базальноклеточная гиперплазия (БКГ+ПМ-Д-), – 51,6 % (49/95). При других вариантах морфологических изменений бронхиального эпителия гематогенные метастазы отмечались
Таблица 1/table 1
|
Параметр/Parameter |
Число пациентов/Number of patients (n=171) |
|
Пол/Gender |
|
|
Муж/Males |
143 (83,6 %) |
|
Жен/Females |
28 (16,4 %) |
|
Возраст, лет/Age, years |
57,8±6,3 |
|
Курение/Smoking |
|
|
Да/Yes |
128 (74,9 %) |
|
Нет/No |
43 (25,1 %) |
|
Гистологический тип опухоли/Histology |
|
|
Плоскоклеточный рак/Squamous cell carcer |
107 (62,6 %) |
|
Аденокарцинома/Adenocarcinoma |
64 (37,4 %) |
|
Стадия/Stage |
|
|
IB |
14 (8,2 %) |
|
IIА |
9 (5,3 %) |
|
IIB |
34 (19,9 %) |
|
IIIА |
84 (49,1 %) |
|
IIIB |
30 (17,5 %) |
Размер опухоли/Tumor size
|
Т1–2 |
51 (29,8 %) |
|
Т3–4 |
120 (70,2 %) |
|
Степень злокачественности/Grade of malignancy |
|
|
G1 |
10 (5,9 %) |
|
G2 |
104 (60,8 %) |
|
G3 |
57 (33,3 %) |
|
Синхронные лимфогенные метастазы/Lymphatic metastases |
|
|
Да/Yes |
82 (48,0 %) |
|
Нет/No |
89 (52,0 %) |
|
Рецидив/ Relapse |
|
|
Да/Yes |
23 (13,5 %) |
|
Нет/No |
148 (86,5 %) |
|
НАХТ/NAC |
|
|
Да/Yes |
90 (52,6 %) |
|
Нет/No |
81 (47,4 %) |
|
Эффект НАХТ/NAC effect |
|
|
Частичная регрессия/Partial Regression |
34/90 (37,8 %) |
|
Стабилизация/Stabilization |
56/90 (62,2 %) |
|
ИОЛТ/IORT |
|
|
Да/Yes |
37 (21,6 %) |
|
Нет/No |
134 (78,4 %) |
Таблица 2/table 2
Клинико-патологические параметры больных НМРЛ
Clinical and pathological parameters of patients NsClC
Частота развития гематогенных метастазов в зависимости от варианта лечения Frequency of distant metastases depending on treatment options
При плоскоклеточном раке легкого гематогенные метастазы диагностировались в 78,1 % (32/41) случаев у больных группы с «изолированной» базальноклеточной гиперплазией (БКГ+ПМ-Д). У пациентов групп БКГ+ПМ+Д- и БКГ-ПМ-Д- в эпителии бронхов мелкого калибра отдаленные метастазы были выявлены в 7,3 % (3/41) случаев, (р=0,0000 по отношению к группе БКГ+ПМ-Д-). В группе больных с дисплазией, сочетающейся с плоскоклеточной метаплазией (БКГ-ПМ+Д+), гематогенные метастазы были диагностированы в 14,6 % (6/41) случаев.
Гематогенные метастазы аденокарциномы легкого также чаще всего наблюдались у больных с «изолированной» базальноклеточной гиперплазией бронхиального эпителия (БКГ+ПМ-Д-) в бронхах мелкого калибра – 89,5 % (17/19) случаев. При других вариантах морфологических изменений в бронхах мелкого калибра ‒ БКГ+ПМ+Д- и БКГ-ПМ-Д- – гематогенные метастазы возникли в 10,5 % ((2/19); р=0,0000 по отношению к группе БКГ+ПМ-Д-) случаев.
Эффективность пред/интраоперационной терапии в профилактике гематогенных метастазов НМРЛ
Результаты исследования показали профилактический эффект дооперационной терапии. Частоту возникновения гематогенных метастазов оценивали через 2 года, 5 и 10 лет наблюдения. В течение двух лет наблюдения гематогенные метастазы значимо реже наблюдались в группах пациентов, получивших комбинированную тера- пию (НАХТ+ИОЛТ+) или только химиотерапию (НАХТ+ИОЛТ-). У пациентов, не получивших дооперационного лечения, гематогенные метастазы регистрировались уже в течение первых двух лет. Преимущество комбинированной терапии отмечалось и в течение пяти лет наблюдения: на уровне тенденции гематогенные метастазы встречались реже (13,5 %), чем в группах сравнения (26,4 и 29,6 %). Эффект терапии нивелировался через десять лет наблюдения (табл. 2).
Для оценки зависимости эффекта терапии от принадлежности пациентов к группам высокого и низкого риска метастазирования были сформированы группы наблюдения в зависимости от изменений бронхиального эпителия в мелких бронхах и от вида предоперационной терапии (табл. 3).
Через два года после лечения ГМ возникли у 7,6 % (13/171) больных НМРЛ. Чаще всего они были диагностированы у пациентов из группы с высоким риском прогрессирования (БКГ+ПМ-Д-). В группе БКГ+ПМ-Д- отдаленные метастазы возникли только у тех больных, которым не проводилась пред- и интраоперационная терапия (21,3 % (10/47). Однако у пациентов этой группы с высоким риском метастазирования, получивших либо неоадъювантную химиотерапию, либо сочетанную терапию, гематогенные метастазы отсутствовали (0 % (0/30) и 0 % (0/18) соответственно) (табл. 3). В группах низкого риска гематогенного метастазирования при сочетании базальноклеточной гиперплазии и плоскоклеточной метаплазии (БКГ+ПМ+Д-) обнаружен один случай (2,2 %) гематогенного метастазирования, причем когда какой-либо терапии не проводилось (5,9 % (1/17)). У пациентов с нормальным эпителием в бронхах
Таблица 3/table 3
Частота развития гематогенных метастазов НМРЛ через 2 года, 5 и 10 лет в зависимости от вида терапии и вариантов морфологических изменений the frequency of development of hematogenous metastases of NsClC after 2 years, 5 years and 10 years
|
Метод лечения/Type of therapy |
Морфологические изменения/Morphological changes 2 года/2 years |
Р / |
|||
|
БКГ+ПМ-Д-/ BCH+SM-D- |
БКГ+ПМ+Д-/ BCH+SM+D- |
БКГ-ПМ+Д+/ BCH-SM+D+ |
БКГ-ПМ-Д-/ BCH-SM-D- |
р type of treatment |
|
|
НАХТ+ИОЛТ+/NAC+IORT+ |
0/18 |
0/15 |
0/1 |
0/3 |
p=1,0000 |
|
НАХТ+ИОЛТ-/NAC+IORT- |
0/30 |
0/13 |
1/3 |
0/6 |
p=0,1085 |
|
НАХТ-ИОЛТ-/NAC-IORT- |
10/47 |
1/17 |
1/7 |
0/11 |
p=0,2045 |
|
p=0,0033 |
p=0,4307 |
p=0,6850 |
p=1,0000 |
||
|
5 лет/5 |
years |
||||
|
НАХТ+ИОЛТ+/NAC+IORT+ |
7/18 |
0/15 |
0/1 |
0/3 |
p=0,0278 |
|
НАХТ+ИОЛТ-/NAC+IORT- |
12/30 |
0/13 |
1/3 |
0/6 |
p=0,0181 |
|
НАХТ-ИОЛТ-/NAC-IORT- |
22/47 |
1/17 |
1/7 |
0/11 |
p=0,0007 |
|
p=0,7745 |
p=0,4307 |
p=0,6850 |
p=1,0000 |
||
|
10 лет/10 years |
|||||
|
НАХТ+ИОЛТ+/NAC+IORT+ |
9/18 |
0/15 |
0/1 |
0/3 |
p=0,0057 |
|
НАХТ+ИОЛТ-/NAC+IORT- |
16/30 |
1/13 |
1/3 |
0/6 |
p=0,0074 |
|
НАХТ-ИОЛТ-/NAC-IORT- |
24/47 |
2/17 |
5/7 |
2/11 |
p=0,0044 |
|
p тип изменений p type of changes |
p=0,9704 |
p=0,4058 |
p=0,2795 |
p=0,4028 |
|
(БКГ-ПМ-Д-) гематогенные метастазы НМРЛ не наблюдались независимо от варианта терапии или ее отсутствия (табл. 3).
Через пять лет наблюдения ГМ возникли у 25,6 % (44/171) больных НМРЛ. В группе БКГ+ПМ-Д- отдаленные метастазы регистрировались в 46,8 % (22/47) случаев у тех больных, которым не проводилась пред- и интраоперационная терапия, у 40,0 % (12/30) больных, получивших только неоадъювантную химиотерапию, и у 38,8 % (7/18) – сочетанное лечение (табл. 3). В группе с дисплазией бронхиального эпителия в мелких смежных бронхах (БКГ-ПМ+Д+) появление гематогенных метастазов существенно не зависело от варианта терапии или ее отсутствия (табл. 3). В группах низкого риска при увеличении срока наблюдения до 5 лет новых случаев развития гематогенных метастазов обнаружено не было (табл. 3).
Через десять лет наблюдения гематогенные метастазы были выявлены уже у 35,1 % (60/171) больных НМРЛ. В группе БКГ+ПМ-Д- они возникали независимо от того, получали больные пред- и интраоперационную терапию или нет (НАХТ+ИОЛТ+ – 50,0 % (9/18) и НАХТ+ИОЛТ- – 53,3 % (16/30), НАХТ-ИОЛТ- – 51,1 % (24/47), р=0,9704) (табл. 3). Аналогичная картина наблюдалась и в группе БКГ-ПМ+Д+ (р=0,2795) (табл. 3). В группе пациентов с низким риском гематогенного метастазирования (БКГ+ПМ+Д-) метастазы наблюдались только в 7,7 % (1/13) случаев, когда проводилась НАХТ без ИОЛТ, и в 11,7 % (2/17) – когда терапия не проводилась (НАХТ-ИОЛТ-). Через 10 лет в группе БКГ-ПМ-Д- отдаленные метастазы развились у 18,2 % (2/11) больных, которым терапию не проводили (НАХТ-ИОЛТ-). Следует подчеркнуть, что в группах пациентов с низким риском гематогенного метастазирования (БКГ+ПМ+Д- и БКГ-ПМ-Д-) при
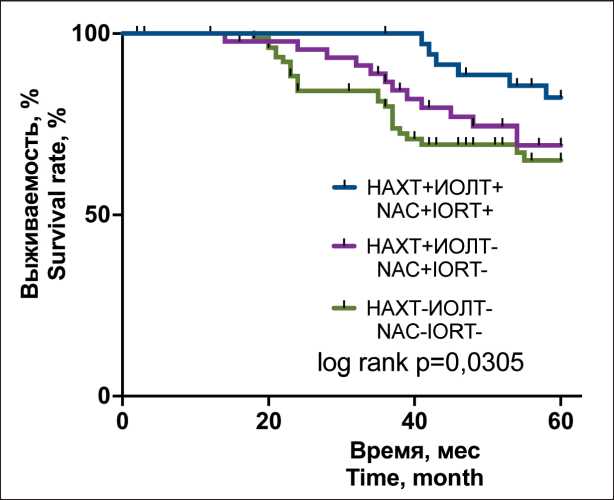
Рис. 3. Безметастатическая пятилетняя выживаемость больных НМРЛ в зависимости от варианта терапии Fig. 3. Five-year metastatic-free survival depending on the characteristics of the treatment of patients with NSCLC проведении комбинированной предоперационной терапии через 10 лет гематогенные метастазы по-прежнему отсутствовали (табл. 3).
Таким образом, в группе низкого риска гематогенные метастазы возникают достоверно реже в течение 5 и 10 лет независимо от варианта пред/ интраоперационного лечения или его отсутствия. При этом оба варианта лечения (НАХТ+ИОЛТ+ и НАХТ+ИОЛТ-) эффективно уменьшают частоту появления гематогенных метастазов в группе высокого риска в течение первых 2 лет наблюдения по сравнению с группой, в которой терапии не было. Через 5 и 10 лет оба варианта терапии были не эффективны в предотвращении возникновения гематогенных метастазов в группе высокого риска метастазирования.
Оценка 5-летней безметастатической выживаемости подтверждает полезность НАХТ в комбинации с ИОЛТ или только НАХТ для увеличения длительности безметастатического периода по сравнению с группой, в которой лечение не проводилось (рис. 3).
Медиана пятилетней безметастатической выживаемости ни в одной группе не была достигнута. Лучшие показатели пятилетней безме-тастатической выживаемости (процент пациентов, не имеющих гематогенных метастазов на момент окончания наблюдения) были в группе больных, получавших комбинированную терапию (82,3 %), по сравнению с группами пациентов, получавших только НАХТ (69,2 %) или не получавших терапию (65,1 %) (р=0,0305).
Оценка значимости факторов прогноза общей выживаемости при НМРЛ
Однофакторный анализ показал связь более короткой общей выживаемости пациентов с наличием гематогенных метастазов ((ОР(95 %ДИ) 3,60 (2,30–5,64), р=0,0000), отсутствием предоперационной НАХТ в комбинации с ИОЛТ (ОР(95 %ДИ) 2,75 (1,42–5,33), р=0,0024), стадией IIIА (ОР(95 %ДИ) 1,79 (1,01–5,04), р=0,0280), обнаружения в респираторном эпителии бронхов, смежных с опухолью, изолированной базальноклеточной гиперплазии (ОР(95 %ДИ) 2,48 (1,01–6,14), р=0,0008). Причем предиктивная значимость комбинированной терапии в прогнозе лучшей общей выживаемости подтвердилась и в многофакторном анализе (табл. 4).
Графики выживаемости, построенные по методу Каплан–Майера, подтверждают связь указанных выше факторов прогноза с продолжительностью жизни пациентов с НМРЛ (рис. 4). Медиана общей выживаемости пациентов группы высокого риска не зависит от варианта терапии (НАХТ+ИОЛТ+ – 72 мес, НАХТ+ИОЛТ- – 65 мес и НАХТ-ИОЛТ- – 60 мес). Оценка влияния вида терапии или ее отсутствия на длительность общей выживаемости в группе низкого риска
Таблица 4/table 4
Однофакторный и многофакторный Кокс-регрессионный анализ связи клинических и патологических параметров с общей выживаемостью больных НМРЛ
univariate and multivariate Cox regression analysis of the relationship of clinical and pathological parameters with overall survival of patients with NsClC
|
Признак/Feature |
Значение/Meaning |
Общая выживаемость/Overall survival |
|||
|
Однофакторный/Univariate |
Многофакторный/Multifactorial |
||||
|
ОР/Hazard ratio (95 % ДИ/CI) |
р1 |
ОР/Hazard ratio (95 % ДИ/CI) |
р2 |
||
|
Риск гематогенного метастазирования/ Risk for distant metastasis |
Низкий/Low |
Ref |
Ref |
||
|
Высокий/High |
2,02 (1,24–3,29) |
0,0043 |
1,06 (0,75–1,32) |
0,1156 |
|
|
Тип изменений в бронхах/ Type of bronchial changes |
БКГ-ПМ-Д-/BCH-SM-D- |
Ref |
Ref |
||
|
БКГ+ПМ-Д-/BCH+SM-D- |
2,48 (1,01–6,14) |
0,0008 |
2,88 (0,90–9,17) |
0,0636 |
|
|
БКГ+ПМ+Д-/BCH+SM+D- |
1,79 (0,70–4,56) |
0,7740 |
3,92 (0,93–12,01) |
0,1488 |
|
|
БКГ-ПМ+Д+/BCH-SM+D+ |
2,41 (0,81–7,19) |
0,4594 |
1,94 (0,56–5,30) |
0,7371 |
|
|
Гистотип/Histotype |
Плоскоклеточный рак/ Squamous cell cancer |
Ref |
Ref |
||
|
Аденокарцинома/ Adenocarcinoma |
1,19 (0,75–1,89) |
0,4571 |
1,22 (0,70–2,12) |
0,4813 |
|
|
Рецидивы/Relapse |
Нет/No |
Ref |
Ref |
||
|
Да/Yes |
1,08 (0,58–2,00) |
0,7949 |
1,90 (0,77–4,65) |
0,1571 |
|
|
Гематогенные метастазы/ |
Нет/No |
Ref |
Ref |
||
|
Distant metastases |
Да/Yes |
3,60 (2,30–5,64) |
0,0000 |
3,79 (1,99–7,27) |
0,0001 |
|
Метод лечения/ Type of treatment |
НАХТ+ИОЛТ+/NAC+IORT+ |
Ref |
Ref |
||
|
НАХТ+ИОЛТ-/NAC+IORT- |
1,83 (0,89–3,74) |
0,7087 |
1,99 (0,92–4,20) |
0,6229 |
|
|
НАХТ-ИОЛТ-/NAC-IORT- |
2,75 (1,42–5,33) |
0,0024 |
3,23 (1,48–7,04) |
0,0019 |
|
|
Пол/Gender |
Муж/Male |
Ref |
Ref |
||
|
Жен/Female |
0,47 (0,21–1,02) |
0,0586 |
0,72 (0,28–1,79) |
0,4810 |
|
|
Размер опухоли/ |
Т1–2 |
Ref |
Ref |
||
|
Tumor size |
Т3–4 |
1,80 (0,67–2,23) |
0,5091 |
1,39 (0,51–3,69) |
0,3631 |
|
IB |
Ref |
Ref |
|||
|
IIА |
1,14 (0,22–5,75) |
0,7093 |
0,83 (0,12–5,68) |
0,6352 |
|
|
Стадия/Stage |
IIB |
0,84 (0,25–2,72) |
0,5516 |
1,25 (0,37–4,19) |
0,4661 |
|
IIIА |
1,79 (1,01–5,04) |
0,0280 |
1,86 (0,60–5,70) |
0,2159 |
|
|
IIIB |
0,87 (0,27–2,79) |
0,6327 |
0,74 (0,21–2,54) |
0,3276 |
|
|
Синхронные лимфогенные метастазы/ Lymphatic metastases |
Нет/No |
Ref |
Ref |
||
|
Да/Yes |
1,53 (0,98–2,36) |
0,0564 |
0,67 (0,36–1,26) |
0,2200 |
|
|
АХТ/ACT |
Нет/No |
Ref |
Ref |
||
|
Да/Yes |
1,14 (0,74–1,77) |
0,5361 |
0,77 (0,43–1,38) |
0,3931 |
|
|
Статус курения/ |
Курит/Smoking |
Ref |
Ref |
||
|
Smoking status |
Не курит/Non-smoking |
1,62 (0,94–2,78) |
0,0765 |
0,75 (0,43–1,31) |
0,3172 |
|
Степень |
1–2 |
Ref |
Ref |
||
|
злокачественности/ Grade of malignancy |
3 |
1,21 (0,75–1,94) |
0,3397 |
0,37 (0,09–1,42) |
0,1295 |
Примечание: р1 – достоверность параметра в однофакторном анализе; р2 – достоверность параметра в многофакторном анализе.
Note: p1 – significance of the parameter in univariate analysis, p2 – significance of the parameter in multivariate analysis.
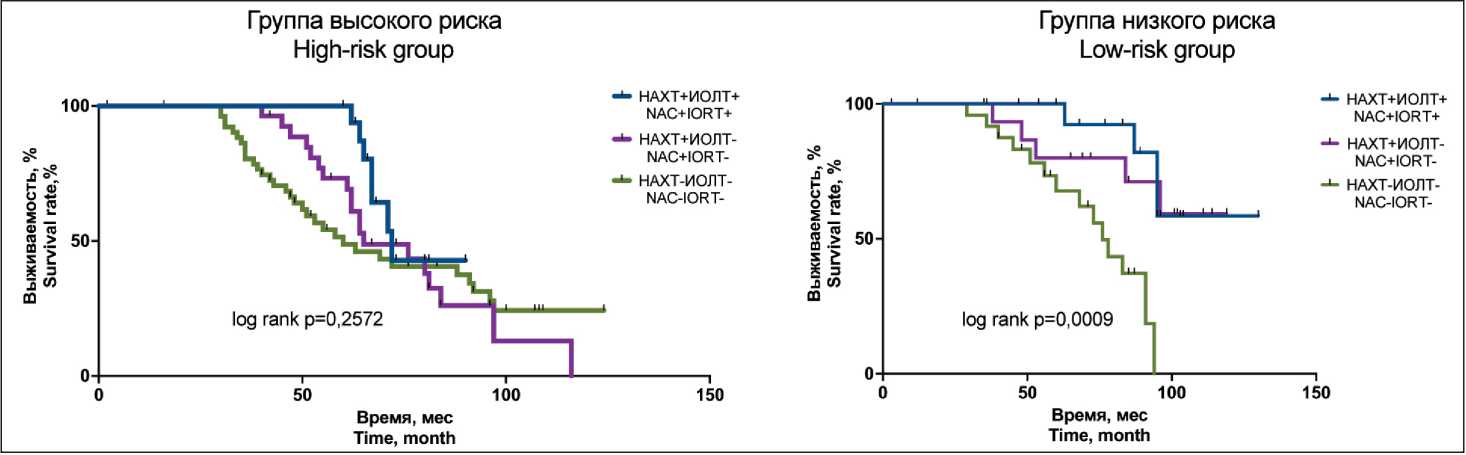
Рис. 4. Общая выживаемость в группах больных НМРЛ с высоким и низким риском гематогенного метастазирования в зависимости от варианта терапии
Fig.4. Overall survival curves in groups of NSCLC patients with high and low risk of hematogenous metastasis, depending on the treatment option
подчеркивает значимость предоперационной терапии и особенно сочетания НАХТ и ИОЛТ. Медиана выживаемости в группах НАХТ+ИОЛТ+ и НАХТ+ИОЛТ- не была достигнута, а процент выживших на конец периода наблюдения составлял 58 и 59 % соответственно. В группе пациентов, не получавших терапии (НАХТ-ИОЛТ-), медиана общей выживаемости составляла 76 мес.
Эффективность адъювантной терапии в профилактике гематогенного метастазирования НМРЛ
Частота развития гематогенных метастазов НМРЛ не зависела от того, проводилась больным АХТ или нет, а в случаях ее проведения и от варианта терапии (рис. 5).
АХТ проводилась у 51,7 % (31/60) больных c гематогенными метастазами НМРЛ. В группе низкого риска метастазирования (БКГ-ПМ-Д-) АХТ проводилась в 45,0 % (9/20) случаев. ГМ возникли у 2/20 (10,0 %) больных, в одном из случаев проводилась АХТ, в другом – нет (рис. 5). В другой группе с низким риском развития гематогенных метастазов (БКГ+ПМ+Д-) АХТ проводили в 44,4 % (20/45) случаев. Отдаленные метастазы были обнаружены всего у 6,7 % (3/45) пациентов (в одном случае АХТ не проводилась, и в двух она была проведена) (рис. 5).
В группе высокого риска развития гематогенных метастазов (БКГ+ПМ-Д-) АХТ проводилась у 51,6 % (49/95) больных. Отдаленные метастазы развились в 43,8 % (21/48) случаев, когда больным проводилась адъювантная химиотерапия, и в 59,5 % (28/47) – когда последней не было (рис. 5). Пациентам другой группы с высоким риском развития гематогенных метастазов (БКГ-ПМ+Д+) адъювантную химиотерапию провели в 45,5 % (5/11) случаев. Из них гематогенные метастазы развились в 40 % (2/5) случаев. У больных, которым АХТ не проводили, ГМ возникли у 66,7 % (4/6) человек. Очевидно, что независимо от принадлежности пациентов с НМРЛ к разным группам риска, выделенным по морфологическим изменениям респираторного эпителия в мелких бронхах, смежных с опухолью, адъювантная химиотерапия существенно не влияла на частоту развития гематогенных метастазов.
Обсуждение
Оценка эффективности предоперационной терапии для профилактики гематогенного метастазирования, с одной стороны, показала целесообраз-
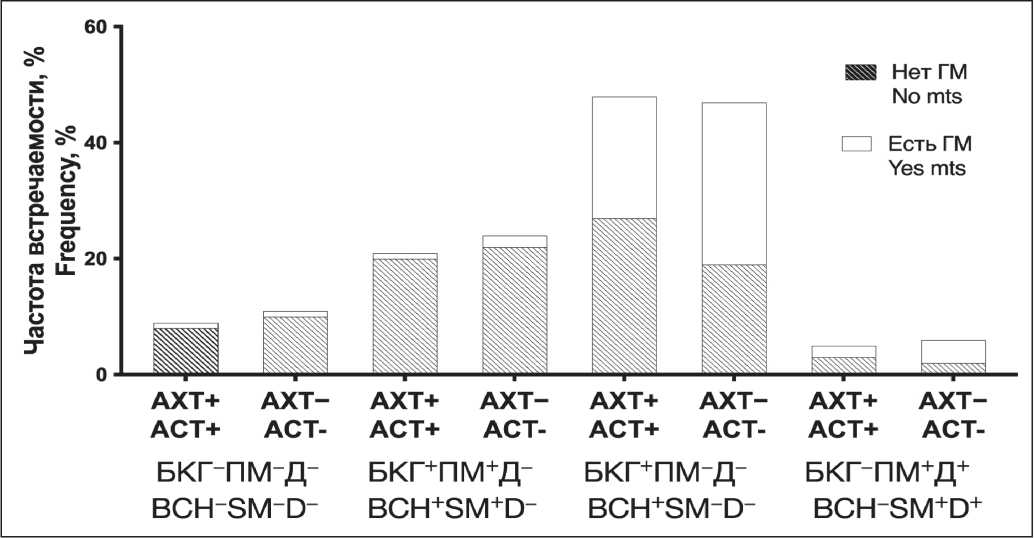
Рис. 5. Частота гематогенного метастазирования в зависимости от варианта изменений эпителия бронхов и адъювантной химиотерапии
Fig. 5. Тhe frequency of hematogenous metastasis depending on the variant of changes in the bronchial epithelium and adjuvant chemotherapy
ность использования сочетания НАХТ и ИОЛТ при НМРЛ, с другой – большое значение стратификации пациентов на группы низкого и высокого риска гематогенного метастазирования. Ограниченная ценность прогностического значения величины первичной опухоли и грэйда демонстрируется тем, что эти параметры не оказались среди факторов, связанных с общей выживаемостью. Результаты работы показали, что характер морфологических изменений респираторного эпителия в мелких бронхах, смежных с первичной опухолью, имеет более значимое и самостоятельное значение.
Профилактический эффект предоперационной и/или интраоперационной лучевой терапии зависел как от ее варианта, так и от принадлежности пациентов к группам низкого и высокого риска гематогенного метастазирования. Особенно отчетлива такая зависимость через 2 года после операции, хотя и через 5 лет она тоже прослеживается. Прежде всего, результаты показывают, что комбинация химио- и радиационной терапии эффективнее, чем одна химиотерапия, и что любой из этих вариантов терапии имеет преимущество в сравнении с группой, в которой терапия не проводилась.
Обращает внимание высокое прогностическое значение отсутствия каких-либо морфологических изменений в эпителии бронхов. Любой вариант примененной предоперационной терапии предотвращал развитие метастазов в этой группе, и только при отсутствии терапии они возникали у части больных через 5 лет наблюдения. Отсутствие морфологических изменений респираторного эпителия в обсуждаемой группе, по-видимому, является не только следствием меньшей выраженности воспаления в бронхах. Можно предположить, что в этой конститутивно обособленной группе пациентов воспаление, вызываемое патогенами, не склонно к хронизации и завершается при элиминации возбудителя. Параллельно с этим в эпителии завершаются проявления регенераторной гиперплазии респираторного эпителия и не складываются условия для его плоскоклеточной метаплазии и/ или дисплазии.
Важен результат оценки эффективности адъювантной терапии. Оказалось, что независимо от групп риска, определяемых по характеру морфологических изменений в эпителии мелких бронхов, назначение адъювантной терапии не вызвало уменьшения частоты возникновения гематогенных метастазов. То есть использованные варианты адъювантной терапии существенно не влияли на диссеминированные и «дремлющие» опухолевые клетки в местах будущих метастазов, как и на формирование метастатических ниш – микроокружения этих опухолевых клеток.
Отсутствие связи эффективности адъювантной терапии с принадлежностью к группам риска гематогенного метастазирования является дополнительным аргументом для обсуждения механизмов различия эффектов предоперационной терапии в группах низкого и высокого риска. Очевидно, что эффективность предоперационной терапии связана с воздействием на первичную опухоль. Причем правомочна гипотеза, что имеет значение не только непосредственное повреждающее действие на опухолевые клетки, но и влияние на микроокружение и в целом на паренхиматозно-стромальные отношения. От микроокружения, как известно, зависят инвазив-ность и способность клеток к интравазации – первому звену метастатического процесса. Подобный взгляд позволяет объяснить вероятность наличия сложной цепи причинно-следственных отношений между эпителиально-мезенхимальными отношениями в мелких бронхах, расположенных вблизи опухоли, и риском гематогенного метастазирования НМРЛ.
Таким образом, выделение групп риска гематогенного метастазирования НМРЛ на основе оценки вариантов морфологических изменений в эпителии мелких бронхов, расположенных вблизи опухоли, позволяет прогнозировать общую выживаемость пациентов, а также оптимизировать терапию НМРЛ. Неоадъювантная химиотерапия, сочетанная с интраоперационным облучением, увеличивает общую выживаемость при НМРЛ в группе высокого риска. Проведение персонализированного пред- интраоперационного комбинированного химиолучевого лечения в группах пациентов с высоким риском развития гематогенных метастазов НМРЛ позволит эффективно проводить профилактику их развития. В то же время правомочно рассмотрение вопроса о необходимости оптимизации неоадъювантной и адъювантной терапии в группах с высоким риском для предотвращения метастазирования через 5 и 10 лет, а у пациентов с низким риском более взвешенно определять показания для периоперационной химиотерапии. Важный результат исследования – обнаруженные закономерности характерны как для плоскоклеточного рака, так и для аденокарциномы легких.
Заключение
Проведенное исследование подтверждает известный в онкологии феномен высокой степени независимости собственно опухолевой и метастатической болезни. Действительно, при одной и той же нозологической форме – НМРЛ – наблюдается разделение на группы высокого и крайне низкого риска развития гематогенных метастазов. Для понимания сущности различий этих групп риска представляется наиболее перспективным изучение конститутивных особенностей иммуновоспали-тельных реакций, определяющих про- или про-тивометастатические эффекты микроокружения опухоли. Предстоит изучение фундаментальных механизмов, лежащих в основе разного течения опухолевой болезни и ассоциированных с характе- ром морфологических изменений в респираторном эпителии мелких бронхов, смежных с первичной опухолью. Независимо от степени понимания механизмов, лежащих в основе различий групп высокого и низкого риска метастазирования, возможны,
Список литературы Эффективность предоперационной терапии в группах с высоким и низким риском гематогенного метастазирования при плоскоклеточном раке и аденокарциноме легкого
- Uprety D., Mandrekar S.J., Wigle D., Roden A.C., Adjei A.A. Neoadjuvant Immunotherapy for NSCLC: Current Concepts and Future Approaches. J Thorac Oncol. 2020; 15(8): 1281-97. https://doi.org/10.1016/j.jtho.2020.05.020.
- SEER*Explorer: An interactive website for SEER cancer statistics [Internet]. Surveillance Research Program, National Cancer Institute. URL: https://seer.cancer.gov/explorer. [Cited 2021 Sep 27].
- Goldstraw P., Crowley J., Chansky K., Giroux D.J., Groome P.A., Rami-Porta R., Postmus P.E., Rusch V., Sobin L.; International Association for the Study of Lung Cancer International Staging Committee; Participating Institutions. The IASLC Lung Cancer Staging Project: proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM Classifcation of malignant tumours. J Thorac Oncol. 2007; 2(8): 706-14. https://doi.org/10.1097/JTO.0b013e31812f3c1a. Erratum in: J Thorac Oncol. 2007; 2(10): 985.
- Le Chevalier T. Adjuvant chemotherapy for resectable non-smallcell lung cancer: where is it going? Ann Oncol. 2010; 21(7): 196-8. https://doi.org/10.1093/annonc/mdq376.
- Albain K.S., Swann R.S., Rusch V.W., Turrisi A.T., Shepherd F.A., Smith C., Chen Y., Livingston R.B., Feins R.H., Gandara D.R., Fry W.A., Darling G., Johnson D.H., Green M.R., Miller R.C., Ley J., Sause W.T., Cox J.D. Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. Lancet. 2009; 374(9687): 379-86. https://doi.org/10.1016/S0140-6736(09)60737-6.
- van Meerbeeck J.P., Kramer G.W., Van Schil P.E., Legrand C., Smit E.F., Schramel F., Tjan-Heijnen V.C., Biesma B., Debruyne C., van Zandwijk N., Splinter T.A., Giaccone G.; European Organisation for Research and Treatment of Cancer-Lung Cancer Group. Randomized controlled trial of resection versus radiotherapy after induction chemotherapy in stage IIIA-N2 non-small-cell lung cancer. J Natl Cancer Inst. 2007; 99(6): 442-50. https://doi.org/10.1093/jnci/djk093.
- Eberhardt W.E., Pöttgen C., Gauler T.C., Friedel G., Veit S., Heinrich V., Welter S., Budach W., Spengler W., Kimmich M., Fischer B., Schmidberger H., De Ruysscher D., Belka C., Cordes S., Hepp R., LütkeBrintrup D., Lehmann N., Schuler M., Jöckel K.H., Stamatis G., Stuschke M. Phase III Study of Surgery Versus Defnitive Concurrent Chemoradiotherapy Boost in Patients With Resectable Stage IIIA(N2) and Selected IIIB Non-Small-Cell Lung Cancer After Induction Chemotherapy and Concurrent Chemoradiotherapy (ESPATUE). J Clin Oncol. 2015; 33(35): 4194-201. https://doi.org/10.1200/JCO.2015.62.6812.
- Johnstone D.W., Byhardt R.W., Ettinger D., Scott C.B. Phase III study comparing chemotherapy and radiotherapy with preoperative chemotherapy and surgical resection in patients with non-small-cell lung cancer with spread to mediastinal lymph nodes (N2); fnal report of RTOG 89-01. Radiation Therapy Oncology Group. Int J Radiat Oncol Biol Phys. 2002; 54(2): 365-9. https://doi.org/10.1016/s0360-3016(02)02943-7.
- Ren Z., Zhou S., Liu Z., Xu S. Randomized controlled trials of induction treatment and surgery versus combined chemotherapy and radiotherapy in stages IIIA-N2 NSCLC: a systematic review and meta-analysis. J Thorac Dis. 2015; 7(8): 1414-22. https://doi.org/10.3978/j.issn.2072-1439.2015.08.14.
- Pöttgen C., Eberhardt W., Stamatis G., Stuschke M. Defnitive radiochemotherapy versus surgery within multimodality treatment in stage III non-small cell lung cancer (NSCLC) - a cumulative meta-analysis of the randomized evidence. Oncotarget. 2017; 8(25): 41670-8. https://doi.org/10.18632/ oncotarget.16471.
- Laktionov K.K., Artamonova E.V., Borisova T.N., Breder V.V., Bychkov Yu.M., Vladimirova L.Yu., Volkov N.M., Ergnyan S.M., Zhabina A.S., Kononets P.V., Kuz'minov A.E., Levchenko E.V., Malikhova O.A., Marinov D.T., Miller S.V., Moiseenko F.V., Mochal'nikova V.V., Novikov S.N., Pikin O.V., Reutova E.V., Rodionov E.O., Sakaeva D.D., Semenova A.I., Smolin A.V., Sotnikov V.M., Tuzikov S.A., Turkin I.N., Tyurin I.E., Chkhikvadze V.D., Kolbanov K.I., Chernichenko A.V., Fedenko A.A., Filonenko E.V., Nevol'skikh A.A., Ivanov S.A., Khailova Zh.V., Gevorkyan T.G., Butenko A.V., Gil'mutdinova I.R., Gridneva I.V., Eremushkin M.A., Zernova M.A., Kasparov B.S., Kovlen D.V., Kondrat'va K.O., Konchugova T.V., Korotkova S.B., Krutov A.A., Obukhova O.A., Ponomarenko G.N., Semiglazova T.Yu., Stepanova A.M., Tkachenko G.A., Khulamkhanova M.M. Zlokachestvennoe novoobrazovanie bronkhov i legkogo. Sovremennaya Onkologiya. 2021; 23(3): 369-402. https://doi.org/10.26442/18151434.2021.3.201048.
- Zheng Y., Jaklitsch M.T., Bueno R. Neoadjuvant Therapy in NonSmall Cell Lung Cancer. Surg Oncol Clin N Am. 2016; 25(3): 567-84. https://doi.org/10.1016/j.soc.2016.02.010.
- NSCLC Meta-analysis Collaborative Group. Preoperative chemotherapy for non-small-cell lung cancer: a systematic review and metaanalysis of individual participant data. Lancet. 2014; 383(9928): 1561-71. https://doi.org/10.1016/S0140-6736(13)62159-5.
- Lim E., Harris G., Patel A., Adachi I., Edmonds L., Song F. Preoperative versus postoperative chemotherapy in patients with resectable non-small cell lung cancer: systematic review and indirect comparison meta-analysis of randomized trials. J Thorac Oncol. 2009; 4(11): 1380-8. https://doi.org/10.1097/JTO.0b013e3181b9ecca.
- Pankova O.V., Tashireva L.A., Rodionov E.O., Miller S.V., Tuzikov S.A., Pismenny D.S., Gerashchenko T.S., Zavyalova M.V., Vtorushin S.V., Denisov E.V., Perelmuter V.M. Premalignant Changes in the Bronchial Epithelium Are Prognostic Factors of Distant Metastasis in Non-Small Cell Lung Cancer Patients. Front Oncol. 2021; 11: 771802. https://doi.org/10.3389/fonc.2021.771802.
- Travis W.D., Brambilla E., Noguchi M., Nicholson A.G., Geisinger K., Yatabe Y., Ishikawa Y., Wistuba I., Flieder D.B., Franklin W., Gazdar A., Hasleton P.S., Henderson D.W., Kerr K.M., Nakatani Y., Petersen I., Roggli V., Thunnissen E., Tsao M. Diagnosis of lung adenocarcinoma in resected specimens: implications of the 2011 International Association for the Study of Lung Cancer/American Thoracic Society/ European Respiratory Society classifcation. Arch Pathol Lab Med. 2013; 137(5): 685-705. https://doi.org/10.5858/arpa.2012-0264-RA.
- Nicholson A.G., Tsao M.S., Beasley M.B., Borczuk A.C., Brambilla E., Cooper W.A., Dacic S., Jain D., Kerr K.M., Lantuejoul S., Noguchi M., Papotti M., Rekhtman N., Scagliotti G., van Schil P., Sholl L., Yatabe Y., Yoshida A., Travis W.D. The 2021 WHO Classifcation of Lung Tumors: Impact of Advances Since 2015. J Thorac Oncol. 2022; 17(3): 362-87. https://doi.org/10.1016/j.jtho.2021.11.003.
- Sobin L.H., Gospodarowicz M.K., Wittekind C. TNM classifcation of malignant tumors [Internet]. New York: Wiley-Blackwell. URL: http://www.uicc.org/sites/main/fles/private/TNM_Classifcation_of_Malignant_Tumours_Website_15 MAy2011.pdf. [cited 2022 Jun 30].


