Эффективность применения коллагеновых мембран для реконструкции полнослойных дефектов гиалинового хряща в эксперименте
Автор: Лазишвили Г.Д., Егиазарян К.А., Никишин Д.В., Воронцов А.А., Храменкова И.В., Тен Г.С., Клинов Д.В.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 4 (46), 2021 года.
Бесплатный доступ
Статья посвящена анализу результатов экспериментального исследования - изучению эффективности применения коллагеновых мембран при хирургическом лечении полнослойных дефектов гиалинового хряща. Цель исследования - изучить биологический потенциал коллагеновых мембран и их способность к трансформации в хрящевую ткань. Исследование проводилось на 4-х свиньях. На суставах правых задних конечностей формировался полнослойный дефект хряща и имплантировалась коллагеновая мембрана Ortokeep. На суставах левых задних конечностей формировались по 2 полнослойных дефекта хряща. На один дефект имплантировалась коллагеновая мембрана Chondro-Gide, на 2-й дефект мембрана не имплантировалась. Животные выводились из эксперимента в сроки 2,3,4,6 месяцев после операции. В статье представлены макроскопический и микроскопический анализ характера регенерации хрящевой ткани в различные сроки после операции. Исследование показало высокий биологический потенциал коллагеновых мембран и их возможность трансформироваться в хрящевую ткань.
Хрящ, локальные дефекты хряща, коленный сустав, технология amic, костно-хрящевой дефект, коллагеновая мембрана, мозаичная пластика
Короткий адрес: https://sciup.org/142234233
IDR: 142234233 | УДК: 617.3
Текст научной статьи Эффективность применения коллагеновых мембран для реконструкции полнослойных дефектов гиалинового хряща в эксперименте
Введение. За последнее годы для восстановления полнослойных дефектов гиалинового хряща широкую популярность получила технология индуцированного матрицей аутохондрогенеза - AMIC (autologous matrix indused chondrogenesis) [1,2,3,4]. Технология AMIC основана на формировании отверстий в субхондральной кости (обеспечивающих транспорт костного мозга на поверхность дефекта) и репаративной способности стромальных клеток костного мозга, поступающего через сформированные отверстия. Образующийся в результате этого «суперсгусток» из красного костного мозга стабилизируется коллагеновой мембраной, имплантируемой в зону дефекта хряща. Естественный клеточный каркас защищает и связывает прогениторные клетки внутри «биологической камеры», стимулируя их дифференциацию для репарации хряща [3,5]
Преимущества технологии AMIC очевидны. Это: мало инвазивная одноэтапная процедура, не требующая культивирования хондроцитов; возможность восстановления крупных дефектов хряща (≥ 6-8 см²); простая хирургическая техника; подтвержденная эффективность в отношении купирования болевого синдрома, восстановления функции сустава и удовлетворенности больных исходами лечения.
Несмотря на широкую популярность технологии AMIC, остается много спорных и нерешенных вопросов, а именно: сроки деградации мембраны, характер её трансформации в хрящевую ткань, качество вновь образованной на месте имплантации мембраны хрящевой ткани и др. [6,7]
В настоящее время коллагеновая мембрана является одним из наиболее востребованных биологических материалов для восстановления хрящевой ткани. К сожалению, высокая стоимость импортных коллагеновых мембран не позволяет внедрить технологию AMIC в широкую клиническую практику отечественных медицинских учреждений. В тоже время потребность в выполнении операций по восстановлению хряща остается высокой. Этот факт определил необходимость разработки отечественного аналога, отвечающего всем современным требованиям, предъявляемым клиницистами к коллагеновым мембранам.
Цель исследования: экспериментальным путем изучить биологический потенциал коллагеновых мембран, их способность к трансформации в хрящевую ткань, оценить качество вновь образованной хрящевой ткани.
В работе использовалось два вида коллагеновых мембран, отличающихся по составу, структуре и характеру производства.
В качестве основной, использовалась разработанная российскими учеными мембрана Ortokeep (Рис.1а). Мембрана сформирована методом электроспиннинга из нановолокон диаметром 300-500 нм, состоящих из смеси полилактида и бычьего коллагена I-го типа (Рис.1б). Мембрана имеет одинаковый микрорельеф и смачиваемость с обеих сторон. Метод формирования мембраны и структура нановолокон радикально отличают ее от зарубежных аналогов, что позволяет произвести объективный сравнительный анализ их биологического потенциала.
В качестве контрольной, использовалась коллагеновая мембрана Chondro-Gide, производства зарубежной компании, синтезированная из свиного коллагена I и III типа, который резорбируется естественным путем (Рис.1г). Мембрана имеет двухслойную структуру (Рис.1д). Плотный слой имеет гладкую, не проницаемую поверхность, что обеспечивает стабилизацию сгустка костного мозга на поверхности субхондральной кости и исключает проникновение клеток костного мозга через мембрану в полость сустава. Пористый слой мембраны состоит из рыхлых коллагеновых волокон, способствующих адсорбции клеток в мембрану (Рис.1е). Структура мембраны имеют высокую устойчивости к растяжению, что препятствует её разрыву. Мембрана Chondro-Gide является наиболее популярным биопродуктом и широко используется для восстановления полнослойных дефектов хряща. Именно поэтому данная мембрана была выбрана нами в качестве контрольной.
Модель эксперимента: исследование проводилось на 4-х свиньях породы «русская белая». Настоящее экспериментальное исследование не противоречило этическим нормам и Международным требованиям по гуманному отношению к лабораторным (экспериментальным) животным, а также ГОСТ Р ИСО 10993-1-2009 «Изделия медицинские».
Исследование выполнено с использованием анальгетиков системного действия, применяемых в ветеринарии и клинической медицине в соответствующих для конкретного животного дозировках. Респираторная поддержка при помощи наркозно-дыхательного аппарата осуществлялась путем ингаляции кислородно-воздушной смеси по полузакрытому контуру.

Рис. 1. Внешний вид и строение коллагеновых мембран: а – мембрана Ortokeep; б - нановолокнистая структура мембраны Ortokeep (электронная микроскопия); в - рост клеток на мембране в эксперименте; г – мембрана Chondro-Gide; д - двухслойная структура мембраны Chondro-Gide (электронная микроскопия, увеличение в 100 раз); е - пористая, адгезирующая клетки поверхность мембраны Chondro-Gide (увеличение в 1500 раз).
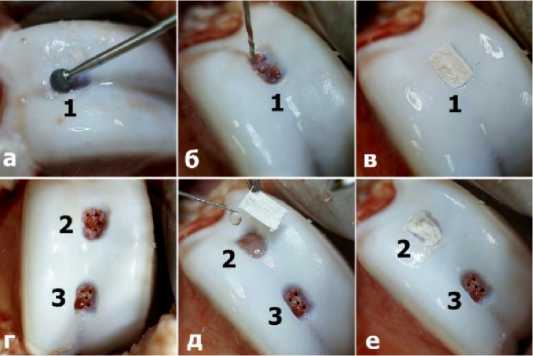
Рис. 2 Этапы формирования полнослойных дефектов и имплантации коллагеновых мембран (разъяснения см. в тексте). Примечание: 1 – дефект № 1 (имплантация мембраны Ortokeep); 2 – дефект № 2 (имплантация мембраны Chondro-Gide); 3 – дефект № 3 (без имплантации мембраны).
Результаты собственных исследований
На суставах правых задних конечностей каждого животного, с помощью круглого бора формировалось по одному полнослойному дефекту хряща (дефект №1) прямоугольной формы, размером 1х0,5 см, доходящего до субхондральной кости (Рис.2 а). Тонким сверлом диаметром 1,5 мм производилось рассверливание субхондральной кости на глубину 1 см, что позволило обеспечить транспорт костного мозга на поверхность дефекта (Рис.2 б). Коллагеновая мембрана Ortokeep моделировалась по форме и размеру дефектов, и фиксировались к субхондральной кости с помощью фибринового клея (Рис.2 в).
На суставах левых задних конечностей формировали по два дефекта: дефект (№2) – для имплантации мембраны Chondro Gide и контрольный дефект (№3) - без имплантации мембраны (Рис.2 г). Коллагеновая мембрана моделировалась по форме и размеру дефекта. После рассверливания субхондральной кости на дефект №2 наносился фибриновый клей и имплантировалась коллагеновая мембрана Chondro Gide (Рис.2 д). На контрольный дефект №3 имплантация мембраны не осуществлялась (Рис.2 е).
Животные выводились из эксперимента в сроки 2,3,4,6 месяцев после операции. Для последующего гистологического исследования предоставлялись крупные костно-хрящевые фрагменты, с расположенными на них исследуемыми дефектами. Для последующего микроскопического исследования из центральной части каждого дефекта производился забор одного фрагмента-биоптата.
Используя микроскоп с разрешением 12 мегапикселей, с каждого гистологического препарата производили микросъемку препарата, с последующим исследованием: воспалительной реакции, клеточного состава, коллагеновых волокон, остеогенеза. Изучаемые характеристики представлены в таблице.
При макроскопическом исследовании дефекта 3 (без имплантации мембран) отмечалось прогрессирующее увеличение его размеров без признаков регенерации хрящевой ткани на поверхности дефекта (Рис.3). Микроскопическое исследование показало признаки прогрессирующей деструкции костной ткани и отсутствие признаков хондрогенеза. Исходы таких операций были расценены как неудовлетворительные. Именно поэтому мы не будем представлять результаты гистологического исследования биоптатов из зоны дефекта 3, а представим лишь сравнительные с другими группами результаты морфометрии (таблица). Это экспериментальное наблюдение еще раз подтверждает низкую эффективность одной лишь туннелизации субхондральной кости, что ставит под сомнение целесообразность выполнения подобных операций в клинической практике.
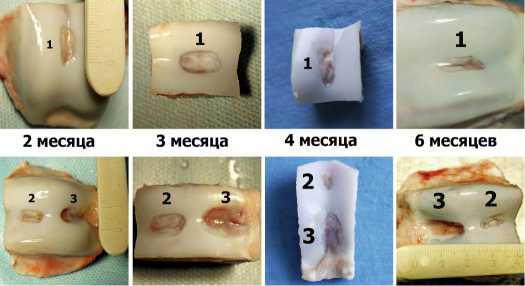
Рис.3. Макро препараты на различных сроках после операции.
Примечание: 1 – дефект № 1 после имплантации мембраны
Ortokeep; 2 – дефект № 2 после имплантации мембраны
Chondro-Gide; 3 – дефект № 3 – без имплантации мембран.
В тоже время в экспериментальных группах (дефекты № 1 и 2) выраженного увеличения размеров дефекта не выявлено. Дно дефектов ровное, но не равномерное. При пальпации дна, ткани на ощупь упруго-эластичные. Оба дефекты покрыты жизнеспособной, стабильной хрящевой тканью. (Рис.3)
Микроскопическое исследование дефекта № 1
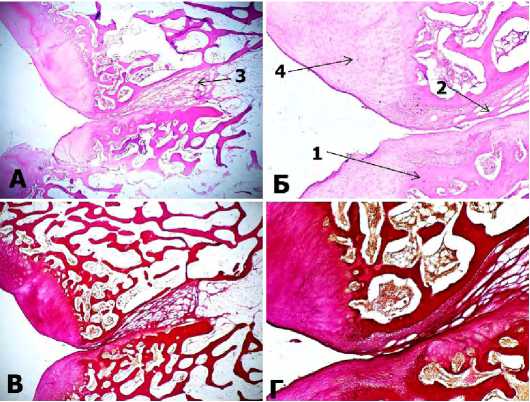
Рис.4 Микроскопия центральной части дефекта № 1 через 6 месяцев после имплантации мембраны Ortokeep. А-окраска гематоксилином и эозином, х40; Б-окраска гематоксилином и эозином, х100; В-окраска по методу Ван-Гизона, х40; Г- окраска по методу Ван-Гизона, х100.
Примечание: 1 – формирование остеоида (новообразованной костной ткани); 2 – грубоволокнистая соединительная ткань; 3 – адипоциты (жировые клетки); 4 – неохондрогенез (новообразованные хондроциты).
При исследовании гистологических стекол, окрашенных гематоксилином и эозином, во всех сроках вывода, воспалительного процесса, лейкоцитарной инфильтрации, не выявлено. Четкая граница интактного хряща выявлялась до срока 4 месяца, а на 6-м месяце граница стирается. Подлежащая костная ткань подверглась значительной резорбции в непосредственной близости от дефекта. Но признаков остеодистрофии в окружающем губчатом веществе не выявлено. На месте удаленного хряща и резорбированной костной ткани формировалась грубоволокнистая соединительная ткань. Начиная с 1-го месяца наблюдалось образование и созревание соединительной ткани и как следствие уменьшения ее объема (табл.). Параллельно по краям дефекта костной ткани происходили активные репаративные процессы – неостеогенез. Дефект первоначально имел колбообразную форму, но в дальнейшем приобретал цилиндрическую форму и к 6 месяцам становился клиновидным. Причем если с 1 месяца до 4 месяца дефект в основном был заполнен грубой волокнистой тканью, то на 6 месяце дефект практически полностью закрылся костной тканью. Формирование неохондроцитов (хонрогенез) проис- ходило активно и не только у края неповрежденного хряща, также выявлялись островки хондроцитов по центру дефекта (Рис. 4). В центре дефекта имелось глубокое щелевидное пространство, уходящее относительно глубоко в губчатое вещество. Процессы неоангиогенеза выраженные. Результаты морфометрии представлены в таблице.
Таким образом, при гистологическом исследовании центральной части образца дефекта № 1 выявлены активные репаративные процессы, направленные на восстановление резорбированной костной ткани, закрытие дефекта, а также восстановление гиалинового хряща. Причем, хондрогенез протекал не только по краю неповрежденного хряща, но и в виде отдельных островков в толще соединительной ткани.
Микроскопическое исследование дефекта № 2
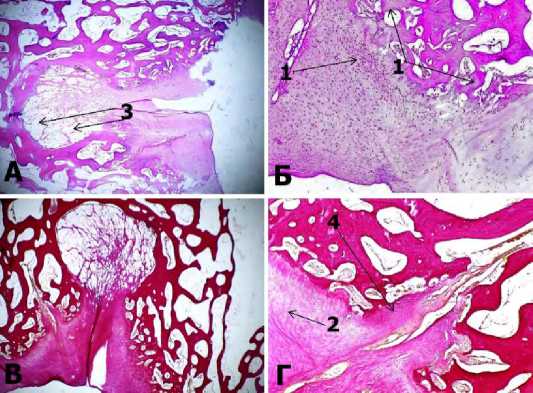
Рис.5 Микроскопия центральной части дефекта № 2 через 6 месяцев после имплантации мембраны Chondro-Gide. А-окраска гематоксилином и эозином, х40; Б-окраска гематоксилином и эозином, х100; В-окраска по методу Ван-Гизона, х40; Г- окраска по методу Ван-Гизона, х100.
Примечание: 1 – формирование остеоида (новообразованной костной ткани); 2 – грубоволокнистая соединительная ткань; 3 – адипоциты (жировые клетки); 4 – неохондрогенез (новообразованные хондроциты).
При исследовании гистологических стекол, окрашенных гематоксилином и эозином, воспалительного процесса, лейкоцитарной инфильтрации, не выявлено. Граница разрушенного хряща нечеткая. По центру сформировалась щелевидная полость, образованная на месте дефекта, подлежащая костная ткань подверглась резорбции (глубина резорбции несколько уменьшилась по сравнению с 3-х месячным результатом), на месте резорбированной костной ткани сформировалась грубоволокнистая соединительная ткань, с тенденцией к образованию костной ткани по краю дефекта и множественными островками хондроцитов в толще дефекта. Дефект имел колбообразную форму, и формирование неохондроцитов происходило активнее в направлении от периферии к центру. Имелсь отдельные щелевидные полости в толще грубоволокнистой соединительной ткани. На дне дефекта между соединительной тканью и костной тканью сформировалась довольно выраженная прослойка, состоящая из жировых клеток. Процессы неоангиогенеза выраженные. Также в толще соединительной ткани формировались островки хондроцитов. Результаты морфометрии представлены в таблице.
Таким образом, при гистологическом исследовании центральной части образца из дефекта № 2 отмечены ускоренные репаративные процессы, формирование островков хрящевой ткани в непосредственной близости к суставной поверхности. Также отмечены изменения глубины дефекта. Из негативных моментов отмечается образование прослойки жировых клеток между соединительно-тканной мозолью и костной тканью. А также наличие щелевидной полости.
Таблица 1
Размерные характеристики гистологического строения центра дефекта при различных видах вмешательств
|
Группа |
2 месяца (M±m) |
3 месяца (M±m) |
4 месяца (M±m) |
6 месяцев (M±m) |
|
|
Толщина интактного хряща, мкм |
Контроль |
734,0±16,12 |
2247,5±36,94 |
2359,8±38,79 |
842,10±21,23 |
|
Chondro-Gide |
1118,5±21,81 |
1230,4±23,99 |
1291,9±25,19 |
838,67±19,12 |
|
|
Ortokeep |
1519,0±38,42 |
1670,5±42,26 |
1341,3±25,08 |
886,35±10,44 |
|
|
Толщина хряща в центре вмешательства, |
Контроль |
0,0 |
0,0 |
0,0 |
0,0 |
|
мкм |
Chondro-Gide |
0,0 |
503,9±22,74 |
571,4±29,96 |
252,68±12,19 |
|
Ortokeep |
0,0 |
534,0±36,42 |
657,1±34,46 |
335,94±13,47 |
|
|
Толщина соединительной ткани в области |
Контроль |
1635,2±187,33 |
1152,2±124,80 |
1094,6±118,56 |
2406,98±178,05 |
|
имплантации, мкм |
Chondro-Gide |
1648,2±137,34 |
1615,2±134,60 |
1534,5±127,87 |
900,58±72,43 |
|
Ortokeep |
2072,0±339,89 |
1968,6±322,90 |
2905,7±204,92 |
1688,66±71,60 |
|
|
Толщина кортикальной пластинки в |
Контроль |
162,9±6,33 |
121,9±7,27 |
134,0±8,00 |
53,22±4,08 |
|
интактной области, мкм |
Chondro-Gide |
162,2±8,37 |
181,6±9,38 |
199,8±10,32 |
102,18±6,60 |
|
Ortokeep |
181,0±9,92 |
198,6±10,91 |
226,0±12,03 |
84,53±5,15 |
|
|
Толщина кортикальной пластинки в цен- |
Контроль |
121,6±7,73 |
96,8±5,53 |
106,5±6,08 |
147,54±18,67 |
|
тре вмешательства, мкм |
Chondro-Gide |
140,4±13,67 |
157,3±15,31 |
173,0±16,84 |
184,76±5,48 |
|
Ortokeep |
149,0±11,01 |
164,4±12,11 |
163,9±14,81 |
142,66±19,93 |
|
|
Объем костной ткани, % |
Контроль |
18,9±0,63 |
18,5±0,62 |
20,4±0,68 |
10,42±0,67 |
|
Chondro-Gide |
16,3±028 |
19,2±0,33 |
21,1±0,36 |
17,41±0,36 |
|
|
Ortokeep |
27,0±0,67 |
29,8±0,73 |
27,1±0,57 |
30,23±0,34 |
|
|
Объем хрящевой ткани, % |
Контроль |
15,4±0,51 |
22,4±0,74 |
24,6±0,82 |
10,64±0,38 |
|
Chondro-Gide |
23,1±0,29 |
25,8±0,33 |
28,4±0,36 |
15,04±0,72 |
|
|
Ortokeep |
27,0±0,57 |
29,4±0,63 |
32,1±1,88 |
19,99±0,43 |
|
|
Объем соединительной ткани, % |
Контроль |
53,3±0,70 |
52,3±0,69 |
44,4±0,58 |
13,31±1,04 |
|
Chondro-Gide |
53,2±0,50 |
40,4±0,48 |
34,4±0,41 |
17,03±0,56 |
|
|
Ortokeep |
43,0±0,47 |
33,7±0,47 |
31,2±0,46 |
18,19±0,53 |
|
|
Объем кровеносных сосудов, % |
Контроль |
5,8±0,16 |
7,1±0,20 |
6,8±0,19 |
8,39±0,42 |
|
Chondro-Gide |
7,5±0,45 |
8,9±053 |
8,4±0,50 |
11,91±0,42 |
Выводы. Подводя итог, хотим отметить, что оба исследуемых материала (коллагеновые мембраны Ortokeep и Chondro-Gide) показали отличные результаты в регенерации полнослойного дефекта хряща. В обеих группах были получены практически идентичные макро и микроскопические результаты. Однако более детальный анализ данных гистологического исследования выявил следующие особенности:
-
• В обеих группах зона имплантации коллагеновых мембран была представлена волокнистой соединительной тканью с включениями хондроцитов.
-
• Коллагеновые мембраны в месте дефекта создавали более благоприятные условия для репаративных процессов, что подтверждается самыми короткими сроками закрытия дефекта собственной соединительной тканью. Созревание соединительной ткани протекало в более короткие сроки.
-
• В зоне имплантации мембран хондрогенез протекал по «рассыпному» типу – в сформированной грубоволокнистой соединительной ткани появлялись «островки» гиалинового хряща. Данные островки первоначально располагались на удалении друг от друга, но имели тенденцию к слиянию между собой. И процессы неохондрогенеза протекали не только на границе со здоровой тканью, но и в толще соединительнотканной мозоли.
-
• Эффективность применения коллагеновых мембран подтверждается цифровыми значениями объема костной и хрящевой тканей.
Таким образом, проведенное исследование подтвердило высокую эффективность коллагеновых мембран для регенерации хрящевой ткани. В тоже время считаем важным изучить данные с более отдаленными сроками исследованиями. Также, были бы весьма ценными исследования с различными по составу мембранами, что является предметом нашей дальнейшей работы.
Список литературы Эффективность применения коллагеновых мембран для реконструкции полнослойных дефектов гиалинового хряща в эксперименте
- Гаркави А.В., Блоков М.Ю. Артроскопическая хондропластика локальных хрящевых дефектов коленного сустава с использованием коллагеновой мембраны Chondro-Gide. Кафедра травматологии и ортопедии. 2015, №3 (15). С.4 - 7. [Garkavi A.V., Blokov M.U. Artroskopicheskaja hondroplastika lokalnih hriachevih defektov kolennogo sustava s ispolzovaniem kollagenovoi membrani Chondro-Gide. Kafedra travmatologii i ortopedii. 2015, No 3 (15). pp.4-7 [In Russ].
- Gao L., Orth P., Cucchiarini M., Madry H. Autologous Matrix-Induced Chondrogenesis: A Systematic Review of the Clinical Evidence. Am J Sports Med, 2019, № 1 (47), pp. 222-231.
- Benthien J.P., Behrens P. Autologous Matrix-Induced Chondrogenesis (AMIC) combining Microfracturing and a Collagen I/III Matrix for Articular Cartilage Resurfacing. Cartilage, 2010, №1, vol.1, рр. 65-68.
- Girolamo L., Schönhuber H.I., Vigano M. et al. Autologous Matrix-Induced Chondrogenesis (AMIC) and AMIC Enhanced by Autologous Concentrated Bone Marrow Aspirate (BMAC) Allow for Stable Clinical and Functional Improvements at up to 9 Years Follow-Up: Results from a Randomized Controlled Study. Journal of Clinical Medicine, 2019, vol.8, №3, рр.392-405.
- Kon E., Filardo G., Brittberg M., Busacca M. et al. Multilayer biomaterial for osteochondral regeneration shows superiority vs microfractures for the treatment of osteochondral lesions in a multicentre randomized trial at 2 years. Knee Surgery Sports Traumatology Arthroscopy, 2018, Vol. 26, рр. 2704 - 2715.
- Егиазарян К.А., Лазишвили Г.Д., Храменкова И.В., Шпак М.А., Бадриев Д.А. Алгоритм хирургического лечения больных с рассекающим остеохондритом коленного сустава. Вестник РГМУ. 2018, №2. C.77-83. [Egiazaryan K.A., Lazishvili G.D., Hramenkova I.V., Shpak M.A., Badriev D.A. Algoritm hirurgicheskogo lechenija bolnich s rassekajushim osteochondritom kolennogo sustava. Vestnik RGMU. 2018. No2. pp.77-83 [In Russ].
- Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П., Гордиенко Д.И., Бут-Гусаим А.Б., Чуловская И.Г., Сиротин И.В., Шпак М.А. Гибридная костно-хрящевая трансплантация - инновационная технология для хирургического лечения обширных костно-хрящевых дефектов коленного сустава. Хирургическая практика. 2019, №4 (40). С.10-18. [Lazushvili G.D., Egiazaryan K.A., Ratyev A.P., Gordienko D.I., But-Gusaim A.B., Chulovskaja I.G., Sirotin I.V., Shpak M.A. Gibridnaja kostnohriashevaja transplantacija - innovacionnaja technologija dla hirurgicheskogo lechenija obshirnih kostno-hriashevich defektov kolennogo sustava // Hirurgicheskaja Praktika. 2019, No4 (40). pp.10-18 [In Russ].


