Эффективность применения модификаций препарата Суперстим в малых дозах на этапе адаптации микрорастений жимолости (Lonicera L) подсекции синей (Caeruleae rehd.) к нестерильным условиям с учетом последействия на этапе доращивания
Автор: Акимова Светлана Владимировна, Семенова Наталья Александровна, Малеванная Наталья Николаевна, Викулина Александра Николаевна, Киркач Вадим Валерьевич, Аладина Ольга Николаевна, Деменко Василий Иванович, Стрелец Виктор Дмитриевич
Журнал: Овощи России @vegetables
Рубрика: Плодоводство, виноградарство
Статья в выпуске: 6 (50), 2019 года.
Бесплатный доступ
Актуальность. В последние годы в России увеличивается интерес к культуре жимолости съедобной, широкое распространение которой сдерживается из-за дефицита качественного посадочного материала. Технология клонального микроразмножения позволяет за короткий срок получить большое количество посадочного материала жимолости, более тысячи растений-регенерантов в год из одного введенного в культуру in vitro меристематического апекса, что в сотни раз больше, чем при использовании традиционных методов вегетативного размножения. Адаптация к нестерильным условиям является заключительным и наиболее ответственным этапом клонального микроразмножения, потери на котором могут составлять от 50 до 90% мериклонов. Следует отметить, что практически нет исследований о том, каким образом происходит дальнейшее развитие адаптированных растений жимолости при доращивании. Методика. Проведено изучение влияния препаратов нового поколения Суперстим 1 и Суперстим 2 в малых и сверхмалых дозах на показатели приживаемости и развития растений жимолости на этапах адаптации и доращивания...
Клональное микроразмножение, жимолость подсекции синей, адаптация к нестерильным условиям, доращивание, сверхмалые дозы
Короткий адрес: https://sciup.org/140245817
IDR: 140245817 | УДК: 634.74:631.81.095.337 | DOI: 10.18619/2072-9146-2019-6-53-61
Текст научной статьи Эффективность применения модификаций препарата Суперстим в малых дозах на этапе адаптации микрорастений жимолости (Lonicera L) подсекции синей (Caeruleae rehd.) к нестерильным условиям с учетом последействия на этапе доращивания
В последние годы в России увеличивается интерес к культуре жимолости. Ещё в 1909 году И.В. Мичурин испытал жимолость съедобную и рекомендовал её для введения в культуру, призывая к широкому использованию в селекции с целью создания ценных сортов [6]. Впервые в Государственный реестр селекционных достижений РФ жимолость была включена лишь в 1987 году [2, 12]. В 2019 году для использования рекомендовано 119 сортов, разнообразных по урожайности, формам, размерам и вкусовым качествам плодов. Но, к сожалению, до сих пор промышленные насаждения жимолости в России сосредоточены в Восточной Сибири [14, 21].
Основным из традиционных способов вегетативного размножения жимолости является зеленое черенкование. В среднем, с одного сформированного маточного растения получают 200-300 зеленых черенков, укореняе-мость которых в зависимости от сорта, применения регуляторов роста, условий года колеблется от 53 до 100%, при этом выход стандартных саженцев достигает 50-60%. Таким образом, при самых благоприятных условиях за два года, с учетом доращивания, данный способ позволяет получить не более 150 растений с одного маточного растения, что не позволяет размножать данную культуру в промышленных масштабах.
Технология клонального микроразмножения позволяет за короткий срок получать большое количество посадочного материала жимолости, более тысячи растений в год из одной введенной в культуру меристемы, что в сотни раз больше, чем при использовании традиционных методов вегетативного размножения. Адаптация к нестерильным условиям является заключительным и наиболее ответственным этапом клонального микроразмножения. Приживаемость и успешное развитие микрорастений на этом этапе зависит от комплекса факторов: типа субстрата, освещенности, температуры и влажности воздуха, инфекционной нагрузки и т.д. На этом этапе важно разрабатывать приемы, повышающие приживаемость и показатели роста и развития растений ex vitro [10, 18, 20]. Следует отметить, что практически нет исследований о том, каким образом происходит дальнейшее развитие адаптированных растений жимолости при доращивании. Нами было отмечено, что, как правило, при пересадке в контейнеры у адаптированных растений жимолости наблюдается замедленный рост, отсутствие ветвления, полегание и ломкость побегов, что требует дополнительного года культивирования в защищенном грунте.
В последнее время широко применяют биологически активные вещества нового поколения с высокой степенью распада за короткий период [16]. В работах ряда исследователей были получены неожиданные результаты при использовании веществ в малых и сверхмалых дозах (СМД) с массовыми долями от 10-5 до 10-17 М. При уменьшении массовой доли вещества на 1-2 порядка эффект закономерно снижался, затем наступала «зона молчания», а при дальнейшем уменьшении массовой доли на 46 порядков от первоначальной эффект возникал снова. Это явление получило название эффекта СМД [2, 3, 4]. Его наблюдали при исследовании разнообразных химических агентов: регуляторов роста растений, противоопухолевых препаратов, нейропептидов и гормонов, иммуномодуляторов, антиоксидантов и других как белковых, так и небелковых соединений. Использование сверхмалых доз БАВ в сельском хозяйстве пока не получило такого широкого развития, как в медицине [8]. Определение четких критериев действия препаратов сокращает сроки проведения работ, улучшает качество адаптации к нестерильным условиям [1, 7], позволяя использовать различные варианты повышения устойчивости растений к поражению возбудителями болезней.
Несмотря на большие успехи в разработке основных этапов клонального микроразмножения, наиболее сложным этапом остается адаптация растений-регенерантов к нестерильным условиям [9,10,18,20]. Один из приемов, используемых при пересадке микрорастений в нестерильные условия – пролив субстрата фунгицидами за 12 ч до высадки. Наши исследования показали, что в этом случае часто ингибируется развитие адаптируемых растений [5]. Известно положительное действие препарата Суперстим против комплекса болезней, например, его применение для предпосевной обработки семян капусты снижало их поражение патогенной микрофлорой, повышало лабораторную всхожесть и энергию прорастания [17]. Поэтому задачей наших исследований было изучение влияния препаратов нового поколения Суперстим 1 и Суперстим 2 в малых и сверхмалых дозах на показатели приживаемости и развития растений жимолости на этапах адаптации и доращивания.
Условия, материалы и методы
Опыты проводили в лаборатории клонального микроразмножения садовых растений лаборатории плодоводства РГАУ-МСХА им. К.А. Тимирязева.
В схему опыта были включены две модификации препарата Суперстим. Суперстим 1 (оригинатор ННПП «НЭСТ М») – высокоэффективный природный стимулятор из ростков картофеля, представляющий сложную многокомпонентную систему с высокой физиологической активностью, которая определяется наличием витаминов, ферментов, органических и нуклеиновых кислот, полным набором ростостимулирующих фитогормонов, регулирует в обработанных растениях синтез собственных гормонов и повышает их урожайность и устойчивость к болезням [15]. Суперстим-2 в своем составе дополнительно содержит диатомовые водоросли.

Рис.1. Обработка растений жимолости сорта Морена перед высадкой на адаптацию в различных концентрациях препаратов Суперстим 1 и Суперстим 2
Fig. 1. Treatment of Morena honeysuckle plants before planting for adaptation at various concentrations of Superstim 1 and Superstim 2
Рекомендуемые нормы расхода – 0,1 г/га для зерновых и 1 г/га – для овощных культур. Нормы расхода для плодовых растений еще не установлены. В клональном микроразмножении Суперстим впервые применили в 2012 году на культуре картофеля [19].
Объекты исследований – in vitro растения жимолости сорта Морена.
Перед переводом растений-регенерантов в нестерильные условия их в течение 30 минут по вариантам выдерживали в опытных растворах (рис.1.). Согласно схеме опыта модификации препарата Суперстим приме- няли в концентрациях от 10-2 до 10-18%, контроль – без обработок. Для получения экспериментальных растворов последовательно разводили исходный маточный раствор. Для приготовления раствора с концентрацией 1x10-2% Суперстим в количестве 100 мг растворяли в 1000 мл готовой питательной среды. Далее 100 мл раствора с концентрацией 1x10-2% доводили питательной средой до 1000 мл и получали раствор 1x10-3%. Аналогичным образом последовательно проводили разведение до более низких концентраций. Затем микрорастения высаживали в субстрат, представляющий собой смесь переходного обогащенного торфа «Пельгорское-М» с перлитом (3:1), пролитый почвенным фунгицидом «Превикур» (2 мл/л) за 12 часов до высадки.
Динамику изменения морфометрических показателей на этапе адаптации проводили по вариантам двукратно через 25 и 35 дней после высадки. Площадь листьев определяли методом калибровочных решеток. Для этого использовали прозрачные пластиковые пластинки размером 10x10 см, на одной из которых были нанесены квадратики площадью 0,5 см2. Листья, не отделяя от растений, вставляли между пластинками и определяли их площадь.
Через 40 дней после высадки на адаптацию все растения были высажены в горшки объемом 1,06 л и перенесены в отсек для доращивания. Через 14 и 28 дней после высадки производили однократную и двукратную некорневую обработку по вариантам опыта. В последующих учетах динамики роста и развития растений через 40 и 70 дней после высадки на доращивание, определяли количество побегов, их суммарную длину и площадь листовой поверхности.
Повторность опытов на этапе адаптации – трехкратная по 5 растений, на этапе доращивания – пятикратная по 1
растению в повторности.
Статистическую обработку результатов проводили по В.А. Доспехову с использованием программы Microsoft Office Exсel 2007 и методических материалов [15, 13]. Их применение подтвердило достоверность полученных результатов.
Результаты и обсуждение
Наши исследования, проведенные на этапах адаптации и доращивания жимолости сорта Морена, выявили следующие закономерности. У исследуемых препаратов по всем изучаемым показателям (суммарная длина побегов, площадь листовой поверхности, число побегов) было
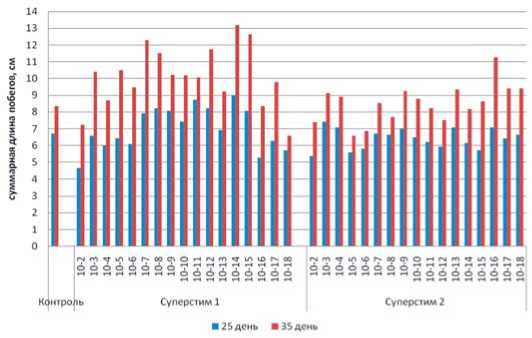
Рис.2. Влияние препаратов Суперстим 1 и Суперстим 2 на суммарную длину побегов растений жимолости (сорт
Морена) на 25 и 35 день после высадки на адаптацию
Fig. 2. The Superstim 1 and Superstim 2 effect on the total shoot length of honeysuckle plants (Morena cultivar) on days 25 and 35 after planting on adaptation
Таблица 1. Влияние препаратов Суперстим 1 и Суперстим 2 на показатели роста и развития растений жимолости (сорт Морена) через 25 дней после высадки эксплантов на адаптацию
Table 1. The effect of Superstim 1 and Superstim 2 on the growth and development of honeysuckle plants (Morena cultivar) 25 days after explant landing on adaptation
|
Концентрация препарата, % |
Приживаемость, % |
Суперстим 1 |
Суперстим 2 |
||
|
Суммарная длина побегов, см |
Площадь листовой поверхности, см2 |
Суммарная длина побегов, см |
Площадь листовой поверхности, см2 |
||
|
Контроль |
100 |
6,7 |
4,2 |
- |
- |
|
10-2 |
100 |
4,6 |
3,5 |
5,4 |
5,9 |
|
10-3 |
100 |
6,6 |
6,1 |
7,4 |
7,2 |
|
10-4 |
100 |
6,0 |
4,5 |
7,1 |
7,4 |
|
10-5 |
100 |
6,4 |
4,0 |
5,6 |
6,1 |
|
10-6 |
100 |
6,1 |
4,6 |
5,8 |
4,4 |
|
10-7 |
100 |
7,9 |
10,0 |
6,7 |
5,4 |
|
10-8 |
100 |
8,2 |
6,6 |
6,6 |
6,4 |
|
10-9 |
100 |
8,1 |
6,4 |
7,0 |
8,6 |
|
10-10 |
100 |
7,4 |
5,5 |
6,5 |
7,8 |
|
10-11 |
100 |
8,7 |
6,5 |
6,2 |
4,8 |
|
10-12 |
100 |
8,2 |
8,4 |
5,9 |
5,9 |
|
10-13 |
100 |
6,9 |
5,5 |
7,1 |
6,0 |
|
10-14 |
100 |
9,0 |
7,2 |
6,1 |
5,4 |
|
10-15 |
100 |
8,1 |
6,7 |
5,7 |
4,9 |
|
10-16 |
100 |
5,3 |
3,4 |
7,1 |
6,3 |
|
10 -17 |
100 |
6,3 |
5,5 |
6,4 |
6,1 |
|
10-18 |
100 |
5,7 |
3,6 |
6,6 |
6,3 |
Таблица 2. Влияние препаратов Суперстим 1 и Суперстим 2 на показатели роста и развития растений жимолости (сорт Морена) через 35 дней после высадки эксплантов на адаптацию
Table 2. The Superstim 1 and Superstim 2 effect on the growth and development of honeysuckle plants (Morena cultivar) 35 days after planting explants on adaptation
|
Концентрация |
Суммарная длина побегов, см |
Площадь листовой поверхности, см2 |
Длина корневой системы, см |
Масса корневой системы, г |
||||
|
(b) |
Суперстим 1 |
Суперстим 2 |
Суперстим 1 |
Суперстим 2 |
Суперстим 1 |
Суперстим 2 |
Суперстим 1 |
Суперстим 2 |
|
Контроль |
8,4 |
8,8 |
6,19 |
0,022 |
||||
|
10-2 |
7,2 |
7,4 |
7,3 |
9,5 |
4,9 |
7,1 |
0,014 |
0,025 |
|
10-3 |
10,4 |
9,1 |
14,5 |
12,1 |
5,2 |
6,2 |
0,016 |
0,022 |
|
10-4 |
8,7 |
8,9 |
10,4 |
12,1 |
4,9 |
6,5 |
0,014 |
0,024 |
|
10-5 |
10,5 |
6,6 |
11,1 |
8,3 |
4,9 |
5,6 |
0,014 |
0,018 |
|
10-6 |
9,5 |
6,8 |
10,6 |
7,8 |
4,6 |
6,5 |
0,012 |
0,024 |
|
10-7 |
12,3 |
8,5 |
18,9 |
12,1 |
5,6 |
6,4 |
0,018 |
0,026 |
|
10-8 |
11,5 |
7,7 |
16,9 |
9,5 |
6,2 |
6,4 |
0,022 |
0,026 |
|
10-9 |
10,2 |
9,3 |
13,8 |
14,1 |
5,2 |
6,4 |
0,016 |
0,026 |
|
10-10 |
10,2 |
8,8 |
14,2 |
12,7 |
5,9 |
6,1 |
0,020 |
0,024 |
|
10-11 |
10,1 |
8,2 |
11,7 |
12,2 |
5,9 |
6,7 |
0,020 |
0,028 |
|
10-12 |
11,7 |
7,5 |
15,6 |
10,4 |
6,1 |
6,4 |
0,024 |
0,026 |
|
10-13 |
9,2 |
9,3 |
9,7 |
14,2 |
6,7 |
6,4 |
0,028 |
0,026 |
|
10-14 |
13,2 |
8,2 |
20,0 |
11,3 |
6,2 |
6,6 |
0,022 |
0,029 |
|
10-15 |
12,6 |
8,6 |
23,6 |
11,1 |
5,9 |
6,9 |
0,020 |
0,031 |
|
10-16 |
8,4 |
11,3 |
9,1 |
20,9 |
5,6 |
6,1 |
0,018 |
0,024 |
|
10-17 |
9,8 |
9,4 |
14,7 |
14,6 |
5,6 |
5,9 |
0,018 |
0,020 |
|
10-18 |
6,6 |
9,4 |
6,9 |
12,0 |
5,6 |
6,7 |
0,018 |
0,028 |
|
НСР 05 а |
0,7 |
■ |
0,2 |
0,0022 |
||||
|
НСР 05 b |
■ |
■ |
8,5 |
1,3 |
0,0116 |
|||
|
НСР 05 ab |
5,6 |
12,2 |
■ |
■ |
||||
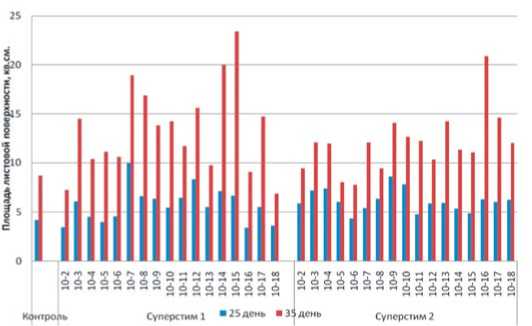
Рис.3. Влияние препаратов Суперстим 1 и Суперстим 2 на площадь листовой поверхности растений жимолости (сорт
Морена) на 25 и 35 день после высадки на адаптацию
Fig. 3. The effect of Superstim 1 and Superstim 2 on the leaf surface area of honeysuckle plants (Morena variety) on days 25 and 35 after planting on adaptation вывялено 4-5 «пиков активности» с интервалом от 2 до 6 порядков, причем у разных показателей наблюдалось преимущество различных «пиков активности», которые не закреплялись в динамике снятия данных.
На 25 день после высадки растений на адаптацию по показателю суммарной длины побегов в вариантах с применением препарата Суперстим 1 были выявлены пики активности: 1x10-3, 1x10-8, 1x10-11, 1x10-14, 1x10-17% (лучшие варианты – 1x10-11 и 1x10-14% – 8,7 и 9,0 см против 6,7 в контроле); по площади листовой поверхности – 1x10-3, 1x10-7, 1x10-12, 1x10-14, 1x10-17 % (лучший вариант 1x10-7 – 10 см2 против 4,2 см2 в контроле).
В вариантах с применением препарата Суперстим 2 по суммарной длине побегов были выявлены 4 пика активности: 1x10-3, 1x10-9, 1x10-13, 1x10-16%, лучший результат получен в варианте 1x10-3 (7,4 см против 6,7 в контроле); по площади листовой поверхности – 1x10-4, 1x10-9, 1x10-13, 1x10-16% (лучший вариант 1x10-9 – 8,6 см2 против 4,2 см2 в контроле) (табл. 1, рис. 2, 3, 4).
На 35 день после высадки растений на адаптацию динамика роста и развития растений изменилась, и проявилось действие других концентраций, однако сохранилось явное преимущество некоторых из ранее выявленных. При изучении суммарной длины побегов в вариантах с применением препарата Суперстим 1 были выявлены следующие пики активности: 1x10-3, 1x10-5, 1x10-7, 1x10-12, 1x10-14 (лучшие варианты 1x10-7 и 1x10-14% – 12,3 и 13,2 см против 8,4 в контроле); по площади листовой поверхности – 1x10-3, 1x10-7, 1x10-12, 1x10-15, 1x10-17 % (лучшие варианты – 1x10-7, 1x10-14, 1x10-15, соответственно, 18,9; 20,0; 23,6 см2 против 8,8 см2 в контроле).
В вариантах с применением препарата Суперстим 2 при изучении суммарной длины побегов были выявлены следующие 4 пика активности: 1x10-3, 1x107, 1x10-9, 1x10-13, 1x10-16 %, (лучший вариант 1x10-16 – 7,4 см против 6,7 в контроле); по площади листовой поверхности – 1x10-4, 1x10-9, 1x10-13, 1x10-16%, лучший вариант 1x10-16 – 20,9 см2 против 8,8 см2 в контроле (табл. 2, рис. 2, 3, 4).

аб

Список литературы Эффективность применения модификаций препарата Суперстим в малых дозах на этапе адаптации микрорастений жимолости (Lonicera L) подсекции синей (Caeruleae rehd.) к нестерильным условиям с учетом последействия на этапе доращивания
- Акимова С.В., Викулина А.Н., Буянов И.Н., Глинушкин А.П. Совершенствование способов подготовки микрорастений малины к адаптации. Плодоводство и ягодоводство России. 2014;39:16-19.
- Блюменфельд Л.А. Понятие конструкции в биологической физике. К вопросу о механизме действия сверхмалых доз. Рос. хим. журн. 1999;XLIII(5):15-20.
- Бурлакова Е.Б. Особенности действия сверхмалых доз биологически активных веществ и физических факторов низкой интенсивности. Рос. хим. журн. 1999;XLIII(5):3-11.
- Верещагин А.Л., Цой Т.Л., Кропоткина В.В. Применение стимуляторов роста в сверхмалых (гомеопатических) дозах в сельском хозяйстве. Производные хитозана и стимуляторы роста в сельском хозяйстве. Ползуновский вестник, Барнаул. 2006;2-1:343-348.
- Викулина А.Н. Адаптация растений рода Rubus L., размноженных in vitro, и оценка их последующего развития. Автореферат дисс.. на соискание ученой степени кандидата с.-х.наук. Москва. 2016. 26 с.
- Гидзюк, И.К. Жимолость со съедобными плодами. Томск: изд-во Томского ун-та, 1981. 230 с.
- Глинушкин А.П., Безрядин С.Г., Айсувакова О.П., Батманова Е.А. Неорганические факторы управления патогенными бактериями. Russian Agricultural Science Review. 2014;3(3):44-48.
- Горбатенко И.Ю. Сверхмалые дозы биологически активных веществ и перспективы их использования. Изв. РАН, серия биологическая. 1997;1:107-110.
- Деменко В.И. Микроклональное размножение плодовых и ягодных культур: методические указания к практическим занятиям по плодоводству. М.: Изд-во РГАУ МСХА, 1997. С.48-50.
- Деменко В.И., Лебедев В.Г., Шестибратов К.А. Адаптация растений, полученных in vitro, к нестерильным условиям. Известия ТСХА. 2010;1:73-85.
- Доспехов Б.А. Методика полевого опыта. М.: Колос, 1968. 253 с.
- Зимина, Е.В. Развитие культуры жимолости и крупноплодного шиповника в Хабаровском крае. Состояние и перспективы развития нетрадиционных садовых культур: Материалы межд. научно-методической конференции, 12-14 августа 2003 г. (Мичуринск). Воронеж: "Кварта", 2003. С.97-99.
- Исачкин А.В., Крючкова В.А. Основы научных исследований в садоводстве: рабочая тетрадь. 3-е изд., исправл. и доп. М.: Изд-во РГАУ-МСХА, 2015. 94 с.
- Плеханова, М.Н. Итоги и перспективы селекции жимолости синей во ВНИИР им. Н.И. Вавилова. Состояние и перспективы развития нетрадиционных садовых культур: Материалы международной научно-методической конференции 12-14 августа 2003 года. Воронеж: Кварта, 2003. С.112-116.
- Разумова Т.Н. Эффективность применения регуляторов роста на картофеле. Вопросы картофелеводства: материалы школы молод. учен. ВНИИКХ. М.:, 2004. С.162-167.
- Романенко Е.С., Брыкалов А.В. Перспективы исследования биорегуляторов роста нового поколения в виноградарстве (обработка черенков винограда водным экстрактом биогумуса и растворами лигногуматов). Проблемы экологии и защиты растений в сельском хозяйстве. Ставрополь: Ставропольский госуд. агр. ун-т., 2004. С.15-17.
- Семенов А.М., Глинушкин А.П., Соколов М.С. Органическое земледелие и здоровье почвенной экосистемы. Достижения науки и техники АПК. 2016;30(8):5-8.
- Сковородников Д.Н., Райков И.А., Челяев Д.Н. Адаптация полученных in vitro растений малины к нестерильным условиям. Вестник Орловского государственного аграрного университета. 2012;35(2):70-72.
- Тектониди И.П., Башкардин В.И., Михалин С.Е. Влияние Фумара и Суперстима в семеноводстве картофеля и результаты грунтоконтроля элиты в 2012 году. Картофелеводство: материалы V научно-практической конференции "Состояние и перспективы инновационного развития современной индустрии картофеля". М.: ВНИИКХ. 2012. С.152-157.
- Шорников Д.Г., Янковская М.Б., Муратова С.А. Укоренение in vitro и адаптация нетрадиционных садовых культур. VIII Международная научно-методическая конференция "Интродукция нетрадиционных и редких растений". Воронеж: Кварта. 2008;1:335-337.
- Janick, J., Paull R.E. The Encyclopedia of fruit and nuts. UK, Oxfordshire, CAB Inernational, 2008. Р.232-236.


