Эффективность различных способов аблации длительно персистирующей фибрилляции предсердий во время коронарного шунтирования
Автор: Чернявский А.М., Пак И.А., Карева Юлия Евгеньевна, Рахмонов С.С., Покушалов Е.А., Романов А.Б.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая болезнь сердца
Статья в выпуске: 4 т.19, 2015 года.
Бесплатный доступ
В работе исследовали проблему хирургического лечения наиболее распространенных в мире заболеваний сердечно-сосудистой системы - ишемической болезни сердца в сочетании с фибрилляцией предсердий. Цель исследования - сравнение эффективности различных способов аблации фибрилляции предсердий у больных ишемической болезнью сердца во время операции коронарного шунтирования. Данное исследование является проспективным, рандомизированным, одноцентровым, неконтролируемым, открытым. В работе проанализировали результаты лечения 98 пациентов с длительно персистирующей фибрилляцией предсердий, которых рандомизировали на три группы: аортокоронарного шунтирования с изоляцией легочных вен (п = 31); аортокоронарного шунтирования с модифицированной процедурой Mini-Maze (изоляция устьев легочных вен в сочетании с аблацией левопредсердного перешейка, созданием межколлекторной линии по крыше левого предсердия, п = 37); аортокоронарного шунтирования с аблацией анатомических зон ганглионарных сплетений (п = 30). По результатам исследования выявили, что у больных ишемической болезнью сердца с длительно персистирующей фибрилляцией предсердий только радиочастотная фрагментация левого предсердия, выполненная во время коронарного шунтирования, позволяет достигнуть удовлетворительных результатов в отдаленном периоде, эффективность составляет 48,65%. Предикторами возврата аритмии в отдаленном периоде у больных с длительно персистирующей фибрилляцией предсердий являются размер левого предсердия более 6,5 см (ОШ 1,18; ДИ 1,01-1,75; р = 0,043) и длительный (более 10 лет) стаж аритмии (ОШ 1,07; ДИ 0,23-5,03; р = 0,038). Аблация ганглионарных сплетений, выполненная одномоментно с коронарным шунтированием, у пациентов с длительно персистирующей фибрилляцией предсердий имеет низкую эффективность в отдаленном периоде (33,3%) и не может быть самостоятельной методикой лечения.
Фибрилляция предсердий, коронарное шунтирование, радиочастотная аблация
Короткий адрес: https://sciup.org/142140704
IDR: 142140704
Текст научной статьи Эффективность различных способов аблации длительно персистирующей фибрилляции предсердий во время коронарного шунтирования
Таблица 1 Распределение пациентов трех групп по характеру сопутствующих заболеваний
Vos С. и коллеги [4] определили факторы, влияющие на прогрессирование данной аритмии. Наряду с такими факторами, как сердечная недостаточность и артериальная гипертензия, терапия с целью контроля желудочковых сокращений, а не синусового ритма оказалась независимым предиктором прогрессирования фибрилляции предсердий (ОР 3,2; 95% ДИ 2,5–4,1, p<0,0001). Вряд ли возможно утверждение, что неритмичное, хаотичное сокращение лучше гармоничного, ритмичного, но удержание ритмичного сокращения требует приема лекарств, низкая эффективность и побочные свойства которых зачастую перевешивают пользу от их приема. С появлением таких технологий, как катетерные, хирургические методы лечения фибрилляции предсердий, в будущем сохранение синусового ритма, возможно, окажется предпочтительным.
Выбор определенной методики аблации для лечения разных форм ФП до сих пор обсуждают специалисты во всем мире. Большинство исследователей считают, что непременным условием для успешного лечения ФП является изоляция легочных вен [5], а при более тяжелых формах – персистирующей и длительно персистирующей – следует наносить дополнительные линии по крыше левого предсердия (ЛП) и в зоне митрального истмуса [6, 7]. Во многие исследования включили пациентов главным образом с пароксизмальной формой ФП без сопутствующих заболеваний. Несмотря на появление данных об эффективности и безопасности аблации ФП у других категорий больных, в частности пациентов пожилого возраста, пациентов с длительно персистирующей ФП, пациентов с нарушенной систолической функцией и сердечной недостаточностью, данный вопрос требует отдельного изучения. Отсутствие оптимальной стратегии аблации и прогнозирования эффективности процедуры у разных категорий пациентов, в том числе у больных ИБС, диктует необходимость продолжения изучения.
Цель исследования – сравнить эффективность различных способов аблации длительно персистирующей ФП у больных ИБС. Первичная конечная точка – свобода от фибрилляции/трепетания предсердий (ФП/ТП) через 3 года после операции.
Материал и методы
Данное клиническое исследование является проспективным, рандомизированным, одноцентровым, неконтролируемым, открытым. В ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» с 2007 по 2012 г. выполнили 297 операций у больных ИБС по устранению фибрилляции предсердий одновременно с аортокоронарным шунтированием.
Критерии включения: показания к коронарному шунтированию; документированная фибрилляция предсердий; длительность аритмического анамнеза более 6 мес.; согласие пациента на участие в исследовании.
Критерии исключения: острая форма или обострение хронической соматической патологии; экстренное оперативное лечение по жизненным показаниям; единственный эпизод ФП, связанный с острым коронарным событием; выраженный спаечный процесс из-за операций, травм грудной клетки в анамне-
Таблица 2 Показатели эхокардиографии у пациентов с длительно персистирующей фибрилляцией предсердий
Из 297 больных 98 (33%) пациентов страдали длительно персистирующей формой фибрилляции предсердий. В зависимости от методики радиочастотной аблации больных рандомизировали на три группы. В первой группе выполняли аортокоронарное шунтирование с изоляцией легочных вен (АКШ + ИЛВ, n = 31). Во второй группе осуществляли аортокоронарное шунтирование с модифицированной процедурой Mini-Maze, или процедурой изоляции устьев легочных вен левого предсердия в сочетании с аблацией левопредсердного перешейка, созданием межколлекторной линии по крыше левого предсердия и/ или изоляцией задней стенки левого предсердия (АКШ + ММ, n = 37). Также эту процедуру называют фрагментацией левого предсердия. Подробное описание техники выполнения данных процедур аблации дано ранее [8]. В третьей группе проводили аортокоронарное шунтирование с аблацией анатомических зон ганглионарных сплетений (АКШ + ГС, n = 30). Рандомизацию пациентов проводили методом непрозрачных запечатанных конвертов. По характеру сопутствующей патологии и антропометрическим показателям больные в группах не различались (табл. 1).
По данным эхокардиографии низкую сократительную способность миокарда левого желудочка с фракцией выброса менее 35% выявили у 11 пациентов, умеренную митральную недостаточность – у 10, аневризму левого желудочка – у 9. Также оценивали линейные размеры левого предсердия. Данные эхокардиографии у пациентов всех групп представлены в табл. 2.
Результаты
Всем пациентам осуществляли одномоментно с аблацией ФП хирургическую коррекцию ИБС: 89 больным – коронарное шунтирование; 18 – коронарное шунтирование с эндартерэктомией из коронарных артерий; 9 – коронарное шунтирование в сочетании с устранением постинфарктной аневризмы левого желудочка; 5 – коррекцию ишемической митральной недостаточности пластикой митрального клапана на опорном кольце; 1 больному с гемодинамически значимым поражением коронарных и церебральных артерий – гибридную процедуру (коронарное шунтирование со стентированием левой внутренней сонной артерии). Характеристика интраоперационного периода и выполненных операций представлена в табл. 3.
По данной таблице видно, что статистически значимо группы различались только по длительности аблации: меньше времени требуется для изоляции устьев легочных вен (p = 0,004); в остальном группы статистически значимо не различались по частоте вмешательств и длительности искусственного кровообращения и окклюзии аорты.
Динамика сердечного ритма в раннем послеоперационном периоде
В госпитальный период у больных с длительно персистирующей ФП чаще всего рецидивы аритмии возникали в течение первой недели после операции с постепенным уменьшением количества эпизодов ФП к концу второй недели. За период наблюдения в палате реанимации у пациентов после радиочастотной изоляции устьев легочных вен, пароксизмы ФП возникали у 6 (19,4%), после радиочастотной фрагментации – у 8 (21,6%), после аблации ГС – у 12 (40%) пациентов. При выписке синусовый ритм сохранялся у
Таблица 3 Интраоперационные данные пациентов трех групп
|
Показатель |
АКШ + ИЛВ, n = 31 |
АКШ + ММ, n = 37 |
АКШ + ГС, n = 30 |
p |
|
Количество шунтов, n |
2,3±0,5 |
2,4±0,7 |
2,2±0,9 |
0,91 |
|
Время искусственного кровообращения, мин |
103,8±54,7 |
106,1±32,1 |
105,8±61,6 |
0,50 |
|
Время окклюзии аорты, мин |
68,8±23,1 |
71,1±33,4 |
70,9±28,9 |
0,08 |
|
Время аблации, с |
246,5±86,6 |
305,9±89,1 |
359,2±144,5 |
0,004 |
|
Вмешательство на митральном клапане, ч (%) |
1 (3,2) |
2 (5,4) |
2 (6,7) |
0,83 |
|
Вмешательство на левом желудочке, ч (%) |
3 (9,7) |
4 (10,8) |
2 (6,7) |
0,84 |
|
Эндартерэктомия, ч (%) |
6 (19,4) |
7 (18,9) |
5 (16,7) |
0,96 |
|
Вмешательство на трикуспидальном клапане, ч (%) |
– |
– |
1 (3,3) |
0,32 |
|
Стентирование ВСА, ч (%) |
1(3,2) |
– |
– |
0,34 |
|
Имплантация электрокардиостимулятора, ч (%) |
2(6,5) |
1(2,7) |
1 (3,3) |
0,72 |
|
EuroSCORE, балл |
5,4±0,6 |
5,6±1,1 |
5,2±1,2 |
0,28 |
23 больных в группе изоляции легочных вен (74,2%); у 28 в группе фрагментации ЛП (75,7%) и у 16 (53,3%) в группе аблации ганглионарных сплетений. Трепетание предсердий в послеоперационном периоде возникали у 3 (9,7%) пациентов в группе АКШ + ИЛВ, у 1 (2,7%) в группе АКШ + ММ, у 2 (6,7%) в группе АКШ + ГС (p = 0,48). Чаще нарушения ритма наблюдались в группе аблации ГС, однако разница в частоте не была статистически значима (р = 0,1). Дисфункция синусового узла возникла в 3 (9,7%) случаях в группе АКШ
+ ИЛВ, в 2 (5,4%) в группе АКШ + ММ и в 1 (3,3%) в группе АКШ + ГС (p = 0,57). В группе АКШ + ИЛВ двум больным и по одному пациенту в группах АКШ + ММ и АКШ + ГС имплантировали кардиостимулятор.
Свобода от фибрилляции предсердий в отдаленном периоде
Для оценки свободы от ФП выполняли построение актуарной кривой Каплана – Майера. Для оценки
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2 н--------------------------1---------------------------1---------------------------1---------------------------1111
0 10 20 30 40 50 60 70
Время после операции, мес.
Рис. 1. Свобода от фибрилляции и трепетания предсердий в различные сроки после радиочастотной абляции в трех группах у больных с длительно персистирующей фибрилляцией предсердий (log-rank test (1 и 2) р = 0,43; log-rank test (1 и 3) р = 0,58; log-rank test (2 и 3) р = 0,21)
Таблица 4 Модель Кокса (отношение шансов рецидива аритмии) у больных с длительно персистирующей фибрилляцией предсердий
К четвертому году после операции синусовый ритм имели 12 из 31 пациента группы изоляции легочных вен, что составляет 38,7%. В группе фрагментации ЛП через 3 года после операции у 18 из 37 пациентов сохранялся синусовый ритм, что составляет 48,6%. В группе аблации ГС только у 10 из 30 пациентов регистрировали синусовый ритм, то есть свобода от ФП в данной группе составила 33,3% (рис. 1).
Данный график показывает, что наименьший процент свободы от ФП и ТП регистрировали в группе аблации ганглионарных сплетений – 33,2%. Наилучшие результаты получены в группе, где выполняли фрагментацию ЛП – 48,6%. Полученные различия в группах оказались статистически незначимы (p = 1,0).
Двухвыборочный анализ между группой изоляции ЛВ и группой фрагментации ЛП не выявил статистически значимой разницы в свободе от ФП и ТП в отдаленном периоде: log-rank test, p = 0,43, F-критерий Кокса, p = 0,23. Не найдена статистически значимая разница в свободе от ФП и ТП между группами АКШ + ИЛВ и АКШ + ГС: log-rank test, p = 0,58, F-критерий Кокса, p = 0,34. Также не обнаружено статистически значимое отличие в свободе от ФП и ТП между группой фрагментации ЛП и группой аблации ГС: log-rank test, p = 0,21, F-критерий Кокса, p = 0,13.
С помощью однофакторного и многофакторного регрессионного анализа с построением модели Кокса выявили факторы, влияющие на рецидив ФП в отдаленном периоде у больных с длительно персистирующей ФП. Такие показатели, как пол, функциональный класс стенокардии, фракция выброса ЛЖ, и сопутствующие заболевания, например ожирение, сахарный диабет, нарушения мозгового кровообращения, артериальная гипертензия, не оказывали значимого влияния на рецидив ФП в отдаленном периоде после операции. Пороговое значение для включения фактора в многофакторную модель считали за 0,25. Данные представлены в табл. 4.
По данным многофакторного анализа, достоверное влияние на частоту возникновения рецидивов ФП оказывали размер левого предсердия более 6,5 см (ОШ 1,18; ДИ 1,01–1,75; p = 0,043) и длительный (более 10 лет) стаж аритмии (ОШ 1,07; ДИ 0,23– 5,03; p = 0,038).
Проаритмогенный эффект радиочастотной аблации длительно персистирующей фибрилляции предсердий
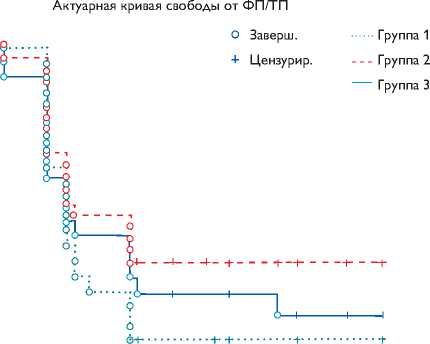
В отдаленном периоде трепетание предсердий выявили у 3 пациентов группы АКШ + ИЛВ (9,7%), причем у 1 – левопредсердное трепетание и у 2 – типичное, в группе АКШ + ММ – 1 типичное трепетание (2,7%) и в группе АКШ + ГС – у 2 больных левопредсердное трепетание предсердий (6,7%). Свобода от левопредсердного трепетания в трех группах представлена на рис. 2.
1,04
1,02
1,00
0,98
0,94
0,92
0,90
0,88
0,86
0,84 0
о Заверш.
4- Цензурир.
Группа 1
Группа 2
Группа 3
Время после операции, мес.
Рис. 2. Свобода от левопредсердного трепетания в трех группах после радиочастотной абляции у больных с длительно персистирующей фибрилляцией предсердий
Свобода от левопредсердного трепетания в группе АКШ + ИЛВ составила 90,3%. В группе АКШ + ММ выявили только один случай типичного трепетания, его купировали электродвижущей силой в послеоперационном периоде. Свобода от ТП составила 97,3%. В группе аблации ганглионарных сплетений выявили два случая левопредсердного трепетания, свобода от трепетания в этой группе составила 93,3%. По данным электрофизиологического исследования, выполненного при повторной госпитализации пациента, выявили источник возникшего трепетания. Нанесением нескольких аппликаций в указанной зоне трепетание купировали. Во втором случае трепетание предсердий купировали сверхчастой стимуляцией предсердий. Тем не менее статистически значимой разницы в возникновении левопредсердного трепетания предсердий между группами не выявили: между группами АКШ + ИЛВ и АКШ + ММ, log-rank test, p = 0,19, F-критерий Кокса, p = 0,09; между группами АКШ + ИЛВ и АКШ + ГС, log-rank test, p = 0,75, F-критерий Кокса, p = 0,32; между группами АКШ + ММ и АКШ + ГС log-rank test, p = 0,36, F-критерий Кокса, p = 0,35.
Обсуждение
В работе исследовали проблему хирургического лечения наиболее распространенных в мире заболеваний сердечно-сосудистой системы – ишемической болезни сердца в сочетании с фибрилляцией предсердий. В условиях тахиаритмии наиболее уязвимыми оказываются больные с нарушением коронарного кровоснабжения. Частота встречаемости фибрилляции предсердий при ИБС достигает 34,5% [9]. Летальность больных с ФП в два раза превышает смертность у лиц соответствующего возраста и пола без этого нарушения ритма сердца [10]. Если пациенту предстоит операция на сердце, то наличие у него ФП является дополнительным независимым фактором риска неблагоприятных исходов в послеоперационном периоде [3].
Медикаментозная терапия не решает основную задачу в лечении ФП: сохранение синусового ритма и профилактика ее рецидива часто не выполнимы, несмотря на использование антиаритмических препаратов. У половины больных ФП антиаритмическая терапия оказывается неэффективной через один год и у 84% – в течение двух лет [11].
За последние 30 лет катетерные технологии и хирургические методы с использованием менее травматичных видов воздействия получили развитие в лечении фибрилляции предсердий.
Независимо от многообразия аблационных методик, обязательным условием для успешного лечения ФП является изоляция легочных вен. Применение дополнительных линий по крыше левого предсердия и в зоне митрального истмуса [7] способствует устранению множественных микрориентри и рекомендуется при лечении персистирующей и длительно персистирующей фибрилляции предсердий. Такой же подход демонстрируют Ардашев А.В. и соавторы (2008), предлагая методику, сочетающую изоляцию легочных вен и модификацию анатомического субстрата в левом предсердии при лечении пациентов с хронической фибрилляцией предсердий [6].
Помимо изоляции устьев легочных вен, изолированной или в сочетании с дополнительными линиями в левом предсердии, 10 лет назад появилась методика патогенетического воздействия на механизмы ФП – аблация ганглионарных сплетений. Впервые применил аблацию ГС в качестве самостоятельного метода лечения фибрилляции предсердий Platt М. в 2004 г. и получил положительный результат: удалось восстановить синусовый ритм у 84% больных [12]. Однако срок наблюдения был коротким и составил 6 мес. Отдаленные результаты вмешательства не столь оптимистичны: через 8 мес. наблюдения в исследовании Lemery R. эффективность аблации ГС у больных с пароксизмальной и персистирующей ФП составила лишь 50%. Учитывая эпикардиальное расположение ганглионарных сплетений, можно предположить, что при операциях на открытом сердце больше технической возможности у хирурга произвести аблацию этих зон, что и сделали в данном исследовании, отдельные результаты которого опубликовали ранее [13].
Доказать эффективность операции по устранению аритмии невозможно без анализа свободы от данного вида аритмии, поэтому золотой стандарт для оценки эффективности новых методик устранения ФП – свобода от фибрилляции предсердий/тре-петания предсердий/тахикардии.
Отметим принятое в ННИИПК им. акад. Е.Н. Мешалкина правило: если больному, страдающему фибрилляцией предсердий, предстоит открытая операция на сердце, в большинстве случаев следует устранить ее во время операции. Это согласуется с рекомендациями ведущих европейских и мировых экспертов по лечению аритмии (HRS/EHRA/ECAS): «С учетом результатов клинических испытаний и накопленного опыта мы считаем, что проведение данных операций допустимо у всех пациентов с симптомной ФП, которым показаны кардиохирургические вмешательства по другим причинам. В данном случае при выполнении операции опытным хирургом имеется значительная вероятность успеха. При вмешательстве в области левого предсердия должна выполняться изоляция устьев легочных вен, при этом целесообразно создание линии абляции, соединяющей зону воздействия с кольцом митрального клапана».
В данном исследовании выполняли различные способы аблации длительно персистирующей ФП и проводили сравнительную оценку их эффективности. По результатам выявили, что у больных с длительно персистирующей формой аритмии нет статистически значимых различий между группами изоляции легочных вен, фрагментации левого предсердия и аблации ганглионарных сплетений как по характеру течения раннего послеоперационного периода, так и частоте развития осложнений в отделении реанимации. Пятилетняя выживаемость составила в группе изоляции легочных вен 96,8%, в группе фрагментации левого предсердия – 100% и в группе аблации ганглионарных сплетений – 96,7%. По данным отчетов, полученных при опросе аппарата длительного мониторирования, к третьему году синусовый ритм сохранялся у 38,7% пациентов группы АКШ + ИЛВ, через 3 года после операции синусовый ритм был у 48,6% больных группы АКШ + ММ, свобода от ФП составила 33,3% в группе АКШ + ГС. Согласно консенсусному документу, минимально приемлемая отсроченная эффективность в качестве объективной конечной точки клинического испытания у пациентов с длительно персистирующей ФП при наблюдении в течение 12 мес. должна составлять 30% [14]. В данном исследовании свобода от ФП/ ТП через 12 мес. после выполнения всех методик аблации составляла 68–73% и также достоверно не отличалась между группами. В исследовании мы проанализировали проаритмогенный эффект различных видов аблации ФП. Свобода от левопредсердного трепетания в группе изоляции легочных вен составила 90,3%, в группе фрагментации – 97,3%, в группе аблации ганглионарных сплетений – 93,3%. Тем не менее статистически значимой разницы в возникновении левопредсердного трепетания между группами не выявили. Левопредсердные тахикардии и тре- петание нередко регистрируются после аблации ФП. Является ли возникновение левопредсердного трепетания после аблации ФП проаритмическим осложнением процедуры или маркером эффективности, свидетельствующим о значительной модификации электрофизиологического субстрата после процедуры, остается предметом дискуссий. Так, некоторые исследователи рассматривают левопредсердное трепетание в качестве признака частичного успеха процедуры [15].
Выводы
-
1. У пациентов ишемической болезнью сердца с длительно персистирующей фибрилляцией предсердий только радиочастотная фрагментация левого предсердия, выполненная во время коронарного шунтирования, позволяет достигнуть удовлетворительных результатов в отдаленном периоде, эффективность составляет 48,65%.
-
2. Предикторами возврата аритмии в отдаленном периоде у больных с длительно персистирующей фибрилляцией предсердий являются размер левого предсердия более 6,5 см и длительный (более 10 лет) стаж аритмии.
-
3. Аблация ганглионарных сплетений, выполненная одномоментно с коронарным шунтированием, у пациентов с длительно персистирующей фибрилляцией предсердий имеет низкую эффективность в отдаленном периоде (33,3%) и не может быть самостоятельной методикой лечения.
Список литературы Эффективность различных способов аблации длительно персистирующей фибрилляции предсердий во время коронарного шунтирования
- Бокерия Л.А., Ревишвили А.Ш., Ольшанский М.С. Хирургическое лечение фибрилляции предсердий: опыт и перспективы развития//Грудная и сердечно-сосудистая хирургия. 1998. №1. С. 7-14.
- Roy D., Talajic М., Dorian Р., Connolly S., Eisenberg M.J., Green M., Kus T., Lambert J., Dubuc M., Gagne P., Nattel S., Thibault B. Amiodarone to prevent recurrence of atrial fibrillation. Canadian Trial of Atrial Fibrillation Investigators//N. Engl. J. Med. 2000. Vol. 342. N= 13. P. 913-920.
- Rogers Ch.A., Angelini G.D., Lucy A. Culliford L.A., Capoun R., Ascione R. Coronary Surgery in Patients With Preexisting Chronic Atrial Fibrillation: Early and Midterm Clinical outcome//Ann. Thorac. Surg. 2006. Vol. 81. N= 5. P. 1676-1682.
- De Vos C.B., Breithardt G., Camm A.J., Dorian P., Kowey P.R., Le Heuzey J.Y., Naditch-Вшiё L., Prystowsky E.N., Schwartz P.J., Torp-Pedersen C., Weintraub W.S., Crijns H.J. Progression of atrial fibrillation in the REgistry on Cardiac rhythm disORDers assessing the control of Atrial Fibrillation cohort: clinical correlates and the effect of rhythm-control therapy//Am. Heart. J. 2012. Vol. 163. № 5. P. 887-893 DOI: 10.1016/j.ahj.2012.02.015
- Sanders P., Berenfeld О., Hocini M., Ja'is P., Vaidyanathan R., Hsu L.F., Garrigue S., Takahashi Y., Rotter M., Sacher F., Scavee C., Ploutz-Snyder R., Jalife J., Ha'issaguerre M. Spectral analysis identifies sites of high-frequency activity maintaining atrial fibrillation in humans//Circulation. 2005. Vol. 112. № 6. P. 789-797.
- Ардашев A.B., Желяков Е.Г., Долгушина E.A., Рыбаченко М.С., Мангутов Д.А., Конев А.В., Волошко С.В., Врублевский О.Ю., Крючко М.В., Ливенцева Э.Н. Радиочастотная катетерная абляция хронической формы фибрилляции предсердий методом изоляции легочных вен и анатомической модификации субстрата аритмии//Кардиология. 2008. № 12. С. 41-48.
- Jais Р., Hsu L.F., Rotter М. Mitral isthmus ablation for atrial fibrillation//J. Cardiovascular Electrophysiol. 2005. Vol. 16. № 11. P. 1157-1159.
- Cherniavsky A., Kareva Y., Рак I., Rakhmonov S., Pokushalov E., Romanov A., Karaskov A. Assessment of results of surgical treatment for persistent atrial fibrillation during coronary artery bypass grafting using implantable loop recorders//Interactive. Cardio Vascular and Thoracic Surgery. 2014. Vol. 18. № 6. P. 727-731 DOI: 10.1093/icvts/ivu016
- Damiano R.J. Jr., Gaynor S.L., Bailey M., Prasad S., Cox J.L., Boineau J.P., Schuessler R.P. The long-term outcome of patients with coronary disease and atrial fibrillation undergoing the Cox maze procedure II J. Thorac. Cardiovasc. Surg. 2003. Vol. 126. № 6. P. 2016-2021.
- Falk R.H. Atrial Fibrillation//N. Engl. J. Med. 2001. Vol. 344. № 14. P. 1067-1078.
- Lundstrom T., Ryden L. Chronic atrial fibrillation. Longterm results of direct current conversion//Acta Medica Scandinavica. 1988. Vol. 223. № 1. P. 53-59.
- Piatt M., Mandapati R., Scherlag B.J. et al. Limiting the number and extent of radiofrequency applications to terminate atrial fibrillation and subsequently prevent its inducibility//Heart Rhythm. 2004. Vol. 1. P. 11-15.
- Чернявский A.M., Рахмонов C.C., Пак И.А., Карева Ю.Е., Покушалов E.A. Оценка эффективности эпикардиальной радиочастотной аблации анатомических зон ганглионарных сплетений левого предсердия у больных ишемической болезнью сердца и фибрилляцией предсердий//Патология кровообращения и кардиохирургия. 2014. Т. 18. №1. С. 14-19.
- Calkins Н., Kuck К.Н., Cappato R., Brugada J., Camm J. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: Recommendations for Patient Selection, Procedural Techniques, Patient Management and Follow-up, Definitions, Endpoints, and Research Trial Design//Heart Rhythm. 2012. Vol. 9. № 4. P. 632-696.e21 DOI: 10.1016/j.hrthm.2011.12.016
- Ammar S., Hessling G., Reents T., Fichtner S., Wu J., Zhu P., Kathan S., Estner H.L.,Jilek C., Kolb C., Haller B., Deisenhofer I. Arrhythmia type after persistent atrial fibrillation ablation predicts success of the repeat procedure//Circ. Arrhythm. Electrophysiol. 2011. Vol. 4. Nb 5. P. 609-614. doi: 10.1161/CIRCEP.111.963256.


