Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации
Автор: Казюлин А.Н., Вельшер Л.З., Бяхов М.Ю., Королева И.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные статьи, собственные исследования
Статья в выпуске: 3 (7), 2013 года.
Бесплатный доступ
В статье описываются литературные данные о частоте, механизмах, факторах риска гепатотоксичности при проведении противоопухолевой лекарственной терапии у больных различными онкологическими заболеваниями. Представлено обоснование и клинический опыт, позволяющий сделать вывод о высокой эффективности использования адеметионина (Гептрала) для преодоления данного осложнения полихимиотерапии. Представлены результаты собственного трехэтапного исследования, позволяющие сделать вывод о высокой частоте гепатотоксичности при проведении полихимиотерапии; проведен анализ значимости ряда факторов риска. Доказано, что сопроводительная терапия адеметионином (Гептралом) у больных метастатическими формами рака с факторами риска ГТ способствует удержанию уровня синдромов холестаза и цитолиза, позволяющего у большинства больных продолжить проводимую схему полихимиотерапии.
Лекарственная терапия, сопроводительная терапия, адеметионин, гептрал
Короткий адрес: https://sciup.org/14045464
IDR: 14045464
Текст научной статьи Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации
Л. З. Вельшер — ГОУ ВПО Московский государственный медико-стоматологический университет, заведующий кафедрой онкологии и лучевой терапии.
М. Ю. Бяхов — ГБУЗ МКНЦ Департамента здравоохранения г. Москы, профессор.
Противоопухолевая лекарственная терапия достоверно увеличивает безрецидивную и в ряде случаев общую выживаемость онкологических больных [1; 2]. Однако, необходимость достаточно длительного лечения, большое число его осложнений и, как следствие, ухудшение качества жизни у таких пациентов с потерей трудоспособности, ограничением достижения максимального эффекта, возможностью летального исхода ставят проблему преодоления токсиче-
Лекарственные средства
Фаза 1 (Ферменты цитохрома Р 450)
Промежуточный метаболизм
Фаза 2 (коньюгация)
Фаза 3 (Выведение из организма)
Окисление
Гидратация Дегалог
енизация
Сульфурирование
ия
е ионом илирование Соединение с аминокислотами Метилирование
-
• с желчью
-
• с мочой
Рисунок 1. Метаболизм лекарственных веществ в печени ских реакций у больных, получающих полихимиотерапию, в ряд первоочередных медицинских и социально значимых проблем [3-6].
Печень является одним из главных органов-мишеней для токсического воздействия химиотерапевтических средств, что обусловлено рядом факторов.
Печень, расположенная между абсорбирующей поверхностью желудочно-кишечного тракта и лекарственными мишенями по всему телу, занимает центральное место в метаболизме практически всех инородных веществ [7]. Это приводит к тому, что лекарственные средства, особенно обладающие выраженным эффектом «первого пассажа», часто в высокой концентрации попадают непосредственно в печень. Метаболизм лекарственных веществ в печени можно, хотя и несколько условно, разделить на три фазы: I фаза — метаболизм ле- карств с участием системы микросомальной фракции гепатоцитов, монооксигеназ, цитохром С – редуктазы и цитохрома Р 450. II фаза — биотрансформация, которой подвергаются лекарства или их метаболиты. III фаза — активный транспорт и экскреция биотрансформиро-ванных продуктов с желчью и мочой [7; 9-12] (рис. 1). Причем токсическое воздействие препаратов и/или их метаболитов может осуществляться на любом из этих этапов.
Адаптировано по: Grant D. M. Detoxification pathways in the liver. Inherit Metab. Dis. // 1991. — Vol. 14. № 4. — P. 421-430 [8].
К настоящему времени изучены и иные механизмы повреждения печени при приеме лекарственных препаратов, например, механизм иммунной гепатотоксичности (ГТ). Лекарственное вещество или его метаболит могут оказаться гаптеном для белков пече- ночной паренхимы, вызывая ее иммунное повреждение [8; 10; 13]. При поражении печени лекарственными препаратами, метаболизирующимися в ней, возникает эффект «обратной связи», когда вследствие нарушения функции гепатоцитов в плазме крови повышается концентрация используемого препарата, что усиливает ГТ. Особую опасность приобретает это поражение при использовании цитостатических средств, выделяющихся с желчью [14; 15]. Значительную роль в повреждении печени играет синдром «лизиса опухоли» под влиянием цитостатической терапии с эндогенной интоксикацией [4], а также сопутствующие интоксикации за счет вирусной, грибковой, бактериальной инфекции и др.
Данные о частоте гепатотоксичности (ГТ) при проведении химиотерапии варьируют от 14,3 до 100% [14; 16-19]. Подобные существенные различия в выявлении данного побочного эффекта могут быть обусловлены различными механизмами действия цитостатических агентов, в т. ч. их повреждающим действием на печень, отличиями в методиках и критериях выявления ГТ. Затруднению определения этиологического фактора поражения печени при проведении химиотерапии способствует массивная сопутствующая терапия, наличие метастатического поражения печени, иммунодепрессия, обусловленная как самой опухолью, так и проводимым лечением, инфицирование вирусами гепатита, злоупотребление алкоголем, фоновый стеатоз печени и многое другое [20].
Необходимо отметить, что различные химиотерапевтические средства потенциально могут вызвать различные виды поражения печени [21-23]:
Алкилирующие агенты (циклофосфан, иофосфамид, мелфаланорамбуцил). Могут приводить к развитию центролобулярного или перипортального повреждения, холестаза, в ряде случаев на фоне холестаза развивается воспаление;
Антиметаболиты (фторурацил, меркаптопурин, метотрексат, гемцитабин). Способны вызывать развитие венооклюзионной болезни, холестаз и оказывают непосредственное цитотоксическое действие на гепатоциты;
Производные нитрозомочевины (карму-стин, ломустин). Приводят к истощению внутри-печеночных запасов глутатиона, что увеличивает риск оксидативного повреждения печени;
Противоопухолевые антибиотики (доксорубицин, блеомицин, митомицин, дактиномицин, митоксантрон). Способны повреждать мембрану гепатоцитов с образованием свободных радикалов;
Винкаалкалоиды, таксаны . Потенциально вызывают различные токсические повреждения печени, включая НАСГ;
Производные платины. Способны вызывать жировой гепатоз, НАСГ, веноокклюзионную болезнь;
Интерфероны, интерлейкины. Активируют T-киллеры и увеличивают экспрессию провоспалительных цитокинов, а также могут оказывать прямое токсическое повреждение гепатоцитов;
Гормонотерапия (тамоксифен, антиандрогены). Может привести к развитию холестаза;
Таргетная терапия (бевацизумаб). Способна вызвать синусоидальную дилатацию.
К препаратам, в наибольшей степени оказывающим токсическое воздействие на печень, относятся метотрексат, циклофосфамид, фто-рурацил, доксорубицин, эпирубицин [14; 15].
ГТ на фоне проведения химиотерапии, являясь безусловным проявлением лекарственной ГТ, имеет свои особенности. Анализ литературных и собственных данных позволил выделить следующие факторы риска ГТ [4; 9; 11; 12; 23; 24-29]:
Полипрагмазия. Если пациент принимает одновременно шесть или более препаратов, вероятность побочного действия у него достигает 80%;
Табакокурение. Приводит к снижению легочного метаболизма ксенобиотиков;
Употребление алкоголя. Повышает риск ГТ при сочетании химиотерапии и алкогольной болезни печени и индукцию ферментов, участвующих в метаболизме препаратов;
Ожирение. Приводит к метаболическому синдрому, неалкогольному стеатогепатиту (снижению функциональных способностей гепатоцитов);
Преклонный возраст (старше 65 лет). Вследствие прогрессивного снижения функциональных способностей гепатоцитов, массы печени, полиморбидности (доказано только для женщин);
Вирусный гепатит. 30-40% пациентов с острым лекарственным гепатитом страдают одновременно вирусным и/или алкогольным заболеваниями печени;
Исходное повышение уровня билирубина . Повышает вероятность развития ГТ вне зависимости от причины;
Исходное повышение уровня щелочной фосфатазы. Повышает вероятность развития ГТ вне зависимости от причины;
Исходное повышение уровня АЛТ. Повышает вероятность развития ГТ вне зависимости от причины;
Дозирование препарата без учета индивидуальных особенностей больного. Необходим учет сопутствующих заболеваний и тяжести состояния больного;
Высокая кумулятивная доза. Прослеживается отчетливая корреляционная связь;
Одновременное употребление ряда продуктов и лекарственных препаратов. Совместный прием химиопрепаратов, лекарств и пищевых средств, являющихся индуторами и ингибиторами, влияет на метаболизм химиопрепаратов в печени;
Тяжелые заболевания сердечно — сосудистой системы, почек. Приводят к снижению элиминации ксенобиотиков;
Бедное белками питание. Способствует снижению уровня белков-носителей, нарушению путей метаболизма;
Метастазы в печени. Уменьшают функциональный объем печени, вызывают перифокальное воспаление.
Соответственно, с учетом высокого риска развития ГТ на фоне проведения полихимиотерапии онкологических заболеваний, заведомо ухудшающей прогноз эффективности лечения, и, соответственно, уменьшающей качество жизни, длительность безрецидивного периода и общую выживаемость, крайне актуальным стал вопрос поиска оптимальных схем сопроводительной терапии, позволяющей преодолеть данное лекарственное поражение печени.
Результаты многочисленных экспериментальных и клинических исследований демонстрируют значимый терапевтический эффект при использовании препаратов из группы ге-патопротекторов при лекарственной ГТ [9; 14; 15]. В наиболее распространенном понимании, это класс препаратов, которые независимо от механизма действия повышают функциональную способность клеток печени к синтезу, дезинтоксикации и выведению различных биологических продуктов, поддерживают устойчивость гепатоцитов к различным патогенным воздействиям и стимулируют регенерацию гепатоцитов. Эффект применения некоторых препаратов изучался в исследованиях по влиянию на объективные показатели функционального состояния печени. Однако действие ряда препаратов изучалось в неконтролируемых исследованиях с использованием недостаточно объективных критериев. Более того, некоторые из препаратов, которые производители относят к гепатопротекторам, являются потенциально вредными и способны оказывать гепатотоксический эффект [9; 11-13; 25-28; 30; 31].
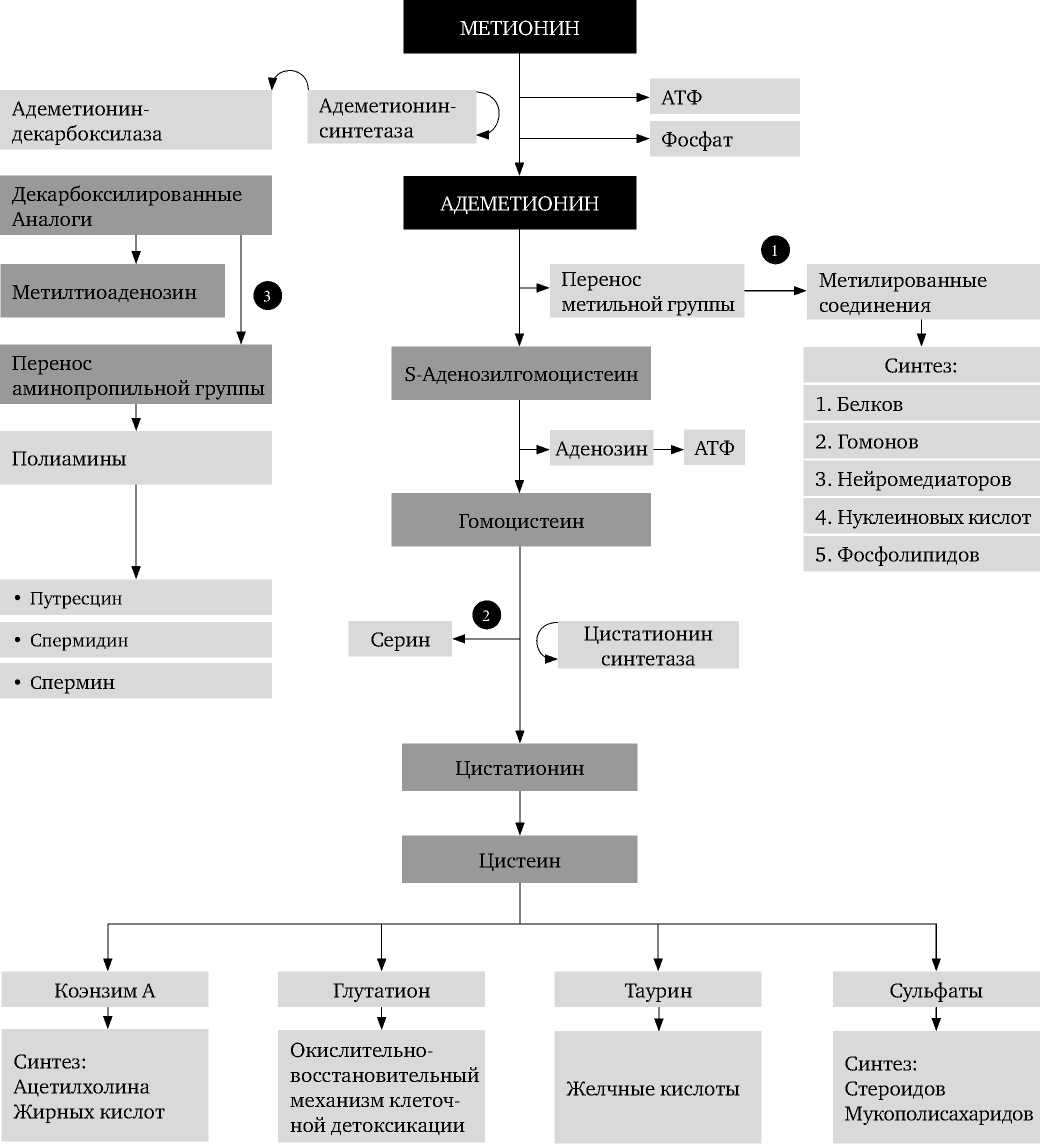
Большинство поражений печени приводит к снижению активности S-аденозил-метионинсинтетазы, что закономерно влечет за собой нарушения продукции адеметионина и биологических реакций. Адеметионин — природное вещество, эндогенно синтезируемое из метионина и аденозина. Это кофермент, принимающий участие в реакциях переноса метильных групп. Впервые был описан в Италии Г. Л. Кантони в 1952 г. S-аденозилметионин образуется из АТФ и метионина ферментом метионин аденозилтрансферазой.
Выделяют 7 эффектов действия адемети-онина: детоксикационный, антиоксидантный, холеретический, холекинетический, антиде-прессивный, нейропротективный, регенерирующий [32-36]. Адеметионин участвует в трех наиболее важных метаболических процессах: трансметилировании, транссульфурировании и аминопропилировании (Рис. 2).
Цит. по: Stramentinoli G., 1987 [38];
Friedel H. A. et al., 1989 [39] в адаптации Ларионовой В. Б. и Горожанской Э. Г., 2010 [35].
Соответственно, как следует из данных проведенных исследований [32-35; 40-46] в случаях лекарственной ГТ с позиций доказательной медицины к числу наиболее эффективных препаратов относится S-аденозил-L-метионин. Причем, особую значимость имеют работы, посвященные коррекции лекарственных поражений печени при лечении онкологических больных, когда отмена препарата, вызвавшего лекарственную ГТ, значительно ухудшает эффективность лечения, прогноз для жизни.
В отечественном открытом клинико-биохимическом исследовании, проведенном в ГУ РОНЦ им. Н. Н. Блохина РАМН наблюдались 44 больных с гемобластозами с ГТ. В схемы

Трансметилирование
Транссульфирование
Аминопропилирование
Рисунок 2. Основные метаболические пути с участием адеметионина
Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации лечения был включен S-аденозил-L-метионин (Гептрал) в дозе 400-800 мг внутривенно либо внутримышечно или по 400-800 мг перорально 2 раза в сутки до устойчивой нормализации функционального состояния печени, продолжительность курса лечения составляла не менее 30 дней. Пациентам с факторами риска ГТ препарат назначали на весь период химиотерапии. В период восстановления гемопоэза отмечалась тенденция к снижению маркеров синдромов холестаза и цитолиза, нормализация уровня маркеров оксидативного стресса, уменьшение проявлений энцефалопатии [32-34]. Защитное действие адеметионина (Гептрала) позволяет сокращать число вынужденных изменений протоколов полихимиотерапии, связанных с поражением печени.
Полученный эффект позволил данному коллективу продолжить исследование на группе из 60 больных с увеличением дозы адемети-онина (Гептрала) до 800-1600 мг внутривенно или внутримышечно либо перорально в суточной дозе 800/1200-1600мг. Назначение способствовало нормализации редоксного состояния крови, достоверному снижению маркеров цитолиза и холестаза [35].
Доказательной является серия работ, проведенных итальянскими исследователями. Описаны результаты открытого исследования эффективности использования адеметионина (Гептрала) по 400 мг 2 раза в сутки у 50 больных с колоректальной карциномой (38) и раком молочной железы (12) и впервые развившейся ГТ на фоне лечения комбинацией ралтитрекседа и оксиплатина, схемы FOLFIRI или схемы CMF.
К концу 2 недели на лечение ответили 70% больных, у которых отмечено достоверное снижение уровня АСТ, АЛТ, ЛДГ вне зависимости от наличия или отсутствия метастазов в печень. Защитный эффект сохранялся на протяжении последующих курсов химиотерапии, значительно снижая частоту переноса курсов или снижения дозы химиотерапевтических препаратов [44].
В 2011 г. опубликованы результаты исследования роли S-аденозил-L-метионин в профилактике FOLFOX-индуцированной ГТ у 105 пациентов с колоректальным раком, получавших адъювантную терапию FOLFOX (лейковорин, оксиплатин, 5-фторурацил). Больные были рандомизированы на 2 группы: в группе сравнения больные получали только полихимиотерапию, в интервенционной группе 60 пациентов в первые сутки очередного этапа лечения однократно получали перорально per osпо 400 мг 2 раза в/сутки адеметионина (Гептрала). ГТ регистрировалась значительно и достоверно реже, выраженность ее была ниже в группе, получавшей данный препарат, чем в группе сравнения. Соответственно перенос курса, снижение дозы препаратов или отмена лечения отмечалась у 71% в группе больных, получающих сопроводительную терапию адеметионином (Гептра-лом) [45] и только у 14% в группе сравнения.
Подобный дизайн исследования применялся при наблюдении за 78 больными с метастатическим колоректальным раком. Больные были рандомизированы на 2 группы. 46 пациентов получали бевацизумаб + режим XELOX (оксиплатин + капецитабин) в течение 3 недель и 32 — дополнительно получали адеме-тионин (Гептрал) по 400 мг 2 раза в/сутки. Гептрал назначался с первого дня ПХТ на протяжении всего курса лечения. Так же, как и в вышеописанном исследовании, ГТ регистрировалась достоверно реже в группе, получавшей гепатопротектор, причем тяжесть ее в данной группе была значительно ниже, чем в группе сравнения. Изменение протокола лечения в виде переноса курса, снижения дозы, отмены химиотерапии в первой группе регистрировалась у всех 100% больных против 37,5% во второй группе [46].
В то же время остаются недостаточно изученными вопросы значимости различных факторов риска острой ГТ у онкологических больных, получающих полихимиотерапевтическое лечение; не уточнены факторы риска поздней ГТ.
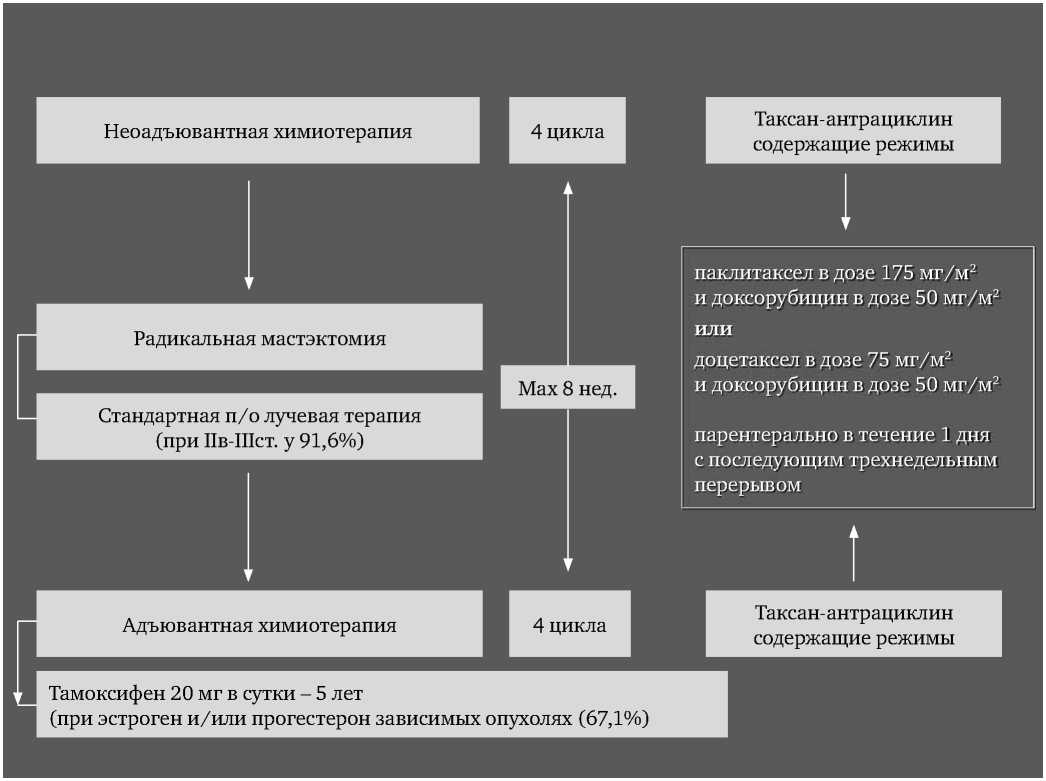
Рисунок 3. Схемы комбинированного/комплексного лечения
Крайне важным является выработка рекомендаций по проведению сопроводительной терапии при полихимиотерапии у больных с оноло-гической патологией, имеющих факторы риска развития острой ГТ.
С целью решения данных вопросов сотрудниками кафедр онкологии и лучевой терапии и пропедевтики внутренних болезней и гастроэнтерологии ГБОУ ВПО Московского государственного медико-стоматологического университета проведено трехэпапное исследование проблем ГТ у онкологических больных.
Первым этапом являлось проведение ретроспективного мультицентрового «случай-контроль» исследования на модели комбинированного и комплексного лечения рака молочной железы. В исследование «Комплексная оценка состояния внутренних органов при химиотерапии рака молочной железы» были включены 1643 больных в 4 клиниках г. Москвы и г. Самары за период 1993-2003 гг., пролеченных/проконсультированных в соответствии с медико-экономическими стандартами РМЖ. Результаты данного исследования обсуждались нами ранее [4; 25-29].
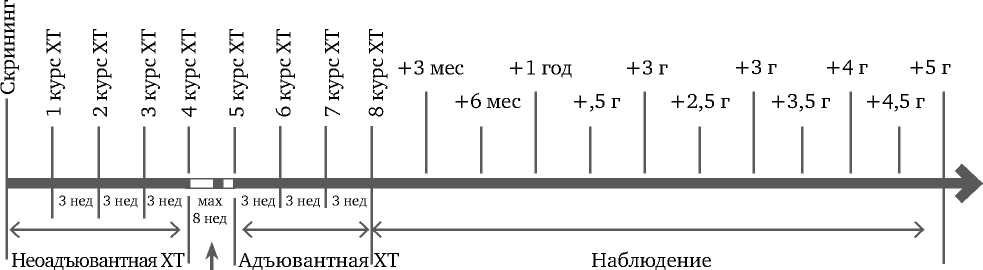
Возрастной диапазон больных был 28-72 года, 66,9% находилось в возрастной группе от 41 до 55 лет. Согласно протоколу исследования нами оценивалась токсичность только у тех пациенток, которые смогли окончить курс комбинированного и комплексного лечения РМЖ. То есть, явления ГТ не должны были превышать степень 1 и 2 во время плановых визитов. Схема комбинированного и комплексного лечения РМЖ и дизайн исследования отражены на рисунках 3 и 4.
Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации
Визит 5
Предоперационный период оперативное лечение послеоперационный период

Допустимые погрешности визитов
Визиты 1–4 и 6–9 – ± 7 дней
Визиты 1-–12 – ± 2 недели
Визиты 13–20 – ± 1 месяц
Рисунок 4. Схема протокола исследования
В числе различных видов токсичности проводилась оценка частоты острой ГТ, в соответствии с критериями Национального ракового института США (National Cancer Institute Cancer Therapy Evaluation Program: Toxicity Criteria) [47], которая выявлялась при обязательных визитах у 439 (26,7±1,2%) из всех больных. Дополнительно к плановым визитам зарегистрированы дополнительные визиты, связанные как с развитием или усугублением токсических реакций, так и в связи с наличием фоновой патологии. Частота острой ГТ с учетом внеплановых визитов была выше и составляла 39,1±1,8% (р<0,05). Данный прирост происходил в основном за счет увеличения частоты 2 степени (2,4±0,4 и 7,9±0,7%, соответственно, р<0,05) и появления ГТ 3 степени (в 4,2% случаев). Причина подобных отличий, на наш взгляд, очевидна: согласно стандартной процедуре обследования больного, получаю- щего химиотерапевтическое лечение, особенно в амбулаторных условиях или в условиях дневного стационара, контрольное клиникоинструментальное исследование осуществляется, как правило, перед проведением курса полихимиотерапии. Подобная тактика определенно помогает принять решение о возможности продолжения лечения в контрольные сроки и/или необходимости изменения доз препаратов, исходя из площади тела и/или изменения схемы лечения. В то же время, частота реальной ГТ на внеплановых визитах была значительно выше, так как определялась после проведения курса полихимиотерапии.
Следует отметить, что из 439 случаев с критериями острой ГТ, используемыми в нашем ретроспективном исследовании, только в 222 случаях (50,6%) в анализируемых историях болезни и амбулаторных картах мы встретили записи лечащего врача либо консуль- танта-гастроэнтеролога о наличии у больных лекарственной ГТ. В остальных случаях данное осложнение полихимиотерапии не привлекло внимание лечащих врачей.
При проведении корреляционного анализа нами был получен неожиданный эффект: возраст и масса тела не являлись факторами риска ГТ в наблюдаемой группе женщин с раком молочной железы при назначении полихимиотерапии с использованием таксанов и доксорубицина, что противоречит литературным данным и требует дальнейшего изучения вопроса.
Нами проведен анализ риска развития ГТ у лиц с исходно повышенными уровнями отдельных биохимических маркеров крови по сравнению с лицами с исходно нормальными серологическими показателями. При этом за критерий ГТ у лиц с изначально повышенными уровнями ферментов сыворотки крови принималось такое повышение их уровня, при котором изменялась степень ГТ. Риск развития ГТ оценивался за весь период наблюдения в целом.
Как видно из таблицы 1, исходно повышенные уровни АЛТ, АСТ, щелочной фосфатазы и билирубина являлись независимыми факторами риска развития ГТ.
Как видно из представленных в таблице 2 данных, наличие жирового гепатоза у пациентов не влияло существенным образом на развитие признаков ГТ. Шансы на развитие подобных признаков существенно увеличивались (ОШ составило 6,87%) при наличии у пациенток исходно признаков неалкогольного сте-атогепатита. Наличие вирусного поражения печени вне зависимости от биохимической активности вирусного поражения являлось независимым фактором значительного увеличения риска развития ГТ у наших больных.
У всех больных с отмеченной острой ГТ были зарегистрированы признаки гемато-, кардио- и панкреатоксичности. Это явилось основанием для проведения корреляционного анализа, который продемонстрировал наличие обратных корреляционных связей между уровнями маркеров острой ГТ и числом нейтрофилов, лейкоцитов, эритроцитов в периферической крови и маркерами ГТ (таблица 3); показателями глобальной систолической и диастолической функций левого желудочка и маркерами ГТ; значениями панкреатической амилазы крови и маркерами ГТ (таблица 4).
Таким образом, по данным 1 этапа исследования наличие исходно повышенных уровней АЛТ, АСТ, щелочной фосфатазы и би-
Таблица 1. Анализ риска развития ГТ у пациентов с исходно имеющимися отклонениями биохимических маркеров по сравнению с больными без таковых и отношение шансов ГТ между этими группами
|
Исходно нормальные уровни M [95%ДИ] |
Исходно увеличенные уровни M [95%ДИ] |
Отношение шансов M [95%ДИ] |
|
|
АЛТ |
22,6% [20,61%–24,73%] |
91,53% [81,65%–96,33%] |
36,99 [14,68-93,15] |
|
АСТ |
22,5% [20,56%–24,52%] |
81,08% [65,8%–95,62%] |
14,73 [6,41-33,80] |
|
ЩФ |
27,59% [25,47%–29,82%] |
86,96% [67,87%–95,46%] |
17,49 [5,17-59,16] |
|
Билирубин |
3,44% [2,65%–4,46%] |
47,22% [36,13%–58,60%] |
25,12 [14,69-42,95] |
Примечание: ДИ — доверительный интервал.
Таблица 2. Риск развития ГТ у больных раком молочной железы на фоне применения терапии таксанами и доксорубицином в зависимости от наличия исходно существующих состояний
|
Количество пациентов |
Отношение шансов развития гепатологической токсичности ОШ [95%ДИ] |
|
|
Жировой гепатоз |
550 |
1,0942 [0,8526-1,4043] |
|
Неалкогольный стеатогепатит |
42 |
6,8735 [3,4873-13,5479] |
|
Хронические вирусные гепатиты В и С. |
17 |
20,5991 [4,6915-90,4448] |
Примечание: ОШ — отношение шансов, ДИ — доверительный интервал.
Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации
Таблица 3. Данные корреляционного анализа уровня маркеров острой гепатотоксичности и острой гематотоксичности
|
Уровень гемоглобина |
Уровень лейкоцитов |
Уровень гранулоцитов |
|
|
АЛТ |
r = –0,558 (p < 0,05) |
r = –0,563 (p < 0,05) |
r = –0,577 (p < 0,05) |
|
АСТ |
r = –0,523 (p < 0,05) |
r = –0,544 (p < 0,05) |
r = –0,526 (p < 0,05) |
|
ЩФ |
r = –0,568 (p < 0,05) |
r = –0,596 (p < 0,05) |
r = –0,566 (p < 0,05) |
|
Билирубин |
r = –0,527 (p < 0,05) |
r = –0,508 (p < 0,05) |
r = –0,515 (p < 0,05) |
Таблица 4. Данные корреляционного анализа уровня маркеров острой гепатотоксичности и других видов острой токсичности
|
Уровень ФВ |
Уровень Ve/Va |
Уровень панкреатической амилазы |
|
|
АЛТ |
r = –0,589 (p < 0,05) |
r = –0,623 (p < 0,05) |
r = –0,562 (p < 0,05) |
|
АСТ |
r = –0,543 (p < 0,05) |
r = –0,574 (p < 0,05) |
r = –0,534 (p < 0,05) |
|
ЩФ |
r = –0,588 (p < 0,05) |
r = –0,566 (p < 0,05) |
r = –0,545 (p < 0,05) |
|
Билирубин |
r = –0,551 (p < 0,05) |
r = –0,534 (p < 0,05) |
r = –0,532 (p < 0,05) |
Примечание: ФВ — фракция выброса левого желудочка; Ve/Va — соотношение скоростей в фазы раннего и позднего диастолического наполнения левого желудочка.
лирубина, неалкогольного стеатогепатита и сопутствующей инфекции вирусными гепатитами В и С является фактором риска развития ГТ. ГТ часто сочетается с гематологической, кардиологической и панкреатической токсичностью, что следует учитывать при назначении курсов полихимиотерапии с использованием таксанов и доксорубицина у женщин с раком молочной железы. Сложность анализа роли факторов риска и трактовки маркеров ГТ определяет необходимость установления диагноза токсичности и назначения корригирующей и поддерживающей терапии онкологами совместно с гастроэнтерологами, гепатологами.
Только у 158 (36,0%) больных с наличием острой ГТ во время плановых визитов были предприняты меры по ее коррекции. Данным больным с момента выявления маркеров ГТ на весь срок лечения назначались препараты растительного происхождения перорально (33 больных), эссенциальные фосфолипиды с пероральным и парентеральным применением в соответствии с имеющимися рекомендациями (66 больных) и S-аденозил-L-метионин (Гептрал) с парентеральным и пероральным применением в соответствии с имеющимися рекомендациями (59
больных). Препараты урсодезоксихолевой кислоты не назначались из-за опасений усиления диарейного синдрома и тошноты, часто сопровождающих химиотерапевтическое лечение.
Ретроспективный анализ маркеров острой ГТ выявил отсутствие положительного влияния применения препаратов растительного происхождения, более того, у 12 из 33 больных было отмечено небольшое увеличение уровня маркеров ГТ. Данный эффект, вероятно, объясняется возможностью усиления холестаза при применении препаратов расторопши [Полунина Т. Е., 2009; 2011]. В то же время мы выявили положительный эффект применения эссенциальных фосфолипидов и адеметионина.
Для анализа эффективности применения гепатопротекторов при ГТ больные были разделены на 3 группы. В группу 1 были включены: а) больные РМЖ с признаками ГТ, выявленными нами, но которым диагноз ГТ не был поставлен во время лечения (n = 217); б) пациенты, у которых диагноз ГТ был установлен, но лечение не назначалось (n = 64); в) лица, которым проводилось лечение препаратами растительного происхождения (n = 33). Всего в данную группу были включены 314 женщин
Таблица 5. Основные биохимические показатели крови у больных раком молочной железы с ГТ к моменту окончания полихимиотерапии
|
Показатель |
Единица измерения |
КГ М±m |
1 группа (М±m) |
2 группа (М±m) |
3 группа (М±m) |
|
Общий белок |
г/л |
82,9±0,1 |
59,8±0,54* 2,3 |
64,2±0,17* 1, 3 |
77,8±0,9* 1,2 |
|
Альбумин |
г/л |
42,3±0,9 |
29,9±0,2* 1, 2 |
34,1±0,1* 1, 3 |
39,1±0,1* 1,2 |
|
Билирубин общий |
мкмоль/л |
11,6±0,4 |
17,1±0,9* |
16,9±1,0* |
13,1±1,71,2 |
|
Билирубин прямой |
мкмоль/л |
3,2±0,3 |
4,5±0,09* |
4,0±0,04* |
3,7±0,17 |
|
Холестерин |
ммоль/л |
4,8±0,2 |
5,2±0,6 |
5,1±0,4 |
4,82±0,9 |
|
АСТ |
ед/л |
21,4±3,4 |
71,9±4,9* 2,3 |
58,2±4,8*1, 3 |
43,6±5,2* 1,2 |
|
АЛТ |
ед/л |
19,4±1,2 |
63,9±3,1* 2,3 |
42,70±2,7*1,3 |
25,6±2,0* 1,2 |
|
ГГТП |
ед/л |
24,4±5,6 |
136,9±6,17* 2, 3 |
75,2±5,02* 1, 3 |
45,8±3,12* 1, 2 |
|
Щелочная фосфатаза |
ед/л |
174,5±5,6 |
261,7±10,2*2,3 |
228,6±10,7* 1 |
198,5±13,1 1 |
|
Креатинин |
мкмоль/л |
68,31±1,5 |
69,2±2,3 |
68,6±1,58 |
68,5±3,69 |
|
Мочевина |
ммоль/л |
4,58±0,2 |
5,21±0,8 |
4,91±0,8 |
4,36±0,3 |
Примечание: *- достоверность отличия от величины в КГ (р<0,05); 1- достоверность отличия от величины в 1 группе (р<0,05); 2- достоверность отличия от величины во 2 группе (р<0,05); 3- достоверность отличия от величины в 3 группе (р<0,05).
с РМЖ. В группу 2 вошли 66 больных, получавших по поводу ГТ эссенциальные фосфолипиды, в группу 3-59 пациенток, получавших S-аденозил-L-метионин (Гептрал). Все 3 группы были близки по половому составу, возрасту, частоте фоновых заболеваний печени, уровню маркеров цитолиза и холестаза.
По данным обязательных визитов, как видно из таблицы 5, в группе 1 средний уровень маркеров ГТ к окончанию проведения химиотерапии стойко превышал показатели в контрольной группе, в то же время в группах 2 и 3 мы отметили тенденцию к нормализации уровня маркеров к концу лечения, значительно более отчетливую в группе 3. Диспротеинемия была достоверно наибольшей (р<0,05) в группе 1 и достоверно наименьшей (р<0,05) — в группе 3. Уровень маркеров холестаза к концу лечения в группе 3 нормализовался, достоверно отличаясь от величин анализируемых маркеров в группах 1 и 2. В группе 2 величины маркеров холестаза испытали тенденцию к снижению по сравнению с группой 1, но продолжали отличаться от контрольных значений. Величины показателей холестаза в группе 1 к концу лечения значительно превышали уровни в контрольной группе и группе 3. Значения маркеров цитолиза достоверно (p<0,05) снизились в группах 2 и 3, причем в группе 3 они были достоверно (p<0,05) более низкими по сравнению с группами 1 и 2, хотя и продолжали несколько превышать уровни в контрольной группе.
Полученные на 1 этапе данные позволили сделать вывод о высокой частоте лекарственной ГТ при проведении химиотерапевтического лечения у онкологических больных (26,7% по данным обязательных визитов и 39,1% с учетом дополнительных визитов), что настоятельно требует сопроводительной терапии гепатопротекторами при полихимиотерапев-тическом лечении данных больных. Получены доказательства высокой эффективности применения S-аденозил-L-метионина (Гептрала) у данных больных, согласующиеся с результатами отечественных и зарубежных работ. Причем наиболее эффективным, по-видимому, является двухэтапное назначение препарата: вначале внутривенное введение с последующим переходом на пероральный длительный прием, предложенный сотрудниками ГУ РОНЦ им. Н. Н. Блохина РАМН [Снеговой А. В., 2010; Ларионова В. Б., 2008; 2008; 2008; 2010]
Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации
На 2 этапе исследования мы провели анализ факторов риска поздней ГТ, а также роли назначения гепатопротекторов на фоне острой ГТ в прогнозе поздней ГТ. Эффект назначения гепатопротекторов оценивался нами у 607 пациенток, истории болезни и амбулаторные карты которых были прослежены нами в течение всего 5-летнего периода наблюдения.
У 46 из 607 пациенток, истории болезни которых были прослежены за 5 лет, были признаки поздней ГТ. Все эти больные перенесли острую ГТ на фоне химиотерапии. Среди 98 пациенток, отнесенных на этапе 1 к группе 1, признаки поздней ГТ во время различных визитов были в 40 случаях (40,8%). Среди 24 больных, отнесенных на этапе 1 к группе 2, поздняя ГТ во время 10-16 визитов (в первые 3 года наблюдения) регистрировалась у 5 пациенток (20,8%). Из 25 лиц, отнесенных на этапе 1 к группе 3, биохимические признаки поздней ГТ были в 1 случае (4,3%), выявленные на 10-12 визитах (в первый год наблюдения). Средняя частота поздней ГТ среди больных, отнесенных к группе 1, была достоверно выше, чем в группах 2 и 3, и она выявлялась за весь 5-летний период наблюдения. Отмечена отчетливая тенденция к более низкой частоте и быстрой редукции поздней ГТ в группе 3 по сравнению с группой 2. Отсутствие статистической достоверности отличия частоты ГТ между группами 2 и 3 связано, очевидно, с небольшим количеством прослеженных больных в рамках данного ретроспективного исследования.
Данные этапа 2 позволили сделать вывод, что фактором риска поздней ГТ является перенесение острой ГТ. Причем сопроводительная двухэтапная терапия адеметионином (Гептралом) во время проведения полихимиотерапии позволяет в наибольшей степени минимизировать риск поздней ГТ, что подтверждает наше предположение, что ведение онкологических больных, получающих полихимиотерапию и имеющих факторы риска ГТ должно проводиться онкологами совместно с гастроэнтерологами, гепатологами.
— Близость потенциальной ГТ при применяемых схемах лечения.
Критериями исключения были:
-
— Первично-множественный рак;
-
— Тяжелое сопутствующее соматическое или психическое заболевание, требующее специального лечения, включая тяжелые инфекционные заболевания в активной форме на момент включения;
— Беременность.
За критерий ГТ у лиц с изначально повышенными уровнями ферментов сыворотки крови принималось такое повышение их уров- ня, при котором изменялась степень гепатотоксичности по этому маркеру в соответствии с рекомендациями Национального ракового института США.
Среди 250 пациентов у 76 (30,4%) имелся такой фактор риска острой ГТ, как наличие хронического вирусного гепатита (ХВГ) с минимальной активностью. Они были рандомизированы на 2 группы: группа 1 ХВГ (41боль-ной) и группа 2 ХВГ (35 больных).
Попытка выделить отдельные группы больных с такими факторами риска ГТ, как курение и злоупотребление алкоголем, не удалась, т. к. у пациентов было одновременное пристрастие к обоим психоактивным факторам, что не явилось неожиданностью, т. к. хорошо известно, что высокое потребление алкоголя, кофе и крепкого чая присуще курильщикам обоих полов.
Соответственно нами были выделены 104 пациента (41,6%), не прекративших курение и злоупотребляющих алкоголем, которые также были рандомизированы на 2 группы: группа 1 КА (53 больных) и группа 2 КА (51 больной). На 1 этапе исследования, в отличие от литературных данных, не было выявлено влияния возраста на риск ГТ, что, возможно, объяснялось искусственным селекционированием выборки. Данный эффект требовал дальнейшего изучения и мы включили в анализируемую группу 70 больных старше 60 лет, рандомизированных на 2 группы: группа 1 П (37 лиц) и группа 2 П (33 лица). Все три пары групп были сопоставимы по полу, возрасту, уровню биохимических маркеров холестаза и цитолиза, которые являлись независимыми факторами риска ГТ на этапе 1 исследования.
Больные групп 1 (основных) наряду с химиотерапией получали сопроводительную терапию адеметионином (Гептралом) по схеме 800 мг в сутки внутривенно капельно с первого дня химиотерапии первые 2 недели, затем перорально в суточной дозе 800 мг до окончания курса лечения. В группах 2 (контрольных) проводилась только химиотерапия.
Конечными точками наблюдения являлись стабилизация или частичная регрессия процесса, а также необходимость отмены лечения, переноса курса либо снижения дозы вследствие развившейся выраженной токсичности. Результаты анализа полученных данных представлены в таблицах 6-8.
Как видно из полученных данных у больных хроническим вирусным гепатитом В исходно имелись несколько повышенные уровни маркеров холестаза и цитолиза, что соответствовало минимальной активности гепатита. Проведение полихимиотерапии в группе 2 ХВГ привело к значительному и достоверному повышению уровня данных маркеров, что трактовалось нами как проявление лекарственной ГТ, выявлявшейся в 68,6% случаев, что, очевидно, и является истинной частотой ГТ у больных онкологическими заболеваниями и фоновой патологией в виде вирусного гепатита В, причем отмечалась значительная частота 2 и 3 степени токсичности. Развитие ГТ сочеталось со 100% необходимостью изменения схемы лечения, вплоть до ее отмены у половины пациентов, что является крайне неблагоприятным прогностическим фактором.
В то же время сопроводительная терапия адеметионином (Гептралом), благодаря своему гепатопротекторному эффекту, препятствовала прогрессированию синдромов холестаза и цитолиза, с достоверно (р < 0,05) более низким уровнем их маркеров по сравнению с контрольной группой. При этом ГТ в основной группе развилась только у 26,8%, больных, что существенно и достоверно ниже (р < 0,05), чем в контрольной группе. Соответственно отсутствие и более легкое течение ГТ у больных основной группы (в большинстве 1 степень токсичности при отсутствии 3 степени) позволили 63,4% больных завершить схему лечения с положительным эффектом. Причем необходимость отмены лечения (9,8% пациентов) также была существенно и достоверно (р < 0,05) ниже, чем в контрольной группе.
У больных, не прекративших курение и злоупотребляющих алкоголем, также отмечалось небольшое, но достоверное повышение уровня маркеров холестаза и цитолиза, что, очевидно, обусловлено токсическим действием этанола. На фоне проведения полихимиотерапии в группе 2 КА также, как и в группе 2 ХВГ, отмечено существенное усиление процессов холестаза и цитолиза с выраженным и достоверным (р < 0,05) повышением их маркеров. Частота ГТ к моменту окончания анализа в контрольной группе составляла 60,8%, что, по-видимому, и являлось истинной частотой ГТ у больных онкологическими заболеваниями, не прекративших курение и злоупотребляющих алкоголем при достаточно высокой частоте 2 и 3 степени токсичности. Соответственно, в данной подгруппе в 51% случаев потребовалось изменение
Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации
Таблица 6. Выраженность гепатотоксичности и необходимость изменения режима лечения в связи с ее развитием у больных онкологическими заболеваниями и фоновой патологией в виде хронического вирусного гепатита В.
|
Ед. измерения |
КГ n-30 |
Группа 1 ХВГ n — 41 |
Группа 2 ХВГ n-35 |
||||
|
Параметр |
До лечения |
После лечения |
До лечения |
После лечения |
|||
|
Возраст |
годы |
56,6±5,8 |
54,1±5,9 |
53,5±5,1 |
|||
|
мужчины |
% |
53,3 |
51,2 |
48,6 |
|||
|
женщины |
% |
46,7 |
48,8 |
51,4 |
|||
|
Билируб. об. |
мкмоль/л |
11,8±1,8 |
17,2±1,9* |
18,1±1,6* |
17,4±1,5 |
32,6±3,9 *1, 2 |
|
|
Билируб. пр. |
мкмоль/л |
3,1±0,2 |
4,9±0,3* |
5,1±0,4* |
4,8±0,3* |
6,4±0,4 *1, 2 |
|
|
ЩФ |
ед/л |
173,3±5,8 |
225,2±21,4 * |
231,3±19,7* |
219,9±20,4 * |
291,8±18,1 *1, 2 |
|
|
ГГТП |
ед/л |
24,1±2,7 |
47,7±4,7* |
49,8±4,9* |
48,1±4,7* |
137,7±4,3 *1, 2 |
|
|
АСТ |
ед/л |
22,4±2,6 |
44,2±3,5* |
55,6±5,3* |
45,5±3,9* |
133,9±8,9 *1, 2 |
|
|
АЛТ |
ед/л |
19,9±1,4 |
31,2±3,5* |
47,6±5,1* |
33,7±3,6* |
124,6±8, 2 *1, 2 |
|
|
ГТ-0 ст. |
% |
- |
100 |
73,2±5,1 |
100 |
31,4±7,8 1, 2 |
|
|
ГТ-1 ст. |
% |
- |
0 |
19,5±6,2 |
0 |
28,6±7,6 2 |
|
|
ГТ-2 ст. |
% |
- |
0 |
7,3±4,1 |
0 |
28,6±7,6 2 |
|
|
ГТ-3 ст. |
% |
- |
0 |
0 |
0 |
11,4±5,4 2 |
|
|
ГТ-4 ст. |
% |
- |
0 |
0 |
0 |
0 |
|
|
Изменение схемы лечения в целом |
% |
- |
- |
36,6±7,5 |
1002 |
||
|
Перенос курса |
% |
- |
- |
17,1±5,9 |
- |
22,9±7,1 |
|
|
Снижение дозы |
% |
- |
- |
9,8±4,6 |
- |
25,7±7,4 |
|
|
Отмена химиотерапии |
% |
- |
- |
9,8±4,6 |
- |
51,4±8,4 2 |
|
Примечание: *- достоверность отличия от величины в КГ (р<0,05); 1- достоверность изменения величины показателя в группе на фоне полихимиотерапии (р<0,05); 2- достоверность отличия от величины показателя в группе 1 ХВГ и группе 2 ХВГ (р<0,05).
Таблица 7. Выраженность гепатотоксичности и необходимость изменения режима лечения в связи с ее развитием у больных онкологическими заболеваниями не прекратившими курение и злоупотребление алкоголем.
|
Ед. измерения |
КГ n-30 |
Группа 1 |
КА n — 53 |
Группа 2 КА n-51 |
||
|
Параметр |
До лечения |
После лечения |
До лечения |
После лечения |
||
|
Возраст |
годы |
56,6±5,8 |
57,3±5,4 |
58,1±5,2 |
||
|
мужчины |
% |
53,3 |
58,5 |
62,9 |
||
|
женщины |
% |
46,7 |
41,5 |
37,1 |
||
|
Билируб. об. |
мкмоль/л |
11,8±1,8 |
16,8±1,6* |
17,9±2,0* |
16,7±1,3* |
29,1±2,5 *1, 2 |
|
Билируб. пр. |
мкмоль/л |
3,1±0,2 |
4,1±0,3* |
4,4±0,4* |
4,3±0,2* |
5,7±0,4 *1, 2 |
|
ЩФ |
ед/л |
173,3±5,8 |
216,2±17,0 * |
222,1±17,4* |
215,9±18,3 * |
279,5±18,0 *1, 2 |
|
ГГТП |
ед/л |
24,1±2,7 |
36,7±4,6* |
44,8±4,4* |
37,7±4,2* |
124,6±4,1 *1, 2 |
|
АСТ |
ед/л |
22,4±2,6 |
36,2±3,4* |
44,8±3,5* |
36,6±3,3* |
74,8±6,9 *1, 2 |
|
АЛТ |
ед/л |
19,9±1,4 |
33,3±3,1* |
41,6±3,3* |
33,7±3,6* |
66,7±6, 2 *1, 2 |
|
ГТ-0 ст. |
% |
- |
100 |
75,5±5,9 |
100 |
39,2±6,8 1, 2 |
|
ГТ-1 ст. |
% |
- |
0 |
18,9±5,4 |
0 |
37,3±6,8 1, 2 |
|
ГТ-2 ст. |
% |
- |
0 |
5,6±3,2 |
0 |
17,6±5,3 1, 2 |
|
ГТ-3 ст. |
% |
- |
0 |
0 |
0 |
11,4±5,4 1, 2 |
|
ГТ-4 ст. |
% |
- |
0 |
0 |
0 |
0 |
|
Изменение схемы лечения в целом |
% |
- |
- |
32,0±6,4 |
- |
51,0±7,02 |
|
Перенос курса |
% |
- |
- |
15,1±4,9 |
- |
15,7±5,1 |
|
Снижение дозы |
% |
- |
- |
9,4±4,0 |
- |
11,8±4,5 |
|
Отмена химиотерапии |
% |
- |
- |
7,5±3,6 |
- |
23,5±5,9 2 |
Примечание: *- достоверность отличия от величины в КГ (р<0,05); 1- достоверность изменения величины показателя в группе на фоне полихимиотерапии (р<0,05); 2- достоверность отличия от величины показателя в группе 1 КА и группе 2 КА (р<0,05).
Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации
Таблица 8. Выраженность гепатотоксичности и необходимость изменения режима лечения в связи с ее развитием у пожилых больных онкологическими заболеваниями.
|
Ед. измерения |
КГ n-30 |
Группа 1 |
П n — 37 |
Группа 2 П n-33 |
||
|
Параметр |
До лечения |
После лечения |
До лечения |
После лечения |
||
|
Возраст |
годы |
56,6±5,8 |
66,4±6,4 |
67,3±5,2 |
||
|
мужчины |
% |
53,3 |
40,5 |
42,4 |
||
|
женщины |
% |
46,7 |
59,5 |
57,6 |
||
|
Билируб. об. |
мкмоль/л |
11,8±1,8 |
13,8±1,5 |
15,1±2,2 |
13,5±1,6 |
25,1±2,7 *1, 2 |
|
Билируб. пр. |
мкмоль/л |
3,1±0,2 |
3,3±0,3 |
3,8±0,4 |
3,2±0,2 |
5,2±0,4 *1, 2 |
|
ЩФ |
ед/л |
173,3±5,8 |
185,1±18,2 |
199,1±17,4 |
183,3±17,8 |
259,8±19,9 *1, 2 |
|
ГГТП |
ед/л |
24,1±2,7 |
30,7±3,6 |
44,9±4,9* |
31,1±3,2 |
75,2±6,2 *1, 2 |
|
АСТ |
ед/л |
22,4±2,6 |
30,2±3,8 |
41,9±4,9* |
29,9±3,9 |
61,2±7,3 *1, 2 |
|
АЛТ |
ед/л |
19,9±1,4 |
23,3±3,2 |
34,6±3,3* |
24,9±3,6 |
52,1±6, 3 *1, 2 |
|
ГТ-0 ст. |
% |
- |
100 |
78,4±6,7 |
100 |
44,4±8,6 1, 2 |
|
ГТ-1 ст. |
% |
- |
0 |
18,9±6,4 |
0 |
33,3±8,2 2 |
|
ГТ-2 ст. |
% |
- |
0 |
2,7±2,7 |
0 |
16,2±6,4 2 |
|
ГТ-3 ст. |
% |
- |
0 |
0 |
0 |
6,1±4,2 1, 2 |
|
ГТ-4 ст. |
% |
- |
0 |
0 |
0 |
0 |
|
Изменение схемы лечения в целом |
% |
- |
- |
16,2±6,1 |
- |
42,4±7,02 |
|
Перенос курса |
% |
- |
- |
8,1±4,5 |
- |
12,1±5,7 2 |
|
Снижение дозы |
% |
- |
- |
5,4±3,7 |
- |
12,1±5,7 2 |
|
Отмена химиотерапии |
% |
- |
- |
2,7±2,7 |
- |
18,2±6,7 1,2 |
Примечание: *- достоверность отличия от величины в КГ (р<0,05); 1- достоверность изменения величины показателя в группе на фоне полихимиотерапии (р<0,05);
-
2- достоверность отличия от величины показателя в группе 1 П и группе 2 П (р<0,05).
схемы лечения, причем в 23,5% случаев полихимиотерапия была отменена вовсе. Хотя данные цифры в 2 раза ниже, чем у больных группы 2 ХВГ, тем не менее они свидетельствуют о выраженной роли курения и злоупотребления алкоголем в отношении прогноза онкологических больных.
Сопроводительная терапия адеметиони-ном (Гептралом) и у данной категории онкологических больных препятствовала выраженному нарастанию холестаза и цитолиза, с достоверно (р < 0,05) более низким уровнем их маркеров по сравнению с контрольной группой. При этом ГТ выявлялась только в 24,5% случаев, что достоверно (р < 0,05) ниже, чем в группе 2КА и протекание ее было существенно мягче (в основном в виде 1 степени токсичности и отсутствии 3 степени). Закономерно, что этот эффект способствовал достоверно (р < 0,05) более низкой частоте необходимости изменения схемы лечения, при этом отмена полихимиотерапии была необходима только в 7,5% случаев, что существенно и достоверно (р < 0,05) ниже, чем в группе 2 КА и 2 ХВГ и была близка к таковой у больных группы 1 ХВГ (9,8%).
У пожилых лиц с онкологическими заболеваниями показатели цитолиза и холестаза до начала лечения были в пределах вариаций нормы. В то же время на фоне полихимиотерапии в группе 2 П (контрольной) отмечено достоверное повышение маркеров холестаза и цитолиза, правда не столь выраженное, как в вышерассмотренных группах, что нашло свое отражение в несколько меньшей частоте ГТ (55,6%), причем она была представлена, в основном, 1 и 2 степенями токсичности. Соответственно в 42,4% случаев лечащие врачи были вынуждены изменить схему лечения, вплоть до полной отмены химиотерапии у 18,2% больных. Несмотря на то, что частота ГТ, ее тяжесть, приводящие к изменению схемы лечения были ниже, чем в вышеанализи-руемых группах, тем не менее необходимость вынужденных изменений протоколов полихимиотерапии, связанных с поражением печени почти в половине случаев является крайне неблагоприятным прогностическим фактором у данных больных.
В группе 1 П сопроводительная терапия адеметионином (Гептралом) при незначительном усилении процессов холестаза и цитолиза позволяла удерживать уровни их маркеров на уровнях, не требующих изменения схем лечения. Так ГТ выявлялась только в 21,6% случаев, что существенно и достоверно (р < 0,05) ниже, чем в группе 2 П, причем токсичность была представлена, в основном, 1 ст. Благодаря этому изменение протокола лечения потребовалось только в 16,2% случаев, что существенно и достоверно (р < 0,05) ниже, чем в группе 2 П, при этом отмена полихимиотерапии потребовалась только у 1 из 37 пациентов.
Предварительный анализ результатов третьего этапа исследования позволил сделать ряд выводов:
-
1. Наличие ХВГ, курение, злоупотребление алкоголем, пожилой возраст являются факторами риска развития ГТ при проведении полихимиотерапии, причем наихудший прогноз для эффективности полихимиотерапии представляет собой ХВГ, сравнительно наименьший — пожилой возраст. Частота ГТ у больных с данными факторами риска составляет 68,6%; 60,8%; 55,6% соответственно;
-
2. Наличие ГТ сочетается с высокой частотой вынужденного изменения протокола лечения (в 100%; 51%; 42,4% случаев соответственно), вплоть до его полной отмены в 51,4%; 23,5%; 18,2% случаев соответственно. Данный нежелательный побочный эффект, очевидно, ухудшает прогноз у больных онкологическими заболеваниями;
-
3. Сопроводительная терапия адеметиони-ном (Гептралом) у больных метастатическими формами рака с факторами риска ГТ препятствует развитию ГТ или поддержанию ее уровня, в первую очередь внутрипеченого холестаза, на уровне, позволяющем у большинствуа больных продолжить проводимую схему полихимиотерапии;
-
4. Двухэтапная схема сопроводительной терапии адеметионином (Гептралом), является, очевидно, оптимальной у данной категории больных, и ее следует рекомендовать для введения в схему полихимиотерапии у больных различными онкологическими заболеваниями.
Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации
Список литературы Эффективность сопроводительной терапии адеметионином (гептралом) при проведении противоопухолевой лекарственной терапии у больных с онкологическими заболеваниями различной локализации
- Семиглазов В. Ф., Семиглазов В. В. Адъювантное химиолучевое лечение рака молочной железы//Практич. онкол. -2008. -№ 1. -С. 9-15
- Rutgers E. Guidelines to assure quality in breast cancer//EJSO. -2005. -Vol. 31. -P. 568-576
- Ушкалова Е. А. Менеджмент желудочно-кишечных побочных реакций, индуцированных противоопухолевыми средствами//Фарматека. -2002. -№ 12. -С. 45-53
- Королева И. А. Комплексная оценка состояния внутренних органов при химиотерапии рака молочной железы. Автореф дисс. докт. М. -2010. -51 с
- Quiones Ribas C., Pontn Sivill J. L., Margel Vila M. et al. Dose intensity received in breast cancer treatment with chemotherapy//Farm. Hosp. -2007. -Vol. 31 (5). -P. 270-275
- Richardson L. C., Wang W., Hartzema A. G., Wagner S. The role of health-related quality of life in early discontinuation of chemotherapy for breast cancer//Breast J. -2007. -Vol. 13 (6). -P. 581-587
- Lee W. Drug-induced hepatotoxicity//N. Engl. J. Med. -2003. -Vol. 349. -P. 474-485
- Grant D. M. Detoxification pathways in the liver. Inherit Metab. Dis.//1991. -Vol. 14. -№ 4. -P. 421-430
- Буторова Л. И., Калинин А. В, Логинов А. Ф. Лекарственные поражения печени. Учебно-методическое пособие. Институт усовершенствования врачей. ФГУ «НМХЦ им. Н. И. Пирогова». М.: 2010. -64 с
- Никитин И. Г., Сторожаков Г. И. Лекарственные поражения печени//В кн.: Болезни печени и желчевыводящих путей: Руководство для врачей. Под ред. В. Т. Ивашкина. -М.: ООО «Издат. Дом «М-Вести»,2002. -416 с
- Полунина Т. Е., Маев И. В., Полунина Е. В. Гепатология для практического врача: Руководство для врачей. М.: Авторская Академия; Товарищество научных изданий КМК, 2009, 354 с
- Полунина Т. Е., Маев И. В. Лекарственные поражения печени//Фарматека. -2011. -C. 54-60
- Моисеев С. В. Лекарственная гепатотоксичность//Клиническая фармакология и терапия. -2005. -Том 14. -№ 1. -C. 1-4
- Floyd J., Mirza I., Sachs B., Perry M. C. Hepatotoxicity of chemotherapy//Semin. Oncol. -2006. -Vol. 33 (1). -P. 50-67
- Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: Практич. рук.: Пер. с англ./Под. ред. З. Г. Апросиной, Н. А. Мухина. -М.: ГЕОТАР-МЕД, 2002. -864 с
- Rodriguez-Frias E. A., Lee W. M. Cancer chemotherapy I: hepatocellular injury//Clin Liver Dis. -2007. -Vol. 11 (3). -P.641-662
- Loriot Y., Perlemuter G., Malka D. et al. Drug insight: gastrointestinal and hepatic adverse effects of molecular-targeted agents in cancer therapy//Nat. Clin. Pract. Oncol. -2008. -Vol. 5 (5). -P.268-278
- Petit E., Langouet S., Akhdar H. et al. Differential toxic effects of azathioprine, 6-mercaptopurine and 6-thioguanine on human hepatocytes//Toxicol In Vitro. -2008. -Vol. 22 (3). -P. 632-642
- Tannapfel A., Reinacher-Schick A. Chemotherapy Associated Hepatotoxicity in the Treatment of Advanced Colorectal Cancer//Z. Gastroenterol. -2008. -Bd. 46 (5). -S. 435-440
- Zorzi D., Laurent A., Pawlik T. M. et al. Chemotherapy-associated hepatotoxicity and surgery for colorectal liver metastases//Br. J. Surg. -2007. -Vol. 94 (3). -P.274-286
- Снеговой А. В., Манзюк Л. В. Эффективность Гептрала в лечении печеночной токсичности, обусловленной цитостатической химиотерапией//Фарматека. -2010. -№ 6. -C. 1-5
- Paul D. et al. Hepatotoxity of chemotherapy//The oncologist. -2001. -Vol. 6. -P. 162-176
- Field K. M. Michael M. Part I: Part II: Liver function in oncology: towards safer chemotherapy use. Lancet Oncol. 2008. -Vol. 9 (11). -P. 1081-1190
- Вельшер Л. З., Маев И. В., Казюлин А. Н. и др. Гепатотоксичность при проведении противопухолевой терапии рака молочной железы (обзор литературы). Паллиативная медицина и реабилитация. 2008; 3: 46-51
- Казюлин А. Н., Вельшер Л. З., Королева И. А. Проблемы гепатотоксичности при проведении противоопухолевой химиотерапии рака молочной железы и методы ее коррекции//Фарматека. -2010. -№ 17 (211). -С. 82-90
- Казюлин А. Н., Вельшер Л. З., Королева И. А. Возможности преодоления гепатотоксичности при проведении комбинированного и комплексного лечения рака молочной железы.//Эффективная фармакотерапия. -2011. -№ 3. -C. 66-72
- Казюлин А. Н., Вельшер Л. З., Данилевская Н. Н., Маевская Е. А. Лекарственная гепатотоксичность при проведении противоопухолевой химиотерапии онкологических заболеваний и возможности ее коррекции//Фарматека. -2012. -№ 8. -C. 37-44
- Казюлин А. Н., Переяслова Е. В. Лекарственная гепатотоксичность в клинической практике//Медицинский совет. -2012. -№ 9. -C. 37-45
- Koroleva I., Kasulin A., Kucheryavyy J., Byahov M. Hepatotoxity in patients with breast cancer during and after taxan-antracyclin-based neoadjuvant chtmotherapy. 21-st International Congress on Anti -Cancer Treatment. Paris, France. 2010; 198-199
- Никитин И. Г. Гепатопротекторы: мифы и реальные возможности//Фарматека. -2007. -№ 13. -C. 14-18
- Ткач С. М. Эффективность и безопасность гепатопротекторов с точки зрения доказательной медицины//Здоров я Украiни. -2009. -№ 6/1. -C. 7-10
- Ларионова В. Б., Горожанская Э. Г. Печеночная недостаточность у онкогематологических больных. Возможности и перспективы применения Гептрала//Фарматека (онкология), № 2, 2008
- Ларионова В. Б., Горожанская Э. Г. Перспективы применения Гептрала при гемобластозах//Общая реаниматология. -2008. -№ 4. -C. 3-12
- Ларионова В., Горожанская Э. Г., Буеверов А. О. и др. Возможности коррекции нарушений печеночного метаболизма при химиотерапии онкогематологических больных//Клинические перспективы гастроэнтерологии, гепатологии. -2008. -№ 5. -C. 1-7
- Ларионова В. Б., Горожанская Э. Г. Возможности Гептрала в коррекции нарушений механизмов антиоксидантной защиты у онкологических больных. Методические рекомендации. -М.: 2010. -C. 49
- Bottiglieri T. S-Adenosyl-L-methionine (SAMe): from the bench to the bedside-molecular basis of a pleiotrophic molecule//Am. J Clin Nutr. -2002. -Vol. 76 (5). -P. 1151S -1157S
- Boelsteri U. A. Mechanisms of NSAID-induced hepatotoxicity. Focus on nimesulide//Drug Saf. -2002. -Vol. 25. -P. 633-48
- Stramentinoli G. Pharmacologic aspects of S-adenosylmethionine. Pharmacokinetics and pharmacodynamics//Am. J. Med. -1987. -Vol. 83 (5A). -P. 35-42
- Friedel H. A., Goa R. L., Benfield P. S-adenosyl-L-methionine. A review of its pharmacological properties and therapeutic potential in liver dysfunction and affective disorders in relation to its physiological role in cell metabolism//Drugs. -1989. -Vol. 38 (3). -P. 389-416
- Santini D., Vincenzi B., Massacesi C. et al. 5-аденозилметионин (гептрал) в лечении поражения печени, вызванного химиотерапией//Фарматека. -2007. -Онкология ASCO. -C. 1-5
- Wang X., Cederbaum A. L. S-adenosyl-L-methionine decreases the elevated hepatotoxicity induced by Fas agonistic antibody plus acute ethanol pretreatment in mice//Arch. Biochem. Biophys. -2008. -Vol. 477 (1). -P. 1-11
- Lu S. C., Mato J. M. S-adenosylmethionine in liver health, injury, and cancer//Physiol. Rev. -2012. -Vol. 92 (4). -P. 1515-1542
- Mato J. M., Martinez-Chantar M. L., Lu S. C. S-adenosylmethionine metabolism and liver disease//Ann. Hepatol. -2013. -Vol. 12 (2). -P. 183-189
- Santini D., Vincenzi B., Massacesi C. S-Adenosylmethionine supplementation for treatment of hemotherapy-induced Liver Injury//Anticancer Reseach. -2003 -P. 5173-5180
- Vincenzi B., Santini D., Frezza A. M. et al. The role of S-adenosyl methionine in preventing FOLFOX-induced liver toxicity: a retrospective analysis in patients affected by resected colorectal cancer treated with adjuvant FOLFOX regimen//Expert Opin Drug Saf. -2011. -Vol. 10 (3). -P. 345-349
- Vincenzi B., Daniele S. Frezza A. M. The role of S-adenosylmethionine in preventing oxaliplatin-induced liver toxicity: a retrospective analysis in metastatic colorectal cancer patients treated with bevacizumab plus oxaliplatin-based regimen//Support Care Cance. -2012. -Vol. 20 (1). -P. 135-139
- Cancer Therapy Evaluation Program, Common Terminology Criteria for Adverse Events, Version 3,0 (CTCAE). -March 31, 2003. Http://ctep. cancer.gov


