Эффективность терапии первой линии у больных раком предстательной железы старческого возраста в реальной клинической практике
Автор: Волкова М.И., Федянин М.Ю., Покатаев И.А., Аль-Акел И.С., Варданян С.Г., Гриднева Я.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.14, 2024 года.
Бесплатный доступ
Цель: оценить эффективность лекарственной терапии 1 линии, проводившейся в реальной клинической практике пациентам ≥ 75 лет с раком предстательной железы (РПЖ). Материал: в ретроспективное исследование включены данные 315 пациентов ≥ 75 лет (медиана возраста — 84 (75–99) года) с гормоночувствительным РПЖ (ГЧРПЖ), получавших противоопухолевую терапию. У 223 (70,8 %) больных имел место неметастатический ГЧРПЖ (нмГЧРПЖ), у 92 (29,2 %) — метастатический ГЧРПЖ (мГЧРПЖ). При нмГЧРПЖ в 8 (3,6 %) случаях назначали монотерапию бикалутамидом, в 215 (96,4 %) — андроген-деприваци- онную терапию (АДТ), из них в интермиттирующем режиме — 164 (73,5 %). Все 92 пациента с мГЧРПЖ получали АДТ, в том числе в составе комбинаций, соответствующих текущим клиническим рекомендациям, — в 38 (41,3 %) случаях (с доцетакселом — 17 (18,4 %), абиратерона ацетатом — 7 (7,6 %), энзалутамидом — 10 (10,9 %), апалутами- дом — 1 (1,1 %)). Медиана времени наблюдения за пациентами с нмГЧРПЖ — 64,2 (2,1–275,7) месяца, за больными мГЧРПЖ — 48,6 (1,0–234,3) месяца. Результаты: медиана длительности 1 линии терапии нмГЧРПЖ составила 40,6 (1,0–243,8) месяца. При нмГЧРПЖ частота снижения ПСА на ≥ 90 % на фоне 1 линии терапии равнялась 67,3 %. Пятилетняя выживаемость больных нмГЧРПЖ без ПСА-прогрессирования (ВБППСА) достигла 70,8 %, выживаемость без прогрессирования (ВБП) — 70,8 %, безметастатическая (БМВ) — 85,0 %, специфическая (СВ) — 97,3 % и общая (ОВ) — 91,5 %. Постоянный режим АДТ при нмГЧРПЖ групп низкого и промежуточного риска снижал БПВ по сравнению с интермиттирующей тера- пией (р = 0,014), но не влиял на БМВ, СВ и ОВ. Медиана длительности 1 линии терапии при мГЧРПЖ составила 14,3 (1,1–137,7) месяца. При мГЧРПЖ частота снижения ПСА на ≥ 90 % на фоне 1 линии терапии равнялась в 38,0 %. У больных мГЧРПЖ 4-летняя ВБППСА составила 50,1 %, БПВ — 50,1 %, СВ — 83,5 % и ОВ — 77,2 %. При мГЧРПЖ АДТ по сравнению с комбинированной терапией снижала БПВ (р = 0,018), СВ (р = 0,053) и ОВ (отношение рисков 3,675 (95 % доверительные интервалы: 1,001–13,489); р = 0,008). Достоверного влияния препарата комбинации на выжи- ваемость больных мГЧРПЖ не выявлено. Выводы: у больных старческого возраста с нмГЧРПЖ АДТ в интермиттирующем режиме не уступает постоянной АДТ в отношении ОВ. У пациентов ≥ 75 лет комбинированная терапия, основанная на АДТ с доцетакселом или инги- биторами андрогенного сигнала, обеспечивает увеличение ОВ по сравнению с АДТ.
Старческий возраст, рак предстательной железы, интермиттирующая терапия, комбинированная терапия
Короткий адрес: https://sciup.org/140310095
IDR: 140310095 | DOI: 10.18027/2224-5057-2024-018
Текст научной статьи Эффективность терапии первой линии у больных раком предстательной железы старческого возраста в реальной клинической практике
Показания к самостоятельной лекарственной терапии у больных раком предстательной железы (РПЖ) являются достаточно широкими и включают первичные неметастатические формы заболевания при противопоказаниях к радикальному лечению, неметастатические рецидивы после локального лечения, а также первичные и рецидивные диссеминированные опухоли. Аденокарцинома предстательной железы уникально чувствительна к андрогенной стимуляции, поэтому основой системного противоопухолевого лечения РПЖ в течение нескольких десятков лет остается андроген-депривационная терапия (АДТ). При неметастатических формах заболевания рекомендо- вана АДТ в монорежиме, при этом допустимо применение интермиттирующей схемы лечения. Диссеминация опухолевого процесса служит показанием к комбинированной терапии с включением АДТ в сочетании с доцетакселом и/или ингибитором андрогенного сигнала. Только АДТ резервируется для пациентов с противопоказаниями к комбинациям [1,2].
Глобальное старение мужской популяции привело к увеличению количества больных РПЖ старческого возраста [3]. Несмотря на существенную неоднородность, в целом возрастная когорта ≥ 75 лет характеризуется высоким индексом коморбидности. В связи с этим естественную продолжительность жизни этой категории пациентов определяет комплекс факторов, включающих РПЖ, сопутствующие заболевания, а также осложнения лечения. Современные рекомендации по лечению РПЖ, сформированные на основании завершенных рандомизированных клинических исследований (РКИ), представляются неоптимальными для больных старческого возраста, не соответствующих критериям включения в большинство протоколов [4–11].
Представленное ретроспективное исследование проведено с целью оценки эффективности лекарственной терапии 1 линии, проводившейся в реальной клинической практике учреждений Департамента Здравоохранений Москвы пациентам с РПЖ в возрасте ≥ 75 лет.
МАТЕРИАЛ
Критериями включения в исследование являлись возраст 75 лет и старше, верифицированный диагноз гормоночувствительного РПЖ (ГЧРПЖ), назначение лекарственной противоопухолевой терапии, наличие доступной информации о сопутствующих заболеваниях, распространенности опухолевого процесса, лечебной тактике, хронологии течения и исходе РПЖ, дате последнего наблюдения или смерти, а также причине смерти в случае ее регистрации.
Критериями исключения служили отсутствие применения назначенной лекарственной противоопухолевой терапии и как минимум одного контрольного обследования после старта лечения.
Первичной целью исследования являлась общая выживаемость (ОВ) в группах пациентов с неметастатическим (нмГЧРПЖ) и метастатическим ГЧРПЖ (мГЧРПЖ). Ко вторичным целям относились: частота снижения ПСА на ≥ 90% при нмГЧРПЖ и мГЧРПЖ, выживаемость без ПСА-прогрессирования (ВБППСА), выживаемость без прогрессирования (ВБП), выживаемость без метастазов (БМВ) при нмГЧРПЖ, специфическая выживаемость (СВ), а также влияние режимов лекарственной терапии на показатели выживаемости в группах пациентов с нмГЧРПЖ и метастатическим мГЧРПЖ.
Отбор пациентов в исследование проводился на основании информации о возрасте и диагнозе, имеющейся в единой медицинской информационно-аналитической системе (ЕМИАС), а также доступных медицинских документах, отраженных в клинической информационной системе ЕМИАС с 1.04.2003 г. по 15.06.2023 г.
Все данные отобранных пациентов внесены в базу на основе электронных таблиц Microsoft Excel с помощью специально разработанного кодификатора. Анализ результатов осуществляли с применением блока статистических программ SPSS Statistics 19. Достоверность различий между количественными показателями вычисляли по критерию t Стьюдента для нормально распределенных величин или по непараметрическому критерию Манна-Уитни. Для сравнения качественных параметров применяли точный критерий Фишера и c2 с учетом непа- раметрических данных и нормального распределения Пуассона. Различия признавали значимыми при p < 0,05. Для бинаризации непрерывных признаков, таких как возраст, индекс коморбидности Чарльсона, уровень ПСА, грейд ISUP, использовали построение ROC-кривых и поиск пограничных значений по их координатам. Продолжительность жизни рассчитывали от даты начала лечения РПЖ или наблюдения до последнего дня наблюдения или неблагоприятного исхода. Выживаемость оценивали по методу Kaplan-Meier, различия выживаемости определяли с помощью log-rank теста, для выявления независимых факторов риска применяли многофакторный анализ Cox. При проведении многофакторного анализа исключали взаимосвязанные факторы (такие как признаки, определяющие группу риска нмГЧРПЖ).
РЕЗУЛЬТАТЫ
Критериям включения соответствовали данные 315 пациентов. Медиана возраста во всей популяции исследования составила 84 (75–99) года, медиана индекса коморбидности Чарльсона с поправкой на РПЖ равнялась 7 (4–12); у 55 (17,5%) больных индекс коморбидности был ≥ 8. Показанием к лекарственному лечению являлся первичный ГЧРПЖ у 280 (88,9%), рецидив РПЖ после радикального лечения первичной опухоли — у 35 (11,1%) пациентов. В 223 (70,8 %) случаях противоопухолевую терапию назначали при нмГЧРПЖ (нмГЧРПЖ), в 92 (29,2%) наблюдении — при мГЧРПЖ (табл. 1).
Медиана возраста 223 больных с нмГЧРПЖ составила 85 (75–99) лет, медиана индекса коморбидности Чарль-сона — 7 (4–12). Медиана ПСА до старта терапии равнялась 13,5 (1,5–600,0) нг/мл. Низкодифференцированные опухоли с грейдом ISUP 4–5 выявлены у 55 (24,7%) пациентов. В 55 (24,7%) случаях диагностированы местнораспространенные формы РПЖ категорий сT3–4, в 12 (5,4 %) наблюдениях выявлены метастазы в регионарных лимфоузлах. Первичный нмГЧРПЖ послужил показанием к лекарственной терапии у 213 (95,5%), рецидивный — у 10 (4,5 %) пациентов. Больные первичным нмГЧРПЖ имели симптомы опухоли в 18,8% (40/213) случаев и были классифицированы в группы высокого и очень высокого риска в 51,6% (110 / 213) наблюдений, включая 6,7 % (14 / 213) мужчин с симптомами РПЖ.
При нмГЧРПЖ немедленная лекарственная терапия назначалась 212 (95,1%), отсроченная — 11 (4,9%) из 223 пациентов. Медиана времени до отсроченного лечения составила 41,1 (4,0–156,0) месяца после установки диагноза. В 215 (96,4 %) случаях назначалась АДТ (в комбинации с бикалутамидом — 3 (1,4%), абиратерона ацетатом и преднизолоном — 2 (0,9%), доцетакселом — 2 (0,9%)), в 8 (3,6%) наблюдениях применялся только бикалутамид в стандартном дозовом режиме. Постоянная терапия проводилась 59 (26,4 %), интермиттирующая — 164 (73,5%) пациентам. Интермиттирующий режим использовался только у больных, получавших моно-АДТ. Подгруппа пациентов, полу-
Таблица 1. Характеристики пациентов старческого возраста, получавших лекарственное противоопухолевое лечение рака предстательной железы
Table 1. Characteristics of older patients receiving systemic antitumor treatmentfor prostate cancer
|
Характеристики |
Неметастатический ГЧРПЖ (n 223) |
Метастатический ГЧРПЖ (n 92) |
Все пациенты (n 315) |
|||
|
N |
% |
N |
% |
N |
% |
|
|
Возраст, медиана (min-max) |
85,0 (75,0-99,0) |
82,5 (75,0-97,0) |
84,0 (75,0-99,0) |
|||
|
ПСА, медиана (min-max), нг/мл |
13,5 (1,5-600,0) |
62,0 (5,9-3500,0) |
16,7 (1,5-3500,0) |
|||
|
Индекс коморбидности Чарльсона*, медиана (min-max) |
7 (4-12) |
7 (4-15) |
7 (4-15) |
|||
|
Индекс коморбидности Чарльсона* ≥8 |
39 |
18,0 |
16 |
17,4 |
55 |
17,5 |
|
Грейд ISUP 4-5 |
55 |
24,7 |
55 |
59,8 |
110 |
34,9 |
|
Категория cT3-4 |
55 |
24,7 |
65 |
70,3 |
120 |
38,1 |
|
Категория cN1 |
12 |
5,4 |
40 |
43,5 |
52 |
16,5 |
|
Отдаленные метастазы |
0 |
0,0 |
92 |
100,0 |
92 |
29,2 |
|
Радикальное лечение первичной опухоли ранее |
10 |
4,5 |
25 |
27,2 |
34 |
10,8 |
|
Медиана наблюдения (min-max), месяцы |
64,2 (2,1-275,7) |
48,6 (1,0-234,3) |
59,6 (1,0-275,7) |
|||
Рассчитан с учетом возраста и коморбидных состояний, наличие РПЖ в индекс не включено.
чавших постоянную АДТ, содержала значимо большую долю больных с грейдами ISUP 4–5, категориями T3–4, относящихся к группам высокого и очень высокого риска (p < 0,05 для всех). Медиана времени наблюдения за пациентами с нмГЧРПЖ равнялась 64,2 (2,1–275,7) месяца.
Медиана возраста 92 больных с мГЧРПЖ составила 84 (75–97) года, медиана индекса коморбидности Чарль-сона — 7 (4–15). Медиана ПСА до старта терапии равнялась 62,0 (5,9–3500,0) нг/мл. Низкодифференцированные опухоли с грейдом ISUP 4–5 выявлены у 55 (59,8%) пациентов. В 65 (70,3%) случаях диагностирован РПЖ категорий сT3–4, в 40 (43,5 %) наблюдениях выявлены метастазы в регионарных лимфоузлах, у всех больных обнаружены отдаленные метастазы (только в нерегионарных лимфоузлах — 19 (20,6 %), в костях скелета с или без поражения лимфоузлов — 67 (72,9%), метастатические очаги в легких в сочетании с другими локализациями метастазов — 6 (6,5%)). Низкая опухолевая нагрузка имела место у 58 (63,0 %), высокая — у 34 (37,0%) больных. Двадцать пять (27,2%) пациентов ранее были подвергнуты радикальному лечению первичной опухоли.
Всем 92 больным с мГЧРПЖ лекарственная терапия, основанная на АДТ, назначалась немедленно после выявления метастазов и проводилась в постоянном режиме в 81 (88,0 %), в интермиттирующем — 11 (12,0 %) пациентам. Моно-АДТ применялась у 54 (58,7 %), комбинации АДТ с другими препаратами — в 38 (41,3 %) случаях. В 3 (3,3%) наблюдениях в качестве препарата комбинации использовался бикалутамид, в 35 (38,0%) случаях применяли агенты, соответствующие текущим рекомендациям [1]. Доцетаксел использовали у 17 (18,4%) больных, включая 5 (5,4%) пациентов с малой опухолевой нагрузкой. Ингибиторы андрогенного сигнала (ИАС) назначались 18 (19,6 %) больным (абиратерона ацетат с преднизолоном — 7 (7,6%), энзалутамид — 10 (10,9%), апалутамид — 1 (1,1 %)). В 5 (5,4%) случаях при первичном мГЧРПЖ проводилась дистанционная лучевая терапия (ДЛТ) на область простаты в циторедуктивном режиме. Медиана времени наблюдения за пациентами с мГЧРПЖ равнялась 48,6 (1,0–234,3) месяца.
Среди 223 пациентов с нмГЧРПЖ биохимический ответ на лечение зарегистрирован во всех случаях. Медиана снижения уровня ПСА в группе составила 88,7% (8,6–99,9%), частота уменьшения ПСА на 90% и более от исходного уровня достигла 67,3% (150 /223). Влияние интермиттирующего или постоянного режима лекарственной терапии на частоту ПСА-ответов не выявлено (p > 0,05).
Медиана длительности первой линии терапии нмГЧРПЖ составила 40,6 (1,0–243,8) месяца. На момент окончания сбора данных 160 (71,7%) пациентов продолжают лечение, 63 (28,3 %) больных завершили терапию первой линии: в 16 (7,2%) случаях — из-за смерти по причине, не связанной с РПЖ (сердечно-сосудистые заболевания — 11 (4,9%), другие причины — 5 (2,3 %)), в 1 (0,4 %) — из-за индивидуально непереносимого нежелательного явления, в 46 (20,7%) — из-за прогрессирования опухолевого процесса с развитием кастрационно-резистентной формы заболевания, сопровождавшейся появлением отдаленных метастазов в 14 (6,3%) и биохимическим прогрессированием во всех наблюдениях.
Тяжелых и серьезных осложнений лекарственной терапии первой линии у пациентов с нмГЧРПЖ не отмечено. У 1 (0,4%) больного развилось индивидуально непереносимое осложнение АДТ (гинекомастия), послужившее поводом для отмены медикаментозной кастрации и назначения монотерапии бикалутамидом.
Из 46 (20,7 %) пациентов с прогрессированием нмГЧРПЖ 7 (3,1 %) больных переведены на симптомати-
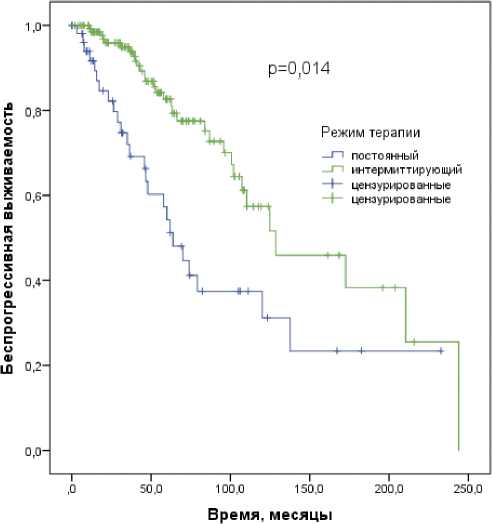
Рисунок 1. Беспрогрессивная выживаемость пациентов старческого возраста с нмГЧРПЖ в зависимости от режима противоопухолевой терапии
Figure 1. Progression-free survival of elderly patients with nonmetastatic hormonesensitive prostate cancer depending on the antitumor therapy regimen ческое лечение на фоне продолжающейся АДТ, последующую терапию получили 39 (17,6 %) мужчин. Проводилось от 2 до 5 линий лечения, включая АДТ в комбинации с доцетакселом и преднизолоном, энзалутамидом, абиратерона ацетатом и преднизолоном.
Пятилетняя выживаемость 223 больных нмГЧРПЖ без ПСА-прогрессирования (ВБППСА) составила 70,8%, ВБП — 70,8%, безметастатическая (БМВ) — 85,0%, специфическая (СВ) — 97,3% и общая (ОВ) — 91,5%. Так как все случаи прогрессирования опухолевого процесса сопровождались повышением уровня ПСА, показатели БПВПСА и БПВ в группе были одинаковы.
Проведен анализ влияния на выживаемость пациентов с нмГЧРПЖ возраста, индекса коморбидности Чарль-сона, исходного уровня ПСА, грейда ISUP, стадии, группы риска первичного нмГЧРПЖ, вида и режима лекарственной терапии (в том числе, с поправкой на группы риска), надира ПСА (табл. 2). В однофакторном анализе выявлено значимое неблагоприятное влияние на БПВ исходного ПСА ≥ 30 нг / мл (р < 0,0001), грейдов ISUP 4–5 (р = 0,006), категорий cT3–4 (р < 0,0001), групп высокого и очень высокого риска (р < 0,0001), рецидивного нмГЧРПЖ (р < 0,0001), постоянного режима АДТ в группах низкого и промежуточного риска (р = 0,014) (рис. 1), а также тенденция к снижению БПВ при категории N1 (p = 0,082). В многофакторном анализе с исключением взаимосвязанных факторов подтверждено независимое негативное влияние на БПВ
Таблица 2. Факторы риска выживаемости 223 больных неметастатическим гормоночувствительным раком предстательной железы, получавших системную противоопухолевую терапию
Table 2. Riskfactorsfor survival in 223 patients with nonmetastatic hormone-sensitive prostate cancer who received systemic antitumor therapy
Среди 92 пациентов с мГЧРПЖ на фоне первой линии терапии во всех случаях зарегистрирован биохимический ответ на лечение. Медиана снижения уровня ПСА в группе составила 71,2% (54,6–99,9%). Уменьшение ПСА на ≥ 90% от исходного зарегистрировано в 35 (38,0 %) случаях (на фоне АДТ с / без бикалутамида — в 16 из 57 (28,1 %), АДТ с доцетакселом — в 7 из 17 (41,2 %), АДТ с ИАС — в 12 из 18 (66,7%)) (p > 0,05 для всех).
У 1 (1,5%) пациента с мГЧРПЖ отмечена гематологическая токсичность 3 степени тяжести на фоне химиотерапии доцетакселом, послужившая показанием к отмене проводимого лечения. Других тяжелых и серьезных осложнений лекарственной терапии первой линии не зарегистрировано.
Медиана длительности первой линии терапии при мГЧРПЖ составила 14,3 (1,1–137,7) месяца. На момент окончания сбора данных 58 (63,0%) пациентов продолжают лечение, 34 (37,0%) больных завершили терапию первой линии: в 28 (30,4%) случаях — из-за прогрессирования, в 6 (6,6%) — из-за смерти (от рака простаты — 2 (2,2 %)), по причине, не связанной с РПЖ — 4 (4,4%), включая 1 (1,1%) смерть от сердечно-сосудистых заболеваний). Во всех случаях биохимическое прогрессирование сопровождалось радиологическим и/или клиническим прогрессированием.
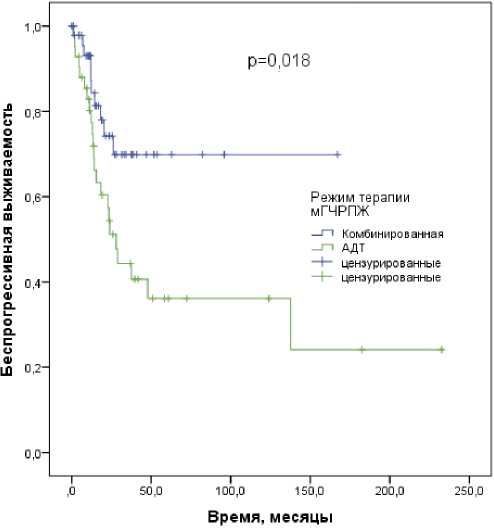
Рисунок 2. Беспрогрессивная выживаемость пациентов старческого возраста с мГЧРПЖ в зависимости от режима противоопухолевой терапии
Figure 2. Progression-free survival of elderly patients with mHSPC depending on the antitumor therapy regimen
У больных мГЧРПЖ 4-летняя ВБППСА составила 50,1%, БПВ — 50,1%, СВ — 83,5% и ОВ — 77,2%. Так как все случаи клинического прогрессирования опухолевого процесса сопровождались повышением уровня ПСА, показатели БПВПСА и БПВ в группе были одинаковы.
Таблица 3. Факторы риска выживаемости 92 больных метастатическим гормоночувствительным раком предстательной железы, получавших системную противоопухолевую терапию
Table 3. Riskfactorsfor survival in 92 patients with metastatic hormone-sensitive prostate cancer who received systemic antitumor therapy
|
Фактор риска |
4 года, % |
Р |
ОР (95% ДИ: НГ-ВГ) |
Знач. |
|
Беспрогрессивная выживаемость |
||||
|
Грейд ISUP 1-3 4-5 |
64,0 22,8 |
0,016 |
1,341 (1,039–1,731) |
0,024 |
|
Объем метастатической нагрузки Малый Большой |
69,2 18,6 |
0,003 |
2,708 (1,218–6,023) |
0,015 |
|
Режим терапии Моно-АДТ АДТ + доцетаксел или ИАС |
36,1 69,9 |
0,018 |
1,592 (0,689–3,675) |
0,276 |
|
Препарат комбинации Доцетаксел ИАС |
56,0 58,0 |
0,852 |
- |
- |
|
Препарат комбинации, большая нагрузка Доцетаксел ИАС |
47,6 56,1 |
0,113 |
- |
- |
|
Препарат комбинации, малая нагрузка Доцетаксел ИАС |
66,7 64,3 |
0,243 |
- |
- |
|
Специфическая выживаемость |
||||
|
Объем метастатической нагрузки Малый Большой |
87,8 77,9 |
0,034 |
- |
- |
|
Режим терапии Моно-АДТ АДТ + доцетаксел или ИАС |
68,4 97,0 |
0,053 |
- |
- |
|
Общая выживаемость |
||||
|
мГЧРПЖ Первичный Рецидивный |
54,8 91,7 |
0,009 |
9,936 (0,947–104,205) |
0,056 |
|
Объем метастатической нагрузки Малый Большой |
82,7 45,3 |
0,008 |
1,334 (0,381–4,669) |
0,652 |
|
Режим терапии Моно-АДТ АДТ + доцетаксел или ИАС |
56,0 86,2 |
0,003 |
4,329 (1,150-16,288) |
0,030 |
Проведен анализ влияния на выживаемость возраста, индекса коморбидности Чарльсона, исходного уровня ПСА, грейда ISUP, категорий cT, cN, времени появления метастазов, опухолевой нагрузки, вида и режима лекарственной терапии, ДЛТ на первичную опухоль, надира ПСА. Среди пациентов с мГЧРПЖ в однофакторном анализе отмечено значимое снижение БПВ при грейде ISUP 4–5 (p = 0,016), большой метастатической нагрузке (р = 0,003) и использовании моно-АДТ в качестве терапии первой линии (р = 0,018) (рис. 2). Достоверного влияния на БПВ препарата комбинации не выявлено, в том числе — в подгруппах с малой и большой метастатической нагрузкой (р > 0,05 для всех). В многофакторном анализе подтверждено независимое негативное влияния на БПВ грейда ISUP 4–5 (ОР 1,341 (95% ДИ: 1,039–1,731); р = 0,024) и объема опухолевой нагрузки (ОР 2,708 (95% ДИ: 1,218– 6,023); р = 0,015). Факторы риска БПВ и БПВПСА были одинаковы из-за совпадения всех случаев биохимического и клинического прогрессирования. Большой объем метастатического поражения являлся единственным значимым фактором неблагоприятного прогноза СВ (р = 0,034); отмечена строгая тенденция к снижению СВ при использовании только АДТ (р = 0,053). В однофакторном анализе негативным влиянием на ОВ обладали синхронные метастазы (р = 0,009), большая метастатическая нагрузка (р = 0,008) и проведение АДТ в монорежиме (р = 0,003). Негативное влияние отсутствия препарата комбинации доказало свое независимое влияние на ОВ в многофакторном анализе (ОР 4,329 (95 % ДИ: 1,150–16,288); р = 0,030) (табл. 3).
ДИСКУССИЯ
Противоопухолевая лекарственная терапия является возможной опцией у отобранных пациентов с нмГЧРПЖ, включая ранее не леченых больных, имеющих противопоказания к радикальной простатэктомии и лучевой терапии, а также у мужчин с рецидивами после радикального лечения [1,2].
Кандидатами для немедленной АДТ при первичных неметастатических формах заболевания являются больные РПЖ групп высокого и очень высокого риска с ожидаемой продолжительностью жизни < 5 лет и пациенты с симптомами опухоли [1]. Среди 213 больных первичным нмГЧРПЖ в нашей серии наблюдений, включившей мужчин в возрасте 75 лет и старше, данным критериям соответствовало 63,8% пациентов; в 36,2 % наблюдений формально допустимым было использование отсроченной терапии, которая на практике использовалась только в 4,9% случаев.
Большинство пациентов (96,4%) получали АДТ, являющуюся стандартом терапии первой линии при нмГЧРПЖ. Однако в 3,6% случаев в схему лечения вводились доцетаксел или антиандрогены 1 и 2 поколений, не зарегистрированные для применения при данной форме заболевания [1,2]. Тем не менее, при низкой частоте отклонений от стандартного протокола лечения полученные результаты не противоречат опубликованным данным РКИ [12].
Индивидуально непереносимая токсичность отмечена в 1 (0,4%) случае. Любое снижение ПСА зарегистрировано у 100 % больных (на ≥ 90 % — 67,3 %). Пятилетняя БПВПСА, БПВ, БМВ, СВ и ОВ в группе составили 70,8%, 70,8 %, 85,0 %, 97,3 % и 91,5% соответственно. Обращает на себя внимание конкордантность показателей БПВПСА и БПВ. Это настораживает в отношении своевременности адекватной регистрации развития кастрационной резистентности в реальной клинической практике.
В однофакторном анализе ожидаемо выявлено значимое неблагоприятное влияние на БПВ исходного ПСА ≥ 30 нг/мл, грейдов ISUP 4–5, категорий cT3–4, групп высокого и очень высокого риска; негативная прогностическая значимость концентрации ПСА, категории сТ и групп высокого риска транслировалась в снижение показателей БМВ. Выделенные нами факторы прогноза валидированы в многочисленных работах [13] и широко используются для стратификации пациентов как в РКИ [1,2], так и при выборе лечебной тактики в клинической практике. Выделенный нами пороговый уровень ПСА ≥ 30 нг/мл, имеющий значимое влияние на прогноз БПВ и БМВ, оказался ниже, чем концентрация > 50 нг/мл, продемонстрировавшая достоверное негативное влияние на ОВ у больных нмГЧРПЖ, включенных в РКИ EORTC 30891 [14]. Это, вероятнее всего, связано с различием анализировавшихся в нашей серии и данном РКИ исходов.
В нашей серии наблюдений отмечено снижение показателей БПВ при рецидивном нмГЧРПЖ (p < 0,0001). В отличие от метастатических форм заболевания, при которых перенесенное радикальное лечение ассоциировано с лучшим прогнозом [6,7], ранее пролеченный нмГЧРПЖ у пациентов, не рассматриваемых в качестве кандидатов для спасительного лечения, как правило, характеризуется значительной местной распространенностью и исходными неблагоприятными характеристиками. Именно эти факторы мы считаем причиной негативного влияния ранее перенесенного радикального лечения на БПВ.
В нашей серии наблюдений 73,5% пациентов с нмГЧРПЖ получали интермиттирующую АДТ. В большинстве РКИ и их мета-анализе не выявлено преимуществ постоянной АДТ по сравнению с интермиттирующим режимом лечения в отношении показателей противоопухолевой эффективности. Так, в канадском РКИ PR. 7 (ПСА-рецидив после ДЛТ, n 1386) при медиане наблюдения 6,9 года интермиттирующая АДТ по сравнению с постоянной АДТ обеспечивала преимущества качества жизни и не уступала ей в отношении показателей ОВ (медиана 8,8 года против 9,1 года соответственно; HR 1,02 (95%CI: 0,86–1,21)). Частота смертей от РПЖ оказалась выше в группе интермиттирующей АДТ, летальность от других причин — в группе постоянной терапии [15]. В европейском РКИ ICELAND (местно-распространенный и рецидивный нмГЧРПЖ, n 702) не отмечено значимых различий интермиттирующей и постоянной АДТ в отношении БПВПСА и ОВ, качества жизни и НЯ [12]. Метаанализ шести РКИ (2015) продемонстрировал отсутствие различий смертности, частоты прогрессирования, а также качества жизни и НЯ при использовании интермиттирующей и постоянной АДТ [16].
При анализе признаков, влияющих на результаты лечения, обращает на себя внимание снижение показателей БПВ у наших больных нмГЧРПЖ групп низкого и промежуточного риска, получавших постоянную АДТ по сравнению с интермиттирующей терапией, что при среднесрочном наблюдении не реализовалось во влияние на БМВ, СВ и ОВ. Эти данные соответствуют результатам РКИ III фазы, включившем 1386 больных нГЧРПЖ, в котором отмечено увеличение времени до развития кастрационной резистентности в группе интермиттирующей АДТ по сравнению с постоянной терапией при поправке на наличие потенциальных факторов риска (HR 0,81 (95% CI: 0,68–0,98); p = 0,03). При медиане наблюдения 9 лет авторы не зарегистрировали значимых различий СВ и ОВ между лечебными группами. Однако пациенты, получавшие интермиттирующую АДТ, имели преимущества в отношении ряда показателей качества жизни, включая приливы, половое влечение, мочевые симптомы и слабость [15].
При среднесрочном наблюдении влияние выделенных нами факторов прогноза БПВ и БМВ на СВ и ОВ пока не реализовалось. Тем не менее, на основании полученных результатов можно предположить, что у пациентов старческого возраста АДТ обладает приемлемой эффективностью и имеет хороший профиль безопасности, обеспечивая результаты сопоставимые с мужчинами, не отобранными по возрасту. У пациентов в возрасте ≥ 75 лет с бессимптомным первичным нмГЧРПЖ групп низкого и промежуточного риска необходимо рассматривать возможность отсроченного назначения терапии. Как при первичном, так и при рецидивном нмГЧРПЖ интермиттирующая АДТ позволяет снизить лекарственную нагрузку и, возможно, способна увеличить время до прогрессирования в группах низкого и промежуточного риска.
Диссеминация РПЖ является фактором неблагоприятного прогноза ОВ и требует проведения противоопухолевой терапии, основанной на комбинациях АДТ с доцетакселом и/или ингибитором андрогенного сигнала [1,2]. Наибольшую актуальность интенсификация лекарственного лечения имеет в подгруппах пациентов с такими общепризнанными факторами риска, как большая метастатическая нагрузка [4] и первичный мГЧРПЖ [17]. В нашей небольшой серии наблюдений (n = 92) подтверждено негативное влияние синхронного появления метастазов и большого объема поражения на прогноз пациентов старческого возраста с мГЧРПЖ.
Только АДТ является допустимой опцией для лечения диссеминированного рака простаты у больных с противопоказаниями к комбинированной терапии [1,2]. В нашей популяции пациентов ≥ 75 лет (медиана возраста — 84 года) с тяжелым коморбидным фоном (медиана индекса Чарльсона — 7) АДТ использовалась в большинстве случаев (58,7 %), в 12,0% наблюдений лечение проводилось в интермиттирующем режиме. Следует отметить, что в настоящее время ранее широко использовавшаяся в реальной клинической практике интермиттирующая АДТ не рекомендована к применению при мГЧРПЖ [1,2]. В 3,3% случаев применялась максимальная андрогенная блокада с антиандрогеном 1 поколения, не имеющая доказанных преимуществ по сравнению с АДТ при мГЧРПЖ [18]. Частота назначения современной комбинированной терапии в 1 линии составила 38,0%, при этом в качестве препарата комбинации ИАС использовались в 19,6 % случаев. Доцетаксел назначали 18,4 % больных, включая 5,4 % пациентов с малой метастатической нагрузкой, при которой гормоно-химиотерапия не предоставляла преимуществ в ОВ по сравнению с АДТ, по данным субанализов РКИ III фазы STAMPEDE и CHAARTED [4,5]. На лечебную тактику, отклонявшуюся от текущих рекомендаций в 62,0 % случаев, несомненно, оказывали влияние стандарты, которые были актуальны в период назначения лечения.
Переносимость и эффективность терапии 1 линии у вошедших в нашу серию наблюдений пациентов старческого возраста с мГЧРПЖ соответствуют данным РКИ, включавших более молодых мужчин. Непереносимая токсичность зарегистрирована у 1 (1,5%) больного, получавшего доцетаксел; серьезных и фатальных НЯ зарегистрировано не было. Ретроспективный характер сбора данных не позволил детально оценить профиль переносимой токсичности.
У наших пациентов с мГЧРПЖ частота глубокого ПСА-ответа со снижением уровня маркера на 90% и более составила 38,0 % и оказалась недостоверно выше у мужчин, получавших комбинированную терапию c включением ИАС или доцетаксела, по сравнению с АДТ (66,7% и 41,2% против 31,6 %). Эти данные согласуются с данными РКИ TITAN, согласно которым снижение ПСА на ≥ 90% было зарегистрировано у 73% больных мГЧРПЖ, получавших АДТ с апалутамидом, и 29% пациентов, рандомизированных в группу АДТ и плацебо [19].
В нашей серии наблюдений при мГЧРПЖ 4-летняя ВБППСА составила 50,1 %, БПВ — 50,1 %, СВ — 83,5 % и ОВ — 77,2 %. Отмечено закономерное независимое негативное влияние на прогноз выживаемости грейда ISUP 4–5 (для БПВ), синхронных метастазов (для ОВ) и большой опухолевой нагрузки (для БПВ, СВ и ОВ). Результаты восьми РКИ III фазы, включавших мужчин, не отобранных по возрасту, свидетельствуют об уменьшении риска смерти на 24–37 % при введении в схему лечения мГЧРПЖ доцетаксела и/или ИАС [4–11]. У наших больных старческого возраста использование АДТ в качестве терапии первой линии значимо снижало БПВ по сравнению с комбинированным лечением (р = 0,018), что транслировалось в строгую тенденцию к уменьшению СВ (р = 0,053) и приводило к достоверному падению показателей ОВ (ОР 3,675 (95 % ДИ: 1,001–13,489); р = 0,008). Аналогичные результаты были получены в дополнительных анализах регистрационных исследований препаратов, рекомендованных для лечения мГЧРПЖ. Субанализы данных РКИ III фазы ARCHES и TITAN, сравнивавших АДТ с антиандрогеном 2 поколения и АДТ с плацебо, продемонстрировали сопоставимое преимущество выживаемости без радиологического прогрессирования и ОВ у больных < 65 лет по сравнению с мужчинами пожилого и старческого возраста [6,8]. В РКИ III фазы ARCHES зарегистрированы сходные профиль безопасности энзалу- тамида и плацебо у пациентов < 75 и ≥ 75 лет [20]. Post-hoc анализ данных РКИ III фазы CHAARTED подтвердил сравнимый выигрыш ОВ и отсутствие значимых различий частоты токсичности 3–5 степеней у больных мГЧРПЖ моложе 70 лет и ≥ 70 лет при назначении АДТ в комбинации с доцетакселом по сравнению с АДТ [21]. Нами не выявлено достоверного влияния на БПВ препарата комбинации, в том числе — в подгруппах с малой и большой метастатической нагрузкой, что может быть связано с недостаточными размерами выборки. Тем не менее, мета-анализ РКИ III фаз подтверждает сопоставимое позитивное влияние доцетаксела и ИАС на БПВ и ОВ пациентов с мГЧРПЖ [22].
По данным РКИ III фазы STAMPEDE, проведение ДЛТ на область первичной опухоли в циторедуктивном режиме у пациентов с мГЧРПЖ и малой метастатической нагрузкой, получающих АДТ, значимо увеличивает ОВ [23]. Однако в РКИ PEACE-1 продемонстрировано, что при назначении комбинированной терапии у данной популяции больных ДЛТ влияния на ОВ не оказывает [24]. В связи с этим актуальные рекомендации предусматривают циторедуктивную ДЛТ в качестве лечебной опции у кандидатов для АДТ с малым объемом опухолевого поражения [1,2]. ДЛТ редко используется у пациентов с мГЧРПЖ старческого возраста в реальной практике (5,4%), что может быть связано с высокой частотой симптомов нижних мочевыводящих путей, препятствующих безопасному проведению облучения. Тем не менее, возможность циторедуктивной ДЛТ следует принимать во внимание при разработке индивидуальной лечебной тактики.
ЗАКЛЮЧЕНИЕ
Противоопухолевая терапия является безопасным и эффективным методом лечения больных ГЧРПЖ старческого возраста. При неметастатических формах заболевания лекарственное лечение должно быть ограничено назначением АДТ. С пациентами, имеющими бессимптомное течение нмГЧРПЖ, необходимо обсуждать возможность применения отсроченного лечения. У мужчин ≥ 75 лет, не имеющих метастазов РПЖ, с адекватным ответом на индукционный курс кастрационной терапии интермиттирующая АДТ является методом выбора, позволяющим снизить лекарственную нагрузку и, возможно, способным увеличить время до прогрессирования опухолевого процесса. Больным мГЧРПЖ старческого возраста без противопоказаний к комбинированной терапии АДТ должна быть дополнена ИАС или, при большой метастатической нагрузке, — доцетакселом с или без ИАС. С пациентами, имеющими малую метастатическую нагрузку и расцененными как кандидаты для АДТ, необходимо обсуждать возможность проведения ДЛТ на область первичной опухоли.


