Экологическая оценка буровых шламов и разработка способа их биоремедиации в условиях Западной Сибири
Автор: Зимнухова А.Е., Гаевая Е.В., Тарасова С.С.
Журнал: Вестник Нижневартовского государственного университета @vestnik-nvsu
Рубрика: Экология и природопользование
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
В статье рассмотрен вопрос биоремедиации буровых шламов. Целью исследования является изучение микробиологическихпроцессов, происходящих в почвогрунтах на основе бурового шлама, с последующим применением их для биологического этапа рекультивации нарушенных земель. Изучены микробиологические характеристики бурового шлама и четырёх образцов почвогрунтов на его основе с добавлением диатомита, доломитовой муки, торфа, гипса, глауконита, гуминового препарата «Росток» в разных пропорциях. Выполнены посевы на агаризованные среды: мясопептонный агар (МПА), крахмало-аммиачный агар (КАА), среду Мюнца, среду Чапека, в зависимости от определяемой группы микроорганизмов. Оценена общая численность микрофлоры, численность сапрофитов, микроорганизмов, растущих на крахмало-аммиачном агаре (КАА), бактерий, использующих углеводороды (УОБ), микромицетов и актиномицетов. Рассчитан коэффициент минерализации. Общая численность микрофлоры в образцах варьировалась от 51 до 271 млн КОЕ/г. Доля сапрофитов составила 16,7-24,8% от общего количества микрофлоры. Доля микроорганизмов, растущих на КАА, составила 15,6-36,6%. Минимальная численность УОБ составила 2,0 млн КОЕ/г почвогрунта, максимальная - 22,0 млн КОЕ/г. Коэффициент минерализации варьируется от 0,81 до 1,63, что говорит о разных темпах процессов минерализации. Численность микромицетов, определённая на среде Чапека, варьировалась в пределах от 0,01 до 3,33 млн КОЕ/г, на КАА - от 0,03 до 10,4 млн КОЕ/г. При этом численность микромицетов намного ниже численности бактерий, что нормально для почвогрунтов. Численность актиномицетов варьировалась от 0,2 до 7,3 млн КОЕ/г. Наибольшая численность актиномицетов отмечена при внесении торфа и гуминового препарата «Росток». Доля актиномицетов в общей численности микрофлоры на КАА составила от 0,6 до 14%. Наблюдается развитие общей численности микрофлоры, увеличение разнообразия микробоценоза, что свидетельствует о снижении концентраций водорастворимых солей, нефтепродуктов и наличии дополнительного источника питания в виде торфа. На основании полученных данных сделан вывод о возможности применения почвогрунтов на основе бурового шлама с добавлением торфа и гуминового препарата «Росток» для рекультивации нарушенных земель.
Буровой шлам, биоремедиация, почвогрунт, рекультивация, микробиологический анализ
Короткий адрес: https://sciup.org/14128635
IDR: 14128635 | УДК: 504.054/502.37 | DOI: 10.36906/2311-4444/23-3/08
Текст научной статьи Экологическая оценка буровых шламов и разработка способа их биоремедиации в условиях Западной Сибири
Зимнухова А.Е., Гаевая Е.В., Тарасова С.С. Экологическая оценка буровых шламов и разработка способа их биоремедиации в условиях Западной Сибири // Вестник Нижневартовского государственного университета. 2023. № 3(63). С. 90–100.
В условиях Западной Сибири актуальным является вопрос обращения с буровыми шламами, образующимися при добыче углеводородного сырья [1; 2]. На сегодняшний день наиболее распространён способ размещения и хранения их в шламовых амбарах, являющихся источником вторичного загрязнения окружающей среды. При этом для восстановления экосистем в северных условиях требуется до 15 лет [3; 4]. В этой связи необходима разработка современных методов рекультивации территорий, занятых шламовыми амбарами.
Важную роль в восстановлении биоценозов играют процессы биоремедиации [5]. В биоремедиации выделяют два основных подхода:
-
1. Биостимуляция, заключающаяся во внесении различных субстратов, биогенных элементов для активации деградирующей способности микрофлоры, при этом наблюдается рост микроорганизмов, способных к очистке почв;
-
2. Биодополнение, заключающееся во внесении специально созданных штаммов-деструкторов.
При этом буровой шлам, являясь выбуренной горной породой, может быть возвращён в геосферные оболочки Земли и использован в качестве почвогрунта для рекультивационных мероприятий при внесении каких-либо добавок.

Целью исследования является изучение микробиологических процессов, происходящих в почвогрунтах на основе бурового шлама, с последующим применением их для биологического этапа рекультивации нарушенных земель.
В качестве основного показателя плодородия почв выступает их биологическая активность в комплексе с химическими и токсикологическими свойствами. Оценка плодородия почв возможна по таким критериям как биомасса микроорганизмов (МО) и ферментативная активность [6].
Ферменты выполняют функцию катализаторов физических, химических, биологических реакций, за счёт чего играют важную роль в процессах, происходящих в почвах. Почвенные ферменты обладают высокой чувствительностью к изменениям, вызванным природными или антропогенными воздействиями [7; 8; 18–20].
Исследования, проводимые в данной области, свидетельствуют о возможности использования ферментативной активности почв в качестве индикаторного показателя загрязнения почв и для характеристики почвогрунтов, полученных на основе буровых шламов [9; 10].
Существует коррелятивная зависимость напряжённости микробиологических процессов в почве с размножением и активностью всей совокупности почвенных сапрофитных микроорганизмов [10]. Оценить общее состояние почвы можно посредством определения общей численности. При этом в плодородных почвах с высоким содержанием органического вещества численность может достигать миллиардов.
Распад и минерализация свежего органического вещества осуществляются в первую очередь благодаря группе аммонифицирующей микрофлоры, так называемой гнилостной, учитываемой на мясопептонном агаре (МПА). Данная микрофлора использует белки – азотсодержащее органическое вещество.
Следующий этап минерализации опада осуществляется группой, учитываемой на крахмало-аммиачном агаре (КАА). Данная группа является разнородной по составу группой бактерий, микромицетов, актиномицетов, использующей для питания органические вещества без азота – углеводы и полисахариды, азот в минеральной форме.
Соотношение бактерий, усваивающих органический и минеральный азот (КАА/МПА), может выступать в качестве одного из показателей интенсификации минерализационных процессов в почве. При более энергичном процессе минерализации микроорганизмы, усваивающие минеральный азот, превосходят по численности микрофлору, которая развивается посредством органического азота.
Почвенные грибы и актиномицеты имеют важное значение в процессе превращения широкого круга органических и минеральных веществ в почве. Они продуцируют многие физиологически активные вещества, такие как аминокислоты, витамины, ферменты, антибиотики. Благодаря последним выражены антагонистические свойства, оказывающие влияние на формирование почвенных микробоценозов [11; 12].
Группу неродственных бактерий, которые способны к использованию углеводородов как единственного источника углерода и энергии, называют УОБ. Данная группа выделяется
^^^^J 92
на плотных или жидких минеральных средах (Раймонда и Мюнца) при использовании углеводородов или нефти в качестве источника питания. Помимо окисления углеводородов, в благоприятных условиях могут использовать более доступные субстраты, а при наличии углеводородов могут получать энергию из них. При этом данная группа получает конкурентное преимущество относительно других видов.
Образец бурового шлама или почвогрунта был перемешан и измельчён до однородного состояния. Для всех образцов определена влажность, с учётом которой далее рассчитана численность микрофлоры на 1 грамм сухого бурового шлама или почвогрунта.
Навеска бурового шлама или почвогрунта была помещена в выпарительную чашу, высушена до постоянной массы при 85°C. На основании потери массы после сушки определена влажность образца.
Далее из образца отбиралась навеска 1 г., вносилась в пробирку с 9 мл физраствора (0,9% хлорида натрия), добавлялся по одной капле стерильный ПАВ ТВИН-80, перекрывался стерильной резиновой пробкой и энергично встряхивался в течение одной минуты. После этого отстаивался в течение десяти минут и готовилась серия разведений полученной взвеси в 10, 100, 1000, 10000 и т. д. раз.
Из полученных разведений выполнялся посев на агаризованные среды для определения численности ряда физиологических групп.
Общее число микрофлоры было определено посевом в толщу мясопептонного агара (МПА). Исследуемая взвесь в объёме 1 мл была внесена в стерильную чашу Петри и залита 25-30 мл тёплой среды МПА, перемешана покачиванием. Инкубирование происходило при 30 °C в течение 3-5 суток. Численность выражена в миллионах клеток или колониеобразующих единиц на один грамм сухой почвы, млн КОЕ/г.
Численность сапрофитной микрофлоры (гнилостной, аммонифицирующей белки) определена посевом 0,1 мл разведений взвеси на поверхность МПА (рис. 1). Посевы были подсчитаны через 3-5 суток термостатирования при 30 °C.

Рис. 1. Внешний вид посевов на МПА (группа сапрофитных бактерий)
В состав МПА входят готовый ГМФ агар, пептон сухой ферментативный, агар бактериологический, вода дистиллированная.
Численность актиномицетов, микромицетов и бактерий, использующих органическое вещество без азота, определена посевом 0,1 мл разведений взвеси на поверхность крахмало-аммиачного арага (КАА). Подсчёт посевов был выполнен через 5-7 суток термостатирования при 30°C.
В состав среды КАА входят крахмал растворимый, (NH 4 ) 2 SO 4 , K 2 HPO 4 , MgSO 4 , NaCl, CaCO 3 , агар бактериологический, вода дистиллированная.
Численность углеводородокисляющих бактерий (УОБ) была определена посевом 0,1 мл разведений взвеси на поверхность агаризованной минеральной среды Мюнца с нефтью, выполняющую функции единственного источника углерода и энергии. Подсчёт посевов выполнен через 7–10 суток термостатирования при 30°C.
В состав среды Мюнца входят NaCl, KNO 3 , MgSO 4 , KH 2 PO 4 , K 2 HPO 4 , агар бактериологический, нефть стерильная.
Численность микромицетов отдельно определена посевом 0,1 мл разведений взвеси на поверхность среды Чапека. Подсчёт выполнен через 3–5 суток термостатировани при 30°C.
В состав среды Чапека входят среда Чапека сухая, агар бактериологический.
В исследовании использованы следующие образцы почвогрунтов:
№1 – буровой шлам (контроль);
-
№2 – буровой шлам смешан с диатомитом и доломитовой мукой в соотношении 80:10:10 %;
-
№3 – буровой шлам смешан с диатомитом, доломитовой мукой, торфом и гуминовым препаратом «Росток» в соотношении 40:10:10:40%;
№4 – буровой шлам смешан с гипсом и глауконитом в соотношении 80:10:10%;
-
№5 – буровой шлам смешан с гипсом, глауконитом, торфом и гуминовым препаратом «Росток» в соотношении 40:10:10:40%.
Общая численность микрофлоры в образцах варьировалась от 51 до 271 млн КОЕ/г (табл.). Численность сапрофитов (аэробных аммонификаторов) составила 8,5 млн КОЕ/г для образца №4, для остальных образцов – от 34,0 до 62,0 млн КОЕ/г (рис. 1). На долю сапрофитов приходится от 16,7 до 24,8 % от общего количества микрофлоры.
Таблица
Результаты определения влажности и микробиологические анализы почвенных образцов
|
№ |
Численность, млн КОЕ/г |
КАА/ МПА |
|||||||
|
Влажность, % |
Общая |
Сапрофитов |
Общая на КАА |
УОБ на Мюнца |
Грибов на Чапека |
Грибов на КАА |
Актиноми- цетов на КАА |
||
|
1 |
0,3 |
271 |
61,0 |
99,3 |
22,0 |
0,08 |
0,1 |
1,0 |
1,63 |
|
2 |
2,1 |
204 |
34,0 |
31,9 |
13,6 |
0,01 |
0,2 |
0,2 |
0,94 |
|
3 |
4,1 |
250 |
62,0 |
50,6 |
13,0 |
3,33 |
10,4 |
7,3 |
0,81 |
|
4 |
2,2 |
51 |
8,5 |
8,7 |
2,0 |
0,02 |
0,03 |
0,6 |
1,02 |
|
5 |
5,5 |
210 |
45,2 |
57,8 |
17,8 |
0,21 |
0,4 |
4,9 |
1,27 |

Количество микроорганизмов, растущих на среде с минеральным азотом, варьировалось от 31,9 до 99,3 млн КОЕ/г для образцов №№ 1, 2, 3, 5. В образце №4 их количество также было минимальным и составило 8,7 млн КОЕ/г. Так, количество микроорганизмов, растущих на КАА, варьируется в пределах от 15,6 до 36,6 % от общей численности. Количество сапрофитов и растущих на КАА сопоставимо во всех образцах.
Численность УОБ в образце №4 была минимальной и составила 2,0 млн КОЕ/г. В остальных образцах численность УОБ была в пределах от 13,0 до 22,0 млн КОЕ/г.
Данные численности микрофлоры разных физиологических групп в логарифмическом масштабе представлены на рисунке 2. Логарифмическая шкала позволяет сравнить величины разного порядка.
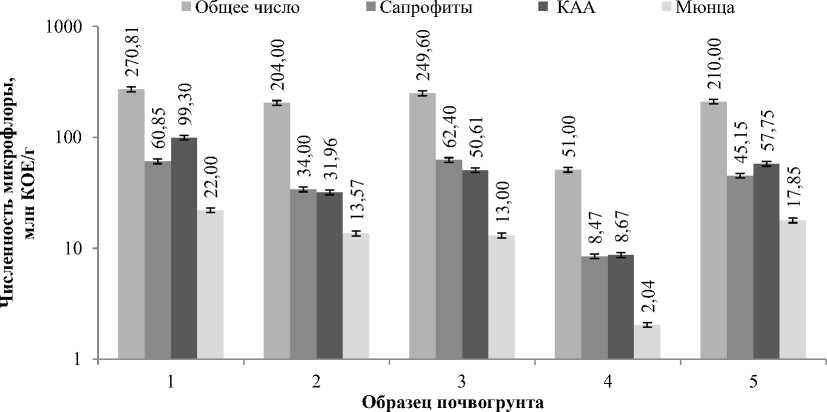
Рис. 2. Численность микрофлоры разных физиологических групп (шкала логарифмическая)
По рисунку 2 видно значимое отличие образца №4 по численности всех исследуемых групп микрофлоры. В данном образце содержится минимальное количество сапрофитов, бактерий, растущих на КАА и углеводородокисляющих бактерий, выращиваемых на среде Мюнца.
Коэффициент минерализации, рассчитываемый как отношение численности микрофлоры, растущей на КАА, к численности микрофлоры, растущей на МПА, был заметно выше единицы в образцах №№ 1 и 5 и составил 1,63 и 1,27 соответственно. В образцах №№ 2 и 4 данный коэффициент был близок к единице и составлял 0,94 и 1,02 соответственно. В образце № 3 наблюдается минимальное отношение КАА к МПА и составляет 0,81, что свидетельствует о наиболее низком темпе происходящих минерализационных процессов (рис. 3).
Почвенные микромицеты являются одними из основных компонентов биоты и имеют непосредственное отношение к процессам почвообразования и круговорота веществ в экосистемах северных территорий [13].
Грибная флора служит индикатором способности почвы к самовосстановлению после антропогенного воздействия [14–17].
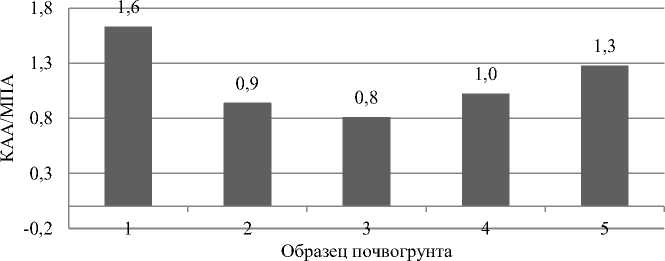
Рис. 3. Коэффициент минерализации (отношение численности микрофлоры, растущей на КАА, к численности микрофлоры, растущей на МПА)
Во всех образцах численность микромицетов была намного ниже, чем бактерий, что является нормой для почвогрунтов. Высокое содержание почвенных грибов может быть связано с такими проблемами, как кислая реакция почвенного раствора, нарушение водновоздушного режима и другими.
Численность микромицетов, определённая на средах Чапека и КАА, была схожа во всех образцах, кроме №3, где численность составила 3,33 и 10,4 млн КОЕ/г соответственно. В остальных численность микромицетов, определённая на среде Чапека, варьировалась от 0,01 до 0,21 млн КОЕ/г, на КАА – от 0,03 до 0,4 млн КОЕ/г.
Численность актиномицетов в образцах №№ 1, 2, 4 варьировалась в пределах от 0,2 до 1,0 млн КОЕ/г, в образцах с внесением торфа (№№ 3 и 5) зафиксирована наибольшая численность – 7,3 и 4,9 млн КОЕ/г соответственно. При этом их доля в общей численности микрофлоры на КАА для образцов №№ 1 и 2 была наименьшей и составила 0,6 и 1%, выше в образцах №№ 4 и 5 – 6,7 и 8,4%. В образце №3 зафиксирована максимальная доля – 14% (рис. 4).
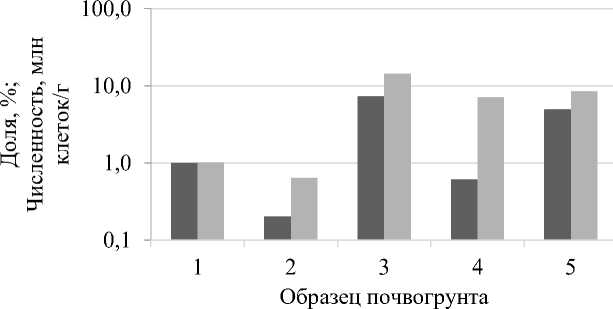
■ Численность
■ Доля в микрофлоре на КАА
Рис. 4. Численность актиномицетов и их доля (в %) в численности всей микрофлоры на КАА
Актиномицеты способны формировать споры и таким образом переживать периоды неблагоприятных условий: недостаток питания, низкую влажность. В связи с этим высокое содержание актиномицетов может свидетельствовать о неблагоприятных условиях для вегетативных форм микрофлоры.
Результаты исследований показывают ингибирующее действие на микробоценоз водорастворимых солей и нефтепродуктов, входящих в состав бурового шлама, а также щелочной реакции среды бурового шлама. В исследуемых почвогрунтах наблюдается развитие общей численности микрофлоры.
Увеличение разнообразия микробоценоза исследуемых почвогрунтов свидетельствует о снижении концентраций водорастворимых солей и нефтепродуктов относительного исходного образца бурового шлама, а также о наличии дополнительных источников питания в виде торфа.
Таким образом, почвогрунты на основе буровых шламов с добавлением торфа и гуминового препарата «Росток» могут быть использованы как исходный материал для биологической рекультивации нарушенных земель.
Список литературы Экологическая оценка буровых шламов и разработка способа их биоремедиации в условиях Западной Сибири
- Васильченко А.В., Воеводина Т.С. Проблема экологической оценки загрязнения почв нефтепродуктами // Вестник Оренбургского государственного университета. 2015. №10(185). С. 147–151.
- Рядинский В.Ю., Соромотин А.В., Денеко Ю.В. Состав и свойства буровых отходов Западной Сибири // Вестник Тюменского государственного университета. 2004. №3. С. 51–55.
- Глазовская М.А., Пиковский Ю.И. Скорость самоочищения почв от нефти в различных природных зонах // Природа. 1980. №5. С. 118–119.
- Назаров А.В. Влияние нефтяного загрязнения почвы на растения // Вестник Пермского университета. 2007. №5(10). С. 134–141.
- Вельков В.В. Биоремедиация; принципы, проблемы, подходы // Биотехнология. 1995. №3-4. С. 20–27.
- Григорьян Г.Р., Николаева Т.Г., Сунгатуллина Л.М. Изменение биологических параметров почвенной экосистемы в агробиоценозах в условиях различных систем земледелия // Георесурсы. 2011. №2(38). С. 9–13.
- Сенчакова Т.Ю. Микромицеты черноземных почв как объект биоиндикации в антропогенно-трансформированных экосистемах // Наука и современность. 2010. №6-1. С. 55–59.
- Пикушова Э.А., Букреев Н.А., Москалева С.К. Пшидаток Изменение численности микромицетов в черноземе, выщелоченном в зависимости от технологий возделывания озимой пшеницы сорта Фортуна // Научный журнал КубГАУ. 2012. №81. С. 459–475.
- Сакаева Э.Х., Рудакова Л.В. Оценка биологической активности техногрунтов на основе буровых шламов для рекультивации нарушенных земель // Теоретическая и прикладная экология. 2020. №4. С. 192–197.
- Тарасова С.С. Экологическая оценка почвогрунтов на основе буровых шламов для биологического этапа рекультивации нарушенных земель в условиях Западной Сибири: дисс… канд. биол. наук. Тюмень, 2022. 195 с.
- Звягинцев Д.Г., Бабьева И.П., Зенова Г.М. Биология почв. М.: Изд-во МГУ, 2005. 445 с.
- Комаревцева Л.Г. Микробиологическая активность почвы на фоне действия и последействия разных видов удобрений // Вестник АПК Верхневолжья. 2010. №3. С. 43–46.
- Хабибуллина Ф.М. Характеристика почвенной микобиоты во вторичных лиственных лесах подзоны средней тайги (Республика Коми) // Известия Самарского научного центра РАН. 2014. №1-3. С. 891–895.
- Назарько М.Д. Изменение состава почвенных микромицетов при интенсивном антропогенном воздействии в северных районах Кубани // Изв. вузов. Пищевая технология. 2007. №4. С. 110–111.
- Колесникова И.Я., Воронин Л.В. Изменение комплексов почвенных грибов под действием различных систем обработки почвы и удобрений // Ярославский педагогический вестник. Естественные науки. 2011. №1. С. 114–118.
- Воронин Л.В., Колесникова И.Я. Инициированные комплексы почвенных грибов в агроценозах // Ярославский педагогический вестник. 2012. №1. Т. III (Естественные науки). С. 90–93.
- Куркина Ю.Н., Нгуен Тхи Лан Хыонг. Микромицеты в почвах Белгородской области под бобовыми культурами // Вестник защиты растений. 2014. №2. С. 51–54.
- Utobo E.B., Tewari L. Soil enzymes as bioindicators of soil ecosystem status // Applied Ecology and Environmental Research. 2015. Vol. 13(1). P. 147–169. https://doi.org/10.15666/aeer/1301_147169
- Baldrian P. Microbial enzyme-catalyzed processes in soils and their analysis // Plant Soil Environmental. 2009. №55 (9). P. 370–378. https://doi.org/10.17221/134/2009- PSE
- Dariush M.-T., Mina K.M. Crude oil-polluted soil induces ultrastructural and enzyme activity changes in the Shoot of Lentil // Journal of Stress Physiology & Biochemestry. 2017. Vol. 10. №1. P. 112–121.


