Экологическая пластичность мембранных глицеролипидов дикорастущих галофитов в условиях Приэльтонья
Автор: Розенцвет Ольга Анатольевна, Богданова Елена Сергеевна, Нестеров Виктор Николаевич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Наземные экосистемы
Статья в выпуске: 3-1 т.15, 2013 года.
Бесплатный доступ
Исследована экологическая пластичность мембранных глицеролипидов надземной части дикорастущих галофитов, произрастающих в биотопах с различным уровнем засоления и увлажнения почвы. Показано, что у облигатных галофитов количество накапливаемых липидов определяется видовыми особенностями и является величиной, зависимой от стадии онтогенеза и условий произрастания. Установлено, что такие показатели, как содержание МГДГ и ДГДГ в пуле ГЛ, содержание ФХ в пуле ФЛ являются «жесткими», то есть непластичными, содержание суммарных липидов, СХДГ, ФГ – умеренно пластичными, а содержание мембранных липидов среди суммарных липидов, а также содержание ФЭ – высоко пластичными.
Галофитная растительность, мембранные глицеролипиды, пластичность
Короткий адрес: https://sciup.org/148201784
IDR: 148201784 | УДК: 581.1
Текст научной статьи Экологическая пластичность мембранных глицеролипидов дикорастущих галофитов в условиях Приэльтонья
И звестно, что галофитная растительность составляет лишь 2% от всех наземных видов растений [11 ] . Тем не менее, растительные ресурсы галофитов природной флоры являются не только источником лекарственного и масличного сырья, но и растений – биомелиоратов в практике сельского хозяйства аридных территорий [9]. Галофиты предпочитают селиться на засоленных почвах, солончаках, солонцах. Благодаря наличию ряда наследственно закрепленных морфологических и физиологических особенностей они устойчивы к повышенной концентрации солей в среде. Среди галофитов выделено четыре группы растений: соленакапливающие, солевыделяющие, соленепроницаемые и локализующие соли в специальных структурных образованиях [3]. Семейство Chenopodiaceae является одним из наиболее солеустойчивых растений [12]. Повышенное содержание солей в почве благоприятно сказывается на их развитии и накоплении биомассы [13]. У данного семейства свойством галофильности обладают большей частью соленакапливающие представители и реже – солевыделяющие. Однако, такие семейства как Plumbaginaceae и Asteraceae также могут переносить высокие концентрации солей в почве.
Способность произрастать на засоленных субстратах определяется солеустойчивостью. Механизмы солеустойчивости разнообразны: ограничение поступления ионов солей в побеги и перенос корнями обратно во внешнюю среду; концентрирование ионов в старых листьях и выделение в солевые железы или на поверхность листьев;
изолирование в вакуолях [17]. Одним из регуляторных механизмов поддержания оптимальных концентраций ионов солей в растительной клетке является модификация мембранных структур всех субклеточных компартментов, связанная с изменением скорости и направленности метаболизма входящих в их состав липидов. В частности показано, что накопление ионов солей воздействует на активность липид-синтезирующих ферментов хлоропластов – галактозил трансферазы и ацила-зы, что приводит к некоторым изменениям в составе гликоглицеролипидов (ГЛ) [2]. На примере корневых клеток одного из сортов сои, чувствительных к избыточному засолению, установлено, что при солевом стрессе уменьшается уровень фосфорсодержащих глицеролипидов (ФЛ) и увеличивается степень насыщенности жирных кислот (ЖК) [23]. Солеустойчивость растений рода Plantago ассоциируется с увеличением содержания холестерина и редукцией – ситостерина [18]. При анализе состава липидов вакуолей галофита Suaeda maritima было показано, что степень насыщенности ЖК важна для компартментализации NaCI: чем выше уровень насыщенных ЖК, тем ниже пассивный транспорт катионов через мембраны [19]. При сравнении состава липидов листьев у разных по солеустойчивости растений было обнаружено, что с увеличением солетоле-рантности увеличивается соотношение ГЛ/ФЛ [16]. Несмотря на достаточно обширные литературные данные, остается много нерешенных проблем. Так недостаточно изучена роль липидов мембран в стратегии соленакопления растений; мало изучена изменчивость содержания общих липидов и отдельных липидных компонентов в фотосинтезирующих органах дикорастущих галофитов под влиянием факторов среды. Эти вопросы связаны с пластичностью или статичностью структурообразующих компонентов клетки, таких как биологические мембраны, у разных функциональных типов растений.
Пластичность любого организма зависит от факторов окружающей среды [14]. Известно, например, о генетической изменчивости для обеспечения фенотипической пластичности растения внутри популяции [26]. Пластичность растений чаще всего связывают с изменением морфометрических параметров отдельных частей растений [10]. Однако изменение морфометрических признаков основано на физиологической и биохимической пластичности растений, которая проявляется в адаптивном изменении химического состава, как результат изменения интенсивности таких важнейших процессов, как фотосинтез, дыхание, газообмен, транспирация, а также биосинтез хлорофилла и других фотосинтетических пигментов [10, 14, 25]. С этой точки зрения изменчивость липидов - одного из ключевых компонентов биологических мембран, также может характеризовать функциональную пластичность растений. Ранее нами показана специфичность состава мембран галофитов с различными механизмами регуляции солевого обмена в зависимости от абиотических факторов среды [7].
Цель работы – изучить экологическую (сезонную и видовую) пластичность мембранных гли-церолипидов в надземной части дикорастущих галофитов в условиях Приэльтонья.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были выбраны Sali-cornia perennans Willd., Suaeda salsa (L.) Pall., Halocnemum strobilaceum (Pall.) Bieb., Petrosimo-nia oppositifolia (Pall.) Litv. из семейства Chenopo-diaceae и Limonium gmelinii (Willd.) O. Kuntze из семейства Plumbaginaceae . Растительный материал отбирали в первой декаде каждого летнего месяца 2011 г. в первой половине дня на экспериментальных площадках (20 х 20 м), расположенных в дельте рек Большая Сморогда (49°07´с.ш., 46°50´в.д.), Чернавка (49°12´с.ш., 44°40´в.д.), Ланцуг (49°12´с.ш., 46°38´в.д.). Район исследования находится в северной части Прикаспийской низменности (Волгоградская обл.), характеризуется близостью залегания грунтовых вод, засоленностью почвогрунтов, что обуславливает формирование солончаковости и солонцева-тости почв и определенного типа растительности [6].
Для биохимических анализов использовали листья по одному из 15 – 20 растений. Среднюю часть листьев или побегов (в случае с Salicornia perennans), собранных с одной площадки, измельчали, из объединенной биомассы составляли три независимых биологических пробы (2-4 г сырой массы), деферментатировали кипящим изопропанолом и до анализа хранили в темном холодном месте. Одновременно отбирали пробы почвы на глубине 15-20 см для определения ки- слотности, влажности и минерального остатка почвенной вытяжки [1].
Липиды экстрагировали трижды смесью хлороформа и метанола (1 : 2, v/v) с одновременным механическим разрушением тканей [4,9]. Количество общих липидов определяли гравиметрически после полного удаления растворителей.
Разделение липидов осуществляли методом тонкослойной хроматографии (ТСХ) на пластинках 10 × 10 или 6 × 6 см с закрепленным слоем силикагеля. Для разделения гликолипидов (ГЛ) использовали одномерную ТСХ в системе растворителей – ацетон : бензол : вода (91 : 30 : 8) и 5%-ный раствор 12MoO 3 × H 3 PO 4 в этаноле для их проявления. Количество ГЛ определяли на денситометре Sorbfil (Россия). Для построения калибровочных кривых использовали моногалак-тозилдиацилглицерин (МГДГ) (“Larodan”, Швеция). Разделение фосфолипидов (ФЛ) проводили методом двумерной ТСХ с использованием систем растворителей: первое направление – хлороформ : метанол : бензол : аммиак (130 : 60 : 20 : 12), второе – хлороформ : метанол : бензол : ацетон : уксусная кислота (140 : 60 : 20 : 10 : 8). Проявляли 10%-ным раствором H 2 SO 4 в метаноле при нагревании до 180оС в течение 15 мин. Количество ФЛ определяли по содержанию неорганического фосфора с последующим перерасчетом на молекулярные массы липидов [4, 24].
Коэффициент вариации ( Cv ) рассчитывали в % по формуле:
Cv = ^X100 д
где А – среднее значение показателя; S x- стандартное отклонение от среднего. Результаты представлены в виде М ± m, где М – средняя арифметическая, m – стандартная ошибка. Достоверность различий оценивали с использованием непараметрического критерия Стьюдента при уровне значимости p < 0.05 [5]. Для статистической обработки использовали программы Statis-tica 6.0 for Windows, Microsoft Excel 2007.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследованные растения в систематическом плане представляют два семейства ( Chenopodi-aceae и Plumbaginaceae ), а в зависимости от типа соленакопления относятся к эугалофитам – S . per-ennans , S . salsa , H . strobilaceum , P . oppositifolia и криногалофитам – L . gmelinii . В таблице 1 представлена характеристика микроклиматических и эдафических условий в местах отбора галофитов.
Из приведенных данных можно видеть, что условия среды в местах произрастания растений различались по уровню увлажненности и солености почвы, а также температурному режиму. Эти характеристики менялись в течение сезона вегетации растений. В июле и августе наиболее увлажненная почва была на р. Ланцуг. В эти же месяцы были зарегистрированы самые высокие (29–
36°С) и низкие (15-22°С) температуры воздуха. В течение летних месяцев менялся также уровень солености почвы. Например, в июне на р. р. Чернавка и Ланцуг соленость не превышала 0,5 г/л, а к июлю этот показатель увеличивался ~ на 40%.
Пластичность липидов оценивали для таких параметров, как количество суммарных липидов, количество мембранных глицеролипидов - сумма ФЛ и ГЛ, а также индивидуальных ГЛ и ФЛ. Результаты показали, что суммарное содержание липидов в надземной части галофитной расти тельности варьировало от 2,7 до 16,2 мг/г сырой массы в зависимости от условий произрастания растений и времени вегетации (табл. 2). В листьях криногалофита L. gmelinii эта величина на протяжении всего времени наблюдения была в 2-5 раз больше по сравнению с эугалофитами. Для большинства видов, за исключением H. strobilaceum, отмечено увеличение количества суммарных липидов к концу лета по сравнению с июнем и июлем.
Таблица 1. Характеристика условий произрастания галофитов
|
Река |
Влажность почвы, % |
Соленость почвы, г/л |
Температура воздуха, ° С |
||||||
|
Июнь |
Июль |
Август |
Июнь |
Июль |
Август |
Июнь |
Июль |
Август |
|
|
Б. Сморогда |
13,4 |
11,7 |
15,6 |
1,0 |
1,4 |
1,0 |
24 |
32 |
15 |
|
Чернавка |
17,6 |
15,0 |
15,2 |
0,3 |
1,3 |
0,8 |
25 |
29 |
15 |
|
Ланцуг |
10,1 |
23,9 |
36,0 |
0,2 |
1,3 |
0,9 |
27 |
36 |
22 |
Таблица 2. Содержание и вариативность суммарных липидов в надземной части галофитов
|
Виды растений |
Период отбора растений |
|||||
|
Июнь |
Июль |
Август |
||||
|
А |
Cv |
А |
Cv |
А |
Cv |
|
|
H . strobilaceum |
6,7±0,6 |
10,7 |
6,5±2,3 |
35,9 |
4,3±0,5 |
11,5 |
|
P . oppositifolia |
5,3±0,6 |
12,6 |
5,2±1,3 |
26,6 |
12,5±2,6 |
21,0 |
|
S . perennans |
2,7±0,6 |
25,3 |
3,9±0,7 |
19,6 |
11,2±2,2 |
20,4 |
|
S . salsa |
4,8±1,4 |
29,7 |
4,0±1,1 |
29,6 |
5,5±1,1 |
20,3 |
|
L . gmelinii |
8,1±1,7 |
21,3 |
8,9±1,0 |
11,5 |
16,2±1,4 |
27,1 |
Примечание: А - среднее значение, мг/г сырой массы; С v - коэффициент вариации,%
Учитывая неоднородность условий обитания, были рассчитаны коэффициенты вариации ( Cv ) количества суммарных липидов. Оказалось, что вариативность этого показателя была видоспецифичной и менялась в зависимости от времени вегетации растений. Так в листьях эугалофитов H . strobilaceum и P . oppositifolia в июле Cv составлял 35,9 и 26,6, а в июне - 10,7 и 12,6% соответственно, что говорит о том, что в июле содержание суммарных липидов в большей степени зависело от условий обитания, чем в июне. В надземной части S . perennans и S . salsa отмечен меньший размах вариации суммарных липидов в течение всего периода наблюдений ( Cv = 19,6-25,3 и 20,329,7). У единственного представителя криногало-фитов L . gmelinii количество суммарных липидов было наиболее стабильным в июле ( Cv = 11,5%) и более вариативным в начале и конце лета ( Cv = 21,3 и 27,1%, соответственно) (табл. 2).
Известно, что солеустойчивость растения меняется в онтогенезе, при этом наименьшая соле-устойчивость отмечается у молодых растений , при формировании вегетативной массы соле-устойчивость повышается, при переходе к бутонизации она опять понижается, а после цветения - повышается [3]. Представленные виды являются облигатными галофитами, их солеустойчи-вость в естественных для них условиях не вызы -вает сомнения. Однако полученные данные свидетельствуют о том, что и у истинных дикорас- тущих галофитов количество накапливаемых липидов определяется видовыми особенностями и является величиной зависимой от стадии онтогенеза и условий произрастания.
Мембранные глицеролипиды, которые являются главными компонетами матрицы биологических мембран, составляли 25-80% от суммы липидов. Остальную часть суммарных липидов представляли запасные липиды. Данные рис. 1 показывают, что для всех видов соленакопителей, в той или иной степени, характерно снижение вклада мембранных глицеролипидов в общий липидный пул в течение лета.
Особенно резко снижалось их содержание в августе в листьях эугалофитов P . oppositifolia , S . perennans , в среднем более чем в 4 раза по сравнению с июнем. В отличие от них у представителя группы криногалофитов L . gmelinii содержание мембранных липидов практически не зависело от стадии вегетации. Такая существенная разница связана, на наш взгляд, не с различиями в регуляции соленакопления, хотя и этот факт нельзя исключать, а скорее с тем, что у исследованных эугалофитов, начиная с июля, на листьях формируются генеративные органы, которые как правило обогащены запасными липидами. В результате относительное содержание мембранных липидов в пуле суммарных липидов постепенно снижается.
Как отмечалось выше, важной характеристикой солеустойчивости растений является соотношение ГЛ и ФЛ. Временная и
видовая вариативность этого показателя представлена на рис. 2.
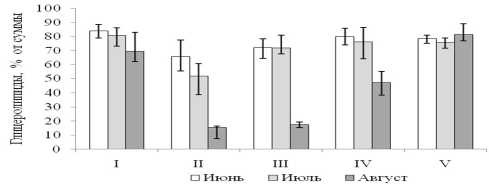
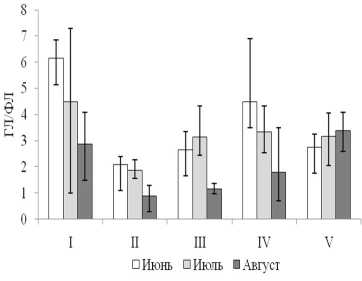
Рисунок. 2. Соотношение мембранных глико- (ГЛ) и фосфоглицеролипидов (ФЛ) в надземной части галофитов. На оси абсцисс: I – H . strobilaceum , II – P . oppositifolia , III – S . perennans , IV – S . salsa , V – L . gmeli-nii
Таблица 3. Коэффициенты вариации мембранных глицеролипидов в надземной части галофитов
Рисунок 1. Содержание мембранных глицеролипидов в наземной части галофитов. На оси абцисс: I – H . strobi-laceum , II – P . oppositifolia , III – S . perennans , IV – S . salsa , V – L . gmelinii
|
Виды растений |
Месяц отбора растений |
|||||
|
Июнь |
Июль |
Август |
||||
|
ГЛ |
ФЛ |
ГЛ |
ФЛ |
ГЛ |
ФЛ |
|
|
H . strobilaceum |
30,2 |
60,0 |
28,8 |
87,9 |
13,9 |
39,1 |
|
P . oppositifolia |
51,3 |
52,5 |
13,6 |
21,9 |
53,2 |
26 |
|
S . perennans |
53,2 |
28,3 |
26,1 |
11,6 |
26 |
23,3 |
|
S . salsa |
36,5 |
11,6 |
52,3 |
42,1 |
30,5 |
42,4 |
|
L . gmelinii |
17,8 |
11,2 |
14,1 |
38,5 |
42,7 |
34,2 |
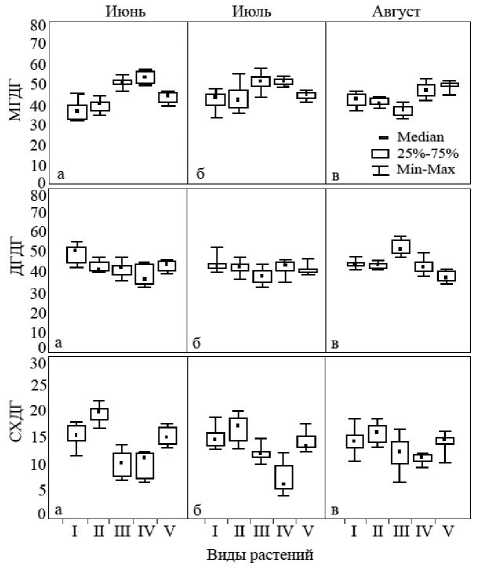
Рисунок 3. Содержание индивидуальных гликогли-церолипидов в надземной части галофитов. На оси ординат: МГДГ – моногалоктозилдиацилглицерол, ДГДГ – дигалоктозилдиацилглицерол, СХДГ – сульфохиновозилдиацилглицерол; абсцисс: I – H . strobilaceum , II – P . oppositifolia , III – S . perennans , IV – S . salsa , V – L . gmelinii
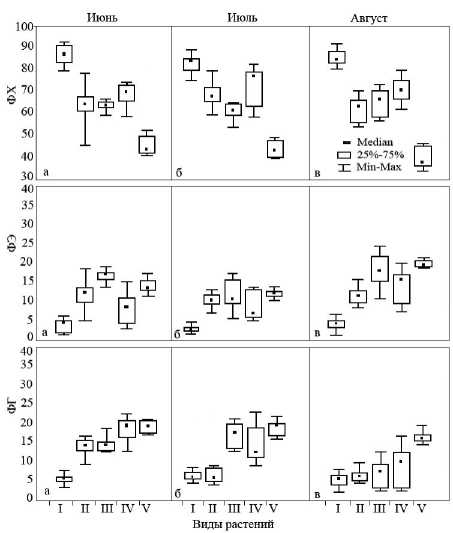
Рисунок. 4. Содержание индивидуальных фосфог-лицеролипидов в надземной части галофитов. На оси ординат: ФХ – фосфатидилхолин, ФЭ – фосфа-тидилэтаноламин, ФГ – фосфатидилглицерол; абсцисс: I – H . strobilaceum , II – P . oppositifolia , III – S . perennans , IV – S . salsa , V – L . gmelinii
Судя по снижению соотношения ГЛ/ФЛ, которое характеризует соотношение пластидных и непластидных мембран, у эугалофитов в течение лета количество ГЛ снижалось, в то время как у криногалофита практически не менялось. Для растений S. salsa , H . strobilaceum , S . perennans характерны большие отклонения от средних показателей величины ГЛ/ФЛ, что говорит о большей зависимости мембранного аппарата от условий произрастания. Анализ вариативности каждого типа мембранных липидов, показал, что для большинства эугалофитов вариативность содержания ГЛ и ФЛ выше в начале и середине лета, а для криногалофита - в конце лета.
Проанализирована также структура и вариации пула ГЛ (рис. 3, табл. 2). Было установленно, что в надземной части всех растений содержание МГДГ и дигалактозилглицерола (ДГДГ) -основных структурных компонентов матрикса мембран тилакоидов, в течении лета менялось мало. Об этом свидетельствуют данные коэффициента вариации: величина Cv, как правило, не превышала 15%. В отличие от двух предыдущих классов липидов вариативность сульфохиновозолглицеролов (СХДГ) была более высокой. Так в листьях эугалофитов S. salsa Cv = 33,6% в середине лета, а в листьях S. perennans -23,2 и 21,1% в июне и августе, соответственно. Данный тип липидов отвечает за стабильность каталитического комплекса СР0-СР1 АТФ-синтазы [20, 21]. Можно предположить, что повышенная вариация данного типа липидов по сравнению с другими классами ГЛ связана с участием в регуляции энергетических процессов.
Не менее важным для структурной организации фотосинтетического аппарата является единственный фосфорсодержащий липид фосфати-дилглицерол (ФГ). Известно, что ФГ способствует тримеризации мономеров светособирающего комплекса, что влияет на формирование гран, а также поддержанию олигомерной структуры по-липептидных комплексов реакционного центра фотосистемы II [15, 22]. Было установлено, что в течение всего времени исследования содержание ФГ во фракции ФЛ составляло от 5,9 до 19,7% (рис. 4). Менее вариативным содержание ФГ во фракции ФЛ было у солевыделяющего растения L . gmelinii (максимальное значение Cv = 11,2). Что касается эугалофитов, то, как правило, вариативность содержания ФГ у них была более интенсивной, и увеличивалась к августу (табл. 4). В целом данные дают основание предполагать, что фотосинтетический аппарат L . gmelinii, представляющего солевыделяющий тип растений, менее зависим от условий произрастания, что, по-видимому, связано с их способностью регулировать солевой обмен с помощью специализированных клеток внутри солевых желез.
Среди других классов фосфорсодержащих глице-ролипидов были идентифицированы фосфати-дилхолин (ФХ), фосфатидилэтаноламин (ФЭ), фосфатидилинозит, фосфатидная кислота и ди-фосфатидидглицерол. Все они характеризуют преимущественно непластидные мембраны. Наиболее изученными с точки зрения солеустойчиво-сти являются ФХ и ФЭ.
Таблица 4. Коэффициенты вариации индивидуальных глико- и фосфоглицеролипидов галофитов
|
Липиды |
Вид |
||||
|
H . strobilaceum |
P . oppositifolia |
S . perennans |
S . salsa |
L . gmelinii |
|
|
Июнь |
|||||
|
МГДГ |
13,5 |
7,5 |
3,9 |
4,6 |
5,4 |
|
ДГДГ |
8,9 |
6,5 |
7,7 |
11,7 |
5,9 |
|
СХДГ |
12,6 |
8,5 |
23,2 |
22,7 |
10,8 |
|
ФГ |
19,1 |
14,4 |
10,8 |
17,3 |
7,7 |
|
ФХ |
4,4 |
14,2 |
3,1 |
6,9 |
9,1 |
|
ФЭ |
39,0 |
67,1 |
8,6 |
47,5 |
13,4 |
|
Июль |
|||||
|
МГДГ |
11,1 |
8,3 |
7,4 |
2,6 |
4,3 |
|
ДГДГ |
9,5 |
8,2 |
8,9 |
8,8 |
6,9 |
|
СХДГ |
11,9 |
12,6 |
9,9 |
33,6 |
14,5 |
|
ФГ |
16,4 |
28,1 |
18,5 |
28,9 |
11,2 |
|
ФХ |
4,3 |
8,0 |
4,8 |
11,8 |
8,2 |
|
ФЭ |
28,0 |
18,8 |
32,9 |
38,8 |
10,1 |
|
Август |
|||||
|
МГДГ |
6,6 |
5,0 |
6,5 |
7,3 |
5,4 |
|
ДГДГ |
3,5 |
4,3 |
6,9 |
8,1 |
8,4 |
|
СХДГ |
13,8 |
12,1 |
21,1 |
6,5 |
15,6 |
|
ФГ |
32,6 |
22 |
44,2 |
19,3 |
10,9 |
|
ФХ |
3,9 |
7,8 |
8,6 |
7,3 |
12,8 |
|
ФЭ |
36,7 |
17,8 |
21,3 |
29,5 |
5,5 |
Анализ состава ФЛ выявил определенную связь с соленакапливающим признаком: у эугалофитов содержалось в среднем в 1,5 раза больше ФХ по сравнению с криногалофитом (рис. 4). Учитывая, что ФХ локализуется на внешней стороне бислоя мембраны, а ФЭ - на внутренней, высокое содержание ФХ может говорить о большей асимметрии и кривизне мембран, и большем влиянии на структуру функциональных белков. Литературные данные показывают, что с увеличением засоленности среды наблюдается тенденция повышения соотношения ФХ/ФЭ. Это находит объяснение в том, что данные липиды различаются по строению и размеру полярной головки, а также по типу конфигураций ламеллярной и гексагональной фазы в липидном бислое. Полагают, что помимо разрыва бислойной структуры гексагональная фаза способна инициировать образование дополнительных гидрофильных водных каналов в биологической мембране, позволяющих пассивную диффузию воды через мембраны [16]. С этой точки зрения мембраны эуга-лофитов Limonium gmelinii и Halocnemum strobi-laceum обладают наибольшей способностью к предотвращению обезвоживания за счет пассивной диффузии воды.
Вариативность ФХ отличалась довольно узкими интервалами. Например, у H . strobilaceum в течение сезона вегетации Cv для ФХ варьировал в диапазоне 3,9-4,4, а у L . gmelinii – 8,2-12,8. Вариативность ФЭ была в 3-10 раз выше, чем в ФХ для всех видов в течение всего периода наблюдений (табл. 3).
В соответствии с литературными данными значение коэффициента вариации Сv менее 10% может служить основанием для отнесения показателя к категории “жестких” [8]. Если Сv > 40%, то правомерно заключение об относительно высокой пластичности показателя, а при вариации 40% > Сv > 10% - умеренно пластичной. Таким образом, такие компоненты как содержание МГДГ, ДГДГ в пуле ГЛ, содержание ФХ в пуле ФЛ являются «жесткими», то есть не пластичными, содержание суммарных липидов, содержание СХДГ, ФГ – умеренно пластичными, а содержание мембранных липидов среди суммарных липидов, а также содержание ФЭ – высоко пластичными.
Список литературы Экологическая пластичность мембранных глицеролипидов дикорастущих галофитов в условиях Приэльтонья
- Аринушкина Е.В. Руководство по химическому анализу почв. М.: Изд-во МГУ. 1970. 487 с.
- Асилбекова Д.Т., Турсунходжаева Ф.М. Липиды листьев Capparis spinosa L.//Хим. раст. сырья. 2009. № 2. С. 97-99.
- Генкель П.А. Физиология жаро-и засухоустойчивости растений. М.: Наука, 1982. 280 с.
- Kейтс М. Техника липидологии. M: Мир, 1975. 322 c.
- Лакин Г.Ф. Биометрия. М.: Высшая школа, 1990. 352 с.
- Лысенко Т.М., Митрошенкова А.Е., Шарпило Н.И., Круглов А.А. Фиторазнообразие восточной Европы//Материалы к флоре Приэльтонья. 2010. № 8. С. 97-107.
- Розенцвет О.А., Нестеров В.Н., Богданова Е.С. Состав мембран дикорастущих галофитов с различными механизмами регуляции солевого обмена в зависимости от абиотических факторов среды//Биологические мембраны. 2013 (в печати).
- Трахтенберг И.М., Сова Р.Е., Шефтель В.О., Онищенко Ф.А. Проблемы нормы в токсикологии. М.: Медицина, 1991. 208 с.
- Atia A., Barhoumi Z., Mokded R. et al. Environmental eco-physiology and economical potential of the halophyte Crithmum maritimum L. (Apiaceae)//J. Medicinal Plants Res. 2011. Vol. 5. P. 3564-3571.
- Cornelissen J.H.C., Lavorel S., Garnier E. et al. A handbook of protocols for standardised and easy measurement of plant functional traits worldwide//Australian J. Bot. 2003. Vol. 51 (4). P. 335-380.
- Dajic Z. Salt stress//Physiology and molecular biology of stress tolerance in plants/editors K.V. Madhava Rao, A.S Raghavendra, K. Janardhan Reddy. Netherlands: Press Springer, 2006. P. 41-99.
- Flowers T.J. Physiology of halophytes//Plant soil. 1985. Vol. 89. P. 41-56.
- Flowers T.J., Colmer T.D. Salinity tolerance in halophytes//New Phytology. 2008. Vol. 179. P. 945-963.
- Givnish T.J. Ecological constraints on the evolution of plasticity in plants//Evolutionary Ecol. 2002. Vol. 16. P. 213-242.
- Hagio M., Sakurai I., Sato S. et al. Phosphatidylglycerol is essential for the development of thylakoid membranes in Arabidopsis thaliana//Plant Cell Physiol. 2002. Vol. 43 (12). P. 1456-1464.
- Hirayama O., Mihara M. Characterization of membrane lipids of higher plants different in salt-tolerance//Agric. Biol. Chem. 1987. Vol. 51 (12). P. 3215-3221.
- Ievinsh G. Biological basis of biological diversity: physiological adaptations of plants to heterogeneous habitats along a sea coast//Acta Univ. Latv. Biology. 2006. Vol. 710. P. 53-79.
- Kuiper P.J.C. Environmental changes and lipid metabolism of higher plants//Physiol. Plant. 1984 (64). Р. 118-122.
- Leach R.P., Wheeler K.P., Flowers T.J., Yeo A.R. Molecular markers for ion compartmentation in cells of higher plants II. Lipid composition of the tonoplast of the halophyte Suaeda maritima (L.) DUM.//J. Experimen. Bot. 1990. Vol. 41. P. 1089-1094.
- Okanenko A.A., Taran N.Y., Kosyk O.I. Plant sulfolipid. 1. Functions//Бiополiмери i клiтина. 2008. Т. 24 (6). С. 431-440.
- Ramani B., Zorn H., Papenbrock J. Quantification and fatty acid profiles of sulfolipids in two halophytes and a glycophyte grown under different salt concentrations//Z. Naturforsch. 2004. Vol. 59. Р. 835-842.
- Siegenthaler P.-A., Tremolieres A. Role of acyl lipids in the function of photosynthetic membranes in higher plants//Lipids in photosynthesis: structure, function and genetics/editors P.-A. Siegenthaler, A. Tremolieres. Dourdrecht: Publ. Kluwer Acad., 1998. P. 145-173.
- Surjus A., Durand M. Lipid changes in soybean root membranes in response to salt treatment//J. Experim. Bot. 1996. Vol. 47 (294). Р. 17-23.
- Vaskovsky V.E., Latyshev N.A. Modified jungnickel’s reagent for detecting phospholipids and other phosphorus compounds on thin-layer chromatograms. J. Chromatogr. 1975. Vol. 115. P. 246-249.
- Youssef A.M. Salt tolerance mechanisms in some halophytes from Saudi Arabia and Egypt//J. Agric. Biol. Sci. 2009. Vol. 5. P. 191-206.
- Zunzunegui M, Barradas M.C.D., Ain-Lhout F. et al. Seasonal physiological рlasticity and recovery capacity after summer stress in Mediterranean scrub communities//Plant Ecol. 2011. Vol. 212. P. 127-142.


