Экологически чистый способ очистки от хромат-анионов сточных вод
Автор: Новоселецкая О.В., Боковикова Т.Н., Артемьева Н.К., Абдуллаева М.Л., Марченко Л.А.
Журнал: Физическая культура, спорт - наука и практика @fizicheskaya-kultura-sport
Рубрика: Экология
Статья в выпуске: 1, 2008 года.
Бесплатный доступ
Синтезирован сорбент со структурой гидроталькита на основе совместно осажденных гидроксидов магнияи алюминия с использованием зольгель метода. Определены адсорбционно-структурные характеристики сорбента. Установлены зависимости изменения селективности по извлечению анионных комплексов хрома на рассматриваемом сорбенте.
Адсорбция, кинетика, сорбент, гидроталькит, анион
Короткий адрес: https://sciup.org/14263471
IDR: 14263471
Текст научной статьи Экологически чистый способ очистки от хромат-анионов сточных вод
димость удаления из промышленных сточных вод гальванических производств хромат-анионов. В производстве средств молекулярной электроники, антикоррозионных добавок в химические источники тока существуют отдельные участки, связанные с переработкой этих отходов [4, 13]. Очистка производственных стоков от хромат-анионов до уровня предельно допустимой концентрации (ПДК) возможна только с использованием сорбционной технологии.
В связи с этим создание на основе гидроксидов металлов ионообменных материалов, позволяющих за счет высоких емкостных и кинетических характеристик осуществить глубокую очистку технологических стоков от токсичных анионов и катионов, является чрезвычайно важной задачей. Следует отметить, что целый ряд эффектов, используемых для разделения ионов с помощью неорганических сорбентов, в принципе не может быть эффективно использован с применением ионообменных материалов на основе органических полимеров. Анализ литературных данных показал, что наиболее перспективными являются сорбенты на основе двойных гидроксидов металлов со структурой гидроталькита.
Методика исследования. Для синтеза совместно осажденных гидроксидов использовали 1,0 % растворы хлоридов магния и алюминия, смешанные в соотношении 1:4, по литературным данным признанных оптимальными. Полученную смесь при интенсивном перемешивании вливали в 1 н раствор гидроксида натрия, взятого в 5 % избытке. Значение рН поддерживали в интервале 9,6-10. Осадок выдерживали в маточном растворе в течение 24 часов, отмывали дистиллированной водой методом декантации до отрицательной реакции на ионы CI– как в растворе, так и в самом осадке, после чего осадок отжимали, подверга- ли гранулированию, а затем высушивали при температуре 120 0С.
Одним из основных свойств неорганических сорбентов является структура порового пространства. Для характеристики пористой структуры использовали следующие характеристики: удельную поверхность; объем пор, отнесенный к массе сорбента; распределение пор по радиусам.
В наших исследованиях удельную поверхность гидроксидов алюминия и магния и совместно осажденных гидроксидов (СОГ) определяли по низкотемпературной адсорбции азота хроматографическим методом [6]. Метод основан на том, что при температуре кипения жидкого азота происходит сорбция из смеси азот-водород газообразного азота, а при комнатной температуре
– его десорбция. Расчёт удельной поверхности проводили по уравнению БЭТ.
Пористую структуру гидроксида алюминия исследовали на ртутно– порометрической установке П-5, которая состоит из поромеров низкого и высокого давления и позволяет определять радиусы пор в интервале эквивалентных радиусов от 30 до 350000 [6].
Некоторые исследователи приходят к выводу о неодинаковой способности к сорбции гидроксидами различных форм анионов. Поэтому целесообразно провести оценку состояния анионов разных элементов в водных растворах.
Для неметаллов и металлов в высших степенях окисления характерно образование оксоанионов [5, 10]. Фактический состав оксоанионов зависит от многих факторов, основные среди них – природа химического элемента, который выступает в качестве центрального атома Э, его степень окисления, концентрация оксоаниона в водном растворе, величина рН жидкой среды [5].
Из всех оксоанионов ограничимся рассмотрением состояния в водных растворах CrO42-, [Fe(CN)6]3-, [Fe(CN)6] 4-, [Hg I4]2-, взаимодействие которых с двойными гидроксидами металлов (II, III) будет далее исследоваться.
Для оксоанионов хрома (VI) в водных растворах возможны как простые, так и полимерные формы, протонированные и депротонированные состояния [1, 9, 12]. Константы диссоциации Н2СrO4: pK1=-0.20 и рК2=6.50 (11-12). Отсюда следует, что молекулярная форма может быть устойчива только в сильно кислых растворах, судя по величине рК2, при определённых условиях вероятно существование иона HCrO4-. Оксоанионы хрома (VI) склонны к полимеризации, в определённых условиях происходит образование Сг2О72– и Сг3О102– [9].
На формы существования Cr (VI) в водных растворах оказывают влияние преимущественно такие факторы, как рН жидкой фазы и концентрация ионов хрома (VI) в растворе. Так, известен [12] сдвиг равновесия в зависимости от рН раствора:
+2OH
Н Сг O Сг О 2- +HO НСгО - + НСг О - +OH НСrO - +
--H
+HO+3OH
+ Cr 2 O 7 2- 3HcrO 4 - 3CrO 4 2-
Согласно приведённой схеме полимерные формы оксоанионов Cr (VI) более устойчивы в кислых растворах. Как считают авторы работы [9], при достижении концентрации ионов Н+ 0.2 М в растворе присутствуют лишь поли– и трихромат-ионы. Полимерные формы сохраняются и при разбавлении раствора, когда концентрация Cr (VI) становится 0.05-0.2 М. Для разбавленных растворов (концентрация Cr (VI) на уровне 10-3 М) влияние рН жидкой фазы на формы существования хрома (VI) выражается диаграммой, которая воспроизведена по работе (Справочник химика. – Т.З. 1964) на рисунке 1. В области рН 2-5 преобладают ионы НСгО42-. При рН>6.5 превалирующей формой становятся ионы СгО42-.
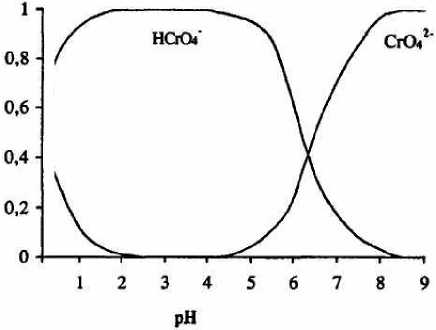
Рис. 1.
Диаграмма форм существования оскоанионов в расчёте к общему содержанию Cr (VI)
Изучение сорбционной активности сорбентов на основе СОГ проводили в статических условиях по стандартным методикам, при этом использовали гранулы в виде шариков диаметром 2,5-3 мм. В качестве адсорбатов использовали Сr (VI). Результаты лабораторных исследований сорбции Cr (VI) представлены в таблице.
Результаты эксперимента показывают, что ионы CrO42– обмениваются с ионами ОН-, входящими в состав совместно осажденных гидроксидов. При этом рН раствора увеличивается с 7,3 до 8,4.
Эффект понижения сорбционной емкости в циклах сорбция-десорбция можно объяснить переходом части ионов
Таблица
Результаты сорбции и десорбции оксоанионов Cr (VI) на СОГ
|
Значения Е, ммоль CrO4 2- / гСОГ |
|||||
|
1 |
2 |
3 |
|||
|
Сорбция |
Десорбция |
Сорбция |
Десорбция |
Сорбция |
Десорбция |
|
1, 23 |
0,846 |
1,05 |
0,73 |
0,72 |
0, 57 |
CrO42– в необменное состояние за счет обмена с ОН –груп-пами слоев структуры:
≡Ме-OH+CrO 4 2-<=>≡Ме-OСrO 3 - + OH.-
Поглощенные таким образом хромат-ионы участвуют в компенсации положительного заряда слоев структуры и тем самым уменьшают содержание межслоевых ионов, способных участвовать в анионном обмене. Образование связи Ме – ОCrO3 подтверждают данные ИК-спектроско-пии: в спектре продукта сорбции по сравнению с исходным образцом появляется дополнительная полоса при 860-910 см-1, которая относится к колебанию связи -О-CrO3– .
Судя по результатам рентгенофазового анализа, насыщение образца ионами CrO42– приводит к образованию новой фазы с меньшим межслоевым расстоянием по сравнению с исходной фазой. По литературным данным [2], такой результат возможен при образовании прямых связей Mе-O-CrO3 .
Анализ полученных результатов позволяет сделать вывод, что в процессе сорбции анионы обмениваются как с гидроксильными группами на поверхности сорбента, так и с гидроксильными группами, принадлежащими внутреннему объему фазы СОГ гидроксидов. Причем в данном случае полизарядные анионы могут обмениваться на гид-роксогруппы гидроксидных слоев, связанных напрямую с атомами металла, и, компенсируя оставшимся зарядом положительный заряд слоев, переходить в неионообменное состояние. Количество ионообменных ионов при этом уменьшается.
На основании полученных данных можно сделать вывод, что взаимодействие ионов CrO4 2– происходит по ионообменному механизму. При изучении кинетики сорбции анионов на полученном сорбенте для реализации анионного обмена в чистой форме в качестве модельных анионов использовали галогенидионы. Ионный обмен проводили из раствора КС1 с концентрацией 0.001 М, при температуре 23°С, рН раствора 9,0. Отсутствие влияния стадии стока ионов в твердую фазу сорбента было подтверждено экспериментально путем последовательного уменьшения размеров гранул и определения скорости поглощения хлорид-ионов для каждой из выделенных фракций. Анализ зависимости скорости ионного обмена от размера гранул подтвердил, что кинетика лимитируется стадией диффузии в поровом пространстве гранул.
Для описания экспериментальных данных кинетики ионного обмена использована математическая модель, предложенная профессором В.В. Вольхиным [3]. Кинетическая кривая сорбции хлорид-ионов на СОГ магния и алюминия представлена на рисунке 2. На кинетической кривой обнаружены два кинетических участка: первый участок отвечает диффузии ионов в макропорах сорбента, на втором участке наблюдается более медленный обмен хлорид-ионов, что, на наш взгляд, вызвано анионным обменом в межслоевых пространствах. Полученные кинетические данные свидетельствуют о высокой скорости химических реакций, приводящих к извлечению анионов из раствора, а также о том, что данные материалы могут быть использованы в процессах очистки сточных вод.
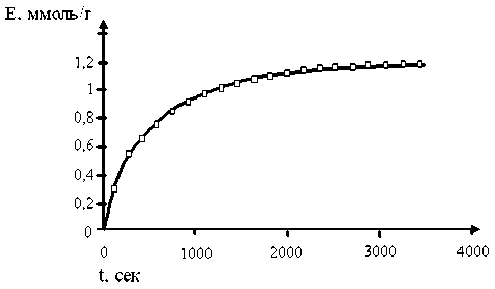
Рис. 2.
Кинетическая кривая сорбции хлорид-ионов на СОГ магния и алюминия
В качестве теоретической основы экспериментального определения параметров сорбции использовали математическую модель Петрова, позволяющую описать экспериментально полученные закономерности. При разработке модели использовали методы, позволяющие решить систему дифференциальных уравнений, предложенные Е.В.Венециановым и Е.Г.Петровым [8].
При проведении опыта известными и постоянными величинами являются: толщина слоя сорбента l, средний диаметр зерен d, скорость фильтрования (υ). Кроме этого, постоянными, но неизвестными величинами являются коэффициенты, характеризующие процесс сорбции.
Этими параметрами являются коэффициент внешней диффузии β и кинетические параметры: коэффициент внутренней диффузии D и критерий, учитывающий относительный вклад внешней и внутренней диффузии Н (критерий Био). Массообменным (емкостным) коэффициентом, характеризующим распределение адсорбированного вещества, является коэффициент Генри Г.
Критерий Био равен:
H =
в2
4 DΓ
= const
(1), безразмерная толщина (Х) слоя сорбента равна:
X = ft — = const v
Связь между безразмерным (Т) и реальным (t) временем сорбционного процесса определяется по формуле:
t = et
Γ
откуда следует однозначное соответствие этих времен.
После логарифмирования последнего соотношения получим:
lg T = lg t + lg в
Γ (4).
Из выражения (4) следует, что в логарифмической системе координат эта связь становится аддитивной, и однозначное соответствие времен может быть установлено продольным смещением временных осей относительно друг друга. Методика сопоставления экспериментальных и теоретических кривых следующая: в результате фильтрования через слой сорбента получают экспериментальные точки зависимости:
uэ=f(tэ) (5), где uэ – экспериментально определенная относительная концентрация ионов в фильтрате;
tэ – время, отсчитываемое с начала фильтрования.
Экспериментальные точки этой зависимости наносили на билогарифмическую сетку (рис. 3.), полностью аналогичную сетке теоретических кривых, добиваясь при этом путем перемещения графиков вдоль осей времени наилучшего совпадения экспериментальных точек с одной из теоретических кривых U=F(X,T) при Н=const до соблюдения равенства uэ=U.
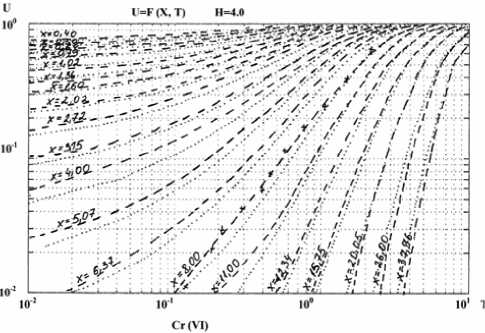
Рис. 3.
Наложение экспериментальных точек фильтрования на теоретические кривые динамики сорбции из жидких сред для Cr (VI).
Проведенные исследования позволили расчетным путем провести количественную оценку относительной способности ионов адсорбироваться полученным сорбентом и на основе сопоставления расчетных и экспериментальных данных определить эффективность теоретических прогнозов и выявить те факторы, влияние которых приводит к отдельным отклонениям.
Выводы
-
1. Определены адсорбционно-структурные характеристики СОГ (удельная поверхность – 135м2/г), общий объем пор – 0,34см3/г, распределение пористости по эквивалентным радиусам), позволяющие предложить синтезированный совместно осажденный гидроксид магния и алюминия в качестве неорганического ионообменника. Величину удельной поверхности образца определяли по низкотемпературной адсорбции азота хроматографическим методом с последующей обработкой полученных результатов по методу БЭТ. Для определения пористости использована ртутная порометрия.
-
2. Методами ИК-спектроскопии и ренгенофазового анализа установлены механизмы взаимодействия CrO42– с совместно осажденным гидроксидом магния и алюминия со структурой гидроталькита.
-
3. Исследована кинетика ионного обмена для вышеуказанных анионов. Установлено, что она лимитируется процессом внутренней диффузии ионов в транспортных порах сорбента. Экспериментальные данные сопоставлены с рассчитанными по моделям кинетики и динамики ионного обмена на зернистых сорбентах, что позволило применить полученные расчетные кривые для обработки и прогнозирования применения сорбента в опытно-промышленных условиях.
-
4. Показана возможность применения сорбентов на основе СОГ магния и алюминия для очистки сточных вод, содержащих Cr (VI), что подтверждено проведением опытно-промышленных испытаний по извлечению Cr (VI) из сточных вод гальванических цехов ОАОТ «Краснодарский ЗИП». Установлено, что сорбент является экологически чистым, высоко селективным к Cr (VI) и устойчив при работе в многоциклическом режиме.
Выявлено, что полученный сорбент способен поглощать Cr (VI) за счет обмена как с поверхностными, так и межслоевыми ОН – группами СОГ. Показана возможность обмена хромат-ионов на гидроксогруппы гидроксидных слоев, связанных напрямую с атомами металла. При этом количество гидроксильных групп, способных обмениваться на Cr (VI) уменьшается, так как Cr (VI) переходит в неионообменное состояние.


