Экологические факторы, регулирующие рост макроводорослей в сообществах арктических морей E. V. Shoshina, V. I. Kapkov, O. A. Belenikina
Автор: Шошина Елена Васильевна, Капков Валентин Иванович, Беленикина Ольга Алексеевна
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Океанология
Статья в выпуске: 1-2 т.19, 2016 года.
Бесплатный доступ
Проанализированы особенности макроводорослей в арктических сообществах в связи с периодическими и непериодическими воздействиями экологических факторов. Показано, что существование фитоценозов бентосных водорослей северных морей контролируется в основном первичными периодическими экологическими факторами, выступающими в качестве триггеров, которые определяют направленность вегетативных и генеративных процессов, а также и способствуют появлению адаптационных приспособлений к экстремальным условиям внешней среды. Поэтому периодические воздействия экологических факторов вызывают лишь структурные перестройки в фитоценозах фукусовых благодаря упругой устойчивости популяций водорослей, приобретенной в результате длительного процесса адаптации к условиям северных морей. Непериодические первичные факторы также нарушают соотношение численности за счет у элиминации и угнетения роста определенных возрастных стадий водорослей. Однако и в данном случае благодаря резистентной устойчивости сообщество водорослей способно со временем восстановить структурно-функциональную организацию.
Макроводоросли, периодические и непериодические экологические факторы, арктические сообщества
Короткий адрес: https://sciup.org/14294898
IDR: 14294898 | УДК: 574.587:582.26/.27(268.4) | DOI: 10.21443/1560-9278-2016-1/2-334-344
Текст научной статьи Экологические факторы, регулирующие рост макроводорослей в сообществах арктических морей E. V. Shoshina, V. I. Kapkov, O. A. Belenikina
В прибрежных водах гидробионты подвергаются воздействию разнообразных экологических факторов, действующих в совокупности и одновременно, и оказывающих прямое и косвенное влияние на развитие бентосного сообщества. Совместное действие экологических факторов наиболее отчетливо проявляется в северных морях, где температура среды, солнечная радиация и приливно-отливные процессы взаимосвязаны и определяют распределение и доминирование бурых водорослей.
Первичные периодические абиотические факторы выступают в качестве элементов среды, оказывающих непосредственное влияние на метаболизм водорослей бентосного сообщества. При этом могут создаваться как оптимальные, так и неприемлемые условия для роста популяций водорослей в пределах экологической устойчивости вида. Для гидробионтов прибрежных экосистем чрезвычайно важна адаптация к периодическим факторам, особенно – к резким изменениям температуры во время полусуточных приливно-отливных явлений, а также к сезонным изменениям солнечной радиации во время полярного дня и полярной ночи. Именно эти экологические факторы регулируют не только численность особей в популяциях, но и жизненные циклы и сроки размножения водорослей.
Вторичные периодические факторы (шторма, подвижки льда, атмосферные осадки), а также внутривидовые и межвидовые отношения в биоценозе обычно сопряжены с первичными факторами и могут усиливать, ослаблять или нейтрализовывать их влияние на водоросли [1]. Причем особенно важно взаимное влияние факторов или явление синергизма, которое применительно к биологическим системам означает, что абиотические и биотические факторы, когерентно взаимодействуя между собой, действуют не аддитивно, а с проявлением нелинейности [2; 3].
Основными экологическими факторами, определяющими рост и развитие водорослей, являются солнечная радиация, температура воды и концентрация биогенных элементов. Для арктических районов характерны доступность световой энергии в течение короткого летнего периода, длительный темновой период, низкая температура воды на протяжении всего года, низкое содержание биогенов во время летней вегетации.
На встречаемость макроводорослей влияют наличие подходящего твердого субстрата и распреснение воды во время таяния снега и льда.
В данной статье анализируются метаболические особенности макроводорослей в сообществах северных морей в связи с воздействием периодических и непериодических экологических факторов. Работа является продолжением анализа материалов исследований сообществ макроводорослей Баренцева моря в связи с экстремальными условиями обитания [4; 5].
Регион исследования. Материал и методы
Исследования адаптационных приспособлений к экологическим факторам макроводорослей проводили в различных районах Баренцева, Белого и Карского морей. Авторами использованы материалы собственных исследований, основанные на результатах экспедиций в указанные моря. Объектами исследования служили макроводоросли бентосных фитоценозов прибрежной зоны морей в различных гидрологических условиях. При визуальном осмотре учитывали характер грунта, проективное покрытие и изобатическое распределение донных сообществ. Применялась методика гидроботанических разрезов от уреза воды до границы произрастания водорослей. На каждом разрезе обрабатывалось 5–7 станций с необходимым числом мерных площадок. В пробах определяли видовой состав, возраст, численность, биомассу каждого вида и всего сообщества. При анализе результатов исследования опирались на данные, полученные по макроводорослям Баренцева моря: Кольского залива [5; 6], Восточного Мурмана (северная часть высокобореальной подзоны) – губа Дальнезеленецкая (68 ° с. ш.) [7], побережья Земли Франца-Иосифа (арктическая зона) - о. Гукер (80 ° с. ш.) [8; 9]. Использованы также материалы по водорослям Карского (арктическая зона) – мыс Желания, Новая Земля [10] и Белого морей (высокобореальная подзона) – губа Чупа, Порья губа Кандалакшского залива [11; 12].
Результаты и их обсуждение
Наиболее разнообразный видовой состав бентосных сообществ макроводорослей и высокие биомассы характерны для Мурманского побережья. При движении на север и восток Баренцева моря и по направлению к Белому морю с увеличением "ледовитости" района наблюдается снижение видового разнообразия и оскуднение донных фитоценозов как в качественном, так и количественном отношениях. На литорали Мурманского побережья доминируют фукусовые водоросли, в сублиторали густые и многолетние сообщества формируют ламинариевые водоросли. В арктических районах сообщества фукусовых водорослей опускаются в сублитораль и постепенно исчезают в суровых ледовых условиях.
Факторы среды и водоросли высоких широт . Жизнедеятельность растений согласована с сезонной динамикой абиотических и биотических факторов. Ведущим является солнечная радиация, однако существенное влияние оказывают температурный режим, динамика биогенов и интенсивность движения водных масс. В суровых климатических условиях арктических морей эндогенная программа ростовых и репродукционных процессов макроводорослей как неподвижных бентосных фототрофных организмов четко согласована с периодическими сезонными изменениями абиотических факторов среды.
Световые (и ледовые) условия в полярный день и полярную ночь и определяют сжатые сроки вегетации макроводорослей в арктических районах. На побережье Восточного Мурмана (губа Дальнезеленецкая, 68 ° с. ш.) вегетационный период составляет около 9 месяцев, в высоких широтах Земли Франца-Иосифа (о. Гукер, 80 ° с. ш.) — не более 3-4 месяцев. Бентосные макроводоросли отсутствуют в полностью покрытых льдами районах, но произрастают в местах, освобождаемых ото льда на короткое (1–2 месяца) летнее время [13]. Характерной особенностью "светового окна" в высоких широтах являются относительно высокая интенсивность света (при открытой воде), длинный световой день (полярный день), низкое положение солнца над горизонтом, постоянная облачность. Важно и то, что световое окно (июль – сентябрь) приходится на период уменьшения фотопериода (после летнего солнцестояния), что служит сигналом для фототрофных организмов к снижению ростовых процессов и подготовке к зиме.
Вегетативные органы, споры, зиготы, микроскопические стадии водорослей, обитающих в Арктике, способны к переживанию длительного темнового периода. Известно, что одноклеточные гаметофиты ламинарии выживают в течение 6 месяцев темноты и при перенесении в благоприятные световые условия в течение 2 недель (как обычно) образуют спорофиты, тогда как споры теплолюбивых видов погибают [14].
На побережье арктических островов встречаются однолетние и многолетние формы растений. По числу видов преобладают микроскопические водоросли, но основную биомассу и облик сообществ создают многолетние бурые водоросли. Однолетние водоросли зимуют на микроскопической стадии развития – в виде спор или микрослоевищ. Многолетние водоросли сохраняют слоевище (или его часть) на протяжении всего года. В полярную ночь, при отсутствии света и при низкой температуре воды, процессы деструкции у водорослей замедляются. Под мощным снежным и ледовым покровом водоросли находятся в достаточно стабильных условиях, не подвергаясь механическому повреждению во время штормов. В результате многие многолетние виды водорослей имеют относительно крупные размеры слоевища.
В тундре на морском арктическом побережье среди высших растений многие виды сбрасывают листья перед наступлением неблагоприятного сезона, но многочисленны вечнозеленые растения. Вечнозеленые кустарнички и полукустарнички типичны для побережья Кольского полуострова [15]. Подобные явления характерны и для макроводорослей, которые образуют подводные заросли в высоких широтах. Так, у Laminaria solidungula слоевище состоит из нескольких небольших по размеру пластин разных лет образования, а Desmarestia aculeata сбрасывает ветви, и только старые части слоевища сохраняются на протяжении зимы, на них затем весной формируются новые побеги [16]. На побережье Земли Франца-Иосифа отмечены растения Laminaria saccharina с одной-двумя старыми пластинами, тогда как в высокобореальных районах Мурманского побережья у этого вида старая пластина (предыдущего года образования) в течение весны разрушается, поэтому летом встречаются растения только с пластиной текущего года образования. Наличие сформированных вегетативных тканей позволяет многолетним водорослям Арктики (как и высшим растениям в тундре) начинать фотосинтез и вегетацию сразу при наступлении благоприятных световых условий [9].
В связи с особенностями сезонного поступления световой энергии фототрофоным организмам свойственна определенная периодичность метаболических и ростовых процессов. Фотопериод как наиболее точный показатель времени для живых организмов выступает ведущим синхронизирующим фактором жизненных циклов до периода года. Характеризуя сезонную динамику роста слоевища водорослей в условиях северных морей в целом, можно выделить период быстрого роста, когда ростовые процессы являются доминирующими (весна – лето) и период замедленного роста, когда скорость и интенсивность роста снижаются до нулевых значений, а процессы деструкции преобладают над процессами роста (осень – зима).
В полярную ночь в зонах роста ламинарии и других видов (фукусы, пальмария, ульвария) не отмечается каких-либо деградационных изменений фотосинтетического аппарата, но регистрируется уменьшение количества запасных веществ. Показано, что в период полярной ночи интенсивность освещения на Мурманском побережье в течение нескольких дневных часов является достаточной для осуществления у водорослей процесса фотосинтеза [17–19]. Наблюдения в природе и эксперименты при длительном отсутствии света в лаборатории показали, что виды с тонкопластинчатой организацией (ульва, пальмария) сохраняют пластинку при отсутствии освещения в течение 20–30 дней, а виды с плотным и дифференцированным слоевищем (ламинария, фукус) остаются живыми спустя 60–90 дней темноты. У фукуса апикальные части оставались живыми в течение 270 дней темноты. Отмечаются следующие механизмы адаптаций, направленные на сохранение функциональной активности зон роста, обеспечивающих длительное существования при отсутствии освещения: потребление запасных веществ (виды с тонкопластинчатой организацией); использование веществ, образующихся при деструкции таллома (ламинариевые водоросли, наличие дальнего транспорта веществ); потребление растворенных органических веществ (органотрофия фукусовых водорослей) [20; 21].
Водоросли, встречающиеся в Арктике, холодоустойчивы. На Мурманском побережье (Восточный Мурман) среднемесячная температура воды на поверхности изменяется от —1,5 ° С (февраль) до 9 ° С (август). На побережье архипелага Земля Франца-Иосифа крайне низкая температура воды наблюдается на протяжении всего года, составляя —1,8 ° С в зимние месяцы! и всего около -0,7 ° С в июле — августе. Водоросли в морских арктических экосистемах живут при температуре воды! ниже 0 ° С на протяжении всего года, а в течение полярной ночи – около точки замерзания морской воды. Особенно ограничивает рост водорослей низкая температура воды в период летней активной вегетации. Зимой низкая температура воды и образование ледовой кромки встречается не только на арктическом побережье, но и в северных районах бореальной зоны. Так, губа Чупа Кандалакшского залива Белого моря покрыта льдом в декабре – мае, в феврале температура воды! поверхностного слоя составляет около —1 ° С, а летом отмечается хороший прогрев этого слоя. В целом водоросли, обитающие на литорали, более устойчивы к воздействию низких зимних температур (как и высоких летних температур, особенно во время отлива) по сравнению с сублиторальными водорослями. Причем наиболее уязвимы водоросли на ранних стадиях развития и в период активной вегетации слоевища.
Характерной особенностью арктических прибрежных районов является отсутствие литорального пояса макроводорослей, фукусы опускаются в сублитораль, хотя микроскопические виды на литорали присутствуют. Так, на побережье моря Бофорта, где ледовый покров присутствует в течение 7-8 месяцев в году, на литорали широкое распространение имеют водоросли небольшого размера: Calothrix scopulorum , Blidingia minima , Pseudendoclonium spp. , Audouinella purpurum ; эти виды имеют широкое географическое распространение, способны жить в широком диапазоне значений температуры и солености [16]. Отсутствие макроводорослей на литорали связывают с подвижками льда, значительным распреснением, а также с низкой температурой воды и воздуха во время отлива. В арктических районах в холодный период года под толстым слоем льда и снега водоросли защищены от воздействия очень низкой температуры воздуха.
На Мурманском побережье, где наблюдаются правильные полусуточные приливы и отливы (высота прилива в губе Дальнезеленецкой составляет до 4,2 м) литоральные водоросли зимой подвергаются дважды в сутки воздействию отрицательной температуры воздуха, которая может опускаться до —18 °С и держаться на этом уровне в течение нескольких дней. Несмотря на такую низкую температуру, крупные бурые водоросли с плотным слоевищем – фукусовые (Fucus vesiculosus, Ascophyllum nodosum) и красные водоросли с тонкими пластинами – пальмария (Palmaria palmatа) и порфира (Porphyra umbilicalis) не утрачивают своей жизнеспособности. Их слоевища покрываются ледяной коркой, и этот ледяной панцирь защищает водоросли. Слоевище порфиры, которая растет на прибойной скалистой литорали и осушается в сизигийный отлив на длительное время (6–8 часов) может промерзать полностью, однако такое случается нечасто, поскольку зимой наблюдается постоянное волнение моря. Механизм устойчивости баренцевоморских водорослей к замораживанию и размораживанию остается не до конца ясным. Полагают, что жизнеспособность водорослей при низких температурах сохраняется за счет наличия криопротекторных веществ в клетках и отсутствия свободной воды – при природной заморозке водоросли теряют влагу [22].
Насколько биогены могут лимитировать рост водорослей в летний период вегетации в арктических условиях? Сезонная динамика трансформации биогенов в арктических прибрежных районах остается мало исследованной. Предполагается, что общая схема такая же, как и на Мурманском побережье: в осенне-зимний период идет накопление биогенов за счет регенерации и конвективного перемешивания, поступление биогенов также идет при таянии снега и льда, а летом они активно поглощаются автотрофами – фитопланктоном и макроводорослями [7].
Рост водорослей зимой за счет запасных веществ – хорошо известный факт. Ламинария Laminaria saccharina способна накапливать органические вещества в слоевище и использовать их для роста в зимний период, когда солнечной радиации недостаточно для положительного баланса продукционных процессов [7; 19]. Так, в условиях Мурманского побережья рост пластины Laminaria saccharina у многолетних растений начинается в декабре в разгар полярной ночи, когда дыхание преобладает над фотосинтезом. При этом у однолетней ламинарии, не имеющей развитой пластины, а следовательно, и больших запасов питательных веществ, рост начинается позднее, с увеличением уровня солнечной радиации, т. е. в конце января – начале февраля. У Laminaria solidungula , единственного вида из ламинариевых водорослей, имеющего преимущественное распространение в Арктике, формирование пластины начинается в конце полярной ночи, а в течение полярного дня происходит запасание веществ в процессе вегетативного роста [16].
От ледовых условий во многом зависит распределение бентосных сообществ в арктических районах Баренцева моря [13]. Припайные льды при движении удаляют подводную растительность на больших пространствах с любого типа субстрата. При образовании льда во время волнения моря шуга сдирает даже мелкие водоросли. Припайный лед оказывает неблагоприятное воздействие и на субстрат, на котором произрастают водоросли: валуны переворачиваются, а камни "замываются" мягкими грунтами из песка, гравия и ила. Поэтому сублиторальные водоросли в спокойных бухтах часто бывают покрытыми достаточно толстым слоем ила. Скопления айсбергов также оказывают большое влияние на сублиторальную растительность. Перемещаясь течениями, они срезают водоросли с верхушек камней и валунов. Таяние айсбергов и льдов приводит к распреснению поверхностного слоя воды. Кроме того, сходящие ледники несут массу частиц грунта с берега, увеличивая мутность и уменьшая освещенность. Этими факторами объясняется скудность и разреженность зарослей водорослей в местах скопления айсбергов и льдов. Так, на литорали островов архипелага Земля Франца-Иосифа растительность практически отсутствует, на глубине до 2–3 м отчетливо выражена деятельность подвижных припайных льдов, а влияние айсбергов, оставляющих вмятины и борозды на грунте, прослеживается до 25–30 м. При отсутствии существенного действия айсбергов и льдов пояс ламинариевых выражен отчетливо, заросли разреженные, с достаточно разнообразным видовым составом [9].
Распреснение поверхностного слоя воды в результате таяния снега и льда также может оказывать значительное влияние на распределение макроводорослей в арктических экосистемах. Известно, что у побережья Гренландии в бухтах при таянии айсбергов соленость воды у нижней поверхности льдин может снижаться до 3–4 ‰, и эта величина является критической для морских видов. По-видимому, распреснение в сочетании с другими негативно влияющими факторами является одной из причин, по которой фукусы опускаются в сублитораль в арктических районах. Водоросли, обитающие на литорали, в целом лучше адаптированы к значительным колебаниям солености на протяжении суток и года. Многие литоральные водоросли являются эвригалинными. Ламинариевые водоросли, напротив, имеют достаточно узкий диапазон толерантности по отношению к солености, поэтому и обитают в сублиторальной зоне. В прибрежных арктических районах распространение получают виды водорослей, которые обладают достаточно широким диапазоном устойчивости по отношению к солености.
Продуктивность макроводорослей в арктических сообществах. Короткое световое окно и длинная полярная ночь, низкая интенсивность света из-за ледяного и снежного покрова на протяжении большей части года, постоянная облачность летом, низкая температура воды (около нуля) на протяжении всего года, и в летний вегетационный период обусловливают низкую продуктивность автотрофов в арктической зоне. У макроводорослей в арктических экосистемах отмечается уменьшение размеров слоевища, снижение интенсивности фотосинтеза, скорости и интенсивности вегетативного роста, снижение репродуктивного потенциала растений. В сообществах макроводорослей в арктических районах наблюдается падение видового разнообразия, биомассы и плотности поселений. Продуктивность макроводорослей и их сообществ в арктических экосистемах существенно ниже по сравнению с бореальными районами.
Многолетние макроводоросли в Арктике существуют при минимальной продукции органического вещества в течение года. Многолетники включают "грубопластинчатые" формы ( Alaria esculenta , Laminaria solidungula ), "грубокустистые" ( Desmarestia aculeata ) и корковые известковые красные водоросли. Некоторые из них могут иметь достаточно крупное слоевище, что является следствием продолжительной жизни растений в связи со снижением интенсивности процессов деструкции из-за низкой температуры. Отмечается уменьшение размеров слоевища, меньшее число ветвей, уменьшение коркового и центрального слоев клеток у арктических форм водорослей ( Phycodrys rubens , Ptilota serrata , Callophyllis cristata и другие) по сравнению с бореальными формами тех же самых видов [16]. Для ламинарий Земли Франца-Иосифа характерна слабая морфологическая расчлененность пластины: у Laminaria saccharina пластина ровная, со слабой гофрировкой, без булей, а у Laminaria digitata она практически не рассечена на лопасти [9]. На примере ламинариевых установлено, что по размерам и особенно по массе слоевища водоросли архипелага Земли Франца-Иосифа уступают растениям с Мурманского побережья.
У макроводорослей на побережье Земли Франца-Иосифа в силу географических и климатических условий фотосинтез и дыхание соответственно в среднем на 20 и 50 % ниже, чем у аналогичных видов южной части Баренцева моря [7; 23]. Результатом снижения метаболической активности водорослей в Арктике являются меньшие размеры и масса большинства бентосных водорослей. При этом уровень интенсивности фотосинтеза и дыхания ламинариевых в районе Земли Франца-Иосифа по своим абсолютным значениям во время короткого летнего периода может приближаться к величинам, отмечаемым для растений Восточного Мурмана. Однако, как показали измерения, уже в августе в водах Земли Франца-Иосифа, фотосинтез макроводорослей превышает дыхание (табл. 1). Содержание хлорофилла имеет достаточно большой разброс, что обусловлено различиями в морфологической структуре слоевища. Величина продукции и дыхания водорослей, обитающих на побережье архипелага, ниже, чем в южной части Баренцева моря: у бурых водорослей продукция ниже на 26 %, дыхание – на 58 %, у зеленых – на 42 и 83 % соответственно. В первую очередь различия обусловлены температурой воды, разница между районами составляет 7—8 ° С.
Интенсивность фотосинтеза, потребление кислорода и содержание хлорофилла а у макроводорослей на побережье Земли Франца-Иосифа [7]
Таблица 1
|
Макроводоросли |
Фотосинтез валовый, мгС/г сырого вещества в сутки |
Дыхание, мл О 2 /г сырого вещества в сутки |
Содержание хлорофилла а , мкг/г сырого вещества |
|
Бурые |
|||
|
Laminaria saccharina |
0,91 |
0,36 |
185,3 |
|
Pilayella litoralis |
1,17 |
0,44 |
147,8 |
|
Красные |
|||
|
Devaleraea ramentacea |
1,08 |
0,41 |
40,4 |
|
Зеленые |
|||
|
Acrosiphonia sonderi |
0,92 |
0,36 |
188,9 |
Исследования фотосинтеза и дыхания макроводорослей в районе Дальних Зеленцов показали, что в полярную ночь жизнедеятельность исследованных водорослей (бурые – Laminaria saccharina , красные – Palmaria palmata , зеленые – Ulvaria obscura ) характеризуется только дыхательными процессами. Фотосинтез начинает преобладать над потреблением кислорода в середине февраля, когда уровень падающей солнечной радиации составляет 30–50 кал/см 2 (рис.). Высокий уровень фотосинтеза отмечается у водорослей в полярный день: в конце апреля ( Ulvaria obscura , Palmaria palmata ) и начале июля ( Laminaria saccharina ). Снижение фотосинтеза до уровня потребления кислорода у всех исследованных видов наблюдается в конце октября, когда уровень падающей солнечной радиации снижается до 50 кал/см 2 . Динамика продукционных характеристик макроводорослей Баренцева моря имеет сезонную изменчивость, которая связана прежде всего с особенностями поступления солнечной радиации.
Исследования в прибрежных водах архипелага Земля Франца-Иосифа указывают на снижение репродуктивного потенциала макроводорослей в арктических районах по сравнению с Мурманским побережьем [13]. На примере ламинарий, обитающих в водах у побережья архипелага, показано, что растения позднее вступают в стадию размножения, поскольку дольше набирают достаточную массу слоевища, необходимую для начала формирования органов размножения. Ниже процент фертильных растений в соответствующих возрастных группах и в поселении в целом, меньше площадь поверхности пластины, занятая спорангиями. Как следствие, на слоевище ламинарий в арктических районах формируется значительно меньше спор, чем в южных районах Баренцева моря.
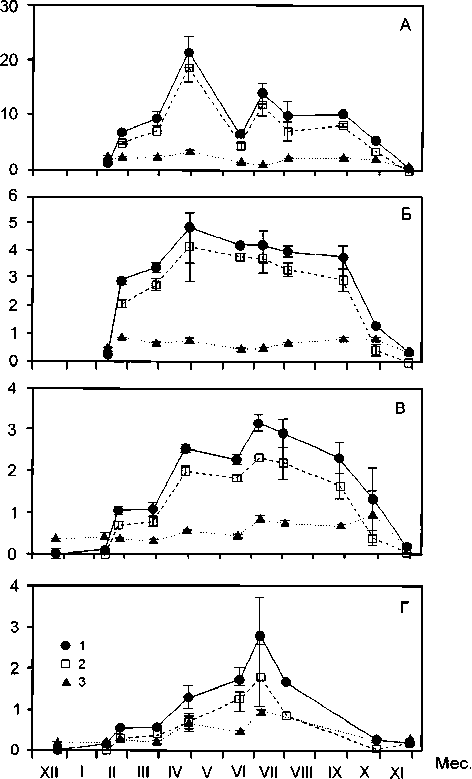
Рис. Годовая динамика валового (1), чистого (2) фотосинтеза и дыхания (3) (млО 2 /г сырого вещества в сутки) водорослей: А – Ulvaria obscura , Б – Palmaria palmata , В–Г – Laminaria saccharina , проростки первого года (В) и взрослые растения (Г) [7]
Считается, что на широте 80 ° с. ш. на поверхность воды поступает 40 % годовой световой энергии от таковой на экваторе и на 25 % меньше, чем в бореальной зоне (60 ° с. ш.) [14; 16]. В Арктике бентосные водоросли встречаются только в местах, освобождаемых ото льда хотя бы на 1–1,5 месяца в летнее время, и отсутствуют в районах с постоянным ледовым покровом. Согласно разным оценкам продуктивность водорослей в Арктике в 2–3 раза ниже, чем в бореальных районах в связи с коротким и холодным вегетационным периодом [24].
Ниже изложенные данные по годовой продукции бентосных талломных водорослей арктических районов свидетельствуют о резком падении ее уровняв в циркумполярной Арктике.
Аляска, море Бофорта (70 ° с. ш., 147 ° з. д.) (табл. 2). Открытая вода наблюдается в июле — сентябре (9 месяцев в году держится ледовый покров), температура воды в это время изменяется от —1 до 4 ° С, соленость 18–25 ‰. Годовой бюджет света (ФАР – фотосинтетически активная радиация) составляет 45–50 моль фотонов на м 2 в год, что около годового минимума, необходимого для произрастания таких крупных водорослей, как ламинария. Количество ФАР изменяется от 5 цмоль ■ м -2 ■ сек -1 (максимум) при ледовом покрове до 200 цмоль ■ м -2 ■ сек -1 при открытой воде. Продукция зарослей Laminaria solidungula оценивается равной 7 гС ■ м -2 в год. В августе на глубине 6—7 м скорость светового потока составляет в августе 100—200 цмоль ■ м -2 ■ сек -1 в дневное время и 20—3 0 цмоль ■ м -2 ■ сек -1 в ночное время; фиксация углерода ламинарией (радиоуглеродный метод) составила 0,09 мкгС/мг в час [25; 26].
Гренландия, Янг Саунд (74 ° с. ш., 20 ° з. д.). Лед держится 9—10 месяцев, свободная ото льда вода — с середины июля по сентябрь. На глубине 10 м водоросли получают потенциально (при отсутствии облачности) 463 моль фотонов ■ м -2 в год. Годовая продукция бурых водорослей составляет 0,1—1,6 гС ■ м -2 в год [27].
Шпицберген, Конгс-фьорд (78 ° с. ш., 20 ° в. д.). Ледовый покров образуется в сентябре и держится до апреля – середины июня. На глубине 10 м водоросли получают потенциально (при отсутствии облачности) 1 092 моль фотонов на м –2 в год [28]. Прибрежные заросли ламинариевых водорослей хорошо развиты.
Канадская Арктика, Иглулик Айленд (69 ° с. ш., 81 ° з. д.). Ледовый покров толщиной около 1,5 м держится на протяжении большей части года; свободная ото льда вода бывает на протяжении 10 недель с августа до середины октября. Водоросли на глубине 8 м получают 590 Е/м 2 света в год; у нижней границы произрастания (20 м) — всего 49 Е/м 2 в год. Годовая продукция бурых водорослей составляет около 20 гС ■ м -2 в год [29].
Архипелаг Земля Франца-Иосифа, о. Хейса, о. Гукера (80 ° с. ш., 52 ° в. д.) (табл. 2). Большую часть года на мелководье в районе о. Хейса держится сплошной припайный лед 1–1,5 м толщиной, море бывает открытым лишь в течение 1–1,5 месяцев в августе – сентябре. Достаточные для фотосинтеза и развития микроскопических и макроскопических водорослей световые условия наблюдаются на протяжении не более 4 месяцев в году (май – август). Продукция водорослей-макрофитов составляет 31–266 мгС/м 2 в сутки; годовая - 133 гС ■ м -2 в год; она соизмерима с продукцией микрофитобентоса и фитопланктона в арктической зоне [23].
Продукционные характеристики сообществ макроводорослей в Арктике и в северной части бореальной зоны
Таблица 2
|
Район, широта, долгота |
Бюджет света |
Продукция макроводорослей |
Источник данных |
|
Земля Франца-Иосифа, о. Гукера, 80 ° с. ш., 52 ° в. д. |
31,2-265,6 мгС ■ м -2 ■ день -1 , 133 гС ■ м -2 ■ год -1 |
[7] |
|
|
Шпицбереген, Конгс-фьорд, 78 ° с. ш., 20 ° в. д. |
1 092 моль ■ м -2 ■ год -1 |
[28] |
|
|
Гренландия, Янг Саунд, 74 ° с. ш., 20 ° з. д. |
463 моль ■ м -2 ■ год -1 (гл. 10 м) |
0,1-1,6 гС ■ м -2 ■ год -1 |
[24; 27] |
|
Мурманское побережье, Дальние Зеленцы, Баренцево море, 69 ° с. ш., 36 ° в. д. |
50-70 кал ■ см -2 ■ день -1 в феврале и 550 ккал ■ см -2 ■ день -1 в июле |
Литораль: 700 гС ■ м -2 ■ год -1 , сублитораль: 2 000 гС ■ м -2 ■ год -1 |
[7] |
|
*Норвегия, район г.Берген, 60 ° с. ш., 0,5 ° в. д. |
240-600 гС ■ м -2 ■ год -1 |
[30; 31] |
|
|
*Германия, о. Гельголанд, 54 ° с. ш. |
400–1 000 моль фотонов ■ м -2 ■ год -1 (4-2 м) |
[14] |
|
|
Аляска, море Бофорта, 70 ° с. ш., 147 ° з. д. |
45-50 моль ■ м -2 ■ год -1 |
7 гС ■ м -2 ■ год -1 |
[25; 26] |
|
Канада, Иглулик Айленд, 69 ° с. ш., 81 ° з. д. |
590 Е ■ м -2 ■ год -1 (8 м), 49 Е ■ м -2 ■ год -1 (20 м) |
20 гС ■ м -2 ■ год -1 |
[29] |
|
*Канада, Новая Шотландия, 43 ° с. ш., 63 ° з. д. |
1 750 гС ■ м -2 ■ год -1 |
[32] |
Примечание. 1 Е = 1 эйнштейн = 1 моль фотонов = 6,02 ■ 10 23 фотонов света.
* Для сравнения приведены данные для бореальных районов.
Таким образом, продукция зарослей бурых водорослей составляет в арктических районах ниже на 1–2 порядка по сравнению с продукцией макроводорослей в северных районах бореальной зоны. Вместе с тем, в различных районах Баренцева моря наблюдаются достаточно высокие значения первичной продукции [7; 33].
Заключение
Существование сложных многоярусных фитоценозов бурых водорослей обеспечивается наличием у популяций адаптационных приспособлений к экологическим факторам при совместном произрастании и увеличивает шансы каждого вида в сообществе на выживание в экстремальных условиях северных морей. Обитая в условиях суточных и сезонных перепадов солнечной радиации, температуры среды, солености и приливно-отливных явлений, бурые водоросли обладают широкой экологической валентностью. Способность бурых водорослей сохранять эндогенные ритмы метаболической активности, синхронизируя их с природными периодическими явлениями, обеспечивает им доминирование в бентосных фитоценозах. Реакции биотической компоненты экосистемы на действие экологических и антропогенного факторов проявляются обычно в форме неспецифического отклика, выражающегося в снижении численности отдельных популяций водорослей, что сопровождается структурной перестройкой фитоценоза. В результате структурных изменений в бентосном сообществе начинают доминировать виды водорослей, обладающие резистентной устойчивостью, способные регулировать численность соотносительно с таковой партнеров по фитоценозу [4].
Первичные периодические абиотические факторы выступают в качестве элементов среды и оказывают непосредственное влияние на продукционные возможности водорослей бентосных сообществ. Вторичные периодические факторы (шторма, подвижки льда, атмосферные осадки) обычно сопряжены с первичными и могут усиливать или ослаблять их влияние. Короткое световое окно и длинная полярная ночь, низкая (около нуля) температура воды в течение всего года, особенно – в летний вегетационный период обусловливают низкую потенциальную продукционную емкость среды для автотрофов в арктической зоне. У макроводорослей в арктических экосистемах отмечаются уменьшение размеров слоевища, снижение интенсивности фотосинтеза, скорости и интенсивности вегетативного роста, снижение репродуктивного потенциала растений, в их сообществах – снижение видового разнообразия, биомассы и плотности поселений. Продуктивность макроводорослей и их сообществ в арктических экосистемах существенно ниже по сравнению с бореальными районами.
Реакции водорослей на экологические факторы меняются в зависимости от сезона, что наиболее четко прослеживается в северных морях. Наибольшее значение в сезонных стадиях активности и покоя принадлежит температуре среды. В зимний период у водорослей существенно падает интенсивность метаболизма, а процессы морфогенеза практически прекращаются, поскольку водоросли переходят преимущественно на эндогенное питание. В клетках водорослей снижается содержание воды, и возрастает концентрация метаболитов, понижающих температуру замерзания цитоплазмы. Зимой во время отлива происходит резкое падение температуры среды, которое сопровождается быстрым охлаждением слоевища водорослей. За столь короткое время центры кристаллизации воды в клетках не успевают сформироваться, стекловидная структура цитоплазмы сохраняет свою целостность, и поэтому резкое падение температуры вызывает у водорослей лишь временный и обратимый анабиоз.
Однако главным регулятором сезонных изменений в фитоценозах макроводорослей являются солнечная радиация и продолжительность светового дня, обусловленные периодическими астрономическими явлениями, которые определяют сезонные циклы роста и размножения. Проявлением адаптации бентосных водорослей к экстремальным условиям арктических морей, обеспечивающей их доминирование в донных фитоценозах, является разобщение во времени и пространстве слоевища вегетативного и генеративного процессов.
Таким образом, существование фитоценозов бентосных водорослей северных морей контролируется в основном первичными периодическими экологическими факторами, выступающими в качестве триггеров, которые определяют направленность вегетативных и генеративных процессов, а также способствуют появлению адаптационных приспособлений к экстремальным условиям внешней среды. Поэтому периодические воздействия экологических факторов вызывают структурные перестройки в фитоценозах фукусовых благодаря упругой устойчивости популяций водорослей, приобретенных в результате длительного процесса адаптации к условиям северных морей. Непериодические первичные факторы также нарушают соотношение численности за счет элиминации и угнетения роста определенных возрастных стадий водорослей. Однако и в этом случае благодаря резистентной устойчивости сообщество водорослей способно со временем восстановить структурнофункциональную организацию.
Список литературы Экологические факторы, регулирующие рост макроводорослей в сообществах арктических морей E. V. Shoshina, V. I. Kapkov, O. A. Belenikina
- Kapkov V. I., Belenikina O. A., Fedorov V. D. Effect of heavy metals on marine phytoplankton//Moscow Univ. Biol. Sci. Bulletin. Allerton Press (NY, USA). 2011. V. 66, N 1. P. 32-36.
- Розенберг Г. С., Рянский Ф. Н. Теоретическая и прикладная экология. Нижневартовск: Нижневартов. пед. ин-т, 2005. 292 с.
- Твердислов В. А., Сидорова А. Э., Яковенко Л. В. Биофизическая экология. М.: КРАСАНД, 2012. 544 с.
- Макроводоросли в системе биологического мониторинга морских прибрежных экосистем/Е. В. Шошина, Г. М. Воскобойников, М. В. Макаров, С. Е. Завалко, В. И. Капков//Вестник МГТУ. 2012. Т. 15, № 4. С. 851-857.
- Шошина Е. В., Капков В. И. Экологические особенности промысловых фукусовых водорослей Мурманского побережья Баренцева моря//Вестник МГТУ. 2014. Т. 17, № 1. С. 180-189.
- Канищева О. В., Шошина Е. В. Возрастная структура поселений Fucus vesiculosus на литорали Кольского залива//Вестник Удмурт. ун-та. Сер. Биология. 2015. Вып. 1. С. 40-47.
- Кузнецов Л. Л., Шошина Е. В. Фитоценозы Баренцева моря (физиологические и структурные характеристики). Апатиты: Изд-во КНЦ РАН, 2003. 308 с.
- Виноградова К. Л., Шошина Е. В. Водоросли//Окружающая среда и экосистемы Земли Франца Иосифа (архипелаг и шельф). Апатиты, 1994. С. 109-116.
- Шошина Е. В., Макаров В. Н., Макаров М. В. Биологические особенности ламинариевых Земли Франца-Иосифа//Биология моря. 1997. № 5. С. 286-292.
- Шошина Е. В., Анисимова Н. А. Макроводоросли из района бухты Ледяная Гавань (Новая Земля, о. Северный, Карское море)//Вестник МГТУ. 2013. Т. 16, № 3. С. 530-535.
- Шошина Е. В. Макрофиты//Исследование фауны морей. 2012. Т. 69 (77). С. 132-149.
- Шкляревич Г. А., Шошина Е. В. Макроводоросли эстуарной зоны (на примере Порьей губы Белого моря)//Труды Карел. науч. центра РАН. 2015. № 6. С. 1-7.
- Голиков А. Н., Аверинцев В. Г. Биоценозы верхних отделов шельфа архипелага Земля Франца-Иосифа//Исследования фауны морей. 1977. Вып. 14 (22). С. 5-54.
- Lüning K. Seaweeds. Their environment, biogeography and ecophysiology. New York: John Wiley, 1990. 527 р.
- Василевская Н. В. Поливариантность онтогенетических процессов растений в условиях высоких широт. Мурманск: Изд-во МГПУ, 2007. 231 с.
- Wilce R. T., Dunton K. H. The Boulder Patch (North Alaska, Beaufort Sea) and its benthic algal flora//Arctic. 2014. N 67 (1). Р. 43-56.
- Быков О. Д. Фотосинтез и темновая фиксация СО2 литоральных макроводорослей Баренцева моря в условиях полярной ночи//Ботан. журн. 2003. № 12. С. 68-73.
- Тропин И. В., Макаров М. В. Фотосинтетический аппарат представителей Fucales (Phaeophyta) Баренцева моря после полярной ночи//Альгология. 2004. Т. 4, № 4. С. 393-404.
- Макаров М. В., Рыжик И. В., Воскобойников Г. М. Механизмы существования бурых водорослей в период полярной ночи: функциональная дифференциация и гетеротрофия//Современные проблемы альгологии. Ростов н/Д, 2008. С. 225-227.
- Воскобойников Г. М., Макаров М. В., Рыжик И. В. Изменения в составе фотосинтетических пигментов и структуре клеток Fucus vesiculosus L. и F. serratus L. Баренцева моря при длительном нахождении в темноте//Биология моря. 2006. Т. 32, № 1. С. 26-33.
- Дифференциация пластины Laminaria saccharina (L) Lamour. как приспособление к длительному отсутствию освещения/М. В. Макаров, И. В. Рыжик, Г. М. Воскобойников, Г. Г. Матишов//Доклады РАН. Общая биология. 2006. Т. 409, № 2. С. 1-2.
- Макаров М. В., Воскобойников Г. М. Влияние освещения и температуры на макроводоросли Баренцева моря//Труды КНЦ РАН. 2013. № 1 (14). С. 95-111.
- Кузнецов Л. Л., Макаревич П. Р., Макаров М. В. Структурно-продукционные показатели морских фитоценозов//Среда обитания и экосистемы Земли Франца-Иосифа (архипелаг и шельф). Апатиты, 1994. С. 89-94.
- Biomass, photosynthesis and growth of Laminaria saccharina in a high-Arctic fjord, NE Greenland/J. Borum, M. F. Pedersen, D. Krause-Jensen, P. B. Christensen, K. Nielsen//Mar. Biol. 2002. V. 141. P. 11-19.
- Dunton K. H., Riemnitz E., Schonberg S. An Arctic kelp community in the Alaskan Beaufort Sea//Arctic. 1982. N 35. P. 465-484.
- Dunton K. H. Growth and production in Laminaria solidungula: relation to continuous underwater light levels in Alaskan High Arctic//Mar. Biol. 1990. V. 106. P. 297-304.
- Benthic primary production in Young Sound, Northeast Greenland/D. Krause-Jensen, M. Kühl, P. B. Christensen, J. Borum//Bioscience. 2007. N 58. P. 160-173.
- Light regime in an Arctic fjord: A study related to stratospheric ozone depletion as a basis for determination of UV effects on algal growth/D. Hanelt, H. Tüg, K. Bischof, C. Gross, H. Lippert, T. Sawall, U. Karsten, C. Wiencke//Mar. Biol. 2001. V. 138. P. 649-658.
- Chapman A. R. O., Lindley J. E. Seasonal growth of Laminaria solidungula in the Canadian high Arctic in relation to irradiance and dissolved nutrient concentrations//Mar. Biol. 1980. V. 57. P. 1-5.
- Sjotun K., Fredriksen S., Lein T.E., Rueness J., Sivertsen K. Population studies of Laminaria hyperborea from its northern range of distribution in Norway//Hydrobiologia. 1993. V. 260/261. P. 215-221.
- Ecological studies of the kelp Laminaria hyperborea (Gunnerus) Foslie in Norway/K. Sjøtun, S. Fredriksen, J. Rueness, T. E. Lein//Ecology of Fjords and Coastal Waters. Amsterdam, 1995. P. 525-536.
- Mann K. H. Ecological energetics of seaweed zone in a marine bay on the Atlantic coast of Canada. II. Productivity of the seaweeds//Mar. Biol. 1972. V. 14. P. 199-209.
- Макаревич П. Р. Первичная продукция Баренцева моря//Вестник МГТУ. 2012. Т. 15, № 4. С. 786-793.


