Экологический фактор, изменяющий активность ферментов антиоксидантной системы - магнитное поле с частотой 66 кГц
Автор: Сергеева Е.Ю., Азанова А.В., Фефелова Ю.А., Сергеев Н.В., Титова М.С., Цугленок Н.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Экология
Статья в выпуске: 10, 2013 года.
Бесплатный доступ
В результате исследований выявлено, что действие магнитного поля с частотой 66 кГц вызывает достоверное увеличение концентрации малонового диальдегида и снижение активности ферментов антиоксидантной системы в крови.
Магнитные поля, перекисное окисление липидов, малоновый диальдегид
Короткий адрес: https://sciup.org/14082707
IDR: 14082707 | УДК: 613.168:613.6-02:616.419-092.9
Текст научной статьи Экологический фактор, изменяющий активность ферментов антиоксидантной системы - магнитное поле с частотой 66 кГц
Методы исследования. В работе использовалась кровь добровольцев, взятая непосредственно перед экспериментом и стабилизированная гепарином. Принцип метода определения активности СОД основан на ингибировании реакции автоокисления адреналина в щелочной среде в присутствии СОД вследствие дисмутации супероксидных анион-радикалов. Об интенсивности автоокисления адреналина судят по динамическому нарастанию поглощения при длине волны 347 нм, обусловленному накоплением продукта окисления, опережающим по времени образование адренохрома с максимумом поглощения при 480 нм; определение активности КАТ выполняли электрофотоколориметрическим методом при длине волны 400 нм. Содержание малонового диальдегида определяли в реакции с тиобарбитуровой кислотой, включающей в себя инкубацию с тиобарбитуровой кислотой исследуемой пробы, экстракцию продуктов реакции бутанолом и спектрофотометрическое измерение их содержания [2]. В качестве источника промышленных магнитных полей использована установка высокочастотная для индукционного нагрева на базе генератора высокочастотного транзисторного ВГТ5-5/66 со следующими характеристиками: частота колебаний магнитного поля 66 кГц, напряженность магнитного поля в непосредственной близости к установке 500 А/м. Статистическая обработка результатов проведена с использованием пакета программ Statistica 6.
Результаты и выводы исследования. При действии магнитного поля с данными параметрами выявлено достоверное снижение активности супероксиддисмутазы (рис. 1).
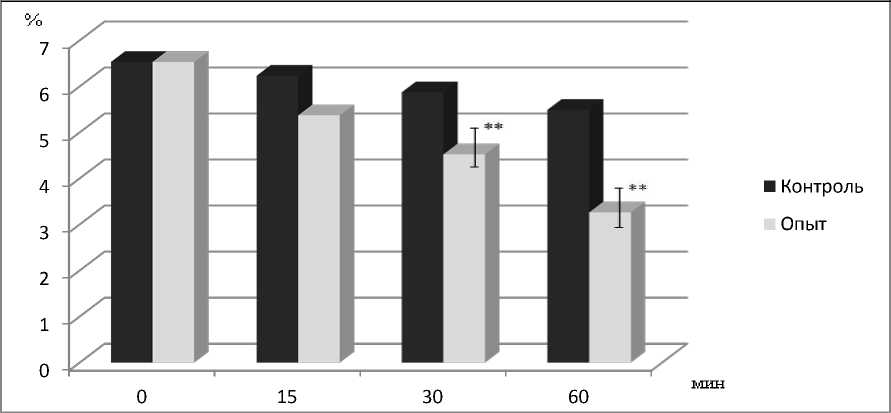
Рис. 1. Изменение активности СОД в крови при действии магнитных полей с частотой 66 кГц in vitro [25–75%], Ме
Здесь и далее **Р < 0,01
При этом воздействие магнитных полей в течение 30 минут приводило к снижению активности СОД в 1,3 раза. Воздействие же магнитных полей в течение 60 минут приводило к снижению активности СОД в 1,7 раза.
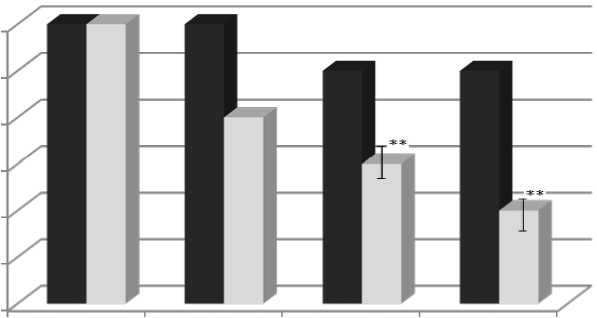
Действие магнитного поля с данными параметрами приводило к достоверному снижению активности каталазы (рис. 2).
%
0,06
0,05
0,04
0,03
0,02
0,01
0,00
30 60
Контроль
Опыт
Рис. 2. Изменение активности каталазы в крови при действии магнитных полей с частотой 66 кГц in vitro [25–75%], Ме
В экспериментах in vitro воздействие магнитных полей в течение 30 минут приводило к снижению активности каталазы в 1,6 раза. Воздействие же магнитных полей в течение 60 минут приводило к снижению активности каталазы в 2,5 раза.
При действии магнитного поля с данными параметрами выявлено достоверное увеличение продукции малонового диальдегида, отражающее выраженность окислительного стресса (табл.).
Изменение продукции МДА в крови при действии магнитных полей с частотой 66 кГц [25–75%], Ме
|
Время воздействия |
Контроль (ммоль/л) (n=27) |
Магнитные поля (n=27) |
|
0 минут |
1,22(1,22+1,23] |
1,22(1,22+1,23] |
|
15 минут |
1,35(1,33+1,35] |
2,56(2,53+2,56] |
|
30 минут |
2,16(2,13+2,16] |
5,86(5,83+5,87]** |
|
60 минут |
2,57(2,53+2,57] |
7,23(7,23+7,25]** |
Примечание: n – объем выборки.
При этом воздействие магнитных полей в течение 30 минут приводило к увеличению продукции малонового диальдегида в 2,7 раза. Воздействие же магнитных полей в течение 60 минут приводило к увеличению продукции малонового диальдегида в 2,8 раза.
Традиционно патогенез окислительного повреждения клеток рассматривался преимущественно с позиций мембрано- и генотоксичности свободных радикалов (перекисное окисление липидов (ПОЛ) и нарушение структуры ДНК), к повышению продукции которых может привести воздействие магнитных полей с используемыми параметрами. Регуляция содержания перекисей и свободных радикалов тканей обеспечивается различными ферментными системами и природными антиоксидантами. На стадии инициирования регуляция ПОЛ в клетке осуществляется посредством генерации супероксидных радикалов, влияния на активность СОД и каталазы, а также на уровень свободного железа. На стадии продолжения цепи изменяется уровень кислорода, микровязкости и содержания полиненасыщенных жирных кислот. На этапе разветвления цепи контроль за уровнем ПОЛ осуществляется за счет влияния на количество свободного железа, активность глутатионпероксидазы и уровень свободных тиолов. На стадии обрыва цепи возникают липофильные антиоксиданты и наблюдаются высокие концентрации свободного железа [1].
Известно, что важнейшим индикатором окислительно-восстановительного гомеостаза клетки является структурное и функциональное состояние клеточных белков, в том числе их термодинамическая и операционная стабильность. Большинство меж- и внутримолекулярных взаимодействий (связывание ионов, субстратов, кофакторов, лигандов, межбелковые и белок-липидные взаимодействия, конъюгация с углеводами, формирование всех видов связи и гидрофобные взаимодействия) напрямую зависят от редокс-статуса среды. В основе денатурационно-ренатурационных превращений и субстрат-ферментных взаимодействий лежит прежде всего тиол-дисульфидный обмен [1, 2]. Реакционная способность цистеиновых остатков белков зависит от присутствия окружающих их ароматических или электростатически заряженных молекул (преимущественно гистидина), а также общего редокс-потенциала системы - при преобладании окислительных валентностей формирование дисульфидных связей облегчено. Редокс-центры белковых молекул в физиологических условиях удалены от поверхности, поэтому белки могут рассматриваться в качестве своеобразного органического матрикса, движение электронов в котором осуществляется благодаря «скачкам» из одного центра в другой или по ковалентным и водородным связям. При этом дисульфидные анионы выступают в роли центров переноса электронов. Формирование дисульфидных связей, катализируемое протеиндисуль-фидизомеразой, обусловливает самоорганизацию белков клетки помимо изомеризации по пролину и ассоциации полипептидных цепей. При этом дисульфидные связи стаилизируют исходное состояние, но не определяют пространственную перестройку белковой молекулы [2]. Промежуточным на пути приобретения стабильной конформации при де- и ренатурационных процессах, сопровождающихся восстановлением дисульфидных связей, является этап формирования «расплавленной глобулы», имеющей объем, превышающий окончательный на 5-15 %, со сниженной степенью ригидности вторичной и третичной структур [1, 3]. Такие структуры способны, будучи локализованными против гидрофобной поверхности, приобретать четвертичную структуру, соответствующую исходной [1,4].
При окислительном стрессе денатурация белковых молекул клетки приводит к уменьшению периода их функционирования в результате повышения чувствительности к протеолитическим реакциям и процессам посттрансляционной модификации (фосфорилированию и рибозилированию); поддержание же частично денатурированных полипептидов в форме «расплавленной глобулы» является обязательным событием при синтезе новых пептидных цепей и их транспорте через клеточные мембраны, что создает основу эффективной регуляции метаболизма через альтерацию редокс-буферных компонентов клетки [1].
Известно, что окислительное повреждение мембран клеток (плазматической, лизосомальной, митохондриальной, ядерной) возникает вследствие окисления полиненасыщенных жирных кислот фосфолипидов, активации и деградации липидных радикалов, реорганизации двойных связей и деструкции липидов. Вследствие появления гидрофильной гидроперекисной группировки в полиненасыщенной жирной кислоте нарушается гидрофобность бислоя, диальдегиды выступают в роли поперечносшивающих бифункциональных реагентов, снижается молекулярная подвижность фосфолипидов, нарушаются липид-белковые взаимодействия, устраняется трансбислойная асимметрия липидов [1, 4].Сопутствующим процессом является деструктурирование мембранных белков – рецепторов, ферментов, ионных каналов, выступающих в роли окисляемых субстратов, особенно при наличии тиоловых групп. Последние, будучи окисленными, образуют высокомолекулярные белковые агрегаты и, таким образом, ответственны за пермеабилизацию мембран внутриклеточных органелл, в том числе митохондрий. В митохондриях протекание такого рода процессов непосредственно сопряжено с формированием свободных радикалов в дыхательной цепи, а также со связыванием ионов кальция с белками, облегчающим их окислительное повреждение. Модуляция тиолдисульфидного обмена в белках митохондриальных мембран лежит в основе повышения их ионной проницаемости [1, 3].
Выводы. Таким образом, мы можем предположить, что воздействие магнитного поля с используемыми параметрами индуцирует развитие окислительного стресса, что является результатом целого ряда взаимосвязанных процессов и реакций.


