Экологический мониторинг морской биоты бухты Алексеева (залив Петра Великого)
Автор: Федорец Ю.В., Шарова О.А., Косьяненко А.А., Аксентов К.И., Раков В.А., Васильева Л.Е.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Природопользование и мониторинг
Статья в выпуске: 1-6 т.13, 2011 года.
Бесплатный доступ
Изучен видовой состав ихтиопланктона и макробентоса б. Алексеева. Установлено, что гибель икры рыб в море на ранних этапах развития связана в основном с факторами ветрового волнения, температуры и солености воды. Построена карта распределения ртути в поверхностном слое донных осадков.
Макробентос, ихтиопланктон, личинки асцидии, ртуть, бухта алексеева
Короткий адрес: https://sciup.org/148199871
IDR: 148199871 | УДК: 574
Текст научной статьи Экологический мониторинг морской биоты бухты Алексеева (залив Петра Великого)
Цель настоящей работы: мониторинг морской биоты б. Алексеева. Для этого предстояло изучить видовой состав и количественное распределение макробентоса и ихтио-планктона, проследить изменения икры на разных стадиях развития в течение нерестового сезона; установить распределение ртути в поверхностном слое донных осадков.
Бухта Алексеева находится в югозападной части Амурского залива, вдается в северо-западный берег о. Попова (рис. 1 А). Вершина бухты мелководная, в средней части глубина увеличивается до 11 м и по направлению к выходу равномерно возрастает до 20 м. В августе 2006 и 2007 гг. температура воды в бухте практически не различалась и составляла в среднем 22-23ºС, с максимумом 29ºС. Осенью 2006 г. температура воды была 8-11ºС, что ниже чем в 2007 г. (10-13ºС). Соленость поверхностных вод летом колеблется от 24 до 32‰, зимой близка к 34‰ [3]. В 2010 г. температура воды в летние месяцы составила в среднем 15-24ºС, соленость поверхностных вод колебалась от 27 до 33‰.
Материал и методы. Макробентос собирали в б. Алексеева в июне-августе 2009 и 2010 гг. на 6 станциях дночерпателем Петерсена с площадью раскрытия 0,025 м2 (см. рис. 1 А). Пробы промывали через гидробиологические сита с ячеей 0,5 мм. Макробентос взвешивали на электронных весах с точностью до 0,01 г. Видовую принадлежность флоры и фауны определяли, а таксономическую принадлежность сверяли по «Таксономическому каталогу…» [7-10]. Для гранулометрического анализа грунт сушили при температуре 60°С в течение 12 часов, затем просеивали через почвенные сита. Структуру осадка определяли по существующей номенклатуре [11]. Ихтио-планктон собирали с мая по октябрь 2006-2010 гг. дважды в месяц в дневное время на 10-15 станциях с глубинами от 1,5 до 20 м (см. рис. 1 А). Сбор проб осуществлялся икорной сетью с диаметром входного отверстия 56,5 см (ИКС-56,5) и сетным мешком из капронового газа № 14 [12]. Горизонтальные (поверхностные) ловы выполняли на циркуляции судна при средней скорости 1,3 м/с в течение 15 мин. Горизонтальное траление выполняли по стандартной методике [12]. Вертикальных лов осуществлялся в слое 20-0 м, а на участках с глубинами менее 20 м – от дна до поверхности воды. Для горизонтальных обловов количество икры (шт.) и личинок (экз.) выражали на лов, а для вертикальных – на 1 м2 акватории. Более 2 тыс. проб ихтиопланктона фиксировали 4% раствором формалина. Для определения видовой принадлежности икры и личинок использовали определители [13, 14]. Одновременно измеряли температуру воды у поверхности. Пробы грунта для определения в них ртути собирали дночерпателем «Океан» с площадью захвата 0,025 см3 и геологической трубкой ГОИН-1,5. Анализ выполнялся на анализаторе ртути РА 915+ с пиролитической приставкой ПИРО.
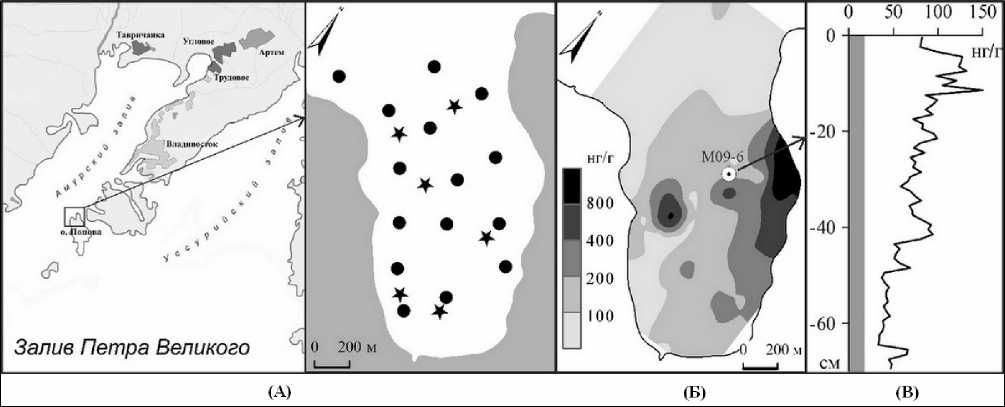
Рис. 1. А – места сбора проб ихтиопланктона (точки) и макробентоса (звездочки); Б – содержание ртути в поверхностном слое (0-5 см) донных осадков; В – содержание ртути в колонке донных осадков М09-6 (серым цветом показан фон для залива Петра Великого)
Результаты и обсуждение. В макробентосе в б. Алексеева обнаружено 128 видов животных и 24 вида макрофитов. Морские травы в бухте представлены Zostera marina и Phyllospadix iwatensis. Заросли зостеры простираются вдоль южного и юго-западного побережья и широкой полосой в кутовой части. Зеленые водоросли Ulva fenestrata и Enteromorpha linza часто встречаются на глубине 0,5-4 м. Среди многочисленных видов бурых водорослей (табл. 1) преобладают Chorda filum и Sar-gassum miyabei. Красные водоросли в основном представлены Corallina pilulifera на участках со скалистыми и каменистыми грунтами в восточной части бухты, на глубине 5-7 м. Виды Neorhodomela larix и Crateloupia divaricata встречаются вдоль северо-восточного и югозападного берегов бухты на глубине от 0,5 до 5-6 м. В юго-западной части бухты на глубине 0,5-1 м на песчано-галечном грунте выделен биоценоз Grateloupia divaricata+Ulva fenestrata+Patiria pectenifera [1]. На этом участке нами отмечен каменистый грунт с наи- лком (частицы от 7 до 10 мм составляют 36 %). Камни покрыты Corallina pilulifera (12-18 %). Наибольшей биомассы достигают офиуры (228,8 г/м2). Высокую численность имеют Polychaeta и Gastropoda (176 экз./м2 и 322 экз./м2 соответственно). Биомасса макробентоса здесь не превышает 930 г/м2, из которой 46,8 г/м2 приходится на Ulva fenestrata.
В южной части бухты между зарослей зостеры на глубине 3-5 м на песчано-илистом грунте (частиц 0,25-0,5 мм – 36 %) располагается полоса Ulva fenestrata. Здесь встречены представители Loricata, Polychaeta, Amphipoda, Izopoda, Nemertini, Ophiuroidea (табл. 2). Офиура Amphiodia fissa образует скопления плотностью до 184 экз./м2. Зеленые водоросли достигают биомассы 1453 г/м2 (Ulva fenestrata) и бурые – 397,5 г/м2 (Dictyota dichotoma). В июле отмечено оседание личинок брюхоногих моллюсков, молодь которых (менее 3 мм) покрывала практически всю поверхность макрофитов. Биомасса и численность Gastropoda здесь составила 477 г/м2 и 6123 экз./м2 соот- ветственно. Наблюдалось также оседание личинок Bivalvia, но их плотность и биомасса были небольшими. В северо-западной части бухты на каменистых грунтах и глубине от 1 до 5-6 м располагается биоценоз Crenomytilus grayanus [1]. Здесь общая биомасса животных составляет 2386,32 г/м2 (из них мидия Грея -1764,97 г/м2), общая плотность 223 экз./м2. Обнаружены Carolina (покрытие 40-50 %), и редкие домики Spirorbidae. Преобладали Loricata
(47 экз./м2 и 44 г/м2), Bivalvia (112 экз./м2 и 16 г/м2) и Polychaeta (48 экз./м2 и 15 г/м2) (табл. 2). Встречены пурпурная и бугорчатая асцидии. Эти животные предпочитают селиться на камнях и скалах в открытой части бухты на глубине от 10 до 17 м. На глубине от 7 до 10 м найдены скопления асцидий (15 экз./м2), а с увеличением глубины они встречаются реже (до 3 экз./м2).
Таблица 1. Видовой состав фитобентоса б. Алексеева
|
Вид |
1 |
2 |
3 |
4 |
5 |
6 |
Вид |
1 |
2 |
3 |
4 |
5 |
6 |
|
Enteromorpha linsa (Chl) |
+ |
+ |
+ |
- |
+ |
- |
Chorda filum (Ph) |
+ |
+ |
+ |
+ |
- |
- |
|
Enteromorpha prolifera (Chl) |
+ |
- |
- |
- |
- |
- |
Costaria costata (Ph) |
- |
+ |
- |
- |
- |
- |
|
Ulva fenestrate (Chl) |
+ |
+ |
- |
+ |
+ |
- |
Laminaria cichorioides (Ph) |
- |
- |
- |
- |
- |
+ |
|
Ulvaria splendens (Chl) |
+ |
- |
- |
- |
- |
- |
Dictyota dichotoma (Ph) |
+ |
+ |
- |
- |
- |
- |
|
Codium fragile (Chl) |
- |
- |
+ |
+ |
+ |
- |
Sargassum miyabei (Ph) |
- |
- |
+ |
+ |
+ |
- |
|
Chaetomorpha melagonium (Chl) |
- |
+ |
- |
- |
- |
- |
Sargassum palidum (Ph) |
- |
- |
+ |
- |
- |
- |
|
Cladophora flexuosa (Chl) |
- |
- |
+ |
- |
- |
- |
Corallina pilulifera (Rh) |
+ |
- |
+ |
- |
+ |
- |
|
Chordaria flagelliformis (Ph) |
- |
- |
+ |
- |
- |
- |
Grateloupia divaricata (Rh) |
+ |
- |
- |
- |
- |
- |
|
Dictyosiphon chordaria (Ph) |
+ |
+ |
- |
- |
- |
- |
Neorhodomela aculeate (Rh) |
+ |
- |
- |
- |
+ |
- |
|
Colpomenia peregeina (Ph) |
+ |
- |
- |
- |
- |
- |
Polysiphonia fibrata (Rh) |
- |
- |
+ |
- |
- |
- |
|
Scytosiphon simplicissimus (Ph) |
- |
+ |
- |
- |
- |
- |
Phyllospadix iwatensis (Emb) |
- |
- |
- |
- |
+ |
- |
|
Desmarestia viridis (Ph) |
- |
- |
+ |
- |
+ |
+ |
Zostera marina (Emb) |
+ |
- |
+ |
+ |
+ |
- |
Таблица 2. Видовой состав зообентоса б. Алексеева
|
Вид |
1 |
2 |
3 |
4 |
5 |
6 |
Вид |
1 |
2 |
3 |
4 |
5 |
6 |
|
Eulalia bilineata (Po) |
- |
+ |
- |
- |
- |
+ |
Neoamphitrite groenlandica (Po) |
- |
- |
- |
- |
+ |
- |
|
Nereiphylla castanea (Po) |
- |
- |
- |
+ |
- |
- |
Pista incarrientis (Po) |
- |
- |
- |
- |
+ |
- |
|
Phyllodoce groenlandica (Po) |
- |
- |
- |
+ |
- |
- |
Lysippe labiata (Po) |
- |
- |
- |
- |
- |
+ |
|
Phyllodoce maculata (Po) |
- |
- |
- |
+ |
+ |
+ |
Melinna elisabethae (Po) |
- |
- |
+ |
- |
- |
- |
|
Pterocirrus macroceros (Po) |
- |
- |
- |
+ |
- |
- |
Pectinaria damai (Po) |
- |
- |
+ |
- |
- |
- |
|
Glycera capitata (Po) |
- |
- |
+ |
+ |
- |
- |
Chone olegi (Po) |
- |
- |
- |
- |
- |
+ |
|
G. chirori (Po) |
- |
- |
- |
- |
- |
+ |
Spirorbis semidentatus (Po) |
+ |
+ |
- |
- |
- |
- |
|
G. onomichiensis (Po) |
- |
- |
+ |
- |
- |
- |
S. nipponicus (Po) |
+ |
- |
- |
- |
- |
- |
|
Glycinde armigera (Po) |
- |
- |
- |
- |
- |
+ |
Circeis nipponicus (Po) |
- |
- |
- |
+ |
- |
- |
|
Goniada maculata (Po) |
- |
- |
- |
- |
- |
+ |
Fabricia crenicolis (Po) |
- |
+ |
- |
- |
+ |
- |
|
Harmothoe imbricata (Po) |
+ |
+ |
+ |
+ |
+ |
- |
Oncoscolex pacificus (Po) |
- |
- |
- |
+ |
- |
- |
|
Lepidonotus squamatus (Po) |
+ |
+ |
- |
- |
- |
- |
Aonides oxycephala (Po) |
- |
- |
- |
+ |
+ |
+ |
|
Nereis tigrina (Po) |
- |
+ |
- |
+ |
- |
Myxicola infundibulum (Po) |
- |
- |
- |
+ |
- |
- |
|
|
N. vexillosa (Po) |
- |
+ |
- |
- |
- |
- |
Thysanocardia nigra (Si) |
- |
- |
+ |
- |
- |
- |
|
N. zonata (Po) |
- |
+ |
+ |
- |
- |
- |
Phascolosoma agasizii (Si) |
- |
- |
+ |
- |
- |
- |
|
Plathynereis bicanaliculata (Po) |
- |
- |
- |
+ |
- |
- |
Balanus crenatus (Ci) |
+ |
- |
+ |
- |
+ |
- |
|
Typosyllis orientalis (Po) |
- |
- |
- |
- |
+ |
- |
Balanus improvisus (Ci) |
- |
- |
- |
- |
+ |
- |
|
Lumbrinereis fragilis (Po) |
- |
- |
+ |
- |
- |
- |
Neomysis sp. (My) |
- |
- |
+ |
- |
- |
- |
|
L. cervicalis (Po) |
- |
- |
+ |
- |
- |
- |
Amphithoe japonica (Am) |
- |
- |
+ |
+ |
- |
- |
|
Scoloplos armiger (Po) |
- |
+ |
- |
- |
- |
+ |
Amphipoda sp. (Am) |
- |
- |
- |
+ |
- |
- |
|
Laonice cirrata (Po) |
- |
- |
- |
- |
- |
+ |
Anisogammarus pugettensis (Am) |
+ |
- |
- |
+ |
- |
- |
|
Cirratulus cirratus (Po) |
- |
- |
- |
- |
- |
+ |
Hyale bassargini (Am) |
+ |
+ |
- |
- |
- |
- |
|
Cirriformia tentaculata (Po) |
- |
- |
- |
+ |
- |
- |
Parhyale zibellina (Am) |
+ |
- |
+ |
+ |
- |
- |
|
Spiophanes uschakovi (Po) |
- |
- |
- |
- |
- |
+ |
Caprella danilewskii (Am) |
- |
+ |
- |
- |
- |
- |
|
Diplocirrus lorgisetosus (Po) |
- |
- |
+ |
- |
- |
- |
Caprella sp. (Am) |
- |
- |
+ |
- |
- |
- |
|
Pherusa plumosa (Po) |
- |
- |
- |
- |
+ |
- |
Cymodoce japonica (Is) |
- |
- |
- |
+ |
- |
- |
|
Ammotrypane multipapilla (Po) |
- |
- |
- |
+ |
+ |
- |
Holotelson tuberculatus (Is) |
- |
- |
- |
+ |
- |
- |
|
Scalibregma inflatum (Po) |
- |
- |
- |
+ |
- |
+ |
Paranthura japonica (Is) |
- |
- |
+ |
- |
- |
- |
|
Axiotella catenata (Po) |
- |
- |
- |
- |
- |
+ |
Pentias hayi (Is) |
- |
+ |
- |
- |
- |
- |
|
Maldane sarsi (Po) |
- |
- |
- |
- |
+ |
+ |
Pachycheles stevensii (De) |
- |
- |
+ |
- |
+ |
- |
|
Pisoides bidentata (De) |
- |
- |
- |
+ |
- |
- |
Modiolus kurilensis (Bi) |
- |
+ |
- |
- |
+ |
- |
|
Pugettia quadridens (De) |
- |
- |
- |
+ |
- |
- |
Mytilus trossulus (Bi) |
+ |
- |
- |
- |
+ |
- |
|
Telmessus cheiragonus (De) |
- |
+ |
- |
- |
- |
- |
Crenomytilus grayanus (Bi) |
- |
- |
+ |
- |
+ |
- |
|
Cancer amphioetus (De) |
- |
- |
- |
- |
- |
+ |
Septifer keenae (Bi) |
- |
- |
- |
+ |
- |
- |
|
Продолжение таблицы 2 |
|||||||||||||
|
Pagurus middendorfii (De) |
+ |
+ |
- |
+ |
- |
- |
Glycymeris yessoensis (Bi) |
- |
- |
+ |
- |
+ |
- |
|
Pagurus sp. (De) |
- |
- |
- |
- |
+ |
- |
Crassostrea gigas (Bi) |
- |
- |
+ |
- |
- |
- |
|
Leptochiton assimilis (Pol) |
- |
- |
- |
+ |
- |
- |
Mizuhopecten yessoensis (Bi) |
- |
- |
- |
+ |
- |
- |
|
Lepidozona albrechti (Pol) |
- |
- |
- |
- |
+ |
- |
Hiatella arctica (Bi) |
+ |
- |
+ |
+ |
- |
- |
|
Tonicella granulata (Pol) |
- |
- |
- |
+ |
- |
- |
Panope japonica (Bi) |
- |
- |
- |
- |
+ |
+ |
|
Tonicella squamigera (Pol) |
+ |
+ |
- |
- |
- |
- |
Keenocardium californiense (Bi) |
- |
+ |
- |
- |
+ |
- |
|
Placiphorella Stimpsoni (Pol) |
+ |
+ |
- |
+ |
- |
- |
Felaniella usta (Bi) |
- |
- |
- |
+ |
+ |
+ |
|
Notoacmea concinna (Ga) |
+ |
+ |
- |
- |
- |
- |
Diplodonta semiosperoides (Bi) |
- |
- |
- |
+ |
- |
- |
|
Collisella heroldi (Ga) |
+ |
- |
- |
- |
- |
- |
Macoma incongrua (Bi) |
- |
- |
- |
+ |
- |
- |
|
Acmaea pallida (Ga) |
- |
+ |
- |
- |
- |
- |
Ruditapes philippinarum (Bi) |
+ |
+ |
- |
+ |
- |
- |
|
Umbonium costatum (Ga) |
- |
- |
- |
+ |
+ |
- |
Protothaca jedoensis (Bi) |
- |
- |
- |
+ |
- |
+ |
|
Homalopoma amussitata (Ga) |
+ |
- |
- |
+ |
+ |
- |
Callithaca adamsi (Bi) |
- |
- |
- |
- |
- |
+ |
|
Homalopoma sanqarense (Ga) |
+ |
- |
+ |
+ |
- |
+ |
Anisocorbula venusta (Bi) |
+ |
+ |
+ |
+ |
+ |
+ |
|
Epheria turrita (Ga) |
+ |
- |
- |
- |
+ |
- |
Mya priapus (Bi) |
- |
- |
- |
- |
+ |
- |
|
Littorina breviculata (Ga) |
- |
+ |
- |
- |
- |
- |
Mya arenaria (Bi) |
- |
- |
- |
- |
- |
+ |
|
Littorina mandshurica (Ga) |
+ |
- |
- |
- |
- |
- |
Apostychopus japonicus (Hol) |
- |
+ |
- |
- |
+ |
- |
|
Littorina squalida (Ga) |
+ |
- |
- |
+ |
- |
- |
Cucumaria fraudatrix (Hol) |
- |
- |
+ |
+ |
+ |
- |
|
Thapsiella plicosa (Ga) |
- |
- |
- |
- |
+ |
- |
Strongylocentrotus nudus (Ech) |
- |
+ |
- |
+ |
+ |
- |
|
Fartulum bucerius (Ga) |
- |
+ |
- |
- |
- |
- |
S. intermedius (Ech) |
+ |
+ |
+ |
+ |
- |
- |
|
Crypthonatica janthostoma (Ga) |
- |
- |
+ |
- |
- |
- |
Patiria pectinifera (Ast) |
+ |
- |
- |
+ |
+ |
- |
|
Alaba vladivostokensis (Ga) |
+ |
- |
- |
- |
- |
- |
Aphelasterias japonica (Ast) |
+ |
- |
- |
- |
+ |
- |
|
Mitrella burchardi (Ga) |
+ |
- |
- |
- |
- |
- |
Lethasterias fusca (Ast) |
- |
- |
- |
- |
+ |
- |
|
Boreotrophon candelabrum (Ga) |
- |
+ |
- |
+ |
- |
- |
Asterias amurensis (Ast) |
- |
- |
- |
+ |
- |
- |
|
Nucella heyseana (Ga) |
+ |
- |
- |
- |
- |
- |
Amphiodia fissa (Oph) |
- |
+ |
- |
- |
- |
- |
|
Bela erosa (Ga) |
- |
- |
- |
- |
- |
+ |
Amphipholis kochii (Oph) |
+ |
- |
- |
+ |
+ |
- |
|
Retusidae sp. (Ga) |
- |
- |
- |
- |
- |
+ |
Amphipholis sp. (Oph) |
- |
- |
- |
- |
+ |
- |
|
Acila insignis (Bi) |
- |
- |
- |
+ |
- |
- |
Ophiura sarsi (Oph) |
- |
- |
- |
- |
+ |
- |
|
Leonucula ovatotruncata (Bi) |
- |
- |
+ |
- |
- |
- |
Halocynthia roretzi (Asc) |
- |
- |
- |
- |
+ |
- |
|
Leonucula tenus tenus (Bi) |
- |
- |
- |
- |
- |
+ |
Halocynthia aurantium (Asc) |
- |
- |
+ |
- |
+ |
- |
|
Vilasina pillula (Bi) |
- |
- |
- |
- |
+ |
- |
Styela clava (Asc) |
+ |
+ |
+ |
+ |
- |
- |
Примечание к таблицам : Chl – Chlorophyta; Ph – Phaeophyta; Rh – Rhodophyta; Emb – Embriobyonti; Po – Polychaeta; Si – Sipunculidae; Ci – Cirripedia; Am – Amphipoda; My – Mysidae; Is – Isopoda; De – Decapoda; Pol – Polyplacophora; Ga – Gastropoda; Bi – Bivalvia; Hol – Holothuroidea; Ech – Echinoidea; Ast – Asteroidea; Oph -Ophiuroidea; Asc – Ascidiacea. 1 – станция 1 (глубина 0,5-1 м); 2 – станция 2 (глубина 4 м); 3 – станция 3 (свал, глубина 5 м); 4 – станция 4 (глубина 6 м); 5 – станция 5 (глубина 8 м); 6 – станция 6 (глубина 15 м).
В кутовой части бухты на глубине 5 м отмечен галечный грунт с примесью крупнозернистого песка (частиц 3-1 мм – 41%). Наибольшая биомасса у двустворчатых моллюсков (659 г/м2). Встречены сипункулиды, полихеты, асцидии (табл. 2). Плотность амфипод была низкой (0,2 экз./м2). В поясе Zostera marina на глубине 1-8 м грунт представлен песком (частиц 0,5-1 мм – 42%) с примесью гальки. В этом районе ранее располагался биоценоз Zostera marina+Stichopus japonicus+Mizuhopecten yes-soensis [1]. Здесь, в поясе зостеры, нами отмечена самая высокая биомасса морской травы (1285,61 г/м2). Биомасса бурых водорослей была меньше ( Sargassum miyabei – 6,75 г/м2 и Chorda filum – 1,32 г/м2). На этой станции преобладали Bivalvia (764 экз./м2 и 981,32 г/м2). Биомасса офиур не превышала 0,12 г/м2. У входной части бухты на глубине более 15 м на илах развит биоценоз Maldane sarsi с молодью брюхоногих и двустворчатых моллюсков (плотностью 3778 экз./м2 и биомассой до 100,05 г/м2).
На экосистему б. Алексеева оказывает влияние ртутное загрязнение, выявленное в 1986 г., тогда концентрации ртути в тканях моллюсков значительно превышали фоновые [6]. В 1990 и 1991 гг. максимальные концентрации ртути обнаружены у модиолуса, наименьшие – у приморского гребешка, однако у последнего были разрушены раковины и снижен прирост. Морфологические аномалии моллюсков характерны для районов с высокими концентрациями ртути в донных осадках [6]. В 2003 и 2004 гг. изучено распределение ртути в поверхностном слое донных осадков (см. рис. 1 Б, В). Обнаружены аномалии в северо-западной и восточной частях бухты. Минимальная концентрация ртути составила 50 нг/г, что в два раза выше геохимического фона зал. Петра Великого [15]. Концентрация ртути в аномальных зонах превышала 800 нг/г, достигая 2500 нг/г. Уровень концентрации ртути в донных осадках наиболее загрязненных акваторий зал. Петра Великого (б. Золотой Рог, устье Второй Речки) составляет 1500-3000 нг/г [16, 17]. В 2009 г. в б. Алексеева отобрана колонка донных осадков (М09-6), в верхней части которой обнаружено увеличение концентрации ртути в два раза по сравнению с нижней. Возможно, обогащение ртутью верхней части колонки связано с антропогенным влиянием. В тоже время в нижней части уровень концентрации ртути был 50 нг/г, что выше фона залива в два раза [16].
Ихтиопланктон б. Алексеева представлен 27 видами рыб из 15 семейств (табл. 2), из которых наибольшее видовое разнообразие у семейств Pleuronectidae и Stichaeidae (по 5 видов). Промысловое значение имеют сельдь C. pallasii , навага Eleginus gracilis , камбалы (Pleu-ronectidae), малоротая корюшка H. japonicus , зубастая корюшка Osmerus mordax и анчоус Engraulis japonicus . Встречены также молодь других видов рыб – постоянных обитателей прибрежного мелководья. Икра и личинки всех видов были подразделены на пространственноэкологические группы, характеризующиеся разной стратегией нереста [17]. Критериями объединения видов в группы служила приуроченность их к водам определенной солености в период нереста [18] и использование определенного нерестового субстрата [19].
Группа I включает солоноватые виды, нерест и жизненный цикл которых проходит на прибрежном мелководье, в пределах литоральной и сублиторальной зоны в условиях изменяющейся солености. Эта группа в ихтио-планктоне была представлена 8 видами ( Liop-setta pinnifasciata, Pholidapus dybowskii, Opist-hocentrus ocellatus, O. zonope, Acanthogobius flavimanus, Chaenogobius heptacanthus, Pallas-ina barbata, Pseudopleuronectes obscurus ), или 30% от общего числа видов.
Группа II объединяет виды, обитающие в морских водах, которые для нереста заходят в реки, устья, приустьевые участки рек и прибрежное мелководье. Этой категории встречено 10 видов (37%). В эту группу входят проходные ( O. mordax ), полупроходные ( H. ja-ponicus , Gasterosteus aculeatus ) и морские ( C. pallasii, E. gracilis , Pseudopleuronectes yoko-hamae , Syngnathus acusimilis и 3 вида из семейства Hexagrammidae) виды, выметывающие пелагическую, демерсальную (литофиты и псаммофилы) или прикрепленную к морским травам и водорослям (фитофилы) икру. Некоторые из них проявляют заботу о потомстве (напр. трехиглая колюшка, формирующая нерестовые гнезда, охраняющие кладки терпуги, а также живородящая рыба-игла).
Группа III включает виды, нерест которых проходит в глубоководных районах заливов, в водах с морской соленостью, а на прибрежное мелководье икра и личинки заносятся течениями. В б. Алексеева отмечены икра и личинки 9 видов (33%) этой группы. Они подразделены на две подгруппы. К первой относятся виды рыб, откладывающие демерсальную икру (Neozoarces steindachneri, Stichaeus nozavae), личинки которых в ихтиопланктоне встречались эпизодически. Во вторую подгруппу включены виды, выметывающие пелагическую икру, такие как дальний мигрант анчоус, и рыбы, совершающие сезонные миграции (Limanda aspera, Hippoglossoides herzen-steini, Hypoptychus dybowskii). Основной нерест рыб этой группы проходит на глубине 15-20 м, однако их икра встречается и в прибрежной зоне.
Наибольшее видовое разнообразие ихти-опланктона отмечено в апреле-мае. Летом преобладали икра и личинки пелагофильных видов, представителей морской и полупроходной экологических групп, основной нерест которых протекает в июне-июле. Пелагическая икра рыб, нерестящихся летом в период наибольшего распреснения вод, имеют меньший диаметр, чем у весенненерестящихся видов, их икра снабжена дополнительными жировыми каплями [18], что позволяете ей удерживаться в поверхностном слое воды [20]. К августу практически все виды рыб завершали нерест. Только в конце сентября и начале октября появлялись личинки рыб сем. Hexagrammidae. С начала июня до начала сентября в планктоне встречались личинки асцидий, так как в этот период происходит нерест Halocynthia auran-thium . В июне 2007 г. плотность личинок Halocynthia auranthium составила 0,35 экз./м3. Пик нереста асцидий был в июле, и плотность личинок находилась в пределах 1,0-1,2 экз./м3, а в августе снизилась до 0,45 экз./м3. В начале сентября личинки асцидий встречались единично, что связано с завершением нереста. Личинки Halocynthia auranthium имели длину 2,53,5, в среднем 3,0 мм. В 2008 г., плотность личинок Halocynthia составляла в июне – 1,1 экз./м3, в июле увеличилась до 2,0 экз./м3, в августе снижалась до 1,05 экз./м3. Длина личинок составляла 2,0-3,7 мм, в среднем 2,5 мм. Таким образом, нерест асцидий происходил в летние месяцы и его пик был в июле, что подтверждает данные из литературных источников [21, 22].
В ихтиопланктоне б. Алексеева очень часто присутствуют мертвые или с аномалиями икринки рыб. Так, количество и доля икры анчоуса с нормально развивающимися эмбрионами, возрастали по направлению от прибрежного мелководья к более открытым районам бухты, что также связано с распространением распресненных вод. Высокий процент нормально развивающейся икры отмечался в поверхностных водах с соленостью более
32‰. В районах, где соленость была менее 20‰, доминировали икринки с деформированными эмбрионами. Нерест анчоуса протекал при температуре воды от 9 до 24°С. В нерестовый сезон выживаемость икры возрастала по мере повышения температуры воды. Наибольшая смертность икры отмечена при переходе с I на II этап развития. Это объясняется тем, что при развитии эмбрион наиболее чувствителен к воздействию внешних факторов на начальных этапах развития. Гибель икры рыб связана в основном с факторами ветрового волнения, изменениями температуры и солености воды, а также с содержанием ртути в поверхностном слое донных осадков. Ртуть попадает в воды б. Алексеева из природных источников. Через бухту проходит разломная зона, явным признаком которой является абразионный уступ на м. Низкий, сложенный глиной. Вдоль этого уступа концентрация ртути в воздухе превышает фоновый уровень для о. Попова в 30 раз [23].
Выводы: в макробентосе в б. Алексеева обнаружено 128 видов животных и 24 вида макрофитов. На скалистых и каменистых грунтах большая биомасса складывается за счет мидии Грея. На мягких илистых грунтах преобладают многощетинковые черви. На песчано-галечном грунте в поясе зостеры наблюдалось наибольшее видовое разнообразие макробентоса. В ихтиопланктоне отмечены личинки 27 видов рыб из 15 семейств. Наибольшее видовое разнообразие ихтиопланктона отмечено в апреле и мае. Численность ихтиопланктона зависит от многих антропогенных и абиотических факторов. Высокие концентрации ртути в донных осадках бухты (50 нг/г) обусловлены как антропогенными, так и природными источниками.
Работа выполнена при финансовой поддержке грантов ДВО РАН 11-III-В-07-143, 11-III-В-07-133, 11-III-В-07-007, 11-III-B-07-047, 11-III-B-07-006.
Список литературы Экологический мониторинг морской биоты бухты Алексеева (залив Петра Великого)
- Волова, Г.Н. Бентос бухты Алексеева (залив Петра Великого)/Г.Н. Волова, Т.И. Жакина, Л.В. Микулич//Прибрежный планктон и бентос северной части Японского моря. -Владивосток: ДВНЦ АН СССР. 1980. С. 32-56.
- Гомелюк, В.Е. Ихтиофауна бухты Алексеева острова Попова (залив Петра Великого, Японское море) и влияние на нее культивирования приморского гребешка/В.Е. Гомелюк, С.Л. Кондрашев, А.В. Левин//Биология шельфовых и проходных рыб. -Владивосток: ДВО АН СССР. 1990. С. 5-8.
- Завертанова, Ю.В. Ихтиопланктон бухты Алексеева (зал. Петра Великого, Японское море) в 2006-2007 гг.//Вопр. рыб. 2010. Т. 11, № 1 (41). С. 38-47.
- Завертанова, Ю.В. Особенности формирования видового состава ихтиопланктона и его взаимосвязь с гидрологическим режимом бухты Алексеева 2006-2007 гг.//Исследования Мирового океана: мат-лы междунар. науч. конф. 26-30 мая 2008 г. -Владивосток: Дальрыбвтуз, 2008. С. 38-41.
- Федорец, Ю.В. Влияние абиотических факторов на выживание икры из северо-восточной части Амурского залива//Проблемы экологии морского шельфа: мат. всерос. науч. молод. конф.-шк. Владивосток 16-22 сент. 2010 г. -Владивосток: Изд-во ДФУ, 2010. С. 175-178.
- Лучшева, Л.Н. Содержание ртути в компонентах экосистемы бухты Алексеева (залив Петра Великого Японского моря)//Биол. моря. 1995. Т. 21. № 6. С. 412-415.
- Ушаков, П.В. Многощетинковые черви дальневосточных морей СССР. -Л.: Зоологический институт, 1955. 445 с.
- Перестенко, Л.П. Красные водоросли дальневосточных морей России. -СПб.: Ольга, 1994. 331 с.
- Виноградова, К.Л. Определитель водорослей дальневосточных морей СССР. Зеленые водоросли. -Л.: Наука, 1979. 147 с.
- Адрианов, А.В. Таксономический каталог биоты залива Петра Великого Японского моря/А.В. Адрианов, О.Г. Кусакин. -Владивосток: Дальнаука, 1998. 350 с.
- Парсонс, Т.Р. Биологическая океанография/Т.Р. Парсонс, М. Такахаши, Б. Харгрейв. -М.: Легкая и пищевая промышленность, 1982. 432 с.
- Расс, Т.С. Методическое руководство по сбору икринок, личинок и мальков рыб/Т.С. Расс, И.И. Казанова. -М.: Пищевая промышленность, 1966. 35 с.
- Перцева-Остроумова, Т.А. Определительные таблицы пелагической икры рыб залива Петра Великого//Изв. ТИНРО. 1955. Т. 43. С. 43-68.
- Okiyama, M. (ed.). Atlas of the early stage fishes in Japan. Tokyo: Tokai Univ. Press. 1988. 1154 p.
- Аксентов, К.И. Антропогенное загрязнение ртутью донных осадков зал. Петра Великого/К.И. Аксентов, А.С. Астахов//Вест. ДВО РАН. 2009. № 4. С. 115-121.
- Поляков, Д.М. Содержание ртути в компонентах экосистемы залива Петра Великого/Д.М. Поляков, М. Вирцавс, С.И. Козлова и др.//Водные ресурсы. 1991. № 5. С. 101-108.
- Давыдова, С.В. Видовой состав ихтиопланктона бухт залива Петра Великого и его сезонная динамика//Изв. ТИНРО. 1998. Т. 123. С. 105-121.
- Шубников, Д.А. Прибрежно-эстуарное сообщество рыб северной части Индийского океана и экологические связи его компонентов//Вопросы ихтиологии. 1977. Вып. 5. С. 824-830.
- Крыжановский, С.Г. Эколого-морфологические закономерности развития карповых, вьюновых и сомовых рыб//Тр. Ин-та морфол. животных АН СССР. 1949. Вып. 1. С. 237-329.
- Подорванова, А.Ф. Основные черты гидрохимии залива Петра Великого (Японское море)/А.Ф. Подорванова, Т.С. Ивашинникова, В.С. Петренко, Л.С. Хомичук. -Владивосток: ДВО АН СССР, 1989. 201 с.
- Саватеева, Л.Ю. Дальневосточные голотурии и асцидии как ценное пищевое сырье/Л.Ю. Саватеева, М.Г. Маслова, В.Л. Володарская. -Владивосток: Изд-во Дальневост. ун-та, 1983. 184 с.
- Косьяненко, А.А. Экология асцидий рода Halocynthia в б. Алексеева//Современное состояние водных биоресурсов: Мат-лы науч. конф., посв. 70-летию С.М. Коновалова. -Владивосток: ТИНРО-Центр, 2008. С. 566-567.
- Колесник, О.Н. Геоэкологический мониторинг содержания ртути в компонентах морских и прибрежный экосистем Южного Приморья (на примере о. Попова)/О.Н. Колесник, А.Н. Колесник, К.И. Аксентов//Геология морей и океанов: Мат-лы XVII междун. науч. конф. (школы) по морской геологии 12-16 нояб. 2007 г. Москва. -М.: ГЕОС, 2007. С. 237-239.


