Экология водорослей-макрофитов Карельской акватории Белого моря как объектов марикультуры
Автор: Немова Нина Николаевна, Шкляревич Галина Андреевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 9 (103), 2009 года.
Бесплатный доступ
Водоросли-макрофиты, акватория белого моря, марикультура, температура, соленость, адаптации, биохимический состав
Короткий адрес: https://sciup.org/14749637
IDR: 14749637
Текст статьи Экология водорослей-макрофитов Карельской акватории Белого моря как объектов марикультуры
Морская среда – важнейший источник биологических ресурсов, поэтому знать явления и процессы, протекающие в море, а также использовать природные богатства во благо человека – задача современных биологов, экологов, биохимиков, альгологов. В настоящее время в связи с актуальностью проблем создания технологических приполярных экосистем появилась необходимость сводного анализа накопленных знаний в этой области. Обзору опубликованных работ по экологии и биологии водорослей-макрофитов посвящена наша работа.
СПЕЦИФИКА УСЛОВИЙ ОБИТАНИЯ ВОДОРОСЛЕЙ В КАРЕЛЬСКОЙ ЧАСТИ АКВАТОРИИ БЕЛОГО МОРЯ
Карелии принадлежат самые продуктивные прибрежные мелководные части Онежского, Кандалакшского заливов и бассейна Белого моря (рис. 1). Соседнее Баренцево море является одним из богатейших биологическими ресурсами регионов Мирового океана. Сотни судов разных стран
ведут здесь промысел рыб и беспозвоночных. Вдоль побережья расположены марикультурные хозяйства. Баренцевоморские морепродукты входят в рацион питания значительной части населения Европы и азиатских районов России. Биологическая продуктивность Баренцева моря в большой степени зависит от притока атлантических вод, который значительно смягчает суровый гидрологический режим высокоширотных вод.
Аналогично биологическая продуктивность Белого моря в определенной степени зависит от водообмена с Баренцевым морем (рис. 2) [19] и от гидрологического режима акватории.
КРАТКАЯ ГИДРОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА КАРЕЛЬСКОЙ АКВАТОРИИ БЕЛОГО МОРЯ.
ТЕМПЕРАТУРА
В весенне-летний период карельская акватория характеризуется резкой вертикальной стратификацией водных масс и высокоамплитудными сезонными колебаниями температуры воды. Летний прогрев распространяется до глубины около 50 м. В районе Онежского залива среднегодовая температура поверхностного слоя воды составляет 3,2 °С, в бассейне +3,5 °С, а в Кандалакшском заливе +4,0 °С [18]. Зимой температура поверхностного слоя воды в бассейне колеблется в пределах от -1,7 до -1,2 °С, а в заливах она меняется от -0,7 до -0,5 °С. Весной температура воды возрастает в среднем на 4 °С в бассейне и на 6 °С – в заливах. Летом поверхностные воды карельской акватории хорошо прогреваются, и в августе их температура составляет в среднем 14–16 °С. В октябре происходит быстрое охлаждение вод прибрежной зоны, и их температура становится ниже таковой открытых вод моря. Средние температуры воды по всем месяцам года колеб- лются в бассейне от -0,4 до 10,6 °С, в Онежском заливе от -1,7 до 11,9 °С, в Кандалакшском заливе от -0,4 до 14,4 °С [11].
СОЛЕНОСТЬ
Соленость воды в карельской акватории так же, как и во всем Белом море, проявляет сезонные и межгодовые флюктуации в зависимости от меняющегося в объеме пресного материкового стока. Пределы внутри сезонных колебаний солености прибрежных поверхностных морских слоев вод достигают самых крайних пределов – от 0 до 28 ‰. Характеристика вертикального распределения солености в бассейне, Кандалакшском и Онежском заливах показана на рис. 3 [19].
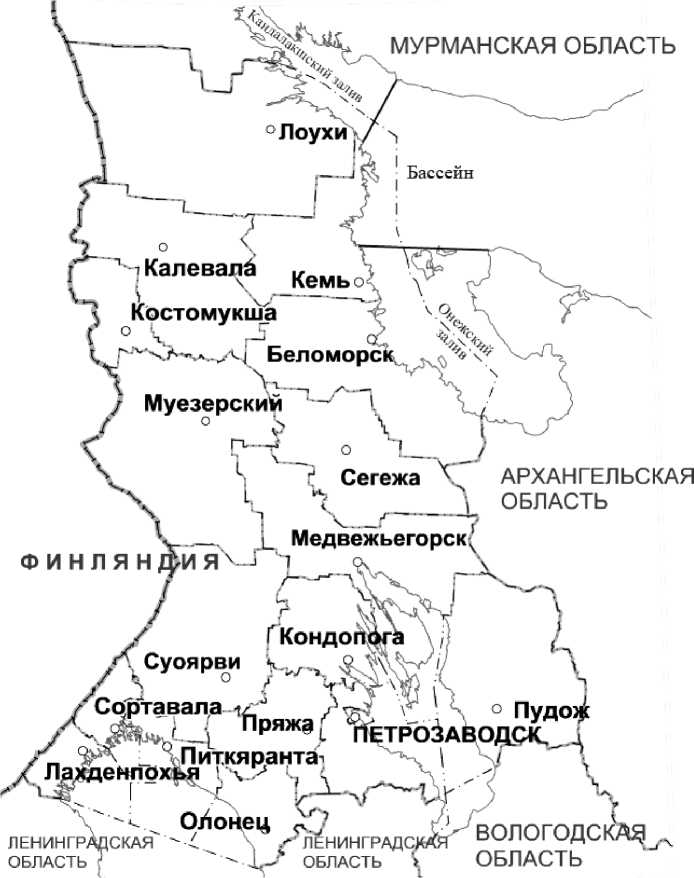
Рис. 1. Карта Карелии с обозначением беломорской акватории в Кандалакшском заливе, бассейне и в Онежском заливе. Ресурсы Интернет (с изменениями) [14].
Пунктирно-точечной линией обозначена граница карельской акватории в Белом море, сплошными линиями – границы заливов.
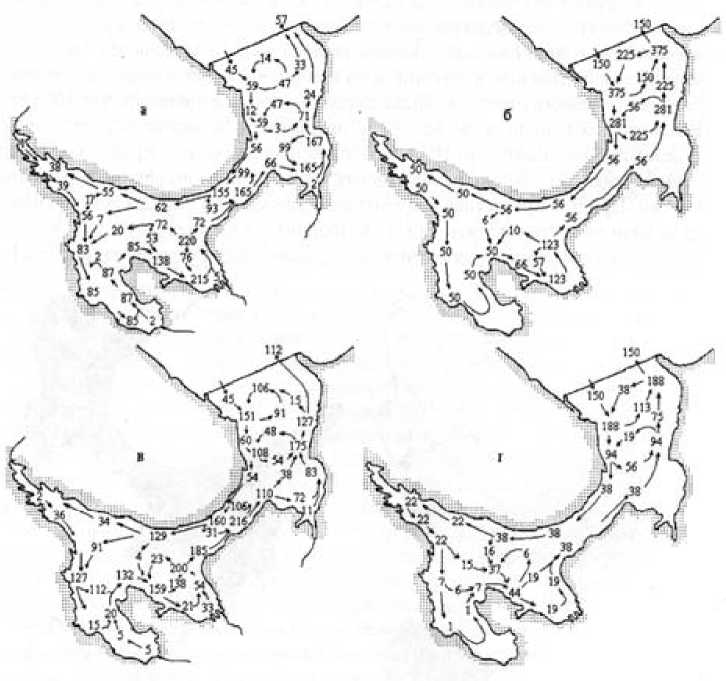
Рис. 2. Расчетный водообмен (км/мес.) между районами Белого моря в период минимального (а, б) и максимального (в, г) речного стока: а, в - верхний слой; б, г - нижний слой [19]
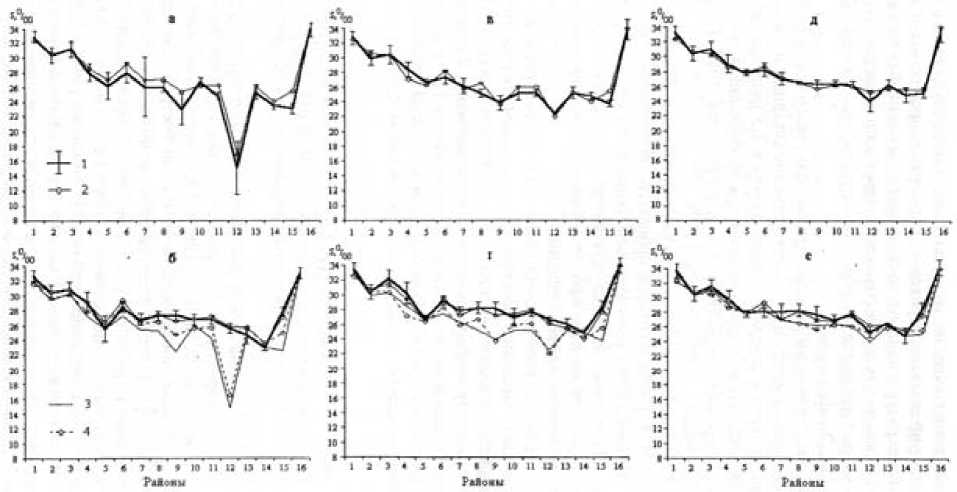
Рис. 3. Распределение солености по районам Белого моря весной (а, б), летом (в, г), осенью (д, е); а, в, д - верхний слой; б, г, е - нижний слой:
1 - диапазоны данных наблюдений, рассчитанные на основе картосхем [19];
2 - расчетные данные;
3 - данные наблюдений в верхнем слое;
4 - расчетные значения в верхнем слое.
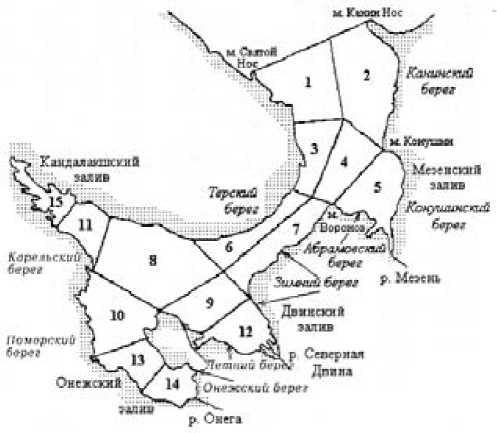
Рис. 4. Районирование Белого моря при исследовании распределения солености [19]
льдом [16] и поверх него – снегом. В районах южной части моря степень освещенности выше, ее наибольшие величины наблюдаются в карельской акватории, особенно в Онежском заливе. Наибольшие значения освещенности приходятся на июнь, наименьшие – на декабрь [29], [12], [2].
ФОТОПЕРИОД
В карельской части беломорской акватории полярной ночи нет и солнце появляется здесь над горизонтом ежедневно в течение года. В северной части карельской беломорской акватории фотопериод в самый короткий день в году (в декабре) составляет около 6 часов, в самый длинный день (в июне) – 24 часа.
Среднемноголетние ежемесячные величины освещенности, фотопериода и прозрачности водной среды карельской акватории Белого моря приводятся в табл. 1.
БИОГЕННЫЕ ЭЛЕМЕНТЫ
Районирование Белого моря при исследовании распределения солености приводится на рис. 4 [19].
ОСВЕЩЕННОСТЬ
В высоких широтах севера Карелии высота солнцестояния мала. Преобладает облачная погода. Поэтому освещенность здесь рассеянная. Условия освещенности для водорослей особенно ухудшаются в осенне-зимне-весенний период, когда Белое море на 5–6 месяцев в году покрывается
Обладая способностью синтезировать органическое вещество из углерода, водорода и кислорода, автотрофные организмы не могут обходиться без биогенов, наиважнейшими из которых являются азотистые соединения, фосфаты, силикаты и микроэлементы: железо, магний, марганец, медь и другие. В водах Белого моря биогенные элементы представлены главным образом в виде органических соединений (табл. 2). Концентрации минеральных веществ, содержащих эти элементы, меньше, и они претерпевают сезонные изменения [32].
Таблица 1
Среднемноголетние ежемесячные величины освещенности L, кал/см2, фотопериода F, доля светлого времени и прозрачности водной среды DS, м карельской акватории Белого моря [18]
Параметр Месяцы года
|
I |
II |
III |
IV |
V Канда |
VI лакшский |
VII залив |
VIII |
IX |
X |
XI |
XII |
|
|
L |
1,6 |
70 |
156 |
267 |
387 |
474 |
455 |
357 |
235 |
127 |
50 |
1,6 |
|
F |
0,123 |
0,329 |
0,467 |
0,617 |
0,815 |
0,913 |
0,898 |
0,74 |
0,563 |
0,411 |
0,234 |
0,12 |
|
DS |
7 |
7 |
7 |
5 |
3 Оне |
3 жский за |
3,7 лив |
4,4 |
5,1 |
5,8 |
6,2 |
7 |
|
L |
3,1 |
90 |
182 |
295 |
420 |
487 |
470 |
380 |
260 |
150 |
60 |
3 |
|
F |
0,167 |
0,354 |
0,479 |
0,604 |
0,771 |
0,875 |
0,854 |
0,708 |
0,563 |
0,417 |
0,271 |
0,167 |
|
DS |
8 |
8 |
8 |
5,5 |
3 |
3 бассейн |
4,5 |
5,2 |
5,9 |
6,6 |
7,3 |
8 |
|
L |
2,6 |
83,3 |
173,3 |
285,8 |
409,2 |
482,8 |
465 |
369,2 |
251,7 |
142,5 |
56,7 |
2,6 |
|
F |
0,153 |
0,346 |
0,475 |
0,608 |
0,786 |
0,888 |
0,869 |
0,719 |
0,563 |
0,415 |
0,25 |
0,151 |
|
DS |
8 |
8 |
8 |
6,5 |
5 |
5 |
5,5 |
6 |
6,5 |
7 |
7,5 |
8 |
Таблица 2
Средние наблюдаемые сезонные концентрации основных биогенных элементов в поверхностных слоях вод карельской акватории Белого моря [18]
|
Район |
Кандалакшский залив |
Онежский залив |
бассейн |
||||||
|
Сезон |
весна |
лето |
осень |
весна |
лето |
осень |
весна |
лето |
осень |
|
Нитриты, мкг N/л |
0,7 |
2,1–2,5 |
1,8–2,0 |
1,7–1,9 |
3,0–3,2 |
4,3 |
1,7–2,2 |
1,4–1,8 |
2,6 |
|
Нитраты, мкг N/л |
28–35 |
16–18 |
30–33 |
59–67 |
19–28 |
30–35 |
11–31 |
29–32 |
37–47 |
|
Фосфаты, мкг P/л |
5–11 |
10–13 |
13–14 |
12–14 |
16–17 |
18–19 |
13–14 |
11–16 |
12–13 |
|
Силикаты, мкг Si/л |
264–296 |
257–262 |
304–310 |
373–422 |
299–335 |
321–341 |
308–446 |
288–347 |
294–301 |
НАКОПЛЕНИЕ КСЕНОБИОТИКОВ
В ПРОМЫСЛОВЫХ МАКРОФИТАХ БЕЛОГО МОРЯ
Как видно из табл. 2, в поверхностных слоях воды, омывающей мелководья с населяющими их водорослями-макрофитами, содержится достаточное количество биогенных элементов для роста и развития этих растений, хотя в некоторые непродолжительные периоды (во время весенней вспышки численности фитопланктона) азот и особенно фосфор могут быть лимитирующими факторами для водорослей. Но если такие факторы возникают время от времени в карельской акватории, то их влияние краткосрочно, так как биогенные элементы способны очень быстро регенерироваться. Все микроэлементы, необходимые водорослям-макрофитам, всегда содержатся в водах Белого моря в достаточном количестве.
Следует отметить, что часть Кандалакшского, Онежского заливов и бассейна с обширной мелководной полосой вдоль карельского берега являются местообитанием многочисленных водоплавающих и прибрежных птиц. Некоторые из них, например, такая крупная морская утка, как гага So-materia mollissima , являются здесь массовыми во время весенне-летнего периода. Все птицы в совокупности вносят существенный экскретирующий вклад и тем самым оказывают положительное биотическое влияние на стабильность благоприятного для водорослей режима биогенных элементов в мелководной акватории [3].
ЗАГРЯЗНЕНИЕ ВОДНОЙ СРЕДЫ БЕЛОГО МОРЯ
Наиболее подвержены антропогенному воздействию Двинский и Кандалакшский заливы. В центральной части акватории концентрация нефтяных углеводородов (НУ) в воде варьирует от 0 до 0,08 мг/л [19]. В Кандалакшском заливе среднегодовая концентрация НУ удерживается в пределах 0,04, а максимальное их содержание может достигать 0,11 мг/л [19]. По данным, полученным научно-исследовательским судном «Профессор Штокман» в августе 2003 года, содержание алифатических углеводородов в водах Белого моря за 10 лет практически не изменилось и сопоставимо с таковыми других шельфовых районов Мирового океана; в Кандалакшском заливе оно в среднем составило 20 мкг/л, в водах бассейна – 12 мкг/л [26]. Уровень содержания тяжелых металлов в воде Кандалакшского залива варьирует от 0,001 до 0,003 мг/л [17].
По данным Н. Ф. Плотицыной [27], полученным в августе 1998 года в Онежском заливе (в районе Соловецких островов), содержание бенз(а)пирена в макрофитах колебалось от 1,8 до 4,1 нг/г сухой массы. Автор допускает, что уровни содержания полиароматических углеводородов (ПАУ) в промысловых водорослях можно принять за региональный фон. Н. Ф. Плотицына отмечает низкий уровень загрязнения промысловых водорослей Белого моря хлорированными углеводородами, который также можно принять за региональный фон. Автор делает вывод, что поскольку в воде Белого моря отмечаются низкие уровни концентрации тяжелых металлов, характерные для незагрязненных морских акваторий, их содержание в промысловых водорослях можно принять как фоновое [27].
РАДИОНУКЛИДНАЯ СИТУАЦИЯ В АКВАТОРИИ БЕЛОГО МОРЯ
Как утверждает Д. Г. Матишов, «экосистема прибрежья является масштабным маргинальным фильтром и аккумулятором антропогенных радионуклидов… Мощную фильтрующую функцию выполняет пояс макрофитов на литорали и в сублиторали» [24; 101]. Но в настоящее время антропогенное радиоактивное загрязнение экосистемы Белого моря заметно уменьшилось и признаков, указывающих на существование действующих локальных источников радиоактивного загрязнения, не выявлено [18].
В целом проведенный анализ данных о состоянии экосистем Белого моря и антропогенного воздействия на них позволяет сделать вывод о том, что «современное состояние морских экосистем (в том числе и беломорских карельских) близко к фоновому, соответствующему климатической норме и относительно низкому уровню антропогенных нагрузок» [19; 63].
ПРОМЫСЛОВЫЕ РЕСУРСЫ ВОДОРОСЛЕЙ В КАРЕЛЬСКОЙ АКВАТОРИИ БЕЛОГО МОРЯ
Группу промысловых водорослей составляют массовые по численности виды макрофитов, определяющие фитоценотический облик мелковод- ной карельской части акватории Белого моря [2]. Среди них преобладают бурые водоросли: фукоиды – Fucus vesiculosus (фукус пузырчатый), Fucus serratus (фукус зубчатый или пильчатый), Fucus distichus (фукус двусторонний), Ascophyllum nodosum (аскофиллум узловатый); ламинарии – Laminaria saccharina (ламинария сахаристая), Laminaria digitata (ламинария пальчаторассеченная). Из красных водорослей заготавливают только Ahnfeltia plicata (анфельцию путаную).
Массовые макрофиты Белого моря в сравнении с баренцевоморскими были исследованы В. В. Кузнецовым в 1934–1940 и 1946–1953 годах. Приводим данные по промысловым видам беломорских водорослей в основном по результатам исследований этого автора [20].
Fucus vesiculosus (фукус пузырчатый)
Слоевище в виде крупных кустов до 100 см высоты, с плоскими ветвями, со срединной жилкой, с ровными или слегка волнистыми краями, дихотомически и неправильно разветвленными, обычно с парными пузырями; прикрепляется к субстрату подошвой. Продолжительность жизни – до 11 лет. Плотность поселений может достигать до 10 000 растений на 1 м2. Бореальноарктический вид распространен в Атлантическом и Северном Ледовитом океанах.
Максимальная ширина «ветвей» слоевища (31 мм) достигает большей величины, чем в Баренцевом море (21 мм). Наибольший годовой прирост длины таллома Fucus vesiculosus в Белом море (213 мм) значительно больше, чем в Баренцевом море (184 мм). Максимальная биомасса этого фукуса колеблется в пределах 7–26 кг/м2 в прибрежных районах бассейна Белого моря и Кандалакшского залива. А. И. Бабков и А. Н. Голиков приводят для опресненных затишных прибрежных участков максимальную биомассу Fucus vesiculo-sus – 8 кг/м2 [1]. Вес генеративных частей слоевища, ежегодно сбрасываемых после периода размножения, достигает 61,3 % от общего веса растений, причем в большинстве случаев относительный вес генеративных частей у беломорских фукусов этого вида меньше, чем у баренцевомор-ских, что В. В. Кузнецов объясняет бóльшими общими размерами беломорских Fucus vesiculosus. Все материалы, приведенные этим автором [20], свидетельствуют о крайней эврибионтности фукуса этого вида, способного жить даже в суровых условиях среднего, а иногда и верхнего горизонтов литорали до глубины 20 м в отдельных локальных участках с чистой (прозрачной) водой. В сублиторали встречаемость Fucus vesiculosus до глубины 10 м – 30 %, до глубины от 11 до 20 м – 2,5 % [31]. Исследования Г. М. Воскобойникова с соавторами и М. В. Макарова показали, что и в Баренцевом море фукус пузырчатый является видом, приспособленным к существованию в экстремальных условиях, приводящих к элиминации других видов макроводорослей [5], [7], [10], [22], [23].
Ascophyllum nodosum (аскофиллум узловатый)
По широте своего распространения на литорали в Белом море этот фукоид может быть поставлен рядом с Fucus vesiculosus. Он в одинаковой мере распространен как в затишных, так и в прибойных участках, и даже там, где прибой достигает максимальной силы, можно найти отдельные низкорослые кусты этой водоросли. A. nodosum, как и F. vesiculosus, выдерживает очень широкие колебания абиотических факторов внешней среды. Поэтому A. nodosum встречается на участках, совершенно противоположных по условиям жизни в них: на скалах в верхнем отделе литорали кутовых участков губ, на скалах и камнях в затишных и сильно опресняемых участках, на скалах и камнях открытых берегов и в сублиторали Белого моря. Осенью по всей длине слоевища литоральных растений закладываются мелкие грушевидные зачатки ре-цептакул, которые в течение зимы постепенно увеличиваются в размерах и к началу лета достигают зрелости. Вскоре после созревания половые продукты выходят в воду, и в течение довольно короткого временного периода рецепта-кулы сбрасываются одновременно на больших пространствах прибрежных мелководий. В июле аскофиллум уже обычно полностью освобождается от старых рецептакул и начинает образование новых. Органы плодоношения составляют значительную часть общей массы: на 1 кг водорослей образуется от 3 до 8,5 тыс. рецептакул массой от 110 до 530 г. При сбрасывании их ас-кофиллум теряет 40–45 % от общей биомассы водоросли в период зрелого плодоношения [20]. Это явление характерно только для A. nodosum , у F. vesiculosus так же, как у Fucus serratus и Fucus distichus , рецептакулы сбрасываются в единичных случаях, чаще они разрушаются (деструк-тируются) после размножения, оставаясь прикрепленными к несущим их частям талломов.
Максимальная длина беломорского аскофил-лума – 153 см, наибольшая продолжительность жизни – около 15 лет, максимальная биомасса – 42,8 кг/м2 [20].
У A. nodosum и F. vesiculosus выявлены резкие межгодовые флюктуации биомассы. 12летние исследования этого процесса на стационарном участке в нижнем горизонте островной литорали прибрежной части карельского берега Белого моря показали наличие резких колебаний их биомассы от 2,7 до 14,7 кг/м2 у первого и от 0,2 до 6,3 кг/м2 у второго. В среднем биомасса A. nodosum составила 9271 ± 299 г/м2, F. vesicu-losus – 3117 ± 158 г/м2 [30].
Fucus serratus
(фукус зубчатый или пильчатый)
На мелководьях вдоль карельского и поморского берегов Белого моря на литорали почти не встречается. Чаще он поселяется ниже нуля глубин – в сублиторали. Здесь этот фукус образует сплошные заросли до глубины 3–4 м. Наибольшая продолжительность жизни фукуса зубчатого в Белом море – около 11 лет. В северной части Онежского залива сублиторальные водоросли этого вида имеют длину таллома до 120 см. Годовой прирост длины слоевища составляет в бассейне до 162 мм, в Онежском заливе – 137 мм [20]. Особенностью беломорских F. serratus является то, что на слоевищах летних растений одновременно имеется большое количество как разрушающихся, так и развивающихся рецептакул. Деструктивные процессы в рецептакулах идут настолько медленно, что они в массовом количестве сохраняются на слоевище до второй половины будущего лета на закрытых от штормовых волновых потоков мелководьях. В. В. Кузнецов высказал предположение, что в основе этого явления лежит замедленное созревание половых продуктов и удлиненный срок деятельности ска-фидий [20]. При просмотре в июле разрушающихся рецептакул, образовавшихся летом предшествующего года, в их скафидиях обнаружено большое количество еще не вышедших в воду оогоний и антеридий. Запасы фукоидов в близлежащей к карельской акватории – в районе Соловецких островов – составляют 32,7 тыс. т [21]. Деление на спорофит и гаметофит у фукусовых отсутствует.
Fucus distichus
(фукус двусторонний)
Фукус этого вида встречается в Белом море довольно редко, и сведения о нем в литературе довольно скудны. По нашему мнению, вид Fucus distichus в карельской акватории нужно исключить из числа промысловых.
ВЛИЯНИЕ КСЕНОБИОТИКОВ (НЕФТЕУГЛЕВОДОРОДОВ) НА БИОХИМИЧЕСКИЙ СОСТАВ ФУКОИДОВ
По карельской акватории (частично), а также вблизи нее проходит фарватер нефтеналивных судов, поэтому существует потенциальная опасность углеводородного загрязнения прибрежной мелководной зоны. В связи с этим следует рассмотреть результаты сравнительного анализа состояния фукуса этого вида, произрастающего в загрязненном нефтеуглеводородами и чистом местообитаниях.
Г. М. Воскобойников [6] исследовал состояние F. vesiculosus в постоянно загрязняемом нефтепродуктами местообитании – на литорали Мурманского морского порта (далее – загрязняемое местообитание (ЗМ)) и в чистом районе (ЧМ). В ЗМ выявлено уменьшение размера, веса и продолжительности жизни, а также снижение скорости роста. Присутствие на загрязненной литорали преимущественно фукоидов может свидетельствовать о специфической устойчивости данных видов водорослей к нефтяному загрязнению. Полученные данные совпадают с результатами экспериментов по влиянию нефти и нефтепродуктов на рост водорослей [28].
Количественное определение отдельных компонентов, проведенное для водорослей из ЧМ, показало сравнительно низкое содержание общих липидов, среднее содержание полярных низкомолекулярных веществ (существенная часть которых представлена маннитом), достаточно высокое содержание альгината и более высокое, чем в ламинариевых водорослях, содержание фукоидана. Содержание общих липидов в F. vesiculosus из ЗМ увеличивается в 3 раза по сравнению с ЧМ. При этом у водорослей из ЗМ наблюдается снижение содержания маннита и фукоидана (соответственно в 2 и 3 раза), хотя содержание альгината падает незначительно. Уменьшение содержания углеводов у фукусов из ЗМ, как предполагает Г. М. Воскобойников [6], обусловлено особенностью их существования в стрессовых условиях. Увеличение содержания общих липидов, по всей вероятности, связано с тем, что нефтяные углеводороды, сорбированные на поверхности талломов, попадают при анализе в эту фракцию. Для окончательного вывода необходимо более детальное исследование состава фракции общих липидов.
Г. М. Воскобойниковым совместно с сотрудником БИН РАН Е. Р. Котловой был проведен анализ гликолипидов фукусов. «Известно, что изменение состава и содержания липидов является одной из первых реакций растительных клеток на стрессовое воздействие. Как правило, наиболее лабильным компонентом оказываются гликолипиды, являющиеся структурной основой мембран хлоропластов и играющие важную роль в процессе фотосинтеза. Адаптация к химическому загрязнению на уровне липидов данного класса выражается в снижении степени ненасыщенности входящих в их состав жирных кислот, а также изменении соотношения индивидуальных липидных молекул. Обычно на фоне снижения относительного содержания моногалактозилдиацилгли-церина (МГДГ) увеличивается вклад дигалакто-зилдиацилглицерина (ДГДГ).
Неспецифической ответной реакцией фосфолипидов, входящих в состав внехлоропласт-ных мембран, является увеличение концентрации фосфатидилхолина (ФХ) и одновременно снижение содержания фосфатидилэтаноламина (ФЭ). Адаптивное значение такого перераспределения связывают с большей устойчивостью ФХ к гидролитическим процессам, наличием у него собственной антиокислительной активности и, что весьма существенно, участием в передаче стрессового сигнала. Кроме того, ФХ служит источником свободного холила, двухступенчатое окисление которого приводит к образованию гли-цинбетаина, одного из наиболее эффективных осмопротекторов, участвующего в защите растительных клеток от повреждающего действия экстремальных температур, обезвоживания и засоления».
Фосфатидилхолин является одним из основных мембранных фосфолипидов большинства видов растений и животных. Однако отдельные организмы не способны синтезировать это соединение. Среди них – некоторые представители порядка Fucales , внехлоропластные мембраны которых построены преимущественно из ФЭ и бетаинового липида диадалглицерингидрокси-метилтриметил b-аланина (ДГТА) [33], который является специфическим липидным компонентом бурых водорослей. Как и ФХ, он содержит триметил-аммонийную группу в полярной части молекулы, но, в отличие от этого фосфолипида, не имеет остатка фосфорной кислоты. К настоящему времени достаточно хорошо изучены распространение, локализация и особенности метаболизма ДГТА. Вместе с тем физиологическая роль этого липида остается невыясненной.
Несмотря на то что F. vesiculosus не способен синтезировать ФХ, его мембранные структуры отличаются особой устойчивостью к химическому загрязнению [34]. Возможно, у F. vesiculosus функционирует другой, альтернативный путь адаптации на уровне липидных молекул – в отсутствие ФХ роль стабилизатора клеточных мембран начинает выполнять его бесфосфорный аналог – ДГТА.
У F. vesiculosus из загрязненного района в 2 раза увеличивается содержание гликолипидов – МГДГ, ДГДГ и сульфохиновозил-диацилглицерина (СХДГ). При этом весьма показательно отсутствие изменений в соотношении основных галактолипидов. Значение МГДГ/ДГДГ составляло 1,6 и 1,7 для водорослей из чистого и загрязненного районов соответственно.
Содержание остальных полярных липидов также возрастало в условиях нефтяного загрязнения. Однако, в отличие от гликолипидов, увеличение индивидуальных фосфо- и бетаинового липидов оказалось неравномерным. Содержание ФЭ и фосфатидилинозита (ФИ) увеличилось в 2 раза, в то время как фосфатидилглицерина (ФГ) – в 3, а ДГТА – в 4 раза. В результате отношение основных липидов внехлоропластных мембран ДГТА/ФЭ увеличилось с 0,49 до 0,89. На основании полученных данных можно сделать вывод, что индуцированные химическим загрязнением адаптивные изменения на уровне мембранных липидов могут включать не только увеличение относительного содержания ФХ, но и других липидов.
Выявленная наибольшая устойчивость к нефтяному загрязнению фукуса пузырчатого по сравнению с другими макрофитами коррелирует с чрезвычайно высокой устойчивостью данного вида к другим альтерирующим факторам внешней среды: опреснению, отрицательной температуре, ультрафиолету. Мы не можем сейчас с определенностью говорить о причинах устойчивости F. vesiculosus к нефтяному загрязнению. Возможно, что токсикант не проникает через толстую полисахаридную оболочку и мембрану в клетки фукуса. Такую точку зрения, анализируя причину устойчивости бурых водорослей к загрязнению, высказывает ряд исследователей [25]. Она объясняет большую токсичность нефтяных компонентов с низким молекулярным весом, легче проникающим через клеточную оболочку, а также большую подверженность влиянию одинаковых доз токсиканта растений на ранних стадиях развития по сравнению со взрослыми растениями [35]. Другой причиной, объясняющей возможность переживания водорослей в условиях нефтяного загрязнения, может быть их способность включать нефтяные углеводороды в метаболизм, что было показано на некоторых микроорганизмах [13]. В пользу этой гипотезы свидетельствуют данные, полученные Г. М. Воскобойниковым [6] из нескольких точек обитания фукусов на Восточном Мурмане, а также анализ литературных данных о том, что концентрация нефтепродуктов у F. vesiculosus, произрастающих в загрязненных местах, может быть в 50 раз выше, чем у этого вида водорослей из чистого места обитания.
Laminaria saccharina (ламинария сахаристая)
В Белом и Баренцевом морях является основным объектом промысла и культивирования (рис. 5) [8].
Рис. 5. Ламинария сахаристая ( Laminaria saccharina) [8]
Заросли ламинарии в карельской акватории Белого моря в основном сосредотачиваются на глубине от 1–2 до 8–10 м. Особенно плотные и продуктивные заросли развиты в районе островов Жижгина и Анзерского, в некоторых губах и вокруг островов западной части Кандалакшского залива [20]. Эти растения имеют крупные размеры. Рост таллома L. saccharina в Белом море заканчивается в июне – июле, а развитие спороносной части начинается в сентябре и заканчивается к июню следующего года, когда завершается рост более молодой части пластинки. Зона роста у ламинарий всех видов интеркалярная и расположена на границе стволика и пластины. Стволик растет на протяжении всего жизненного цикла ламинарий, пластина, особенно в верхней ее части, сбрасывается по мере ее «старения» фрагментарно непрерывно в течение всей жизни спорофита. Период интенсивного роста слоевища продолжается с января по июль – в это время процессы роста преобладают над процессами разрушения. Существенное замедление роста вплоть до его остановки наблюдается в сентябре – декабре. Средняя масса L. saccharina в западной части Кандалакшского залива составляет 760 г (максимальная масса наиболее крупных экземпляров – 1309 г) при средней общей длине слоевища в 182 см и ширине – 152 см. В районе губы Гридиной средняя масса одного спорофита в начале лета не превышала 229 г (максимальная – 814 г) при длине слоевища в 187 см. Причем зимой здесь спорофиты более крупные, и их масса составляет в среднем 477 г при длине 298 см. Сорусы спорангиев образуют темное пятно в центральной части пластины таллома L. saccharina. Споро-ношение наступает у растений в возрасте 8– 12 месяцев, и в Белом море оно продолжается почти круглый год. Наибольшее количество спор в популяции производят однолетние растения. Длительность жизни спорофита в Белом море составляет 6–8 лет [20], жизненный цикл пластинки завершается обычно в течение 24–28 месяцев. Ламинария имеет гетероморфный жизненный цикл, включающий чередование микроскопического гаметофита (у ламинариевых гаметофиты раздельнополые) и макроскопического спорофита (рис 6). Промысловое значение имеет спорофит [9].
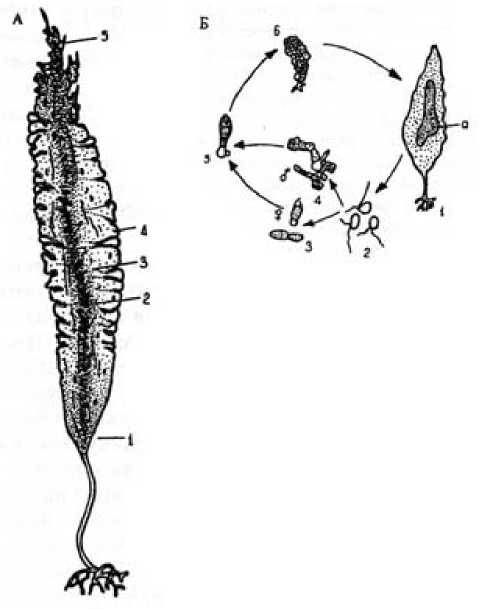
Рис. 6. Морфология (А) и жизненный цикл (Б) ламинарии сахаристой:
А: 1 – зона роста, 2 – центральная часть, 3 – бегристая часть, 4 – волан, 5 – дистальная (деградирующая) часть слоевища; Б: 1 – спорофит (спороносное пятно), 2 – зооспоры, 3 – женский гаметофит, 4 – мужской гаметофит, 5, 6 – ранний спорофит [9]
Laminaria digitata
(ламинария пальчаторассеченная)
Вдоль карельского берега ламинария этого вида сплошных зарослей и однородных «чистых» таксоценозов не образует, а растет совместно с L. saccharina, Fucus serratus и Fucus disti-chus на глубине 1–12 м. Самые крупные беломорские растения достигают массы 1–1,1 кг при общей длине слоевища до 90–95 см. Морфология и биология ламинарии пальчаторассеченной и ламинарии сахаристой сходны. Сроки развития спорофита и спороношения у L. digitata аналогичны таковым у L. saccharina . Спорофиты живут в Онежском заливе до 4–5 лет, в югозападной части Кандалакшского залива – до 10– 12 лет [20]. Запасы ламинарий в районе Соловецких островов составляют 240 тыс. т [21].
Ahnfeltia plicata (анфельция путаная)
A. plicata в Белом море широко распространена и встречается почти повсеместно, хотя по своей общей биомассе занимает весьма скромное место: ее общая биомасса здесь примерно в 50 раз меньше биомассы ламинарий. Тем не менее этот вид имеет важное промысловое значение как источник получения агар-агара. Все данные по беломорской анфельции приводятся по В. В. Кузнецову [20].
В Онежском заливе небольшие пятна зарослей A. plicata площадью 5–10 м2 располагаются преимущественно на глубине от 1–3 до 5 м. На 1 м2 таких пятен находится от 30 до 65 растений с биомассой от 860 до 1085 г. В некоторых случаях биомасса анфельции достигает 2–5 кг/м2. Рост слоевища этой водоросли начинается в апреле – мае и заканчивается в ноябре; зимой рост приостанавливается. Размер годового прироста длины неповрежденного слоевища в среднем составляет всего 2 см; поврежденные растения (обрываемые штормом или срезаемые при драгировках) дают годовой прирост в среднем 3–4,6 см. Увеличение общих размеров и веса слоевища неповрежденных растений происходит путем ежегодного правильного дихотомического ветвления, наблюдаемого в конце сезона роста. Это дает возможность правильного определения возраста каждого растения, максимальной продолжительности жизни (по числу дихотомических ветвлений – каждое ветвление соответствует одному году жизни растения) и скорости роста. Кроме этого, на поперечных срезах нижней части растения бывают хорошо видны годовые кольца, по числу которых также можно определить возраст растения, на что впервые было указано еще Джонсоном в конце XIX столетия [20]. В настоящее время считается, что продолжительность жизни беломорских растений анфель-ции составляет 6–8 лет. Возможно, что максимальная продолжительность жизни растений несколько больше, так как наиболее крупные из них имеют слоевище длиной до 40 см. Размножение анфельции изучено еще недостаточно. Известны только органы бесполого размножения – немате-ции, формирующие моноспоры. У беломорских растений нематеции образуются осенью, сохраняются в течение всей зимы, а период спороношения в северной части Онежского залива продолжается с апреля до начала июля. Образование и развитие нематеции не имеет какого-либо существенного значения для изменения биомассы размножающихся растений. В. В. Кузнецов предполагает, что годовая продукция беломорской анфельции составляет приблизительно 1/6 часть (12–17 %) ее общей биомассы [20]. Запасы анфельции в районе Соловецких островов составляют всего 0,6 тыс. т.
ЗАКЛЮЧЕНИЕ
Прогресс человечества нуждается в поисках новых ресурсов – пищевых, кормовых, лекарственных и других, и люди начинают обращать пристальное внимание на растительные ресурсы моря, до сих пор не достаточно используемые. Крупные морские водоросли-макрофиты ценны и как продукты питания, и как продуценты альгината, маннита, богаты витаминами и микроэлементами, они содержат 6–9 % белка, 17–60 % углеводов, около 4 % липидов [4]. Одной из особенностей морских гидробионтов является их способность избирательно концентрировать в организме в процессе жизнедеятельности из морской среды редкие и рассеянные химические элементы. Концентрация некоторых элементов в тканях морских водорослей превышает их содержание в окружающей среде от десятков до тысяч раз. Накопление йода, например, в бурых водорослях может составлять от 6 до 1230 мг/%. Ламинариевые водоросли – это уникальный природный энтеросорбент, способствующий выведению из организма человека тяжелых металлов, радионуклидов. По содержанию витаминов, микроэлементов ламинария может конкурировать с овощами и фруктами.
Морская растительность играет громадную роль не только в жизни морских живых существ, но прямо и косвенно – в жизни человека. Академик Л. А. Зенкевич говорил, что через несколько десятилетий заявит о своем рождении новая наука – подводная агрономия. Многие морские районы будут вотчиной наших водных хозяйств. Времена становления аквакультур наступают. Перед нашей республикой встает настоятельная необходимость организации и развития мари-культурных хозяйств и, в первую очередь, – водорослевых. Подсчитано, что 1 га водорослевого поля может дать столько белковых, углеводных и других необходимых человеку веществ, сколько его получают с 25 га пшеничного или картофельного поля [15]. За 1 день интенсивного (весеннего) фотосинтеза у фукуса синтезируется 82,5–115,5 г С орг./м2 /день, у аскофиллума – 134,3–143,5 г С орг./м2 /день, у ламинарии сахаристой – 89,7–141,9 г С орг./м2 /день [4].
Доминирующими формами прибрежной морской зоны являются фукоиды и ламинариевые. Биомасса водорослей колеблется от нескольких десятков грамм до десятков килограмм. В качестве объектов культивирования в Белом море преобладают бурые водоросли: фукоиды – Fucus vesiculo-sus (фукус пузырчатый), Fucus serratus (фукус зубчатый или пильчатый), Fucus distichus (фукус двусторонний), Ascophyllum nodosum (аскофиллум узловатый); ламинарии – Laminaria saccharina (ламинария сахаристая), Laminaria digitata (ламинария пальчаторассеченная).
Большое значение для решения проблем водорослевой марикультуры имеют исследования адаптации организмов промысловых видов к изменяющимся условиям окружающей среды на клеточном уровне, выражающейся в изменении биохимического состава и содержания углеводов и липидов, а также в альтерациях таких важных биологически активных веществ, как маннит, альгинат, фукоидан и другие.
Список литературы Экология водорослей-макрофитов Карельской акватории Белого моря как объектов марикультуры
- Бабков А. И., Голиков А. Н. Гидробиокомплексы Белого моря. Л.: Изд-во зоол. ин-та АН СССР, 1984. 104 с.
- Белое море. Биологические ресурсы и проблемы их рационального использования. Ч. I. СПб., 1995. 250 с.
- Белое море. Биологические ресурсы и проблемы их рационального использования. Ч. II. СПб., 1995. 250 с.
- Блинова Е. И., Возжинская В. Б. Морские макрофиты и растительные ресурсы океана//Основы биологической продуктивности океана и ее использование. М.: Наука. 1971. С. 137-171.
- Воскобойников Г. М. Об устойчивости фукуса пузырчатого к факторам среды//Тез. докл. междунар. конф. «Биологические основы устойчивого развития прибрежных морских экосистем» (г. Мурманск, 25-28 апреля 2001 г.). Апатиты: Изд-во КНЦ РАН, 2001. С. 53.
- Воскобойников Г. М. К вопросу об адаптации и регуляции роста морских макрофитов северных широт//Материалы Второй Всероссийской школы по морской биологии (г. Мурманск, 3-5 ноября 2003 г.). Апатиты: Изд-во КНЦ РАН, 2004. С. 15-30.
- Воскобойников Г. М., Макаров М. В. Влияние уменьшения солености на жизнеспособность и скорость роста бурых водорослей Баренцева моря//Тез. докл. 11-й науч.-практ. конф. МГТУ (г. Мурманск, 19-29 апреля 2000 г.). Мурманск: МГТУ, 2000. С. 504-505.
- Воскобойников Г. М., Макаров М. В., Пантелеева Н. Н. Биотехнологии искусственного выращивания морских гидробионтов. Проблемы и перспективы биотехнологии культивирования бурых водорослей в Баренцевом море//Современные информационные и биологические технологии в освоении ресурсов шельфовых морей/Мурм. мор. биолог. ин-т КНЦ РАН. М.: Наука, 2005. С. 256-272.
- Воскобойников Г. М., Макаров В. Н., Макаров М. В., Шошина Е. В. Биотехнологии в полярной марикультуре и использовании морских биоресурсов Арктики//Современные технологии и прогноз в полярной океанологии и биологии. Апатиты: Изд-во КНЦ РАН, 1999. С. 100-123.
- Воскобойников Г. М., Макаров М. В., Рыжик И. В., Степаньян О. В. Изменения у макрофитов Баренцева моря под влиянием нефтепродуктов//Материалы междунар. конф. «Нефть и газ арктического шельфа» (г. Мурманск, 17-19 ноября 2004 г.). Мурманск: ММБИ КНЦ РАН, 2004. С. 67-73.
- Гидрометеорология и гидрохимия морей СССР. Т. II. Белое море. Вып. 1. Гидрометеорологические условия. Л.: Гидрометеоиздат, 1991. 240 с.
- Гидрометеорология и гидрохимия морей СССР. Т. II. Белое море. Вып. 2. Гидрохимические условия и океанологические основы формирования биологической продуктивности. Л.: Гидрометеоиздат, 1991. 193 с.
- Гусев М. В., Коронелли Т. В. Физиолого-биохимические основы микробиологического окисления нефтепродуктов в море//Человек и биосфера. Вып. 7. М.: Изд-во МГУ, 1982. С. 20-31.
- Интернет-ресурсы http://maps.karelia.ru
- Казьмин В. Д. Морские сокровища. М.: Пищ. пром-сть, 1972. 135 с.
- Карпович В. Н. Кандалакшский заповедник. Мурманск: Мурманское книжное изд-во, 1984. 156 с.
- Качество морских вод по гидрохимическим показателям. Ежегодник. 2002. СПб.: Гидрометеоиздат, 2005. 128 с.
- Комплексные исследования процессов, характеристик и ресурсов российских морей Северо-Европейского бассейна (проект подпрограммы «Исследование природы Мирового океана» федеральной целевой программы «Мировой океан»). Вып. 1. Апатиты: Изд-во Кольского научного центра РАН, 2004. 557 с.
- Комплексные исследования процессов, характеристик и ресурсов российских морей Северо-Европейского бассейна (проект подпрограммы «Исследование природы Мирового океана» федеральной целевой программы «Мировой оке-ан»). Вып. 2. Апатиты: Изд-во Кольского научного центра РАН, 2007. 633 с.
- Кузнецов В. В. Белое море и биологические особенности его флоры и фауны. М.; Л., 1960. 322 с.
- Макаров В. Н. Изучение состояния запасов промысловых водорослей Соловецких островов и вопросы рационального промысла и охраны пояса макрофитов//Проблемы экологии Белого моря: Тез. докл. науч.-практ. конф. Архангельск; Соловки, 1982. С. 62-65.
- Макаров М. В. Толерантность некоторых водорослей-макрофитов к ультрафиолету-В//Экологический мониторинг морей Западной Арктики (от концепции к практике): Тез. докл. междунар. конф. (г. Мурманск, 23-25 октября 1997 г.). Мурманск, 1997. С. 78-79.
- Макаров М. В. Влияние длительного затемнения на пигментный состав некоторых видов водорослей Баренцева моря//Тез. докл. междунар. конф. «Биологические основы устойчивого развития прибрежных морских экосистем» (г. Мурманск, 25-28 апреля 2001 г.). Апатиты: Изд-во КНЦ РАН, 2001. С. 139.
- Матишов Д. Г. Источники, перенос и распространение искусственных радионуклидов в компонентах морских экосистем//Теория и практика комплексных морских исследований в интересах экономики и безопасности российского Севера: Тез. докл. междунар. науч.-практ. конф. (г. Мурманск, 15-17 марта 2005 г.). Апатиты: Изд-во Кольского научного центра РАН, 2005. С. 101.
- Нельсон-Смит А. Нефть и экология моря. Л.: Гидрометеоиздат, 1977. 302 с.
- Немировская И. А. Углеводороды в экосистеме Белого моря//Океанология. 2005. Т. 45. № 5. С. 678-688.
- Плотицына Н. Ф. Накопление загрязняющих веществ в промысловых макрофитах Белого моря//Оптимизация использования морских биоресурсов и комплексное управление прибрежной зоной Баренцева моря: Тез. докл. регион. семинара, посвященного 45-летию Первой научной сессии Мурманской биологической станции (г. Мурманск, 30 ноября 1999 г.). Мурманск: ММБИ КНЦ РАН, 1999. 105 с.
- Степаньян О. В. Морфофункциональные перестройки у водорослей-макрофитов Баренцева моря под влиянием нефти и нефтепродуктов: Автореф. дис. … канд. биол. наук. Мурманск, 2003. 29 с.
- Федоров В. Д., Корсак М. Н., Бобров Ю. А. Некоторые итоги изучения первичной продукции фитопланктона Белого моря//Гидробиол. журн. 1974. Т. 10. № 5. С. 9-14.
- Шкляревич Г. А. Запасы и временная гетерогенность биомассы водорослей-макрофитов на литорали островов вершины Кандалакшского залива Белого моря//Водоросли, лишайники, грибы и мохообразные в заповедниках РСФСР: Сб. тр. ЦНИЛ Главохоты РСФСР. М., 1989. С. 5-16.
- Шкляревич Г. А. Водоросли и беспозвоночные животные мелководий Порьей губы. Апатиты, 1999. 70 с.
- Berger V., Dahle S., Galaktionov K., Kosobokova X., Naumov A., Rat kova T., Savinov V., Savinova T. White Sea. Ecology and environment. St. Petersburg; Tromso, 2001.157 p.
- Eichenberger W., Araki S., Muller D. G. Betaine lipids and phospholipids in brown algae//Phytochemistry. 1993. Vol. 34, 5. P. 1323-1333.
- Smith K. L., Bryan G. W., Harwood J. L. Changes in endogenous fatty acids and lipid syn thesis associated With copper pollution in Fucus spp.//J. Exp. Bot. 1985. Vol. 36. № 165. P. 663-669.
- Thelin Is. Effects, in culture, de deux petroles bruts et d un dispersant petrolier sur les zygotes et les plantules de Fucus serratus Linnaeus (Fucales, Phaeophyceae)//Bot. Mar. 1981. Vol. 24. P. 515-519.


