Эколого-биохимический мониторинг состояния некоторых литоральных поселений мидий Mytilus edulis L. в Кандалакшском заповеднике
Автор: Фокина Наталья Николаевна, Шкляревич Галина Андреевна, Руоколайнен Татьяна Рудольфовна, Немова Нина Николаевна
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Биоэкология
Статья в выпуске: 2 т.22, 2019 года.
Бесплатный доступ
Мидии Mytilus edulis L., обитающие на литорали, являются традиционным объектом мониторинга состояния прибрежных экосистем. В процессе эколого-биохимических исследований некоторых литоральных поселений мидий в Кандалакшском природном заповеднике выявлялись модификации в структуре локальных популяций, а также осуществлялся поиск биохимических маркеров на уровне состава липидов, отражающих хроническое действие факторов окружающей среды. Анализ размерно-возрастной структуры прибрежных поселений Mytilus edulis L. показал межгодовую динамику протекания естественных процессов, связанных с режимом пополнения молодью и гибелью моллюсков. Выявленные значительные различия показателей плотности и биомассы поселений Mytilus edulis L. обусловлены, вероятно, влиянием на их жизнедеятельность антропогенной нагрузки (прежде всего продолжительных сбросов пресной воды из системы гидроэлектростанции). Состав липидов и жирных кислот в жабрах литоральных мидий определен с помощью методов тонкослойной, газожидкостной и высокоэффективной жидкостной хроматографии...
Литораль, двустворчатые моллюски, плотность, биомасса, липиды, жирные кислоты
Короткий адрес: https://sciup.org/142220011
IDR: 142220011 | УДК: 594.124:577.115 | DOI: 10.21443/1560-9278-2019-22-2-213-224
Текст научной статьи Эколого-биохимический мониторинг состояния некоторых литоральных поселений мидий Mytilus edulis L. в Кандалакшском заповеднике
*Институт биологии Карельского научного центра РАН, г. Петрозаводск, Россия; ORCID: 0000-0002-1209-3019, e-mail:
Мидии Mytilus edulis L., обитающие на литорали, являются традиционным объектом мониторинговых исследований состояния прибрежных экосистем, так как они ведут прикрепленный образ жизни и устойчивы к воздействию различных факторов окружающей среды (температуры, солености, загрязнений) (Наумов, 2006; Goldberg, 1986; Gosling, 1992). Влияние факторов различной природы модифицирует структуру локальной популяции моллюсков, что отражается на таких экологических характеристиках, как плотность, биомасса и размерно-возрастная структура. Биохимические показатели (активность ферментов, концентрация биологически активных соединений), по колебаниям значений которых можно судить о состоянии организма, в первую очередь подвержены воздействию факторов внешней среды. При этом изменения биохимического статуса свидетельствуют о развитии компенсаторного ответа организма на действие факторов окружающей среды (Hochachka et al., 2002; Немова и др., 2004). К числу таких биохимических показателей относятся липиды; по альтерациям их состава можно выявлять модификации в структурной организации биологических мембран, а также энергетические потребности организма и активации каскадов метаболических реакций, направленных на регуляцию клеточных функций (Vance et al., 2002).
В настоящем исследовании дана экологическая характеристика некоторых прибрежных поселений Mytilus edulis L. (в частности, установлены их размерно-возрастная структура, плотность и биомасса) и определен липидный статус жабр мидий, обитающих на биотопах литорали с различным гидродинамическим режимом и антропогенной нагрузкой. Жабры двустворчатых моллюсков одними из первых подвергаются воздействию внешних факторов среды, поэтому можно полагать, что модификации их липидного состава отражают первичную компенсаторную реакцию организма на действие факторов различной природы.
Материалы и методы
Характеристика мест сбора проб
В течение 2009–2015 гг. проводился экологический мониторинг состояния некоторых литоральных поселений мидий, локализованных на территории Кандалакшского заповедника (Белое море) (рис. 1).
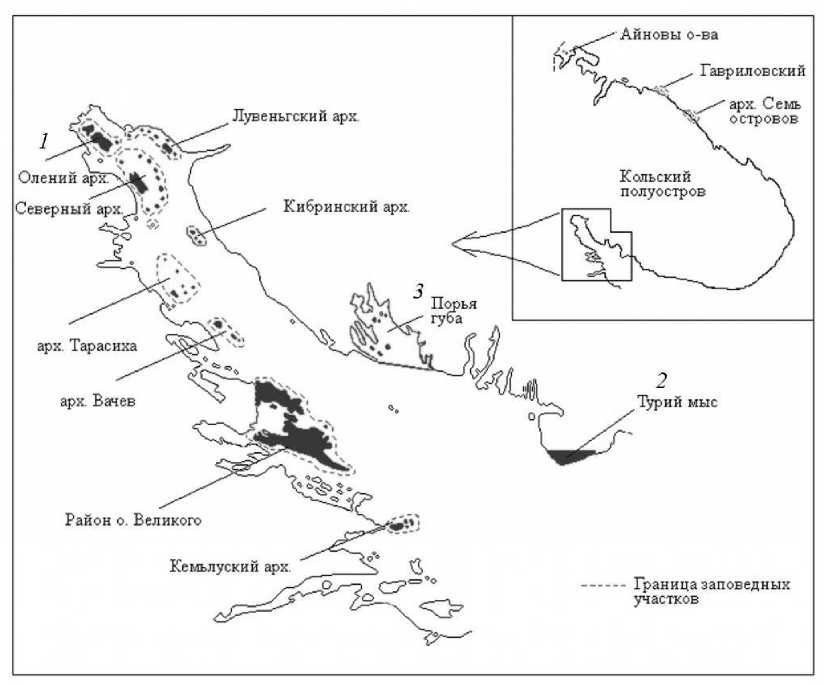
Рис. 1. Карта-схема мест исследования литоральных поселений на территории Кандалакшского заповедника : 1 – биотоп 1, литораль острова Олений;
2 – биотоп 2, литораль на мысе Турий; 3 – биотоп 3, литораль в губе Порья Fig. 1. Scheme of the studied intertidal settlement sites in the Kandalaksha Nature Reserve : 1 – Biotope 1, the Oleniy Island;
2 – Biotope 2, the Tury Cape; 3 – Biotope 3, the Porya Bay
Исследуемые биотопы (мидиевые банки) имеют гидродинамические характеристики (табл. 1). Биотоп 1 – локальное поселение мидий на литорали острова Олений в вершинной части Кандалакшского залива – подвергается значительному антропогенному воздействию: сюда поступает большая часть пресных водотоков, попадающих в Белое море с территории Карельского перешейка и Кольского полуострова. Мидии на литорали биотопа 1 в отдельные годы находятся в условиях весеннего опреснения в результате залповых сбросов пресной воды из водохранилища озера Имандра для каскада гидроэлектростанции (ГЭС), а также естественных стоков реки Нива, содержащих бытовые и промышленные отходы. Более того, расположение данного биотопа рядом с нефтебазой служит причиной частых разливов нефти на данной территории (Шкляревич и др., 2015). Биотоп 2 – поселение мидий на литорали мыса Турий – глубоководный район, значительно удаленный от источников загрязнения. Для данного биотопа характерна высокая степень гидродинамической активности, в том числе прибойность и течения. Биотоп 3 находится на литорали губы Порья и, так же как и биотоп 2, отличается относительно стабильным соленостным режимом, удален от источников загрязнений, и для него тоже характерны прибойность и течения.
Определение размерно-возрастных характеристик, плотности и биомассы исследуемых литоральных поселений мидий Mytilus edulis L.
В полевых условиях определяли размер и возраст моллюсков Mytilus edulis L. (1758), вели учет их численности, а также фиксировали мягкие ткани мидий (жабры) для биохимического анализа. Возраст моллюсков устанавливали по числу годичных колец на раковине, размер моллюсков измеряли с помощью штангенциркуля. Размер площади для отбора проб составлял 0,1 м 2 ; отбирали по пять проб с каждого биотопа (для этого использовали металлический цилиндр с режущей поверхностью нижнего края). Грунтовая часть проб промывалась морской водой через сито с ячеей 1 мм.
В морской воде исследуемых биотопов было определено содержание цинка, марганца и свинца, однако их уровень не превышал предельно допустимых значений для морских акваторий.
Таблица 1. Характеристика мест сбора литоральных мидий Mytilus edulis L. в Кандалакшском заповеднике
Table 1. Specification of the studied biotopes in the Kandalaksha Nature Reserve
|
Место сбора |
Течения / волновая активность |
Год |
Температура*, °C |
Соленость*, ‰ |
Нефтепродукты**, мг/л |
Железо**, мг/л |
Медь**, мг/л |
|
Биотоп 1 (Олений остров) |
↓/↓ |
2009 |
13,3 |
10,5 |
0,06 |
0,02 |
0,04 |
|
2010 |
13,8 |
14,2 |
– |
– |
– |
||
|
2011 |
16,6 |
11,6 |
0,76 |
0,04 |
<0,003 |
||
|
2012 |
16,9 |
9,7 |
– |
– |
– |
||
|
2013 |
16,6 |
16,0 |
– |
– |
– |
||
|
2014 |
15,4 |
12,2 |
– |
– |
– |
||
|
2015 |
16,8 |
12,7 |
– |
– |
– |
||
|
Биотоп 2 (Турий мыс) |
↑/↑ |
2009 |
13,8 |
21,2 |
3,00 |
0,02 |
0,08 |
|
2010 |
13,3 |
22,7 |
– |
– |
– |
||
|
2011 |
16,6 |
22,2 |
<0,05 |
0,02 |
<0,003 |
||
|
2012 |
12,9 |
22,9 |
– |
– |
– |
||
|
2013 |
13,5 |
20,1 |
– |
– |
– |
||
|
2014 |
16,4 |
22,5 |
– |
– |
– |
||
|
2015 |
16,5 |
22,8 |
– |
– |
– |
||
|
Биотоп 3 (Порья губа) |
↑/↑ |
2009 |
12,9 |
20,3 |
0,56 |
0,02 |
0,07 |
|
2010 |
– |
– |
– |
– |
– |
||
|
2011 |
17,7 |
24,1 |
<0,05 |
0,01 |
<0,003 |
||
|
2012 |
17,5 |
20,7 |
– |
– |
– |
||
|
2013 |
17,7 |
24,6 |
– |
– |
– |
||
|
2014 |
14,2 |
24,1 |
– |
– |
– |
||
|
2015 |
17,5 |
21,1 |
– |
– |
– |
Примечание. *Значения были получены посредством однократного измерения во время сбора мидий. **Анализ морской воды на содержание загрязняющих веществ был проведен в Центре лабораторного анализа и технических измерений по Республике Карелии.
Анализ состава общих липидов и жирных кислот
Для биохимического анализа отбирали жабры крупных особей Mytilus edulis L. одинакового возраста и размера на стадии репродуктивного покоя (стадии 0) (табл. 2). В данном исследовании приведены результаты анализа состава липидов мидий, собранных на биотопах в 2013–2015 гг., полученные с помощью приборов Центра коллективного пользования научным оборудованием Федерального исследовательского центра "Карельский научный центр РАН" (г. Петрозаводск).
Липиды экстрагировали из жабр литоральных мидий смесью хлороформа и метанола (2 : 1) по методу Folch et al. (1957). Методом тонкослойной хроматографии (пластины Silufol, Россия) определяли основные классы липидов (фосфолипидов, триацилглицеринов, холестерина и его эфиров). Количественное содержание основных классов липидов вычисляли методом, указанным в работах Сидорова и др. (1972) и Engelbrecht et al. (1974). Состав жирных кислот общих липидов устанавливали с помощью газожидкостного хроматографа Agilent 7890A (США). Состав фосфолипидов анализировали методом высокоэффективной жидкостной хроматографии с использованием прибора "Стайер" (Россия) по методу, разработанному Arduini et al. (1996).
Таблица 2. Размерно-возрастная характеристика литоральных мидий Mytilus edulis L., взятых на биохимический анализ Table 2. Size and age characteristics of intertidal mussels Mytilus edulis L. taken for biochemical analysis
|
Год сбора материала |
Биотоп 1 |
Биотоп 2 |
Биотоп 3 |
|||
|
Возраст моллюска |
Длина раковины, мм |
Возраст моллюска |
Длина раковины, мм |
Возраст моллюска |
Длина раковины, мм |
|
|
2013 |
(9+)–(10+) |
29–36 |
(9+)–(10+) |
30–32 |
(8+)–(9+) |
30–36 |
|
2014 |
(9+)–(11+) |
36–42 |
(9+)–(10+) |
31–38 |
(8+)–(9+) |
39–46 |
|
2015 |
(8+)–(10+) |
31–39 |
(8+)–(10+) |
30–36 |
(8+)–(10+) |
34–41 |
Критерии Краскела – Уоллиса и Тюки (Tukey-HSD test) были использованы для оценки достоверности различий в составе липидов жабр литоральных мидий, обитающих на исследуемых биотопах.
Результаты и обсуждение
В процессе исследования установлены межгодовые колебания размерно-возрастного состава, плотности и биомассы рассматриваемых литоральных поселений мидий в различных районах Кандалакшского заповедника. Возрастная структура поселения мидий на литорали биотопа 1 характеризовалась присутствием моллюсков в возрасте от 0+ до 14+ лет, за исключением проб 2012 и 2015 гг. В 2012 г. здесь были зафиксированы мидии только 0+ и 1+ возрастов, а в 2015 г. – моллюски не старше 5 лет (рис. 2). Массовая гибель моллюсков в 2012 г. на данном локальном участке связана с продолжительным (в течение мая – июня) залповым сбросом пресной воды из системы ГЭС, в результате которого был резко нарушен естественный природный ход процесса весеннего распреснения прибрежных морских вод (Шкляревич и др., 2015). Обычно к июлю (когда проводится сбор моллюсков) отмечается восстановление данного поселения мидий за счет миграции моллюсков из верхних слоев сублиторали. Причину отсутствия особей мидий старших возрастов в 2015 г. на литорали биотопа 1 пока установить не удалось. Возрастной состав поселений мидий на литорали биотопов 2 и 3 с относительно стабильным соленостным режимом и высокой гидродинамической активностью характеризуется присутствием мидий в возрасте от 0+ до 11+; неоднородность демографической структуры отмечается на протяжении всего периода исследования (рис. 3, 4), что отражает естественные межгодовые колебания, связанные, вероятно, с элиминацией прежде доминирующих генераций и режимом пополнения молодью. Мидиевая банка, находящаяся на литорали биотопа 1, по сравнению с поселениями биотопов 2 и 3, отличается низкими показателями плотности и биомассы (рис. 5), что обусловлено воздействием ряда абиотических и биотических факторов окружающей среды. Основным абиотическим фактором, определяющим амплитуду колебаний количественных показателей данного мидиевого поселения, является, по-видимому, ежегодное распреснение в этой части акватории, вызванное деятельностью ГЭС (Шкляревич и др., 2015).
Состав липидов и жирных кислот отражает состояние организма и используется в качестве биомаркера при индикации воздействия факторов окружающей среды (Hochachka et al., 2002; Vance et al., 2002). В данном исследовании показана межгодовая динамика липидного и жирнокислотного состава жабр литоральных Mytilus edulis L., а также зависимость модификаций на уровне состава липидов от условий среды обитания на литорали исследуемых биотопов Кандалакшского заповедника (табл. 3–5). В 2015 г. у моллюсков из биотопов 1 и 2 отмечалось повышенное содержание холестерина, тогда как у мидий из биотопа 3 наблюдался обратный эффект. Вместе с тем менялся уровень фосфолипидов; при этом динамики в содержании доминирующего фосфолипида мембран – фосфатидилхолина (ФХ) – выявлено не было, однако отмечались изменения на уровне минорных фосфолипидов мембран: фосфатидилэтаноламина (ФЭА), фосфатидилсерина (ФС) и фосфатидилинозитола (ФИ). Значительный рост уровня ФЭА и снижение уровня ФИ были характерны для мидий из биотопа 1 в 2015 г. Увеличение содержания ФЭА наблюдалось также в жабрах мидий из биотопа 2 в 2014–2015 гг., а моллюски из биотопа 3 отличались повышенным содержанием ФС в 2015 г.
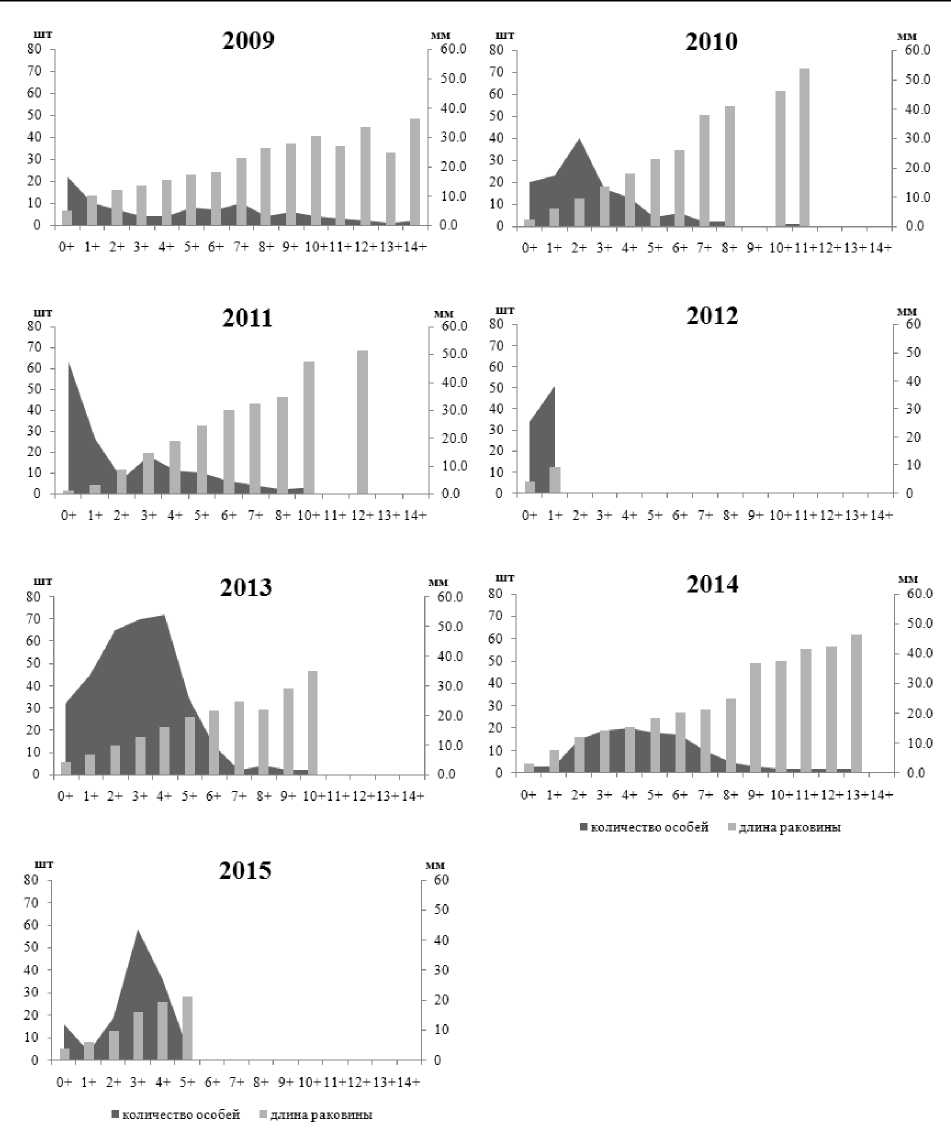
Рис. 2. Размерно-возрастная структура литорального поселения мидий Mytilus edulis L. из биотопа 1 (Олений остров, Кандалакшский залив, Белое море)
Fig. 2. Size and age structure of the intertidal mussels Mytilus edulis L. settlement of Biotope 1 (the Oleniy Island, Kandalaksha Bay, White Sea)
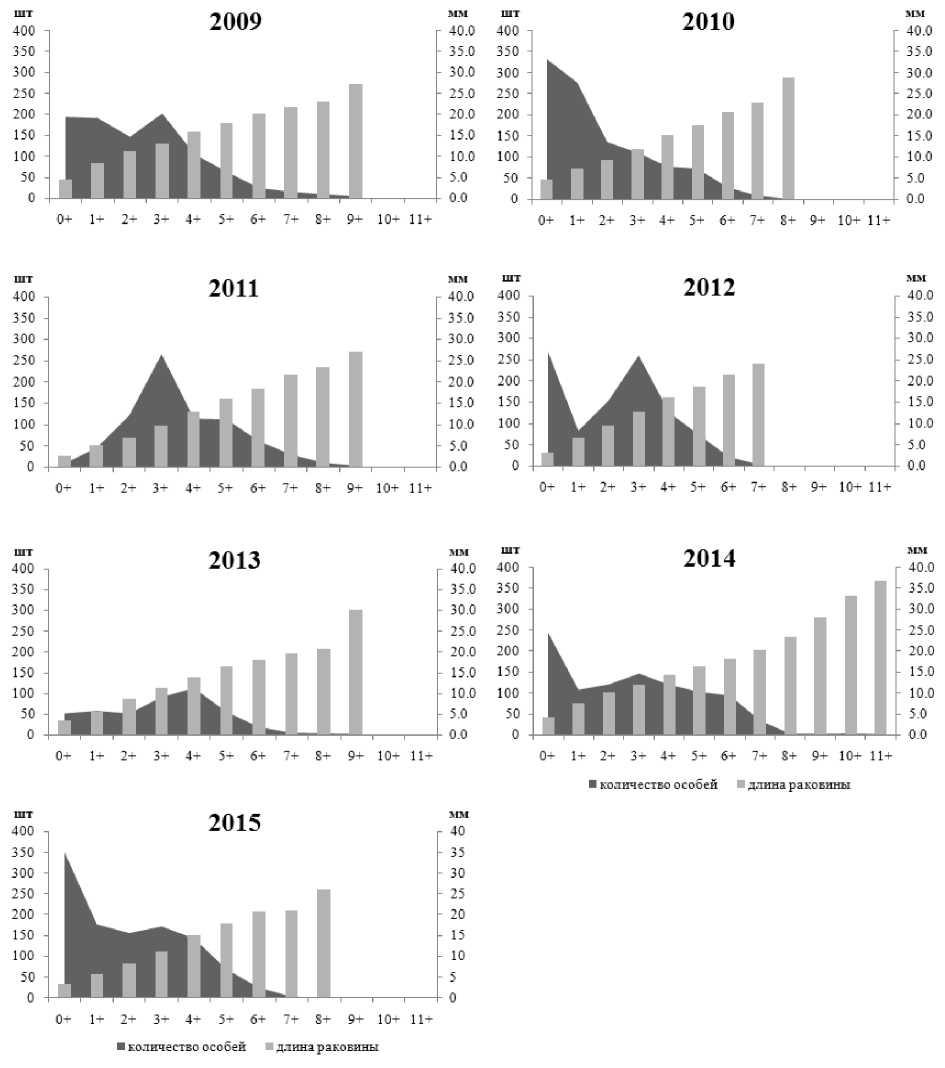
Рис. 3. Размерно-возрастная структура литорального поселения мидий Mytilus edulis L. из биотопа 2 (Турий мыс, Кандалакшский залив, Белое море)
Fig. 3. Size and age structure of the intertidal mussels Mytilus edulis L. settlement of Biotope 2 (the Tury Cape, Kandalaksha Bay, White Sea)
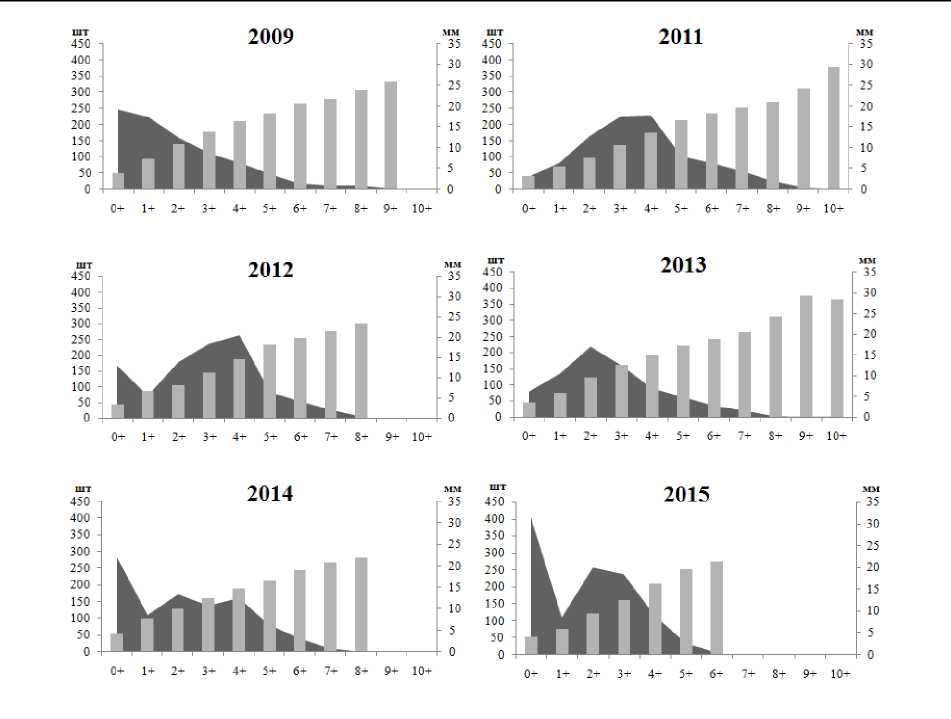
Рис. 4. Размерно-возрастная структура литорального поселения мидий Mytilus edulis L. из биотопа 3 (Порья губа, Кандалакшский залив, Белое море)
Fig. 4. Size and age structure of the intertidal mussels Mytilus edulis L. settlement of Biotope 3 (the Porya Bay, Kandalaksha Bay, White Sea)
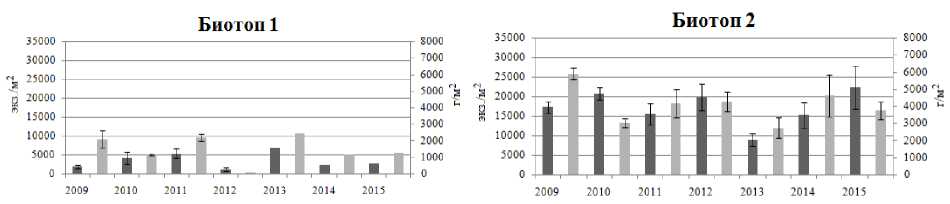
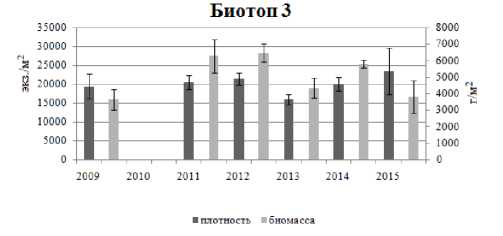
Рис. 5. Показатели плотности и биомассы литоральных поселений мидий Mytilus edulis L. (биотопы 1–3) в Кандалакшском заповеднике
Fig. 5. Density and biomass of the studied intertidal mussel Mytilus edulis L. settlements in the Kandalaksha Nature Reserve
Таблица 3. Состав липидов и жирных кислот жабр Mytilus edulis L., собранных на литорали биотопа 1 (Олений остров, Кандалакшский залив, Белое море)
Table 3. Lipid and fatty acid content in the gills of the intertidal mussels Mytilus edulis L.
collected in Biotope 1 (the Oleniy Island, Kandalaksha Bay, White Sea)
|
Год сбора материала |
2013 \ |
2014 \ |
2015 \ |
Среднее значение |
|
Запасные липиды, % сухой массы |
||||
|
Триацилглицерины |
0,84 ± 0,1 |
1,00 ± 0,18 |
0,64 ± 0,13 |
0,83 ± 0,09** |
|
Эфиры холестерина |
0,46 ± 0,05 |
0,35 ± 0,24 |
0,21 ± 0,08 |
0,34 ± 0,09** |
|
Мембранные липиды, % сухой массы |
||||
|
Холестерин |
4,83 ± 0,3 |
4,10 ± 0,1 |
3,43 ± 0,33* |
4,12 ± 0,21 |
|
Фосфолипиды |
5,75 ± 0,85 |
5,28 ± 0,49 |
8,70 ± 0,32* |
6,58 ± 0,51 |
|
Фосфатидилинозитол |
0,06 ± 0,02 |
0,07 ± 0,02 |
0,01 ± 0,0* |
0,04 ± 0,01** |
|
Фосфатидилсерин |
0,12 ± 0,02 |
0,14 ± 0,02 |
0,11 ± 0,04 |
0,12 ± 0,02 |
|
Фосфатидилэтаноламин |
0,18 ± 0,05 |
0,15 ± 0,04 |
0,37 ± 0,02* |
0,23 ± 0,03 |
|
Фосфатидилхолин |
2,27 ± 0,33 |
2,42 ± 0,41 |
3,76 ± 0,42 |
2,82 ± 0,27** |
|
Лизофосфатидилхолин |
2,06 ± 0,34 |
1,29 ± 0,19 |
1,41 ± 0,18 |
1,59 ± 0,16** |
|
Состав жирных кислот общих липидов, % суммы жирных кислот |
||||
|
Маркеры диатомовых водорослей |
||||
|
16:1n-7 |
1,40 ± 0,14 |
2,89 ± 0,33* |
2,20 ± 0,25 |
2,16 ± 0,21 |
|
20:5n-3 |
8,30 ± 0,43 |
7,50 ± 0,44 |
15,35 ± 0,17* |
10,39 ± 0,96 |
|
16:1n-7/16:0 |
0,13 ± 0,01 |
0,22 ± 0,04 |
0,18 ± 0,02 |
0,18 ± 0,02 |
|
20:5n-3/22:6n-3 |
0,45 ± 0,03 |
0,50 ± 0,04 |
0,85 ± 0,01* |
0,60 ± 0,05 |
|
Маркеры бактерий (детрита) |
||||
|
15:0 |
0,52 ± 0,04 |
0,55 ± 0,07 |
0,32 ± 0,02 |
0,46 ± 0,04 |
|
17:0 |
0,82 ± 0,06 |
0,75 ± 0,06 |
0,79 ± 0,03 |
0,79 ± 0,03** |
|
18:1n-7 |
1,28 ± 0,05 |
1,90 ± 0,13* |
1,59 ± 0,04 |
1,59 ± 0,08 |
|
18:1n-7/18:1n-9 |
1,05 ± 0,2 |
1,21 ± 0,36 |
3,64 ± 0,18* |
1,97 ± 0,35 |
|
Маркеры динофлагеллят |
||||
|
16:0 |
10,93 ± 0,11 |
14,25 ± 1,9* |
12,06 ± 0,28 |
12,42 ± 0,7 |
|
18:1n-9 |
1,74 ± 0,72 |
3,74 ± 2,12 |
0,44 ± 0,01* |
1,97 ± 0,78 |
|
18:4n-3 |
0,76 ± 0,05 |
0,77 ± 0,05 |
1,40 ± 0,09* |
0,98 ± 0,09 |
|
22:6n-3 |
18,39 ± 0,52 |
15,49 ± 1,53 |
18,14 ± 0,26 |
17,34 ± 0,61 |
|
22:6n-3/20:5n-3 |
2,24 ± 0,13 |
2,06 ± 0,17 |
1,18 ± 0,01* |
1,83 ± 0,14 |
|
Маркеры зоопланктона |
||||
|
18:2n-6 |
1,35 ± 0,14 |
1,27 ± 0,18 |
0,86 ± 0,06* |
1,16 ± 0,09** |
|
20:4n-6 |
8,89 ± 0,32 |
6,60 ± 0,66* |
6,96 ± 0,22* |
7,48 ± 0,36** |
|
20:1 |
7,92 ± 0,18 |
6,68 ± 0,85 |
6,43 ± 0,14 |
7,01 ± 0,32 |
|
22:1 |
0,31 ± 0,1 |
0,27 ± 0,06 |
0,32 ± 0,05 |
0,30 ± 0,05 |
|
20:4n-6/20:5n-3 |
1,08 ± 0,05 |
0,87 ± 0,06 |
0,45 ± 0,02* |
0,80 ± 0,07 |
Примечание. *Различия достоверны при сравнении липидного состава мидий в зависимости от года сбора материала.
**Различия достоверны при сравнении липидного состава мидий в зависимости от места сбора мидий.
Таблица 4. Состав липидов и жирных кислот жабр Mytilus edulis L., собранных на литорали биотопа 2 (Турий мыс, Кандалакшский залив, Белое море)
Table 4. Lipid and fatty acid content in the gills of the intertidal mussels Mytilus edulis L.
collected in Biotope 2 (the Tury Cape, Kandalaksha Bay, White Sea)
|
Год сбора материала |
2013 1 |
2014 1 |
2015 |
Среднее значение |
|
Запасные липиды, % сухой массы |
||||
|
Триацилглицерины |
0,29 ± 0,1 |
0,53 ± 0,09 |
0,46 ± 0,14 |
0,43 ± 0,06** |
|
Эфиры холестерина |
0,04 ± 0,02 |
0,00 ± 0,0 |
0,09 ± 0,06 |
0,05 ± 0,02** |
|
Мембранные липиды, % сухой массы |
||||
|
Холестерин |
5,16 ± 0,24 |
5,08 ± 0,95 |
3,18 ± 0,36 |
4,47 ± 0,41 |
|
Фосфолипиды |
4,78 ± 0,42 |
6,34 ± 1,19 |
6,38 ± 0,26* |
5,83 ± 0,45 |
|
Фосфатидилинозитол |
0,07 ± 0,02 |
0,10 ± 0,04 |
0,03 ± 0,0 |
0,07 ± 0,02** |
|
Фосфатидилсерин |
0,09 ± 0,01 |
0,15 ± 0,03 |
0,17 ± 0,05 |
0,14 ± 0,02 |
|
Фосфатидилэтаноламин |
0,10 ± 0,01 |
0,30 ± 0,1* |
0,27 ± 0,03* |
0,23 ± 0,04 |
|
Фосфатидилхолин |
2,37 ± 0,32 |
2,64 ± 0,69 |
1,97 ± 0,37 |
2,32 ± 0,27** |
|
Лизофосфатидилхолин |
1,40 ± 0,2 |
1,61 ± 0,46 |
1,32 ± 0,11 |
1,44 ± 0,16** |
|
Состав жирных кислот общих липидов, % суммы жирных кислот |
||||
|
Маркеры диатомовых водорослей |
||||
|
16:1n-7 |
1,59 ± 0,12 |
1,47 ± 0,1 |
1,87 ± 0,15 |
1,64 ± 0,08 |
|
20:5n-3 |
7,41 ± 0,62 |
8,82 ± 0,87 |
12,80 ± 0,24* |
9,68 ± 0,7 |
|
16:1n-7/16:0 |
0,14 ± 0,01 |
0,14 ± 0,01 |
0,14 ± 0,01 |
0,14 ± 0,01 |
|
20:5n-3/22:6n-3 |
0,42 ± 0,03 |
0,50 ± 0,06 |
0,69 ± 0,01* |
0,54 ± 0,04 |
|
Маркеры бактерий (детрита) |
||||
|
15:0 |
0,56 ± 0,02 |
0,52 ± 0,04 |
0,39 ± 0,01* |
0,49 ± 0,02 |
|
17:0 |
0,86 ± 0,07 |
1,03 ± 0,03 |
0,85 ± 0,05 |
0,91 ± 0,04 |
|
18:1n-7 |
1,67 ± 0,05 |
1,45 ± 0,11 |
1,67 ± 0,02 |
1,59 ± 0,05 |
|
18:1n-7/18:1n-9 |
0,67 ± 0,09 |
0,78 ± 0,07 |
1,65 ± 0,1* |
1,03 ± 0,13 |
|
Маркеры динофлагеллят |
||||
|
16:0 |
11,19 ± 0,33 |
10,62 ± 0,41 |
13,50 ± 0,48* |
11,77 ± 0,4 |
|
18:1n-9 |
2,74 ± 0,47 |
1,89 ± 0,15 |
1,03 ± 0,07* |
1,88 ± 0,24 |
|
18:4n-3 |
0,88 ± 0,04 |
0,80 ± 0,03 |
2,03 ± 0,14* |
1,24 ± 0,16 |
|
22:6n-3 |
17,54 ± 0,19 |
17,63 ± 0,37 |
18,58 ± 0,19* |
17,92 ± 0,19 |
|
22:6n-3/20:5n-3 |
2,42 ± 0,17 |
2,08 ± 0,21 |
1,45 ± 0,02* |
1,98 ± 0,14 |
|
Маркеры зоопланктона |
||||
|
18:2n-6 |
2,71 ± 0,04 |
1,80 ± 0,04* |
1,70 ± 0,12* |
2,07 ± 0,13 |
|
20:4n-6 |
10,92 ± 0,37 |
10,76 ± 0,26 |
8,88 ± 0,2* |
10,19 ± 0,29** |
|
20:1 |
7,54 ± 0,15 |
8,10 ± 0,22 |
6,65 ± 0,2* |
7,43 ± 0,19 |
|
22:1 |
0,27 ± 0,09 |
0,24 ± 0,05 |
0,47 ± 0,1* |
0,32 ± 0,05 |
|
20:4n-6/20:5n-3 |
1,51 ± 0,11 |
1,27 ± 0,13 |
0,69 ± 0,02* |
1,16 ± 0,11 |
Примечание. *Различия достоверны при сравнении липидного состава мидий в зависимости от года сбора материала. **Различия достоверны при сравнении липидного состава мидий в зависимости от места сбора мидий.
Таблица 5. Состав липидов и жирных кислот жабр Mytilus edulis L., собранных на литорали биотопа 3 (Порья губа, Кандалакшский залив, Белое море)
Table 5. Lipid and fatty acid content in the gills of the intertidal mussels Mytilus edulis L.
collected in Biotope 3 (the Porya Bay, Kandalaksha Bay, White Sea)
|
Год сбора материала |
2013 \ |
2014 \ |
2015 |
Среднее значение |
|
Запасные липиды, % сухой массы |
||||
|
Триацилглицерины |
0,90 ± 0,19 |
0,62 ± 0,16 |
0,32 ± 0,15 |
0,61 ± 0,11 |
|
Эфиры холестерина |
0,44 ± 0,16 |
0,31 ± 0,06 |
0,00 ± 0,0* |
0,25 ± 0,07 |
|
Мембранные липиды, % сухой массы |
||||
|
Холестерин |
3,61 ± 0,26 |
3,96 ± 0,17 |
4,81 ± 0,5* |
4,12 ± 0,23 |
|
Фосфолипиды |
6,56 ± 0,45 |
5,05 ± 0,36* |
5,86 ± 0,49 |
5,82 ± 0,29 |
|
Фосфатидилинозитол |
0,02 ± 0,01 |
0,02 ± 0,01 |
0,02 ± 0,0 |
0,02 ± 0,01** |
|
Фосфатидилсерин |
0,07 ± 0,01 |
0,07 ± 0,01 |
0,13 ± 0,01* |
0,09 ± 0,01 |
|
Фосфатидилэтаноламин |
0,33 ± 0,05 |
0,34 ± 0,04 |
0,29 ± 0,06 |
0,32 ± 0,03 |
|
Фосфатидилхолин |
2,14 ± 0,42 |
1,90 ± 0,17 |
1,52 ± 0,36 |
1,85 ± 0,19** |
|
Лизофосфатидилхолин |
1,21 ± 0,34 |
0,76 ± 0,05 |
0,61 ± 0,06 |
0,86 ± 0,13** |
|
Состав жирных кислот общих липидов, % суммы жирных кислот |
||||
|
Маркеры диатомовых водорослей |
||||
|
16:1n-7 |
1,14 ± 0,16 |
1,51 ± 0,1 |
1,99 ± 0,14* |
1,55 ± 0,12 |
|
20:5n-3 |
12,67 ± 0,38 |
12,00 ± 0,09 |
13,03 ± 0,26* |
12,57 ± 0,18 |
|
16:1n-7/16:0 |
0,08 ± 0,01 |
0,12 ± 0,01 |
0,16 ± 0,01* |
0,12 ± 0,01 |
|
20:5n-3/22:6n-3 |
0,61 ± 0,01 |
0,60 ± 0,01* |
0,66 ± 0,01* |
0,63 ± 0,01 |
|
Маркеры бактерий (детрита) |
||||
|
15:0 |
0,46 ± 0,04 |
0,46 ± 0,02 |
0,40 ± 0,06 |
0,44 ± 0,02 |
|
17:0 |
0,94 ± 0,04 |
1,04 ± 0,03 |
1,11 ± 0,02* |
1,03 ± 0,02 |
|
18:1n-7 |
0,94 ± 0,07 |
1,19 ± 0,04 |
1,79 ± 0,14* |
1,31 ± 0,11 |
|
18:1n-7/18:1n-9 |
0,91 ± 0,16 |
1,63 ± 0,3 |
2,02 ± 0,2* |
1,52 ± 0,17 |
|
Маркеры динофлагеллят |
||||
|
16:0 |
13,49 ± 0,35 |
12,26 ± 0,16 |
12,12 ± 0,41* |
12,62 ± 0,24 |
|
18:1n-9 |
1,16 ± 0,23 |
0,89 ± 0,25 |
0,97 ± 0,22* |
1,01 ± 0,13 |
|
18:4n-3 |
1,04 ± 0,03 |
1,00 ± 0,07 |
1,55 ± 0,06* |
1,20 ± 0,07 |
|
22:6n-3 |
20,78 ± 0,44 |
19,98 ± 0,36 |
19,62 ± 0,3 |
20,13 ± 0,24 |
|
22:6n-3/20:5n-3 |
1,64 ± 0,02 |
1,67 ± 0,03* |
1,51 ± 0,03* |
1,61 ± 0,02 |
|
Маркеры зоопланктона |
||||
|
18:2n-6 |
2,14 ± 0,12 |
1,59 ± 0,08* |
1,72 ± 0,06 |
1,82 ± 0,08 |
|
20:4n-6 |
7,40 ± 0,25 |
6,51 ± 0,18 |
6,16 ± 0,14* |
6,69 ± 0,17** |
|
20:1 |
7,18 ± 0,17 |
7,79 ± 0,2 |
6,94 ± 0,18* |
7,30 ± 0,14 |
|
22:1 |
0,33 ± 0,05 |
0,49 ± 0,09 |
0,41 ± 0,1 |
0,41 ± 0,05 |
|
20:4n-6/20:5n-3 |
0,58 ± 0,02 |
0,54 ± 0,02 |
0,47 ± 0,01* |
0,53 ± 0,01 |
Примечание. *Различия достоверны при сравнении липидного состава мидий в зависимости от года сбора материала. **Различия достоверны при сравнении липидного состава мидий в зависимости от места сбора мидий.
Состав жирных кислот у двустворчатых моллюсков, как и у большинства фильтрующих консументов, служит трофическим биомаркером, содержащим компоненты фито- и зоопланктона, а также детрита (бактерий), отражая тем самым пищевой спектр моллюска (Freites et al., 2002; Irisarri et al., 2014; ^ajdek et al., 2013; Delaporte et al., 2005). Так, маркером диатомовых водорослей является преобладание в составе жирных кислот эйкозапентаеновой кислоты (20:5n-3/22:6n-3 > 1), тогда как доминирование докозагексаеновой кислоты (22:6n-3/20:5n-3 > 1) – маркером динофлагеллят; повышенный уровень арахидоновой кислоты (20:4n-6/20:5n-3 > 1) по сравнению с жирными кислотами фитопланктонного происхождения – маркером зоопланктона, а повышенные количества вакценовой кислоты (18:1n-7/18:1n-9 > 1) – маркером бактерий детритного происхождения. В 2015 г. в жабрах литоральных мидий из всех исследуемых биотопов 1–3 наблюдалось снижение доли докозагексаеновой и арахидоновой кислот по отношению к эйкозапентаеновой кислоте, а также повышение уровня вакценовой кислоты (табл. 3–5). Вероятно, данные особенности жирнокислотного состава мидий отражают общие тенденции климатических и гидрологических изменений, происходивших в Кандалакшском заливе в 2015 г. (независимо от выбранного биотопа) и свидетельствовавших о преобладании в пище мидий диатомовых водорослей и бактерий детритного происхождения.
Несмотря на то что содержание липидов и жирных кислот в жабрах литоральных мидий колебалось в зависимости от года исследования, были выявлены некоторые особенности главным образом у моллюсков, обитающих на литорали биотопа 1 (табл. 3). Так, в жабрах мидий из первого биотопа отмечено повышенное содержание запасных липидов (триацилглицеринов и эфиров холестерина), для которых межгодовая динамика не была характерна. По-видимому, повышенный уровень запасных липидов у моллюсков из биотопа 1, подверженного антропогенному воздействию (нефтяному загрязнению и ежегодному распреснению), свидетельствует об активации процессов детоксикации ксенобиотиков и/или о накоплении метаболических резервов, направленных на поддержание жизнедеятельности моллюсков при обитании в условиях стрессового воздействия. Кроме того, у моллюсков из биотопа 1 отмечался повышенный уровень ФХ и его лизоформы. Для данных фосфолипидов также не была характерна межгодовая динамика. Низкое содержание ФИ, линолевой (18:2n-6) и арахидоновой кислот у мидий из биотопа 1, по сравнению с биотопом 2, вероятно, обусловлено расходованием данных липидов на синтез гормон-подобных молекул – эйкозаноидов (преимущественно простагландинов), которые, как было показано ранее, участвуют в процессах адаптации моллюсков к различным факторам среды обитания (Bell et al., 2003; Di Marzo et al., 1991; Freas et al., 1980; Stanley-Samuelson, 1987).
Заключение
Межгодовая динамика состава липидов и жирных кислот в жабрах литоральных мидий, обитающих на исследуемых биотопах Кандалакшского заповедника, обусловлена воздействием как абиотических факторов окружающей среды, так и антропогенной нагрузкой.
Продолжительные эколого-биохимические мониторинговые исследования прибрежных морских территорий позволяют выявить не только модификации в структуре локальных популяций, но и определить биохимические показатели на уровне состава липидов, отражающие продолжительное действие факторов окружающей среды.
Авторы благодарны сотрудникам Кандалакшского государственного природного заповедника за содействие в сборе материала, использованного в ходе исследования.
Финансовое обеспечение исследования осуществлялось из средств федерального бюджета, направленных на выполнение государственного задания № 0218-2019-0076 (АААА-А17-117031710039-3).
Список литературы Эколого-биохимический мониторинг состояния некоторых литоральных поселений мидий Mytilus edulis L. в Кандалакшском заповеднике
- Наумов А. Д. Двустворчатые моллюски Белого моря. Опыт эколого-фаунистического анализа. СПб.: ЗИН РАН, 2006. 367 с.
- Немова Н. Н., Высоцкая Р. У. Биохимическая индикация состояния рыб. М.: Наука. 2004. 215 с.
- Сидоров В. С., Лизенко Е. И., Болгова О. М., Нефедова З. А. Липиды рыб. 1. Методы анализа//Лососевые (Salmonidae) Карелии. Вып. 1: Экология, паразитофауна, биохимия. Петрозаводск: КФАН СССР, 1972. С. 150-163.
- Шкляревич Г. А., Моисеева Е. А. Антропогенное влияние регулируемого сброса пресных вод из систем ГЭС в Белое море на мелководных беспозвоночных//Ученые записки Петрозаводского государственного университета. Сер. Биологические науки. 2015. Т. 153, № 8. С. 46-51.
- Arduini A., Peschechera A., Dottori S. . High performance liquid chromatography of long-chain acylcarnitine and phospholipids in fatty acid turnover studies//Journal of Lipid Research. 1996. Vol. 37, Iss. 3. P. 684-689.
- Biochemistry of lipids, lipoproteins and membranes/eds.: D. E. Vance, J. E. Vance. 4th ed. Elsevier, 2002. 624 p.
- Delaporte M., Soudant P., Moal J., Kraffe E. Incorporation and modification of dietary fatty acids in gill polar lipids by two bivalve species Crassostrea gigas and Ruditapes philippinarum//Comparative Biochemistry and Physiology. Part A: Molecular & Integrative Physiology. 2005. Vol. 140, Iss. 4. P. 460-470. 10.1016/j.cbpb.2005.02.009
- DOI: :10.1016/j.cbpb.2005.02.009
- Di Marzo V., Cimino G., Crispino A., Minardi C. A novel multifunctional metabolic pathway in a marine mollusc leads to unprecedented prostaglandin derivatives (prostaglandin 1,15-lactones)//Biochemical Journal. 1991. Vol. 273, Iss. 3. P. 593-600
- DOI: 10.1042/bj2730593
- Engelbrecht F. M., Mari F., Anderson J. T. Cholesterol. Determination in serum. A rapid direction method//South African Medical Journal. 1974. Vol. 48(7). P. 250-256.
- Folch J., Lees M., Sloan-Stanley G. H. A simple method for the isolation and purification of total lipides from animal tissues//Journal of Biological Chemistry. 1957. Vol. 226, Iss. 1. P. 497-509.
- Freas W., Grollman S. Ionic and osmotic influence on prostaglandin release from the gill tissue of a marine bivalve, Modiolus demissus//Journal of Experimental Biology. 1980. Vol. 84. P. 169-185.
- Freites L., Fernández-Reiriz M. J., Labarta U. Fatty acid profiles of Mytilus galloprovincialis (Lmk) mussel of subtidal and rocky shore origin//Comparative Biochemistry and Physiology. Part B: Biochemistry and Molecular Biology. 2002. Vol. 132, Iss. 2. P. 453-461. 10.1016/S1096-4959(02)00057-X
- DOI: :10.1016/S1096-4959
- Goldberg E. D. The mussel watch concept//Environmental Monitoring and Assessment. 1986. Vol. 7, Iss. 1. P. 91-103
- DOI: 10.1007/BF00398031
- Gordon Bell J., Sargent J. R. Arachidonic acid in Aquaculture feeds: Current status and future opportunities//Aquaculture. 2003. Vol. 218, Iss. 1-4. P. 491-499. 10.1016/S0044-8486(02)00370-8
- DOI: :10.1016/S0044-8486
- Gosling E. G. The mussel Mytilus: Ecology, physiology, genetics, and culture. Amsterdam; New York: Elsevier, 1992. 589 p.
- Hochachka P. M., Somero G. N. Biochemical adaptation. Mechanism and process in physiological evolution. New York: Oxford University Press, 2002. 466 p.
- Irisarri J., Fernández-Reiriz M.-J., De Troch M., Labarta U. Fatty acids as tracers of trophic interactions between seston, mussels and biodeposits in a coastal embayment of mussel rafts in the proximity of fish cages//Comparative Biochemistry and Physiology. Part B: Biochemistry and Molecular Biology. 2014. Vol. 172-173. P. 105-115. 10.1016/j.cbpb.2014.04.006
- DOI: :10.1016/j.cbpb.2014.04.006
- Najdek M., Blažina M., Ezgeta-Balić D., Peharda M. Diets of fan shells (Pinna nobilis) of different sizes: fatty acid profiling of digestive gland and adductor muscle//Marine Biology. 2013. Vol. 160, Iss. 4. P. 921-930. 10.1007/s00227-012-2144-x
- DOI: :10.1007/s00227-012-2144
- Stanley-Samuelson D. W. Physiological roles of Prostaglandins and other Eicosanoids in Invertebrates//The Biological Bulletin. 1987. Vol. 173, N 1. P. 92-109.


